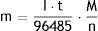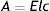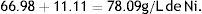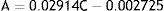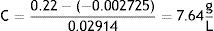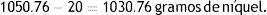Tratar de integrar conocimientos a veces resulta muy complicado en las ciencias experimentales, sin embargo, la industria de la galvanotecnia nos brinda una gran oportunidad porque permite integrar los conocimientos de la electroquímica con los de la química analítica y por ende la utilización de instrumentos de variada sofisticación en la determinación de analitos. Los colores de los diferentes electrólitos en los baños de electrólisis, en las citadas plantas, permiten utilizar el sensor colorimétrico para ayudar al operador de planta a cuantificar el grado de electrodeposición del metal del electrólito coloreado. Los baños de níquel son de extraordinaria importancia en una planta cromadora, o en aquellas que requieren depositar cobre duro en rodillos de impresión, o en pequeños talleres de artesanos o joyeros, porque el recubrimiento de níquel permite depositar sobre él otros metales de mayor valor, como el oro y la plata, mejorando la estética de la pieza obtenida y elevando su resistencia a la corrosión y desgaste. El operador de planta experimentado es capaz de determinar el grado de agotamiento del electrólito observando la intensidad del color para enviarlo a análisis cuantitativo, con el objeto de agregar en forma exacta la cantidad de sales de níquel que necesita el baño. El uso del sensor colorimétrico permite realizar esta operación de manera bastante eficiente, permitiendo resolver rápidamente, in situ, el problema analítico.
Trying to integrate knowledge sometimes is very difficult in the experimental sciences, however, the electroplating industry gives us a great opportunity because it allows integrating the knowledge of electrochemistry with the analytical chemistry and hence the use of instruments of varied sophistication in the determination of analytes. The colours of different electrolytes in the bath of electrolysis, in the cited plants, allow using the colorimetric sensor to help plant operator to quantify the degree of electrodeposition of metal of the colored electrolyte. The nickel baths are of extraordinary importance in a electroplating plant, or those requiring to deposit hard copper for the printing roller or small workshops of artisans or jewelers, because nickel coating allows deposit on it, other metals as gold or silver, of greater value, improving the aesthetics value of the obtained piece part and raising their resistance to corrosion and wear. The plant experienced operator, is capable of determining the degree of depletion of electrolyte observing the intensity of the colour to be sent to quantitative analysis, with the aim of adding exactly the amount of nickel salts that need the bath. Using the colorimetric sensor allows this operation efficiently enough, allowing solving quickly, in-situ, the analytical problem.
La electrólisis es un proceso electroquímico de gran importancia para los países mineros porque es la responsable de la obtención de metales de alta pureza (99,98%) y, por ende, del gran valor agregado que se alcanza al utilizar esta tecnología («electro refinación» o «electro obtención») en el proceso final de producción de metales de alta pureza. La electrólisis tiene múltiples aristas porque involucra a un líquido capaz de conducir la corriente eléctrica, que recibe el nombre de electrólito. Esta solución acuosa contiene sales del metal que se desea electrodepositar y mayoritariamente es coloreada. Además, las leyes que controlan el proceso permiten calcular con bastante precisión la masa de los productos obtenidos, el tiempo en que se realiza el proceso, la corriente que se requiere e incluso la velocidad y el espesor de la capa de metal reducido. Sobre este proceso existe abundante literatura básica (Rekha, 2001; Peter y Kevin, 2015; Lou y Huang, 2004) y especializada (The Canning handbook: Surface finishing technology, 1982; Electroplating engineering handbook, 1984; SAMFA, 2008).
La ley de Faraday es la que gobierna la electrólisis y se postula en dos partes: 1) «La masa depositada en el cátodo, durante la electrólisis es directamente proporcional a la cantidad de electricidad transferida a este electrodo», y 2) «Para una determinada cantidad de electricidad, la masa de un material depositado en el electrodo es directamente proporcional al peso equivalente del elemento que se reduce». Matemáticamente se puede unificar en una sola ecuación:
donde I es la corriente eléctrica continua en amperios, t es el tiempo en segundos, M es la masa molar del metal en g/mol y n es la valencia del metal (electrones por mol) (Zaragoza, 2016).
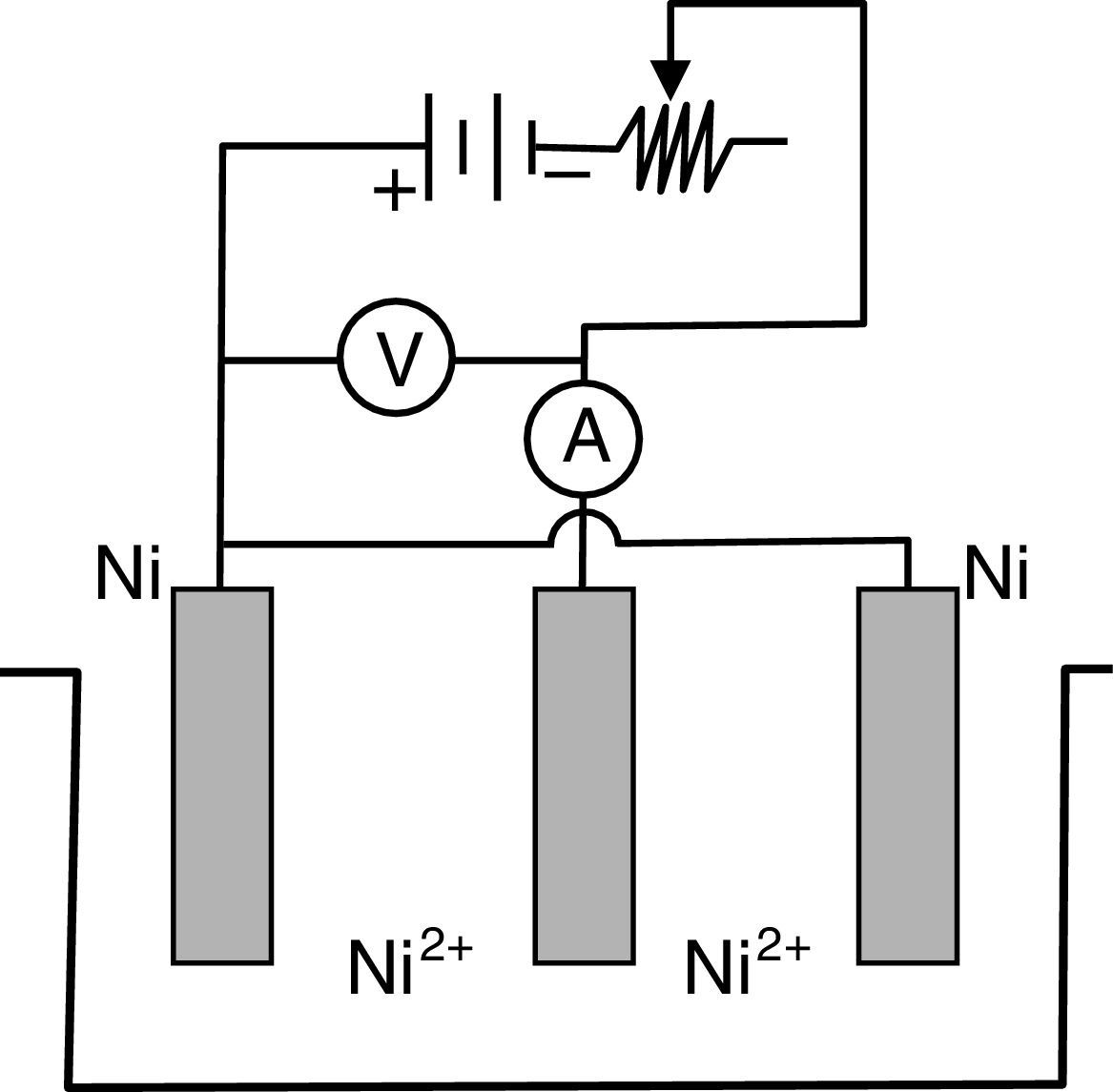
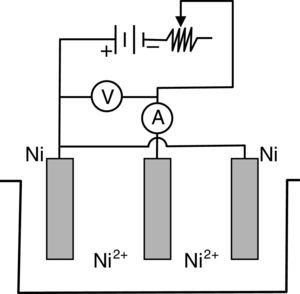
Para aplicar esta ley se debe contar con una instalación que comprende los elementos que se presentan en la figura 1.
Para el caso del niquelado, esta configuración trielectródica está formada por dos ánodos de níquel puro (que en las plantas industriales son canastillos de titanio rellenas con pellets de níquel electrolítico) y un cátodo (la pieza que debe niquelarse) ubicado en el centro de la celda electrolítica, para que se recubra por ambas caras.
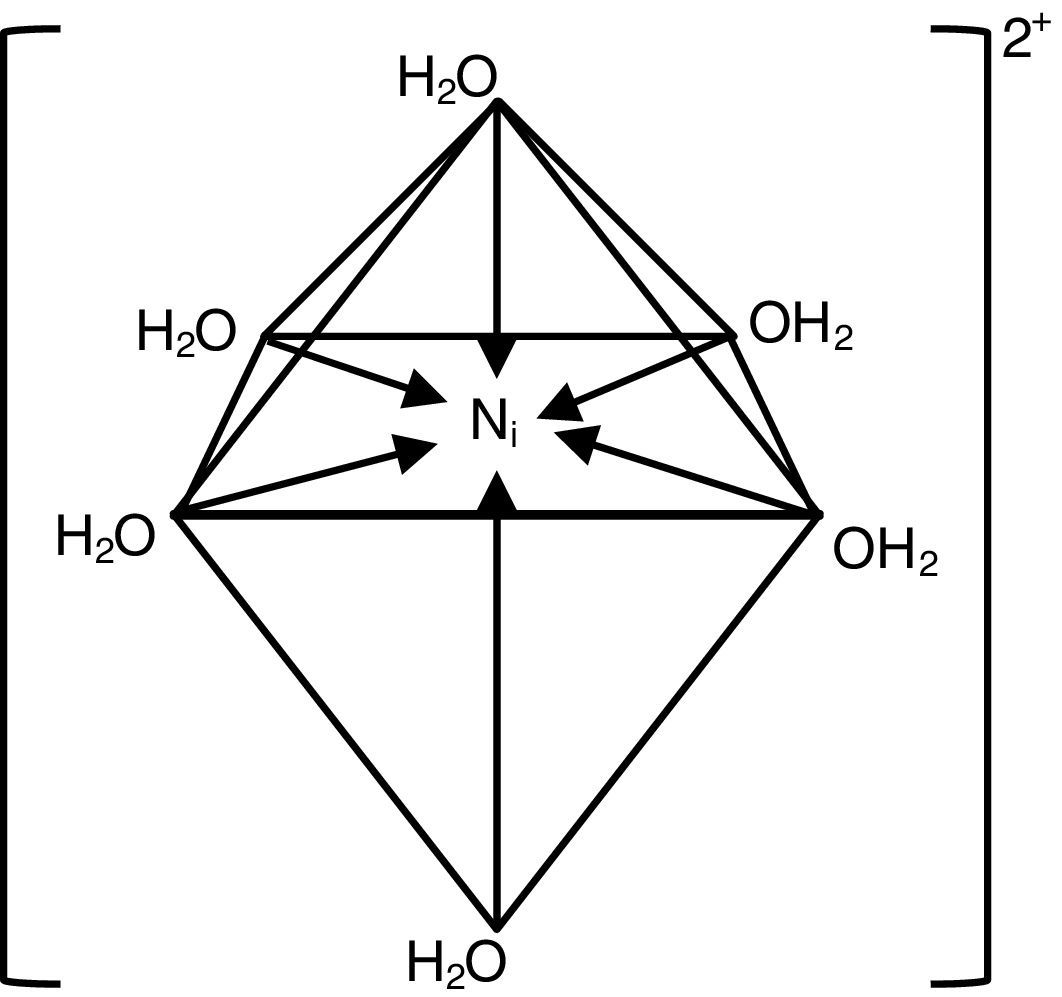
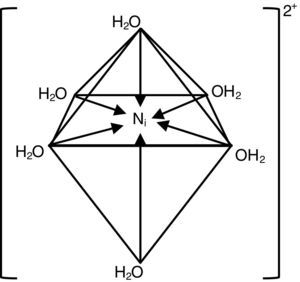
Como se observa, contiene una fuente de corriente continua, un regulador de corriente, un amperímetro, un voltímetro, un cátodo y dos ánodos, sumergidos en el electrólito que contiene una determinada concentración de sales de níquel, ácido bórico y abrillantador. La composición química del electrólito corresponde al llamado «baño de Watts» que contiene 300g/l de sulfato de níquel, 45g/l de cloruro de níquel (ambos hexahidratados), 30-37g/l de ácido bórico y cantidades variables de aditivos abrillantadores. La temperatura de operación fluctúa entre 32 y 70°C. La densidad de corriente (ddc) varía entre 1-6 A/dm2. Se prefiere trabajar con agitación permanente, y el electrólito debe ser filtrado semanalmente en función al número de piezas que se están niquelando y al grado de turbidez que presenta. El color del electrólito es verde-azulado y su intensidad permite al operador visualmente determinar cuándo está agotado y debe ser enriquecido con las dos sales de níquel (Caballero, Díez y Wideberg, 2011). El intenso color se debe a la formación de compuestos complejos; en este caso se forma un hexaacuocomplejo octaédrico, que se formula como [Ni(H2O)6]2+, y se representa estructuralmente de acuerdo con el esquema presentado en la figura 2 (Connelly et al., 2005; Housecraft y Sharpe, 2005). Esta solución tiene un espectro de absorción que presenta una banda angosta a los 395nm y dos bandas anchas entre los 570 y 800nm. Estas bandas se reproducen muy bien en las soluciones individuales de sulfato de níquel, cloruro de níquel y en la mezcla de ambas sales. Se estima que esta solución absorbe energía a 25,000, 14,000 y 9,000cm-1, y el color verde-azulado que se observa se debe a la segunda banda de absorción (aprox. 14,000cm-1).
De acuerdo al espectro electromagnético del acuocomplejo de níquel.
Esta información, entregada por el espectro de absorción en el rango visible, nos permite seleccionar el led que utilizaremos en los sensores colorimétricos (Vernier. Software y Tecnología, 2007; Pasco, 2015). Los dos tipos de sensores usados en el laboratorio (Pasco y Vernier) tienen cuatro leds: rojo (697nm), naranja (630nm), verde (565nm) y azul (460nm). Se deduce que los dos primeros podrían servir para determinar la concentración del níquel total en solución, porque son los más cercanos a la longitud de onda 680nm del complejo. Puesto que la concentración de los iones de níquel es determinante en el funcionamiento óptimo del baño de niquelado, gobernando la ddc y el umbral en que se empieza a producir un depósito nodular o el «quemado» del depósito de níquel, es indispensable controlar su concentración mediante el uso de alguna técnica analítica, usualmente la absorción atómica. Sin embargo, el sensor colorimétrico presenta una serie de ventajas frente a las clásicas técnicas instrumentales, y se ha observado que se cumple con la ley de Lambert y Beer:
donde A es la absorbancia, E es la absortividad (l/cm mol), c es la concentración de la especie absorbente (mol/l) y l es la longitud de la celda (cm). Según esta ley, la gráfica de la absorbancia vs. concentración debe ser una línea recta que pase por el origen.El sistema utilizado consta de una computadora que permite medir y monitorear las interfases y el sensor por medio de los software Data Studio y LoggerPro, generando finalmente el gráfico absorbancia vs. tiempo y hojas de cálculo.
Al estructurar una práctica de laboratorio incluyendo sensores, nos situamos en el aprendizaje de la química asistida con computación, por medio de un software (Secretaría Educación Pública, 2010; Daza et al., 2009; Quiroga, Ferrer, Sebok y Gobbi, 2014), proporcionando al alumno no solo conocimientos, habilidades y destrezas para manejar una determinada técnica, sino también se logra que aplique los conceptos e interprete matemáticamente sus resultados utilizando instrumentos con datos reales.
Parte experimentalSe utilizaron dos tipos de sensores que dieron similares resultados, de marca Pasco y Vernier. El sensor colorimétrico de la Pasco posee cuatro leds: rojo (697nm), azul (460nm), verde (565nm) y naranja (630nm) (tabla 1).
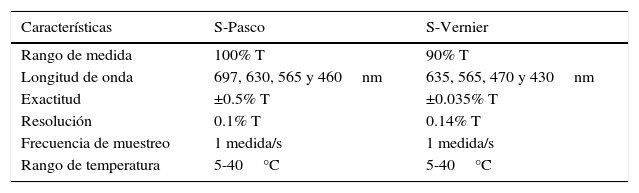
Las características de los sensores utilizados se resumen en la tabla 2.
Características de los sensores utilizados
| Características | S-Pasco | S-Vernier |
|---|---|---|
| Rango de medida | 100% T | 90% T |
| Longitud de onda | 697, 630, 565 y 460nm | 635, 565, 470 y 430nm |
| Exactitud | ±0.5% T | ±0.035% T |
| Resolución | 0.1% T | 0.14% T |
| Frecuencia de muestreo | 1 medida/s | 1 medida/s |
| Rango de temperatura | 5-40°C | 5-40°C |
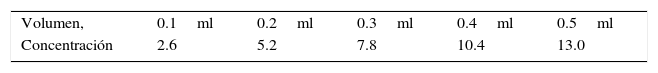
Para obtener la recta de calibrado, se utilizó la solución que contiene los componentes del baño de Watts. Se procedió a calcular el contenido de níquel total en el baño considerando las relaciones:
262.85g/mol de NiSO4 6H2O contiene 58.69g Ni.
300g de esta sal contendrán 66.98g de Ni.
En el caso del cloruro de níquel:
237.69g/mol de NiCl2 6H2O contiene 58.69g Ni.
45g de esta sal contendrán 11.11g de Ni
Es decir, en total en el baño habrán:
Si se utiliza una cubeta de 3ml de volumen, entonces tendremos que para cada alícuota de electrólito, calcularemos la concentración de níquel de acuerdo a la expresión:
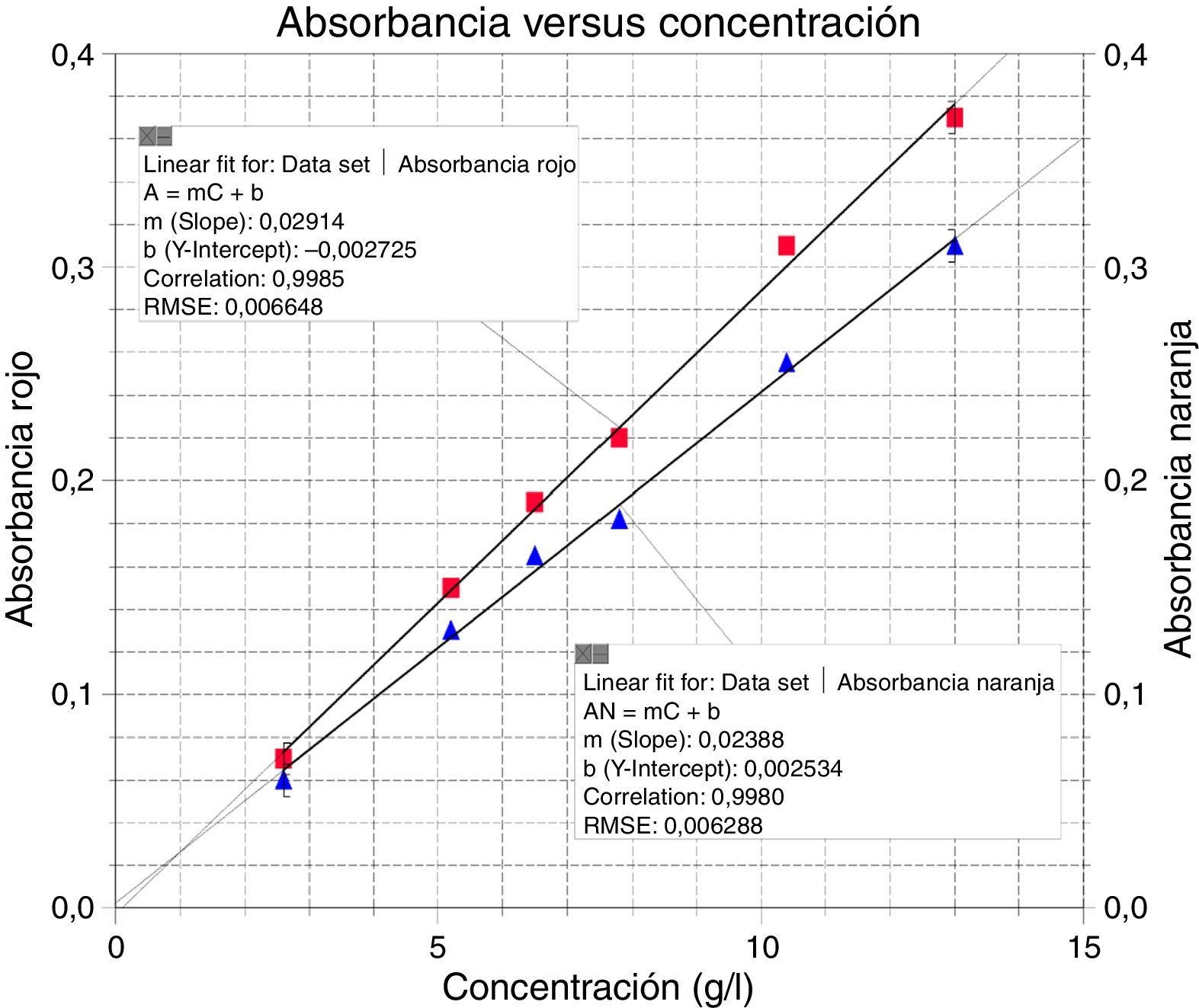
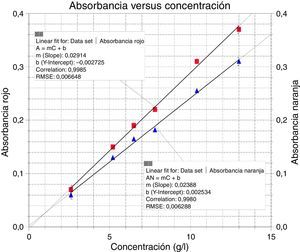
donde [Ni2+]c es la concentración de níquel en la cubeta, Ve es el volumen de la alícuota de electrólito en ml, y Vt es el volumen total de la cubeta (3ml). Los resultados se presentan en la tabla 3.Una vez llenadas las cubetas del colorímetro, se fueron registrando los valores de absorbancia. El sensor arrojó valores constantes de absorbancia vs. tiempo para cada concentración. Luego con estos datos se procedió a graficar absorbancia vs. concentración, presentados en la figura 3.
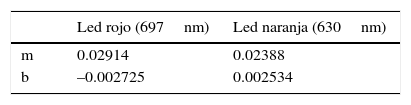
Para este rango de concentraciones se observó que tanto el led rojo como el naranja presentan buena linealidad, es decir, se cumple con la ley de Lambert y Beer, como se observa en los gráficos 1 y 2 incluidos en la figura 3. Se decidió seleccionar el rojo para las determinaciones de las concentraciones del baño de niquelado, considerando las indicaciones obtenidas de los cálculos de regresión lineal que el programa nos muestra en la figura 3.
La información obtenida de este cálculo nos permite definir la curva de calibración (repetida en tres ocasiones) que mejor representa la relación entre la absorbancia (A) y la concentración (C), es decir, será la curva que utilizaremos para la determinación de las concentraciones de las soluciones desconocidas. La interpretación de esta información es la siguiente: dado que A=mC+b, donde A es la absorbancia de la solución, C es su concentración, m es la pendiente de la curva («factor de calibración»), b es la intersección de valor de absorbancia o del eje, y n es el número de observaciones (conjunto de valores de C y de A), en este caso el programa nos arrojó los valores que se muestran en la tabla 4.
Por consiguiente, la ecuación de la mejor línea (que corresponde al led rojo) se podría representar de la siguiente manera:
La recta obtenida con el led rojo, es decir con una longitud de onda λ=697nm, presenta una mejor linealidad y una mayor pendiente. Este resultado se corrobora con el espectro de absorción del electrólito de Watts, porque presenta la mayor absorbancia entre 570-800nm.
En el electrólito de tipo Watts, debe haber inicialmente una concentración de níquel total igual a 78.09g/l, considerando el aporte de las dos sales. En función del periodo y la intensidad de explotación del baño, la intensidad del color azul-verdoso de la solución disminuye, a pesar de que durante la electrólisis el ánodo de níquel electrolítico se está constantemente disolviendo.
Se determinó en una planta de régimen normal de explotación, que la concentración de níquel fluctuó entre 8.2 y 20.9g/l en el transcurso de un mes y que mediante estos gráficos se pudo realizar el control de calidad del baño. En otras palabras, tomando una muestra de electrólito, previamente filtrada a través de carbón activado, el sensor arrojaba datos de absorbancia y con ellos se podía «rectificar» la concentración de las sales en el baño. Por ejemplo, si al cabo de 10 días de explotación se toman 0.5ml del electrólito, se diluyen hasta 3.0ml con agua destilada en la cubeta, se registra la absorbancia, y esta era igual a 0.22 (con led rojo), entonces, usando los datos de la curva de calibración, tenemos que:
Esta concentración obtenida interpolando en la curva de calibración del electrólito de Watts corresponde a la concentración de Ni (II) en el electrólito que está siendo explotado y que presenta niveles menores a los exigidos para la obtención de un recubrimiento óptimo. En otras palabras, significa que se tendrían que adicionar sales de níquel para restituir la absorbancia correspondiente a 13.01g/l.
Sin embargo, se debe recordar que la concentración de sulfato de níquel es 6.02 veces mayor a la del cloruro de níquel, es decir, se debería agregar 0.172g/l de sulfato de níquel y 0.028g/l de cloruro de níquel. En la práctica el consumo de ambas sales no se realiza en la misma proporción, y se debe determinar la concentración de cloruros en la solución para calcular en forma precisa cuál ha sido su consumo y, por diferencia, determinar la cantidad de sulfato que se debe agregar.
Si correlacionamos los cálculos arrojados por el sensor con el consumo de níquel en la planta, con el fin de conocer la cantidad de níquel que se gasta mensualmente, se plantea el siguiente problema:
Calcular la masa de níquel que se consumirá en el baño de niquelado, cuando se hace pasar una corriente eléctrica de 6A durante 160h (20días de trabajo de 8h diarias). La resolución del problema se realiza con ayuda de las leyes de Faraday. El cálculo del equivalente-gramo del níquel es 58.69/2=29.34g/Equiv-g, y la cantidad de corriente Q=6A* 576,000 s=3,456,000C. Si se sabe que 96,500C electrodepositan 29.34g de níquel, entonces los 3,456,000C depositarán 1,050.76g de níquel.
Es decir, el baño de niquelado explotado consumirá normalmente 1.051kg de níquel en los 20 días de trabajo. Entonces, una vez calculada la concentración de níquel total en el electrólito y adicionadas las sales de níquel, se completa la masa, adicionando pellets de níquel en las canastillas de titanio, que constituyen los ánodos del baño de niquelado, con el fin de restituir completamente la merma de níquel.
En el problema propuesto, si consideramos que los baños utilizados son de 100l, y se determinó que al cabo de 20 días hacían falta 0.2g/l de níquel en forma de sales, entonces la diferencia debe ser adicionada en forma de pellets:
Resultados y discusionesAl estructurar una práctica de laboratorio incluyendo sensores, se proporciona al alumno no solo conocimientos, habilidades y destrezas para manejar una determinada técnica, sino también se logra que aplique los conceptos e interprete matemáticamente sus resultados utilizando instrumentos con datos reales. Es decir, se cumple con todas las expectativas de la docencia en el laboratorio. En este caso, el alumno comprende el concepto y la técnica de medida del sensor colorimétrico, incluso conocerá el lenguaje de las características de este sensor óptico (rango de medida, precisión, linealidad, sensibilidad, resolución, rapidez de respuesta, repetitividad, etc.), es decir, está ingresando al mundo de los instrumentos modernos de laboratorio al utilizar un simple dispositivo que es capaz de medir magnitudes físicas o químicas (variables de instrumentación), que en este caso permiten resolver un problema relacionado con la determinación de la concentración de níquel en un electrólito real.
Al entender el funcionamiento básico de un sensor, el estudiante está capacitado para aplicar cualquier configuración similar (sensor-interface-computador software-pantalla) que se le presente en los cursos de química analítica instrumental o en la industria, es decir, el estudiante no solo está integrando conocimientos de diversas áreas de la química y matemática, sino que además está ingresando seriamente al mundo instrumental computacional. En suma, la práctica propuesta permite realizar posteriores ejercicios experimentales para obtener mayor número de datos, para validar el uso de sensores en este y otros procesos electrolíticos.
En este caso se utilizó un ejemplo concreto de una planta de galvanotecnia, y se demostró que con un sensor de fácil acceso y de bajo costo se puede realizar un control de calidad con resultados bastante confiables, de manera rápida e in situ.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.