Si algo he aprendido durante décadas de docencia en la Química Inorgánica, es a no usar las palabras “todos, siempre, ningún, nunca”, ya que el comportamiento de las sustancias químicas no es algo completamente conocido. Muchas de las posibles combinaciones que hasta hoy son inexistentes, pueden serlo no por imposibles, sino porque nadie las ha intentado obtener, o lo que es más, porque simplemente nadie las ha descubierto en la naturaleza.
Un ejemplo clásico en la Química Inorgánica de por qué estas palabras no deben usarse, es la existencia de compuestos de los gases nobles. Durante décadas el paradigma del octeto fue tan fuerte, que a pesar de que los laboratorios químicos de investigación contaban con todo lo necesario para preparar estos compuestos, el famoso octeto estable desalentó cualquier intento de obtenerlos.
En muy, pero muy pocas ocasiones, me doy permiso de usar alguna de estas palabras al dar mi clase, y trato siempre de resaltar ante mis alumnos lo extraordinario que tiene que ser algo para que en su descripción sea apropiada alguna de estas palabras.
Una de estas ocasiones, es cuando hablo del flúor y aseguro que nunca se le encuentra en estado elemental en la naturaleza. Se sabe que la obtención de este halógeno en estado elemental ha sido una de las mayores proezas experimentales en la historia de la química. Experimentadores tan notables como Scheele, Davy y Gay Lussac fracasaron en el intento, llevándose como único resultado quemaduras serias. Los hermanos George y Thomas Knox también sufrieron serias quemaduras que casi matan a Thomas y los investigadores Paul Louyet en Bélgica y Jerome Nickles de Francia literalmente murieron en el intento.
Fue Henry Moissan, en París, quien después de varios intentos logró finalmente domar a la fiera en 1886. Esta hazaña, que muy pocos en la actualidad han vuelto a intentar, le valió el premio Nobel de Química en 1906, cuando se lo ganó a Dimitri Mendeleiev, quien murió al año siguiente, sin Premio Nobel.
Y ahora me entero de que hay un mineral que en algunas vesículas en su estructura contiene un gas que es nada menos que flúor elemental.
Se trata de un mineral conocido hace unos doscientos años, que por su particular olor se conoció como fluorita fétida o antozonita. Químicos tan célebres como Wöhler y von Liebig propusieron varias posibles fuentes del olor y a lo largo de los años las pruebas químicas y aun la espectrometría de masas no lograron descifrar el misterio; se llegó a proponer que el olor provenía de compuestos de fósforo, de arsénico, o de yodo, azufre, selenio u oxígeno elemental en la forma de ozono.
En 2012, el equipo de científicos dirigidos por el Prof. Florian Kraus, en la Universidad Técnica de Munich, Alemania, han demostrado la presencia de flúor elemental en muestras de esta pestilente fluorita, mediante pruebas de Resonancia Magnética Nuclear de 19F. En estas determinaciones, que se realizaron in situ (sin destruir las muestras) se encontró claramente una señal que es asignable sin lugar a duda a la especie F2.
La explicación surge cuando se analiza el efecto del contenido de material radiactivo en el mineral. El uranio contenido en trazas en la antozonita emite radiación ionizante que permite la formación de átomos de F, que a su vez forman moléculas de F2 en vesículas de CaF2, lo que las mantiene aisladas y por lo tanto estables.
Increíble que no se hubiera detectado hasta 2012 que el olor de ese mineral era debido a flúor elemental. ¿Cómo hallaron estos alemanes que estaba atrapado el F2 en la matriz cristalina? Espero que nos cuentes más sobre ello. Andoni Garritz Director de Educación Química
Pues la referencia del Angewandte Chemie International Edition narra lo siguiente:
La fluorita CaF2, suele tener color, cuyo origen ha sido estudiado previamente. Esto se ha atribuido a la presencia de una gran variedad de impurezas, entre ellas uranio y algunos otros elementos radiactivos. Se ha asociado el color de las muestras a la demostrada presencia de cúmulos de calcio metálico en muestras del mineral. Inclusive se han producido estos cúmulos de calcio metálico en muestras de CaF2 sintético e incoloro, mediante irradiación (β, γ, láser). Junto con la formación de cúmulos durante los experimentos de irradiación se observó la formación de burbujas y se propuso que el gas formado era F1.
La muestra de antozonita o fluorita fétida analizada por los autores del trabajo que ahora reseño contenía 235U, 238U, y sus productos 224Th, 234Pa, 214Pb, 214Bi, 210Pb y 210Bi, capaces de emitir radiación. β.
OLIERON el gas que salió de la muestra al triturarla y compararon el olor con F2 de procedencia conocida, y comprobaron que el olor era el mismo. Los investigadores declaran que el olor es muy diferente al O3, Cl2, OF2, HOF, HF y XeF2, ya que OLIERON todos éstos y resultaron ser diferentes.
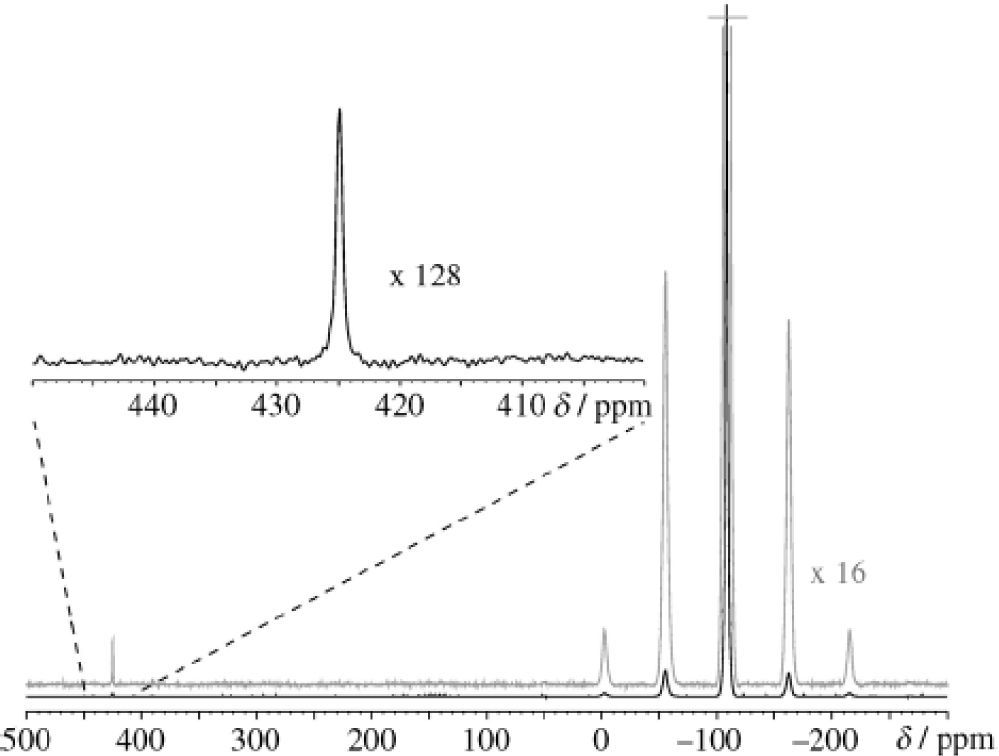
Para confirmar sus observaciones organolépticas, decidieron someter la muestra mineral a RMN de 19F en estado sólido y obtuvieron el espectro que se muestra en la figura 1.
Las señales centradas en −109 ppm corresponden al F− en la fluorita, mientras que la pequeña señal que se observa en 425 ppm es asignable al F2. Mediante varias mediciones cuantitativas, se obtuvo que la concentración de F2 en la muestra era de 0.46+0.06 mg/g de antozonita. Laura Gasque
Dr. Francisco José Barnés de Castro, Director Fundador
Dr. Jorge Manuel Vázquez Ramos Director de la Facultad de Química, UNAM
Dr. Eduardo Bárzana García Secretario general de la UNAM
Dra. Suemi Rodríguez Romo, Directora de la Facultad de Estudios, Superiores Cuautitlán
Dra. Cecilia Anaya Berríos, Presidente Nacional de la Sociedad, Química de México
Andoni GarritzRuiz
(andoni@unam.mx)
Gisela Hernández Millán
(ghm@unam.mx)
Arturo Villegas Rodríguez
(arturovr@gmail.com)
Carlos Amador Bedolla
Silvia Bello Garcés
Adela Castillejos Salazar
José Antonio Chamizo Guerrero
Enrique González Vergara
Hermilo Goñi Cedeño
Gisela Hernández Millán
Jorge G. Ibáñez Cornejo
Glinda Irazoque Palazuelos
Rafael Martínez Peniche
Ana Martínez Vázquez
María Teresa Merchand Hernández
Adolfo Obaya Valdivia
Laura Ortiz Esquivel
Aarón Pérez Benítez
Clemente Reza Martínez
Alberto Rojas Hernández
Yadira Rosas Bravo
Plinio Sosa Fernández
Marta Bulwik (Ministerio de Educación, Argentina)
Alvaro Chrispino (Centro Federal de Educagao Tecnológica Celso Suckow da Fonseca, Brasil)
Cecilia I. Díaz V (Panamá)
Manuel Fernández Núñez (Universidad de Cádiz, España)
Gabriel A. Infante (Pontificia Universidad Católica de Puerto Rico)
Mercé Izquierdo Aymerich (Universidad Autónoma de Barcelona, Catalunya)
María Gabriela Lorenzo (Universidad de Buenos Aires, Argentina)
Rómulo Gallego (Universidad Pedagógica Nacional, Colombia)
Manuel Martínez Martínez (Universidad de Santiago, Chile) Mansoor Niaz (Universidad de Oriente, Venezuela)
José Claudio del Pino (Universidade Federal do Rio Grande do Sul, Brasil)
Mario Quintanilla Gatica (Pontificia Universidad Católica de Chile)
Andrés Raviolo (Universidad Nacional del Comahue, Argentina) Joan Josep Solaz-Portolés (Universitát de Valencia, España)
Santiago Sandi-Ureña (University of South Florida, USA)
Vicente Talanquer Artigas (University of Arizona, USA)
Jesús Vázquez-Abad (Université de Montréal, Canadá)
Amparo Vilches(Universitat de Valencia, España)
Jaime Wisniak (Ben-Gurion University of the Negev, Israel)
Lourdes Zumalacárregui (Instituto Superior Politécnico “José Antonio Echeverría”, Cuba)
Guadalupe Rangel Esparza/ Caligrafía Digital, SC TeL: (55) 4352 2030 educacion.quimica@gmail.com
Alberto Villagómez Guzmán, Gabriela Araujo
Formación Gráfica, SA de CV, Matamoros # 112, Col. Raúl Romero, 57630, Edo. de México, Tel. (55) 5797 6060
Suscripciones benefactoras adquiridas
José Luis Mateos Gómez (Fundador)
Francisco Barnés de Castro
Adela Castillejos Salazar
José María García Sáiz
Gustavo TavizónAlvarado
Kira Padilla Martínez
Eduardo Rojo y de Regil
Silvia Bello Garcés
Plinio Sosa Fernández
José Manuel Méndez Stivalet
Glinda Irazoque Palazuelos
Universidad Autónoma Metropolitana