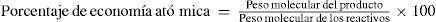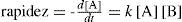In the present work, an introduction to Green Chemistry and its 12 principles are discussed. Additionally, the experiences of the author on the application of green chemistry in teaching are described.
Como producto de la actividad industrial desarrollada desde finales del siglo XIX (en los inicios de la Revolución Industrial) y durante todo el siglo XX, el ser humano logró un incremento en su calidad de vida, el cual lamentablemente también implicó un gran deterioro del medio ambiente, debido a que se generaron graves problemas de contaminación, sobre todo en el último cuarto del siglo XX. Para tratar de resolver estos problemas de contaminación se propuso el programa de Química Verde, cuyo principal objetivo era hacer una química más benigna con el medio ambiente, y a través del cual se pretenden desarrollar procedimientos sintéticos benignos con este último (Marteel-Parrish, 2007).
Este programa toma en cuenta los problemas de generación de residuos (los intenta minimizar más que tratarlos) y sobre todo procura recuperar las materias primas para poderlas volver a utilizar (Uffelman, 2007). Algo que es un hecho, es que nadie puede juzgar los problemas involucrados en los procesos químicos de una mejor manera que los propios científicos del área. Esto significa que solamente un químico bien entrenado, independiente y responsable es quien deberá establecer las políticas ecológicas, y no los políticos, ya que estos últimos son los que tienden a reaccionar con exageración a los escándalos sobre la contaminación, sin un conocimiento profundo del problema. Ninguna de las soluciones a los problemas ecológicos para el siglo pasado (siglo XX) provino de políticos, incluyendo las propuestas de los partidos autodenominados ecologistas. Siempre han sido los científicos químicos en activo, quienes han cambiado los productos y los hábitos conforme surgen los problemas. Un ejemplo de lo anterior es el programa de Química Verde, que se desarrolló a finales del siglo XX, y el cual fue propuesto originalmente en los Estados Unidos de Norteamérica (Warner and Anastas, 2000), y que en la actualidad también se aplica en la Unión Europea, así como en otras partes del mundo. Esta estrategia, que se ha aplicado tanto a nivel educativo, como a nivel científico e industrial, busca implementar buenas prácticas en la síntesis de compuestos químicos. La propuesta consta de 12 principios, los cuales fueron planteados por Paul Anastas, quien entonces se encontraba trabajando en la EPA (Agencia de Protección Ambiental, por sus siglas en inglés) y por John C. Warner (Universidad de Massachusetts, Lowell) (Anastas and Warner, 2000). Estos principios son una guía que ayuda a explicar y aplicar lo que significa la definición de la Química Verde (Fuhrhop and Li, 2003).
Estos 12 principios proporcionan un marco de referencia para que los químicos puedan aplicar la filosofía de la química verde, y los cuales son los siguientes:
- •
Prevención en la generación de residuos.
- •
Maximizar la economía atómica.
- •
Síntesis empleando sustancias no tóxicas.
- •
Diseño seguro, con productos químicos eficaces y de poca toxicidad.
- •
Evitar el uso de sustancias auxiliares.
- •
Eficiencia energética.
- •
Uso de materias primas renovables.
- •
Reducción de derivados.
- •
Catálisis: se emplearán catalizadores lo más selectivos posibles.
- •
Degradación limpia para que los productos químicos no persistan en el medio ambiente.
- •
Análisis (monitoreo) continuo de contaminación.
- •
Seguridad intrínseca y prevención de accidentes.
Cuando un químico toma en cuenta estos principios, él mismo favorece al medio ambiente y a la larga se pueden disminuir los gastos económicos de las compañías al reducir el costo que implica el control de la contaminación y la cantidad de energía utilizada. Esta propuesta cae dentro de un concepto más amplio como lo es la sustentabilidad (desarrollo sustentable o sustentabilidad ecológica) (León-Cedeño, 2008-2009).
En los procesos sintéticos, el pilar fundamental de esta propuesta es la catálisis (Trost, 1995, 2002). Los requerimientos de energía, la cantidad de residuos, y el número de pasos en los procesos de aislamiento y purificación, todos son minimizados al incrementar la selectividad de las reacciones catalizadas. Las reacciones en las que se forman enlaces carbono-carbono utilizando paladio como catalizador (por ejemplo las reacciones de Heck (1968), de Noyori (1987) y de Suzuki (1995)) son estrategias que se aplican con éxito en esta dirección y las cuales ya se aplican con tanta frecuencia como es posible tanto en los laboratorios de investigación como en la industria (Aktoudianakis, et al., 2008).
Además, los procesos sintéticos deben ser átomo eficientes, esto es, que la mayor parte de la masa de los reactivos quede incorporada en la masa de los productos. Además, los reactivos deberán ser lo más simples como sea posible. Se han propuesto varias maneras de cuantificar qué tan verde es un proceso, como por ejemplo midiendo su eficiencia atómica, una propuesta hecha por Barry Trost de la Universidad de Stanford (Trost, 1995, 2002; Andraos and Sayed, 2007). La economía atómica se define por la siguiente relación (ecuación 1).
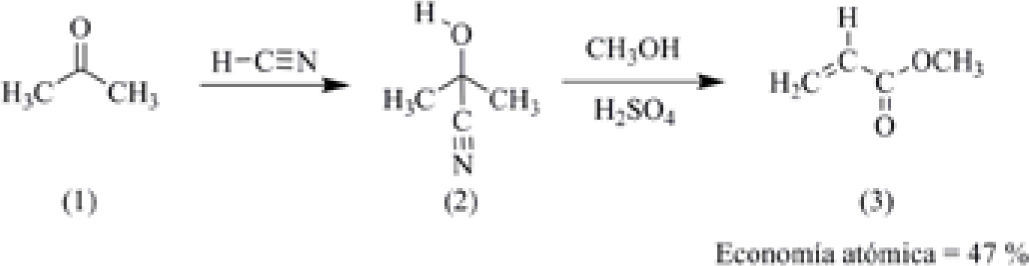
Un ejemplo para ilustrar lo anterior se encuentra en una modificación hecha por la Compañía Shell Corporation para obtener el metacrilato de metilo (3) (esquema 1), el cual es el precursor utilizado para la fabricación del polimetacrilato de metilo, también llamado vidrio orgánico y que tiene las marcas registradas de Plexiglas y Lucite. La primera síntesis utiliza como materia prima a la acetona (1), la cual se hace reaccionar con cianuro de sodio en presencia de un catalizador ácido para formar la cianohidrina de la acetona (2), la cual al reaccionar con metanol en presencia de ácido experimenta una reacción de deshidratación y conversión del nitrilo en el éster metílico, formando el compuesto (3). Todo el proceso tiene una economía atómica del 47%.
En el proceso de la Compañía Shell Corporation para obtener el metacrilato de metilo, la economía atómica es muy baja, debido a que el ácido cianhídrico y el ácido sulfúrico se utilizan en cantidades estequiométricas (Sheldon, 1997).
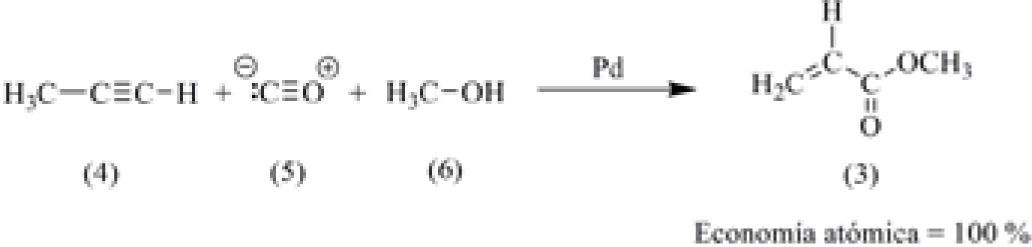
En la síntesis modificada haciendo uso de los principios de la Química Verde, se hace uso de un proceso catalítico. En este proceso, se utiliza como materia prima el propino (4), el cual se hace reaccionar con monóxido de carbono (5) y metanol (6), en presencia de paladio metálico como catalizador (esquema 2). Este proceso tiene una economía atómica del 100%, ya que todos los átomos de los reactivos quedan incorporados en el producto final (Sheldon, 1997).
Los compuestos químicos que tienen usos domésticos e industriales siempre deberán ser biodegradables, así como lo deberían de ser los intermediarios en sus propias síntesis químicas, principio 10 de la Química Verde (Robert and Aubrecht, 2008).
Otros de los principios de la Química Verde (principios 3 y 5) implican eliminar o bien reemplazar los disolventes orgánicos por el agua o por fluidos supercríticos, en particular el dióxido de carbono (CO2). Este último no sólo se ha utilizado como disolvente en la industria de la limpieza en seco (tintorerías) sino que en general el CO2 puede sustituir a los disolventes clorados (Hitzler, 1997). Sin embargo, el agua es con mucho el principal disolvente de elección en la síntesis no covalente y su uso se ha incrementado en la síntesis covalente (Sobral, 2006; Sauvage and Delaude, 2008; Aktoudianakis, et al., 2008).
En cuanto a la posibilidad de llevar a cabo las reacciones químicas sin utilizar disolventes, si consideramos una reacción de segundo orden, en la que los reactivos A y B interaccionan entre sí para formar el producto D,
La expresión para la rapidez de dicha reacción de segundo orden se muestra en la ecuación 2.
La ecuación 2 representa cómo influye en la rapidez de la reacción la concentración de los reactivos en el paso lento determinante de la rapidez de dicha reacción. De acuerdo con esta ecuación, si la concentración se incrementa, la rapidez de la reacción también se incrementa. Si se elimina el uso del disolvente, la concentración será la más alta posible y por lo tanto la rapidez de la transformación de los reactivos en el producto también será la máxima posible. Uno de los principios de la Química Verde (principio 5) implica el aplicar lo anterior, eliminando el uso del disolvente (como una sustancia auxiliar) en muchas reacciones de segundo orden, con lo que se ha conseguido llevar a cabo las reacciones a temperatura ambiente y en tiempos de reacción cortos (Doxsee and Hutchinson, 2004; Chi Nguyen and Weizman, 2007; Crouch, et al., 2007).
La sustitución de los ácidos de Lewis solubles por soportes sólidos (formados por aluminosilicatos, sulfatos o fosfatos), y los cuales pueden contener dentro de su estructura a los propios ácidos de Lewis como el cloruro de aluminio, es una práctica común (Clark, 2002). La ventaja de esta técnica es que una vez que termina la reacción, los sólidos son separados por medio de una filtración, y es posible reactivarlos y reciclarlos. Esto ayuda a prevenir la generación de residuos (Sereda and Rajpara, 2007; Christensen, et al., 2008). Una técnica que ha venido a complementar el uso de los soportes sólidos es la síntesis orgánica asistida por microondas (MAOS por sus siglas en inglés) (Dinstzner, Wucka, and Lyons, 2006; Montes, et al., 2006; Martin and Kellen-Yuen, 2007; Musiol, et al., 2006; Juaristi, 2009). Recientemente, se han utilizado los líquidos iónicos como disolventes y medios iónicos para llevar a cabo numerosas reacciones en química orgánica (Mak, et al., 2006; Cheney, et al., 2008).
Finalmente, y algo que ya es usual en la Química Verde, es que se debe hacer uso de materias primas renovables. Por ejemplo, ya se hace uso del ácido láctico para formar polímeros biodegradables (principios 3 y 7 de la Química Verde) (Robert and Aubrecht, 2008).
Con todos estos antecedentes, a continuación se mostrarán algunas de las experiencias que el autor ha desarrollado aplicando algunas de las técnicas de la Química Verde en sus actividades docentes en la Facultad de Química de la Universidad Nacional Autónoma de México (UNAM), en la Escuela de Ciencias Químicas de la Universidad La Salle, (ULSA), así como en la Olimpiada Nacional de Química, el cual es uno de los Programas de la Academia Mexicana de Ciencias.
Los objetivos concretos que se persiguen son los siguientes:
- a)
Que el alumno conozca estas nuevas técnicas para llevar a cabo reacciones químicas.
- b)
Hacer más sencillos los experimentos, al eliminar el uso de disolventes (aplicando el principio 5 de la Química Verde), además las reacciones se llevan a cabo a temperatura ambiente, con lo cual se evita el calentamiento a reflujo y de esta manera se elimina o disminuye el consumo de energía (aplicando el principio 6 de la Química Verde).
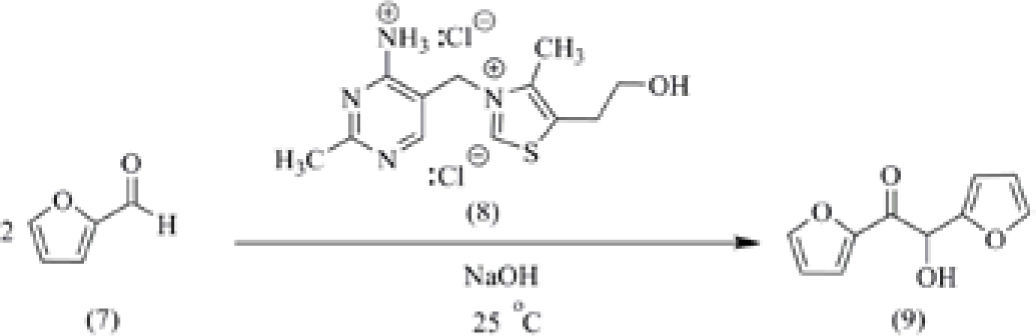
a) Reacción de condensación benzoínica. Ya se ha descrito el uso de la tiamina (8) como catalizador en la reacción de condensación benzoínica, (Doxsee and Hutchinson, 2004, pp. 201-205), la cual se ha ejemplificado utilizando furfural (7) como sustrato para obtener furoína (9) como producto (esquema 3). Esta técnica modificada es importante, ya que cuando la reacción se lleva a cabo empleando la técnica normal, se utilizan cianuros metálicos como catalizadores empleando calentamiento a reflujo. El uso de la tiamina como catalizador implica la ventaja de utilizar un reactivo inocuo, no tóxico, en lugar del cianuro (principios 3 y 12 de la Química Verde). Además, la reacción se lleva a cabo a temperatura ambiente (ahorro de energía, principio 6 de la Química Verde). Lo importante en la técnica, para asegurar un buen éxito en esta reacción, es la adición lenta del hidróxido de sodio sobre la tiamina, en frío (baño de hielo) y en porciones. La mezcla de reacción se deja dentro de un recipiente que se mantiene cerrado y aislado de la luz. A los tres días se observa la formación de producto, el cual se aísla por filtración y se purifica por recristalización de etanol. Esta reacción se lleva a cabo utilizando diferentes aldehídos (furfural, 2-carboxalde-hídopirrol o bien derivados del benzaldehído).
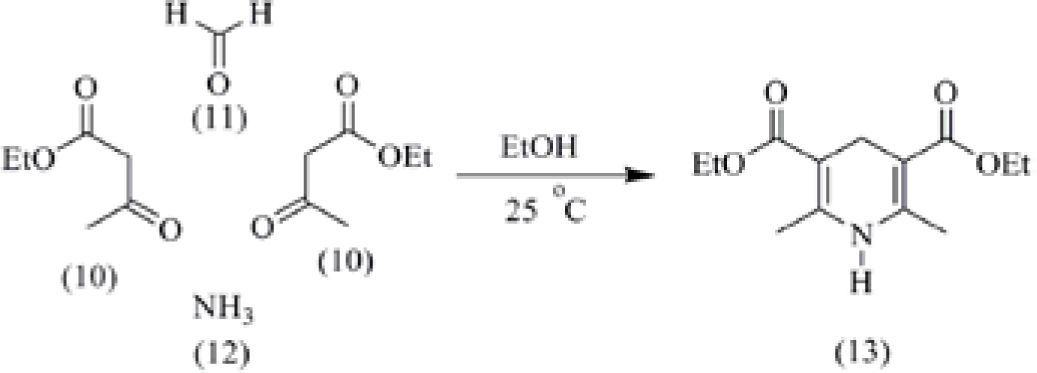
b) Sintesis de 1,4-dihidropiridinas de Hantzsch. Un grupo de profesores del Departamento de Química Orgánica de la UNAM decidió extrapolar las condiciones de la reacción de multicomponentes (o dominó) a la reacción de Hantzsch para obtener 1,4-dihidropiridinas, transformación que ya está descrita bajo condiciones libres de disolvente (Gupta, Paul, and Loupy, 2007). La reacción consiste simplemente en mezclar los reactivos en un recipiente: dos equivalentes del acetoacetato de etilo (10), el formaldehído (11) y el amoniaco (12) (esquema 4), en presencia de etanol. Se tapa el frasco, el cual se mantiene cerrado a temperatura ambiente (aplicando el principio 6 de la Química Verde) y a los tres días se observa la formación del producto, la 3,5-dietoxicarbonil-2,6-dimetil-1,4-dihidropiridina (13), la cual se aísla por filtración y se purifica por medio de una recristalización con etanol.
2) Reacciones efectuadas a temperatura ambiente en ausencia de disolventeComo ya se comentó, uno de los objetivos de la Química Verde es el de eliminar el uso de disolventes, para incrementar la concentración de los reactivos y en forma proporcional incrementar la rapidez de las reacciones efectuadas. La reacción de condensación aldólica cruzada dirigida, que se conoce como la reacción de Claisen-Schmidt, ya está descrita para obtener cetonas α,β-insaturadas, empleando hidróxido de sodio, sin utilizar disolvente y a temperatura ambiente (Doxsee and Hutchinson, 2004, pp. 115-119). Se han desarrollado técnicas para llevar a cabo diferentes reacciones de este tipo, las cuales se comentan a continuación. Una constante en todas las técnicas desarrolladas es que los alumnos utilizan un vaso de precipitados y una varilla de vidrio como el equipo normal para llevar a cabo estas transformaciones.
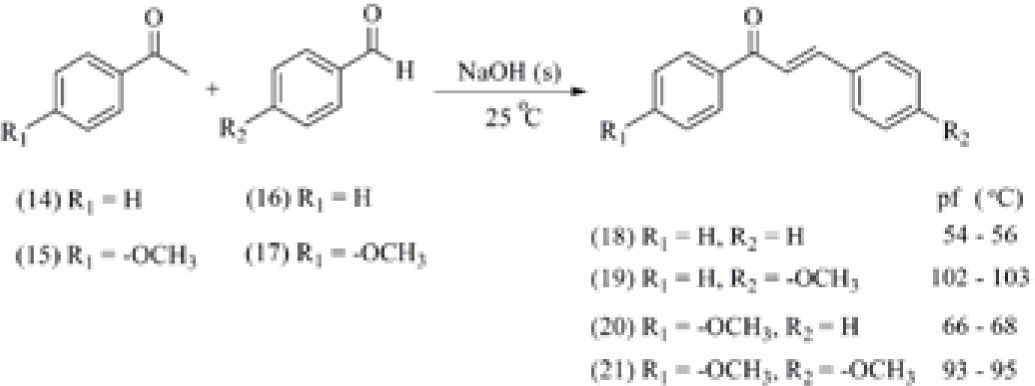
a) Se desarrolló y optimizó la reacción de Claisen-Schmidt para obtener derivados de la chalcona, utilizando acetofenona (14), o bien la 4-metoxiacetofenona (15), y como aldehídos al el benzaldehído (16), o bien el 4-metoxibenzaldehído (17) (esquema 5). En esta técnica la chalcona (18) se forma en menos de 5 minutos de agitación y en otros casos se debe agitar por unos 20 minutos (compuesto (21)). Debido a que se pueden obtener las combinaciones de productos que aparecen en el Esquema 5, el experimento permite evaluar la habilidad manual del estudiante y su poder de deducción, al considerar el punto de fusión de cada uno de los cuatro posibles productos obtenidos (Ríos-Quiroz, 2007).
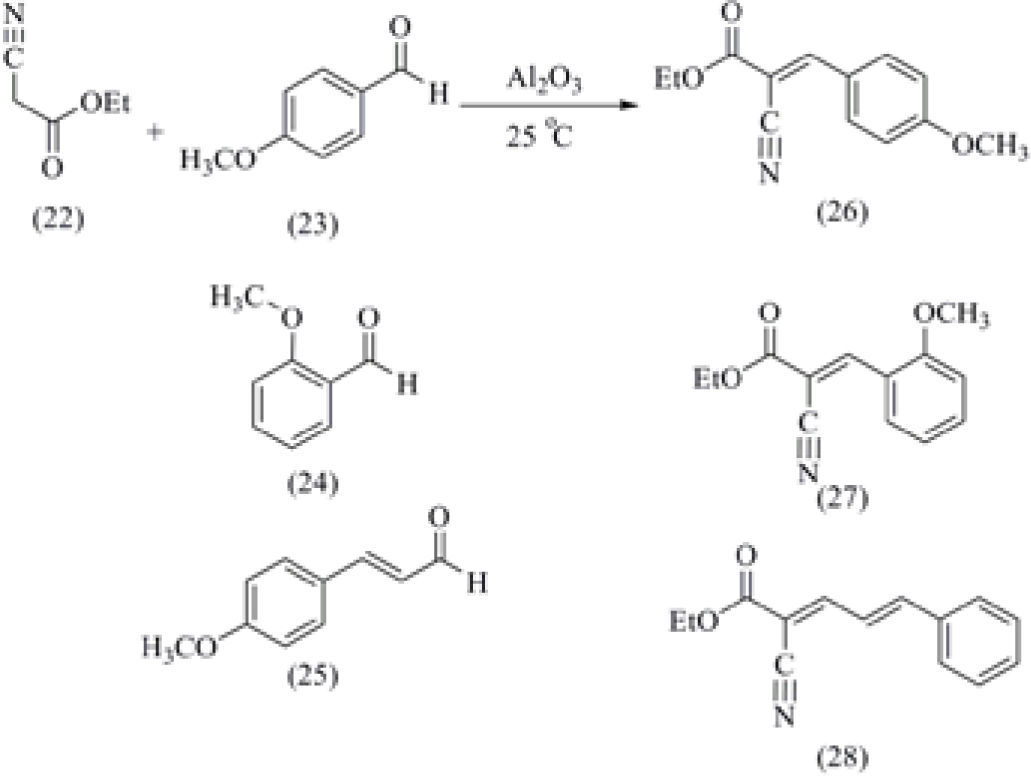
b) Una reacción relacionada con la transformación de Claisen-Schmidt es la condensación de Knoevenagel, la cual consiste en la reacción entre un compuesto con hidrógenos activos y un aldehído (Texier-Boullet and Foucaud, 1982). En la 14ª Olimpiada Nacional de Química (Universidad de Sonora, Hermosillo, 2005), se utilizó el cianoacetato de etilo (22) el cual se hizo reaccionar con tres aldehídos diferentes, como el 4-metoxibenzaldehído (23), el 2-metoxibenzaldehído (24) y el cinamaldehído (25), esquema 6.
Con estos tres aldehídos se lograron obtener tres productos diferentes, el 2-ciano-3-(4'-metoxifenil)-2-propenoato de etilo (26), el 2-ciano-3-(2'-metoxifenil)-2-propenoato de etilo (27), y el 2-ciano-5-fenil-2,4-pentadienilato de etilo (28), y cada uno de ellos presentaron diferentes valores de RF con lo cual los alumnos que participaron en la Olimpiada pudieron identificar el aldehído con el que trabajaron empleando la técnica cromatografía en capa fina (Elizalde-Galván, 2005).
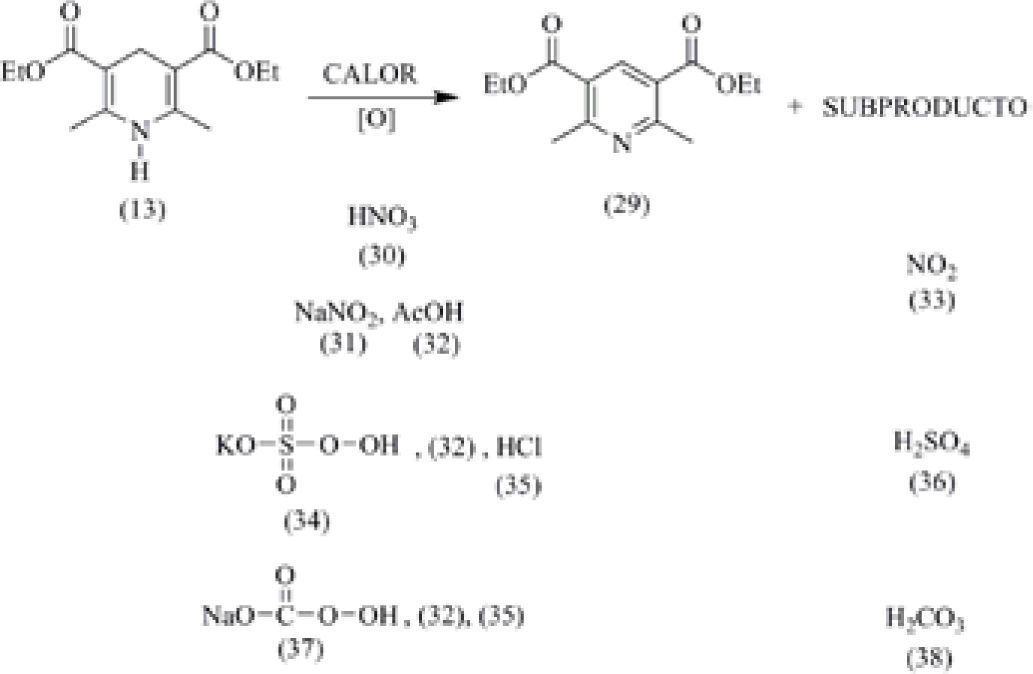
3) Uso de nuevos agentes oxidantesOtra de las prácticas en las que se aplican algunos principios de la química verde es en la oxidación de 1,4-dihidropiridinas para obtener las piridinas correspondientes. Por ejemplo, en el esquema 7 se muestra la oxidación de la 3,5-dietoxicarbonil-2,6-dimetil-1,4-dihidropiridina (13) que se oxida para formar la 3,5-dietoxicarbonil-2,6-dimetilpiridina (29). Los agentes oxidantes que se pueden utilizar en la técnica normal son el ácido nítrico (30) o bien el nitrito de sodio (31) en presencia de ácido acético (32). El principal problema cuando se utilizan los dos reactivos anteriores es que se genera como subproducto dióxido de nitrógeno (33), el cual es muy tóxico. Dentro de los nuevos agentes oxidantes de los que se dispone, y que permiten aplicar los principios 3 y 12 de la Química Verde, se encuentran el oxono (el monopersulfato de potasio) (34) (Beaulieu, et al., 2003) que genera como subproducto ácido sulfúrico (36) y el monopercarbonato de sodio (37) (McKillop, and Sanderson, 1995) cuyo subproducto es ácido carbónico (38) que se descompone en dióxido de carbono y agua. Se logró establecer que los dos reactivos funcionan bien con una mezcla de ácido acético (32) y de ácido clorhídrico (35) en una relación (6:4), bajo calentamiento a reflujo por 60 minutos (Menes-Arzate, 2007).
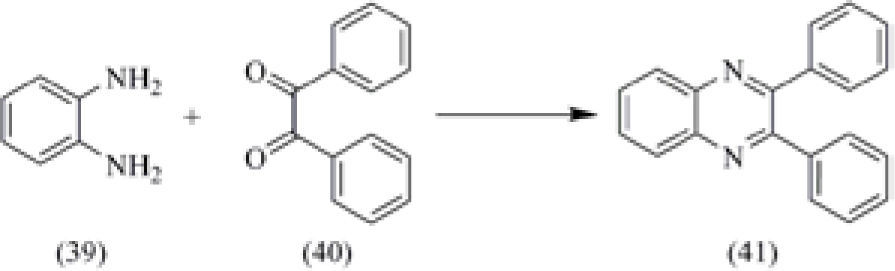
4) Reacciones efectuadas utilizando la Síntesis Orgánica Asistida con Microondas (MAOS)El uso de las microondas para llevar a cabo la síntesis de compuestos orgánicos, aplicando la técnica en fase sólida empleando arcillas como soportes para los catalizadores (técnica MAOS), es una alternativa que se ha empleado en los laboratorios de docencia e investigación en la UNAM y en la ULSA (León-Cedeño, 2009). Un ejemplo de la aplicación de la técnica MAOS es en la síntesis de quinoxalinas, para ilustrar la formación de 1,4-diazinas. Estos últimos compuestos son importantes, ya que las 1,4-diazinas se forman durante el calentamiento de los alimentos, y son las responsables de su aroma y sabor. Para tal propósito, se lleva a cabo la síntesis de la 2,3-difenilquinoxalina (41) por medio de la reacción de condensación entre la orto-fenilendiamina (39) con el bencilo (40), esquema 8. La síntesis normal consiste en calentar a reflujo los dos reactivos en presencia de etanol como disolvente por 15 minutos. Cuando se emplea el calentamiento con microondas, el tiempo de reacción se reduce a 1 minuto.
Sorprendentemente, si los reactivos se mezclan a temperatura ambiente, agitando con una varilla de vidrio, ocurre la reacción a los tres minutos (aplicando el principio 6 de la Química Verde) (Jiménez-Curiel, 2008).
Conclusiones- 1)
El uso de algunas de las técnicas de la Química Verde ha permitido reducir los tiempos de reacción al eliminar el uso de disolventes y ahorrar en el consumo de energía, ya que muchas de las reacciones se llevan a cabo a temperatura ambiente.
- 2)
El material de vidrio para llevar a cabo dichas transformaciones acaba siendo un vaso de precipitados y una varilla de vidrio.
- 3)
Se han cumplido los objetivos planteados originalmente, ya que los alumnos conocen éstas técnicas y las cuales esperamos que las apliquen en su futura vida profesional.