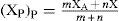This study presents the history of the conceptual development of a model which integrates and distinguishes three types of primary bonds. A triangle is obtained by plotting two of any different variables of the electronegativity for binary compounds. This allows the segregation of the well defined ionic, covalent and metallic compounds into three regions. The aims of this work are: 1. To popularize the model and to encourage its use among the students; 2. To display its advantages and limits; 3. To infer the impact of the model on: a) The classification of the compounds primarily covalent, ionic and metallic; b) The concept of the intermediate bonding between covalent and metallic for homonuclear compounds and among covalent, ionic and metallic for heteronuclear ones, and c) The definition of a criterion to divide between ionic and covalent compounds.
La química moderna tiene sus raíces en tres conceptos fundamentales: 1) las moléculas están formadas por átomos que se mantienen juntos debido a enlaces químicos; 2) en los enlaces químicos está involucrada una distribución compartida de electrones entre los átomos que los forman, y 3) los electrones no siempre se comparten equitativamente. Esta trilogía, representada en la frase “Las moléculas son átomos unidos por electrones que se comparten inequitativamente” posibilita que la electronegatividad se vea como ese “algo” de los átomos que, al unirse, causa que los electrones del enlace se compartan de manera desigual. Todo lo anterior según las ideas de Mullay (1987). No hay autor que no reconozca la relación entre la electronegatividad y el enlace; de una u otra forma es íntima. Por eso, para determinar la naturaleza del enlace es útil tomar como guía la propiedad atómica llamada electronegatividad.
Para la mayoría de los alumnos —en los semestres iniciales de una licenciatura— no es fácil comprender estos conceptos; aun para los maestros encargados de su aprendizaje la tarea no es sencilla: nada tan difícil como enseñar conceptos nuevos a alumnos de recién ingreso. Por ello se hace necesario definir qué y qué tanto se desea que los alumnos comprendan de esos conceptos, esto es, su nivel, extensión e implicaciones —entre ellas su aplicación, su utilidad—, para cada semestre de la carrera en cuestión, y cómo hacerlo. Las características y las distintas ideas existentes sobre cada concepto impiden un conocimiento concreto. Por otro lado, sabemos que no existen “Verdades”, sólo diversas maneras —parece que cada vez mejores— de ver y entender las cosas; cada químico comprometido con el conocimiento y la educación tiene su idea (su verdad) de lo que es e implica cada concepto. Por lo mismo, los libros de texto introductorios de química y los profesores de las materias respectivas presentan los conceptos de manera diferente en cantidad, enfoque y profundidad. Detectamos que tienen en común que: 1) los muestran como generalizaciones —no señalan sus límites— en un afán simplificador; 2) los plantean como verdades; 3) se hace con poca creatividad y motivación, y 4) no enseñan a aplicarlos, a cuestionarlos, ni a relacionarlos con aspectos de la vida cotidiana.
Además, durante el aprendizaje es muy importante cómo se adquiere el conocimiento, ya que esto determina el nivel de comprensión, la identificación de habilidades por parte de los alumnos y el desarrollo del gusto por aprender. Un verdadero cambio en el conocimiento se logra cuando se aprende a construir significados, esto es, a encontrar estructuras donde hay desórdenes, al reorganizar conceptos y al investigar sobre sus posibles relaciones. Si se hace con éxito se obtienen las bases académicas y la motivación para enfrentar conceptos de mayor alcance, más complicados, elevados o profundos.
Para enfrentar lo anterior es necesario encontrar maneras motivadoras de enseñar los conceptos. En la literatura que relaciona a la electronegatividad con los tres conceptos mencionados al inicio es posible encontrar modelos visuales atractivos. Son triángulos que se obtienen al graficar dos de las variables de la electronegatividad: sus valores, diferencias, medias aritméticas o geométricas, para compuestos binarios homonucleares (átomos iguales) y heteronucleares (átomos diferentes); cada uno de sus vértices representa a un tipo de enlace: metálico (M), iónico (I) y covalente (C). Los triángulos se han utilizado para determinar el tipo de enlace en los compuestos, investigar las relaciones entre las variables de la electronegatividad, reorganizar los conceptos relativos a ella y al enlace, así como valorar sus ventajas y límites. En lo general, estos triángulos tienen dos características exclusivas y valiosas: permiten una aplicación directa y clara de la electronegatividad e integran y distinguen los tres tipos básicos de enlace en un modelo.
Presentamos su desarrollo histórico para que se aprecien sus fundamentos, alcances y limitaciones, todo resultado de relacionar las distintas variables que pueden conformar este modelo, poco divulgado en nuestra región. Con el conocimiento y la creatividad de cada profesor se puede inducir a los alumnos para que infieran el impacto del modelo en la estructura y, por ende, en las propiedades de la materia; esto se hace pidiéndoles que relacionen las diversas variables de la electronegatividad a los tres tipos de enlace e interpreten las diferentes reorganizaciones que se obtienen. Los autores de este escrito lo hacen en su clase de Introducción a la Ciencia e Ingeniería de Materiales, de la carrera de Ingeniería Química Metalúrgica, impartida en la institución donde laboran, orientando a los alumnos con preguntas definidas, lecturas específicas para que construyan varios triángulos usando diferentes variables de la electronegatividad, analicen sus posibles significados, interpreten las diversas reorganizaciones obtenidas y, sobre todo, cuestionen las posibles implicaciones.
Los objetivos son: ayudar a la divulgación de los triángulos, al tiempo que se presenta su desarrollo histórico; mostrar todas las posibilidades para su construcción y sus implicaciones; indicar las aplicaciones que se les han dado; discutir las características del triángulo como único modelo que integra los tres tipos de enlace y que permite una aplicación precisa de la electronegatividad; exhibir las limitaciones y aportes de cada triángulo en el momento de su concepción; reflexionar sobre sus implicaciones, así como promover su uso en el salón de clase y en los libros de texto.
La electronegatividad y el enlaceLinus Pauling (1932a), trabajando con las energías de enlace en compuestos considerados covalentes, asignó valores de electronegatividad a los primeros 10 elementos y determinó una medida del carácter iónico del enlace. El hecho fue muy importante pues, aunque relativa, proporcionó una medida del comportamiento electrónico de los átomos en el enlace. En otro trabajo del mismo año, Pauling (1932b) se preguntaba si era posible encontrar una transición continua, desde un tipo de enlace a otro, al variar constantemente uno o varios parámetros de los que determinan la naturaleza de una molécula o cristal. Concluyó que, en algunos casos, la transición podía ser continua, mientras que en otros existía una discontinuidad. Después, encontró y propuso una relación para medir el porcentaje de carácter iónico en un enlace I = 1−e1/4XA−XB2 con la que fijó un valor de diferencias de electronegatividades de 1.7 —o su correspondiente 50% de ionicidad— como un límite para separar a los compuestos iónicos (valores arriba de 1.7) de los covalentes (Pauling, 1960). En el mismo sentido, Paul Ander y Anthony J. Sonnessa (1975) obtuvieron una relación parecida, con la que determinaron un valor de 2.1, correspondiente al mismo 50%. Estos valores y otros similares han sido cuestionados y desechados, aunque algunos libros de texto los siguen utilizando.
Los verdaderos pensadores químicos difieren en sus conceptos sobre los tipos de enlace y en la manera de integrarlos, lo que se ha visto reflejado en el contenido de los libros de texto y en el conocimiento que imparten los profesores del área. Presentaremos la situación, de manera general, dando algunas referencias como ejemplos: casi todos aceptan la existencia de tres tipos primarios de enlace: iónico (I), covalente (C) y metálico (M), situación que puede apreciarse en los libros de texto introductorios de materiales; algunos artículos y libros introductorios de química separan —o no presentan— al metálico por considerarlo inexistente, ya que lo estiman como una variación del covalente (Allen y Capitani, 1994; Anderson et al., 1994) y otros más por no poder entenderlo y menos saber cómo integrarlo al iónico y al covalente, sobre todo varios profesores de química. Desde Pauling (1932a), lo común es aceptar que el enlace covalente presenta un carácter iónico en mayor o menor medida. Pocos, basados en el hecho de que el enlace metálico es el más común en la naturaleza (alrededor del 80% de los elementos), plantean que el covalente y el iónico son sólo variaciones de éste (Gilman, 1999). Otros pocos afirman que los enlaces de muchos compuestos binarios no pueden ser descritos en términos de tipos de enlace simple sino que comparten las propiedades de varios y que las descripciones de los enlaces tipo son sobresimplificaciones (Alckok, 1990). Uno que otro considera la existencia de enlaces con características de dos de los primarios (Carter, 1991) y otros más, con características de los tres (Askeland, 1998; Alckok, 1990; Sproul, 2001; Smith, 2006).
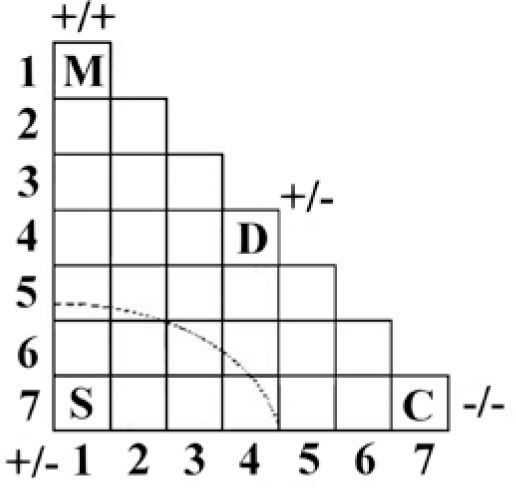
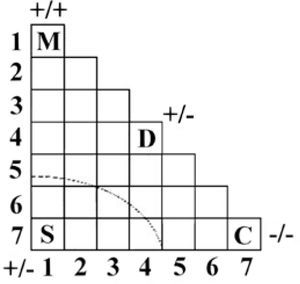
Los triángulos2El primer antecedente conocido se publicó antes que los trabajos clásicos de Pauling, cuando Hans G. Grimm (1928) decidió ordenar los siete grupos “A” de la tabla periódica en una combinación matricial binaria con forma triangular (figura 1), desde los más electropositivos hasta los más electronegativos —términos planteados por Avogadro (1809)— para explicar la reactividad química. Cada cuadrado representa al conjunto de compuestos binarios formados entre los elementos de los grupos horizontales y los elementos de los grupos verticales. Los vértices indican el carácter de los compuestos: M para los metales, S para las sales (los compuestos iónicos), D para los tipo diamante y C para los covalentes homoatómicos, a los que Grimm llama moléculas atómicas (A). Sin embargo, no especifica ningún compuesto; fue sólo una forma de explicar, en general, entre qué tipo de elementos se pueden formar los grupos característicos de compuestos.
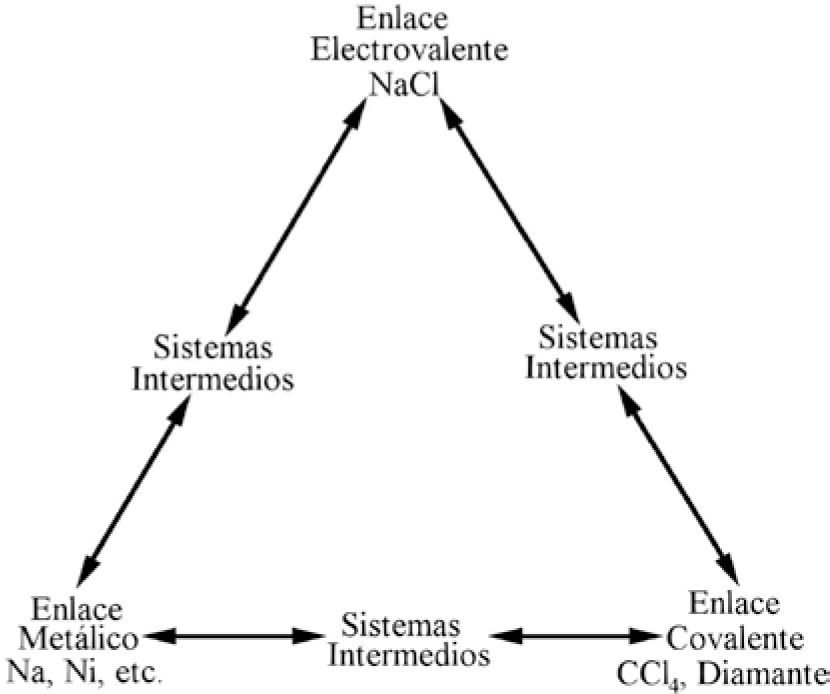
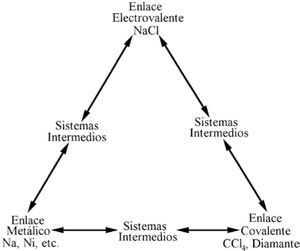
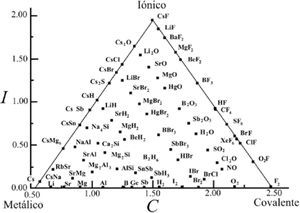
Conard Fernelius y Richard Robey (1935), como parte de su trabajo respecto al estado metálico, se plantearon una disyuntiva con la frase: “En la unión metálica participan las características de las uniones covalente (homopolar) y elecrovalente (iónico o heteropolar), aunque tal vez sea mejor verla no como intermedia entre ellas sino como un tipo distinto y separado de enlace entre átomos”. Después de una larga presentación de argumentos, proponen el triángulo de la figura 2 para mostrar que se inclinan por la segunda alternativa. En él colocan compuestos en los vértices, representativos de los enlaces C e I, y dos elementos metálicos en el vértice del enlace M, a los que llaman “verdaderos sistemas metálicos”; así señalan una diferencia total entre los tres enlaces. Ubican a los “sistemas intermedios” sobre las líneas del triángulo, infiriendo la existencia de tres tipos: I-C, I-M y C-M. Estos autores son los primeros en presentar la figura del triángulo tal como se ha utilizado hasta hoy.
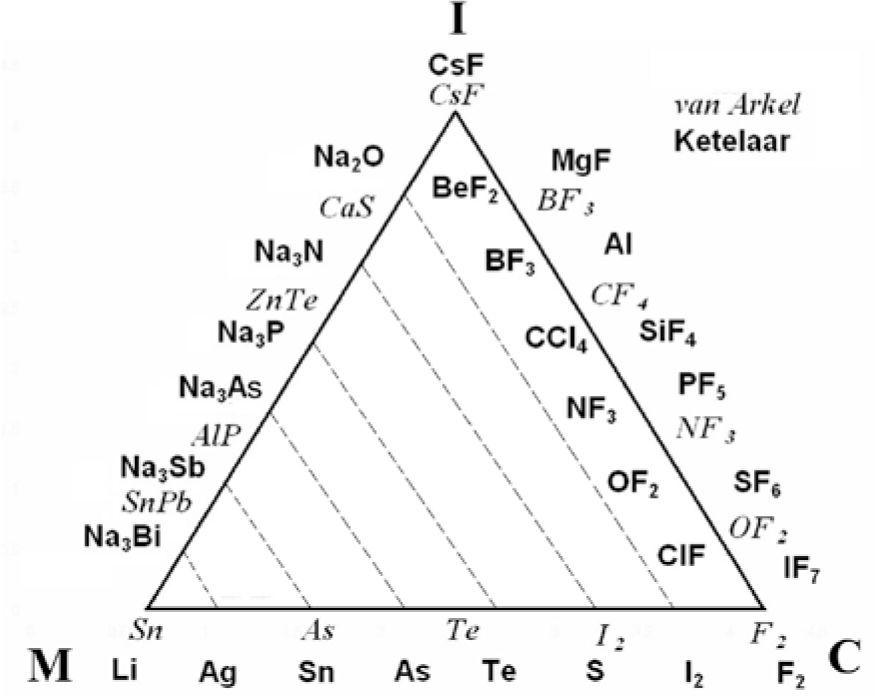
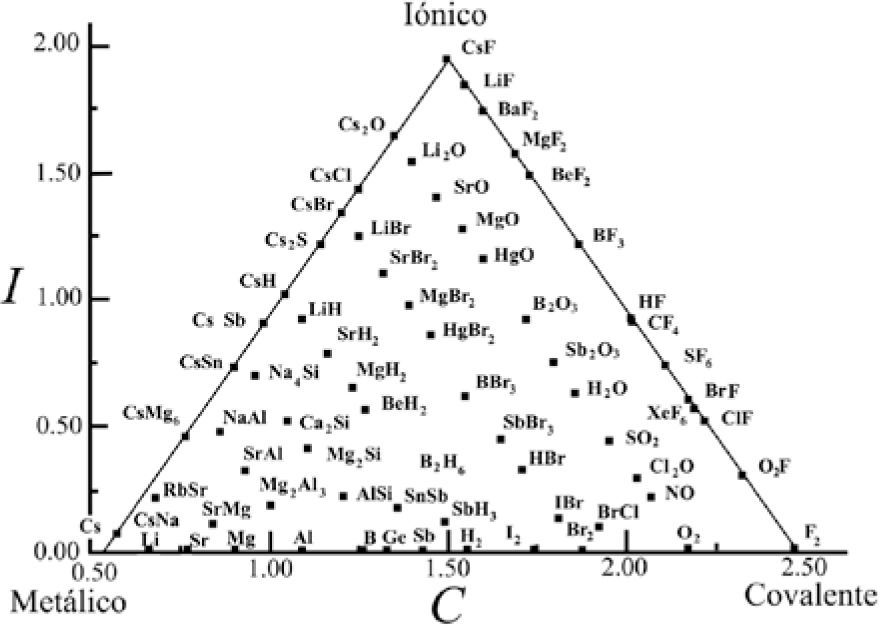
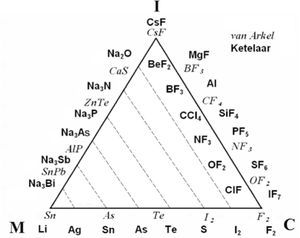
El triángulo mostrado en la figura 3 integra dos triángulos: el publicado en el libro de texto de Antón E. van Arkel (1949) y en el de Jan A. A. Ketelaar (1953). Se le conoce como el triángulo de van Arkel-Ketelaar (VAK); las líneas punteadas son de Ketelaar. Van Arkel y Ketelaar colocaron elementos y compuestos sobre los bordes del triángulo, que serían equivalentes a los sistemas intermedios indicados en el triángulo de C. Fernelius y R. Robey (1935). Cuando ambos autores sitúan al F2 en el vértice inferior derecho lo reconocen como el del enlace C puro y al colocar al CsF en el vértice superior, lo catalogan como el compuesto I puro; cada autor define al enlace M puro escogiendo a un elemento diferente, van Arkel al Sn y Ketelaar al Li. Ketelaar comenta en su libro, al referirse a su triángulo, que los tipos de enlace son idealizados, que “la constitución de cualquier sustancia forma combinaciones en la mayoría de las cuales predomina claramente uno de los tipos” y que “existen transiciones graduales entre los tres tipos”. Es posible observar que la base del triángulo representa la transición de la tabla periódica desde los elementos metálicos hasta los covalentes (o viceversa) y, hacia el vértice superior, el incremento en ionicidad de los compuestos. Los lados del triángulo simbolizan los compuestos intermedios M-I (el izquierdo) y los C-I (el derecho), con lo que, conforme los compuestos se ubiquen más cerca de cada uno de los vértices I, C o M, su enlace será mayormente I, C o M. Ketelaar parece indicar, con las líneas punteadas, un mismo grado de carácter metálico de los compuestos unidos por ellas.
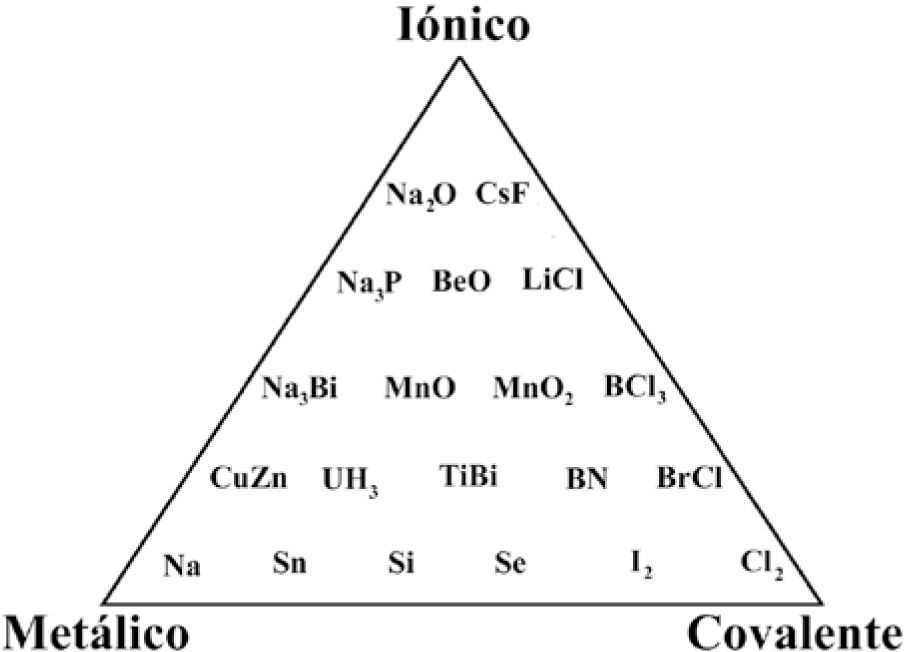
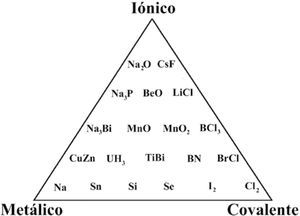
William Jolly (1984) presentó un triángulo en su libro de química inorgánica (figura 4), en el cual ubica compuestos en sus límites y centro. Años después, Jolly (1991) utiliza sólo compuestos sólidos y comenta: “Parece ser que la mejor forma de clasificar sólidos sería en términos de los tipos de enlace entre los átomos, esto es C, I, van der Waals y metálico. Sin embargo, los enlaces que son sólo de uno u otro tipo son raros y en la mayoría de los cristales hay enlaces de más de un tipo”. Jolly dio un paso más al incluir seis compuestos en el centro del triángulo.
Hasta donde sabemos, además de los libros de química de van Arkel, Ketelaar y Jolly, cuatro más han usado los triángulos —principalmente el de Ketelaar—: K. Harvey (1963), CBA (1964), M. Ormerod (1970) y K. Mackay (1989).
Los triángulos mencionados arriba son cualitativos, el resultado del pensamiento intuitivo que se sustenta en la comprensión del conocimiento, logrado durante el trabajo cotidiano.
Las primeras propuestas para cuantificar al triángulo salen a la luz en la primera mitad de los años 90 y todas se basan en la electronegatividad y sus funciones.
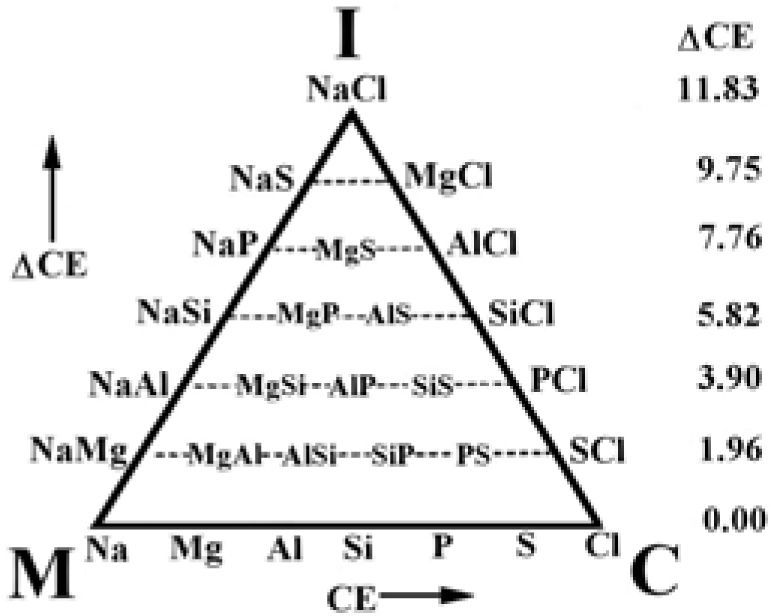
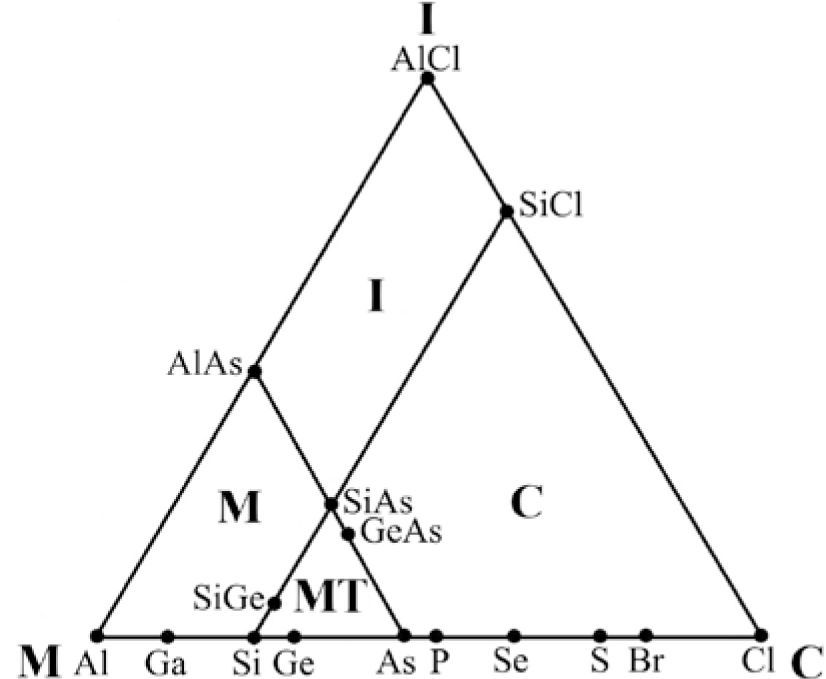
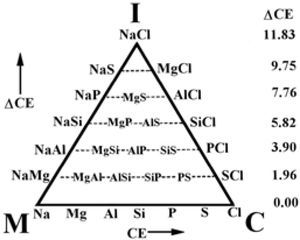
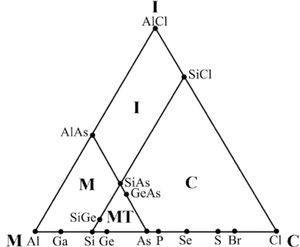
Leland C. Allen (1992), usando los compuestos formados con los elementos del tercer periodo de la tabla periódica, propone una forma para semicuantificar al triángulo de VAK. No resulta difícil imaginar que las líneas punteadas del diagrama de Ketelaar (figura 2) lo inspiraron en este sentido. En la figura 5 se aprecia cómo sitúa estos elementos en la base del triángulo a intervalos regulares, representando un incremento en su Energía de Configuración (CE, por sus siglas en inglés) (Allen, 1989), la cual, según William Jensen (1995), “es el eufemismo que usa Allen para la electronegatividad”. Poco después, T. Meek (1993) se refiere a la CE como “la electronegatividad espectroscópica”. Allen (1989) define CE como “la energía promedio de un electrón, de los de la capa de valencia, de un átomo libre en estado basal”. Allen señala que la cuantificación del triángulo de VAK por CE y ΔCE ayuda a interpretar qué nos está diciendo la tabla periódica, permitiendo diferenciar los enlaces M, I y C; también indica que los compuestos de cada elemento están alineados y los coloca sobre las líneas horizontales punteadas dentro del triángulo, asignándole a cada nivel un valor de diferencia de energías de configuración (ΔCE), que se incrementa desde la base hasta el vιrtice superior (I); el mismo Jensen (1995) seρala que asignarle un sólo valor de ΔCE a cada nivel horizontal es un error, pues cada compuesto tiene su propio valor de ΔCE y comenta que, con su trabajo, Allen implica que el triángulo está conformado por los valores de CE y de ΔCE. Con su triángulo, Allen relaciona la ubicación de algunos compuestos a dos variables de la electronegatividad (Allen, 1989) o de CE (Allen, 1992). Posteriormente, Allen et al. (1993) usaron las mismas variables de CE propuestas por Allen (1992) con la idea de clasificar los compuestos binarios genéricos de acuerdo con su enlace: I, M o C. Produjeron seis gráficas triangulares: cuatro corresponden a los compuestos formados entre los elementos de los grupos 1, 2, 13, 14, 15, 16 y 17 para los periodos 2, 3, 4 y 5 respectivamente; otra se hizo con los compuestos formados entre los elementos de los grupos 13, 14, 15, 16 y 17 para los periodos 3 y 4, y la otra se construyó con los compuestos formados entre los elementos de los grupos 1 y 17. En todas se pueden apreciar cuatro áreas, que corresponden a los compuestos M, I, C y Metaloides (MT), delimitadas por dos líneas rectas que son paralelas a los lados del triángulo y que se intersecan; así, dicen, se clasifican los compuestos. La figura 6 es la representativa de las otras cinco y corresponde a la construida con los periodos 3 y 4. Al proponer una región de enlace Metaloide los autores parecen indicar la existencia de un enlace diferente a M, C e I.
Esquema propuesto por L. Allen (1992).
Método gráfico de L. Allen (1993).
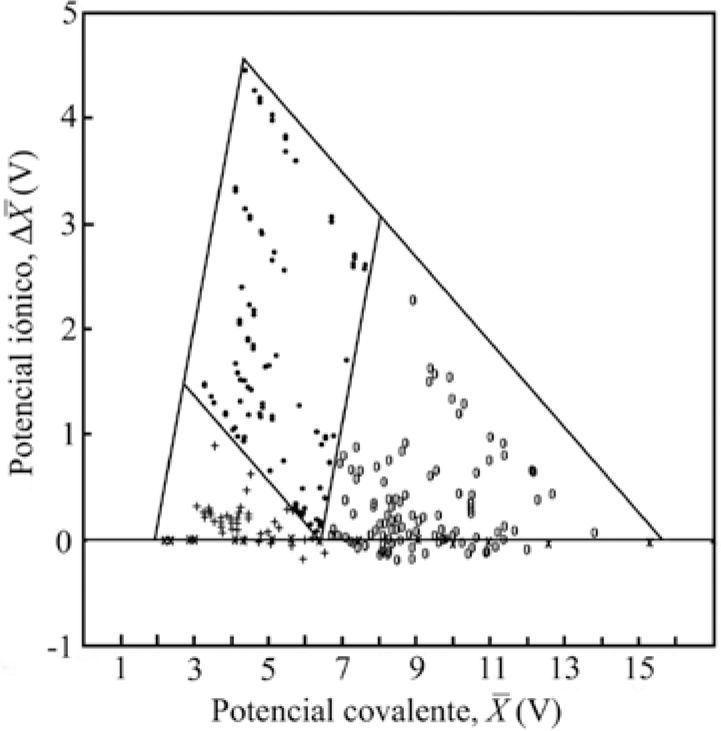
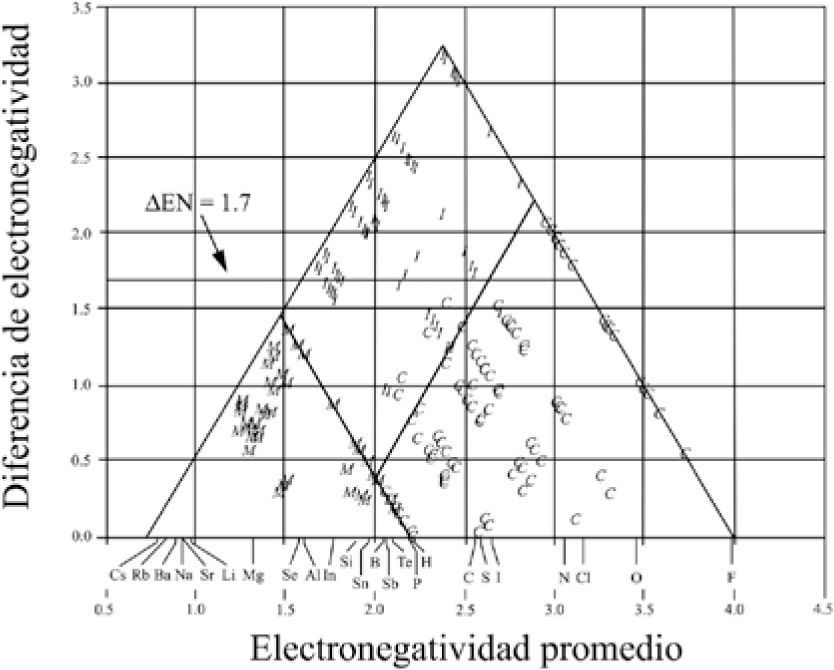
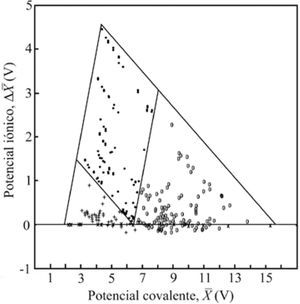
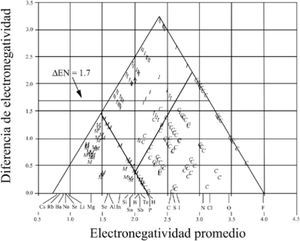
El mismo año, Gordon Sproul (1993), comenta que a pesar de que la electronegatividad es un concepto unificador del enlace, ha recibido un tratamiento limitado en la mayoría de los textos de química general. Por ello, publicó un triángulo escaleno (figura 7), obtenido al graficar X¯ (el promedio de las electronegatividades) en el eje de las abscisas, como un potencial de covalencia, y la diferencia de las electronegatividades promedio, antes y después del enlazamiento Δ X¯, en el eje de las ordenadas, como un potencial de ionicidad; la escala de electronegatividad que utilizó fue la de Mulliken, revisada por Bratsch (1988a; 1988b). Utilizó 297 compuestos binarios bien identificados como I, C o M (Wells, 1975). Encontró dos líneas rectas, paralelas a los lados del triángulo, que lo dividen en tres áreas, a las que llama regiones de enlace I, M y Molecular (C). Solamente diez compuestos quedaron fuera de su área, con lo que su método presentó un error de 3.4%. Señala que “las dos funciones analíticas usadas para construir el triángulo proveen una guía útil para predecir el carácter del enlazamiento”.
X¯vs.Δ X¯. G. Sproul (1993). • iónicos; º covalentes; + metálicos; × compuestos homoatómicos.
A diferencia de Allen et al. (1993), no define una región para los semimetales. El siguiente año, Sproul (1994a) evaluó 15 escalas de electronegatividad usando los triángulos. Graficó X¯vs.Δ X¯ para 311 compuestos, bien identificados por su tipo de enlace (Wells, 1984). Sproul comenta que “producen gráficas bidimensionales que dividen efectivamente el enlazamiento de los compuestos en tres regiones casi exclusivas: M, C e I”. Estas gráficas tienen forma de triángulos, divididos en regiones con líneas rectas paralelas a sus lados. Sproul observa que “mientras pocos, si no es que ninguno, de los compuestos está unido con enlaces puramente C, I o M, la preselección de los compuestos —con un claro y describible carácter del enlace primario— produce una separación relativamente obvia”. Añade que las gráficas “provienen de la covalencia a lo largo de un eje y de la ionicidad a lo largo del otro” y que “casi todos los compuestos binarios exhiben este tipo de enlace fraccional a lo largo de estos dos continuos”. Concluye: las 15 escalas consideradas dan gráficas de X¯vs.Δ X¯ que segregan efectivamente a los compuestos binarios en tres regiones de tipo de enlace M, C o I, para todos los compuestos considerados; son necesarios dos parámetros para segregar satisfactoriamente los compuestos dentro de su tipo de enlace; las gráficas indican las proporciones relativas de los tres tipos de enlace puros que ocurren en los enlaces de los compuestos binarios; las escalas que proveen la mejor segregación de los compuestos son la de Allen y la de Nagle, con un acierto superior al 96%.
Sproul (1994b), evaluó los triángulos obtenidos al graficar diferentes funciones de la electronegatividad, independientes entre sí, desde la posibilidad que presentan para segregar los compuestos en las tres áreas clásicas: I, M y C. Utilizó para sus gráficas los mismos 311 compuestos sólidos que en (1994a) y la escala de electronegatividades de Allen (1989). Graficó X¯vs.Δ X¯ ; la media geométrica (Xgeo) vs.X¯ ; la electronegatividad más alta en el compuesto (Xal) vs. la electronegatividad más baja en el compuesto (Xba), y Xbavs. Δ X¯. Indica un acierto de 94%, solamente para la gráfica (Xgeo) vs. Δ X¯. Su conclusión: la gráfica de Xba vs. Δ X¯ (figura 8) muestra que estas variables son las que pueden ser más útiles al describir la relación de la electronegatividad con los tres tipos de enlace.
X¯vs. Δ X¯. Sproul (1994a). I, iónicos; º covalentes; M, metálicos y algunos homoatómicos.
La figura 9 es el triángulo isósceles obtenido por William Jensen (1995) al graficar X¯vs.Δ X¯ para 69 compuestos binarios y aleaciones, dice él. Indica que la escala de electronegatividad usada fue la de los rusos Martynov y Batsanov (1980), “ligeramente modificada”, basada en un promedio de las energías sucesivas de ionización para los electrones de valencia de los elementos. Jensen indica que “todos los compuestos caen en el triángulo, con los extremos I, C y M en cada vértice. Los casos intermedios, representando la transición entre un extremo y otro, se encuentran a lo largo de los límites y en el cuerpo del triángulo”. Indica que los compuestos de cada elemento se agrupan en dos líneas diagonales cuyo origen corresponde a la sustancia simple (enlaces homonucleares) en el eje de las X¯ ; la línea izquierda contiene a los compuestos en los que el elemento en cuestión es el componente más electronegativo y la derecha, en la que es el más electropositivo. Por último, da ejemplos de cómo usa el modelo en su curso de química, localizando en el triángulo grupos característicos de compuestos (Fases Zintl y los que presentan conductividad detectable, metales). Su triángulo implica que el F2 es totalmente covalente, el Cs totalmente metálico y el CsF totalmente iónico.
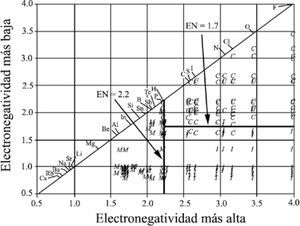
En el año 2001, Sproul publica otro artículo con el objetivo de mostrar que los valores de Δ X entre los átomos del compuesto no es una función apropiada para separar el enlazamiento iónico del covalente.
Para tal efecto utiliza 312 compuestos binarios de elementos representativos, con tipos de enlace conocidos; estos compuestos están caracterizados en base a sus propiedades estructurales y físicas (Wells, 1984) y grafica X¯vs. Δ X para cada uno de ellos, obteniendo la figura 10.
X¯ vs. ΔX. G. Sproul (2001). C, covalentes; I, iónicos; M, metálicos.
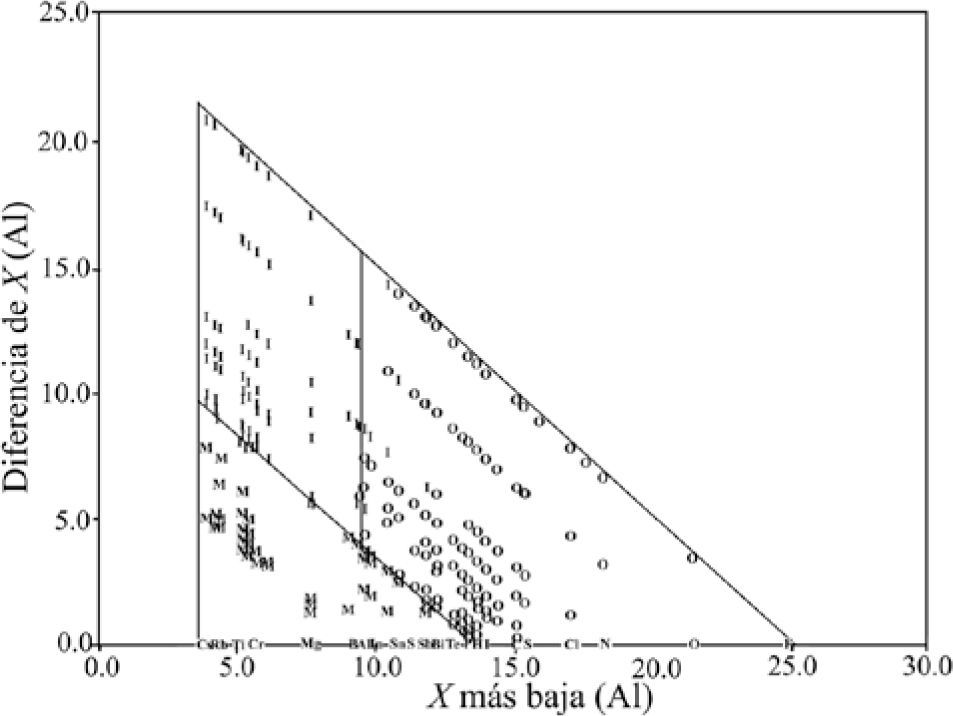
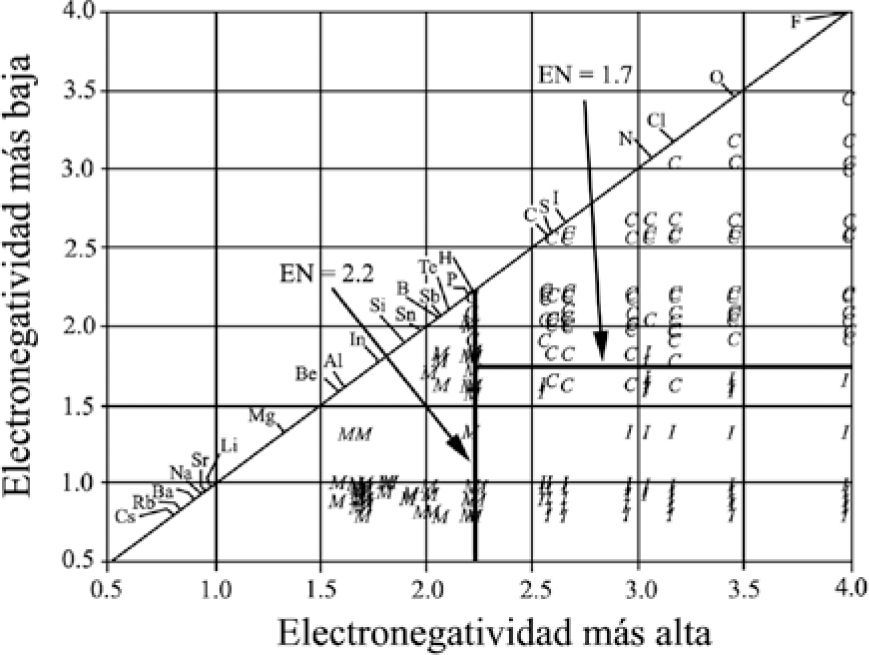
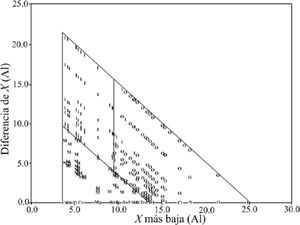
Nuevamente separa los compuestos por tipo de enlace usando líneas rectas, paralelas a los lados del triángulo. Comenta que debido a que muchos compuestos sugieren un carácter de enlace mixto, Wells generalmente describe a los compuestos por su geometría, calificándolos en términos tales como: “iónico”, “esencialmente covalente” y “enlace metálico”, y que seleccionó solamente aquellos compuestos binarios formados por elementos representativos que exhibían, primariamente, uno de los tres tipos de enlace. El grupo de compuestos estaba constituido por 164 descritos como covalentes, 94 como iónicos y 54 como metálicos. Utilizó la escala de electronegatividades de Pauling —puesta al día por Allred (1961)— porque “es una de las más ampliamente reconocidas”. Basándose en su gráfica, discute y desecha el valor de 1.7 de diferencia de electronegatividades, propuesto por Pauling, usado tradicionalmente para dividir a los compuestos primariamente iónicos de los covalentes. Determina un error en la división de los compuestos de 16%. Asimismo, comenta que “es también aparente que el enlace metálico puede, y debería, ser incluido al comparar los valores de electronegatividad y las características del enlace”. Por otro lado, construye una gráfica colocando el valor del elemento con Xal a lo largo de las abscisas y el del Xba en las ordenadas. Con las líneas rectas divisorias entre los tres distintos grupos de enlaces tipo, paralelas a los ejes (figura 11), determina que los compuestos que tienen un elemento con un valor de electronegatividad menor a 2.2 son metálicos, que los compuestos que contengan un elemento con un valor mayor a éste son covalentes o iónicos y que un valor de 1.7, para el elemento del compuesto de menor electronegatividad, permite dividir a los compuestos iónicos de los covalentes. Indica que existe un porcentaje total de error de 4: 6% para los iónicos, 2% para los covalentes y 0% para los metálicos. Señala las limitaciones en utilidad de cada triángulo, para concluir que el triángulo conformado por los valores de electronegatividad es el más útil para predecir el tipo de enlace; que la electronegatividad puede ser una guía para determinar el tipo de enlace, y que todos los enlaces son una mezcla de los tres tipos de enlace ideales, excepto los homoatómicos.
G. Sproul (2001): I, iónico; C, covalente y M, metálico.
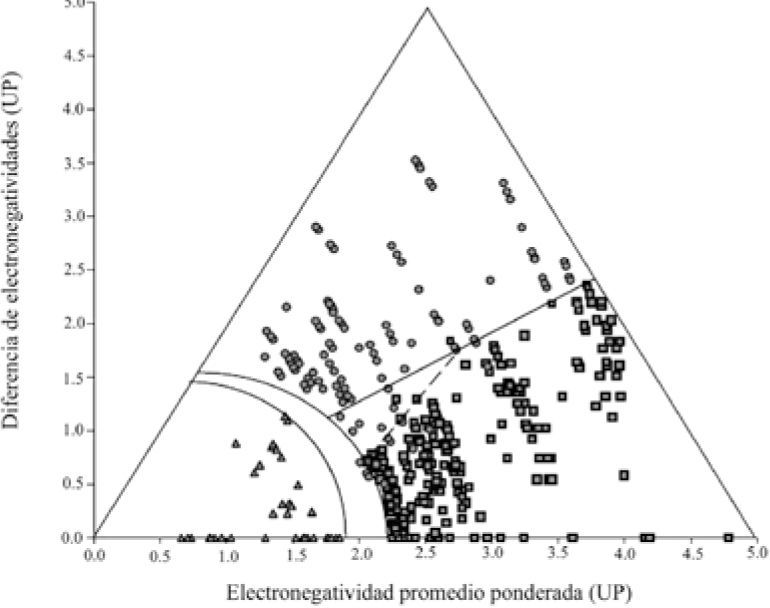
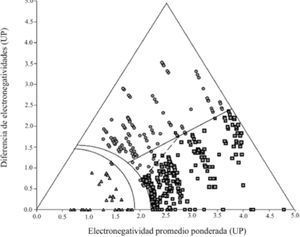
Con el tiempo y la inclusión de un mayor número de compuestos, los límites del triángulo fueron creciendo hasta alcanzar su máximo tamaño con Terry L. Meek y Leah D. Garner (2005). Ellos propusieron el concepto de la electronegatividad promedio ponderada (XP)P, con la ecuación,
donde XA y XB son las electronegatividades de los elementos del compuesto y m y n representan su número de átomos) que permitió incluir moléculas con diferente número de átomos, que anteriormente quedaban ubicadas en un mismo punto. Para que cupieran en el triángulo, lo ampliaron intuitivamente y asignaron a los vértices de los enlaces iónico y covalente un valor de 5 Unidades Pauling3 (UP) y uno de cero, al del metálico. Tomaron 321 compuestos (Ketelaar, 1953) —formados entre los elementos de los grupos 1-2 y 12-18, para los periodos 1-6 de la tabla periódica— binarios aislados y purificados, con estructuras conocidas y con, solamente, enlaces heteronucleares. Los enlaces de los compuestos habían sido clasificados (Greenwood y Earnshow, 1997) predominantemente como de un solo tipo. Se agregaron 37 elementos “bien definidos”, como también 62 compuestos generalmente descritos como intermedios: 23 C-I, 34 C-M y 5 I-M. Se graficaron sus valores de (Xp)pvs. ΔX (figura 12) obtenidos usando la escala de electronegatividad de Allen (1989). No todos los compuestos se ubicaron en el triángulo: quedaron fuera aquellos con iones binucleares discretos, los homo y heteronucleares que contienen grupos de átomos o de iones, los Zintl; los M3E —formados entre los grupos 1 y 15— y los subóxidos de Rb y Cs. Con su gráfica afirman haber encontrado una buena discriminación entre los tipos de enlace predominante I, C y M —cada uno en un área— y entre los de enlace intermedio: C-I, C-M, M-I, definiendo las ecuaciones que representan las líneas (curvas y rectas) divisorias entre ellos. Los autores plantean la limitación de usar el triángulo sólo para enlaces en compuestos binarios.
Definen la línea divisoria entre compuestos I y C con la ecuación ΔX = 0.62 (Xp)p, que les sirve para implicar que es erróneo el criterio propuesto por Pauling respecto a que un 50% (Δ X = 1.7) de carácter iónico del enlace del compuesto sería el límite para su clasificación como I ó C.
Observaciones y discusiónLa evolución de los triángulos lleva más 80 años. Explícita o implícitamente, su estructura se basa en la electronegatividad. Los primeros triángulos propuestos no eran cuantitativos, muestran la representación gráfica del entendimiento de la química por parte de químicos importantes en su época. Cuando comienzan a cuantificarse se hace utilizando a la electronegatividad y sus funciones, que son independientes entre sí. Al principio se hizo con el afán de entender y, conforme se realizaban propuestas para relacionar estas funciones, se buscó relacionar cuáles de ellas presentaban un modo mejor para agrupar sustancias en función de su enlace predominante, como una base para la predicción. Debido a que en su etapa cualitativa se utilizaban básicamente los mismos compuestos para ubicar los vértices, los límites de los triángulos propuestos por los autores eran similares. Una vez que comenzó su cuantificación, estos límites comenzaron a crecer hasta alcanzar su máximo tamaño con Meek y Garner (2005) y su propuesta de la electronegatividad promedio ponderada.
Cada autor señala un modo diferente de agrupar compuestos de una manera más efectiva, aunque no infalible. Hasta donde se sabe, no existe otro método o modelo basado en la electronegatividad que sea mejor. De cualquier forma, todos los triángulos, resultado de graficar diversas variables de la electronegatividad, integran y distinguen los tres enlaces tipo.
En el triángulo más usado, la altura evidencia la ionicidad, representada por la diferencia de las electronegatividades de los compuestos heteroatómicos. De igual modo, la base muestra la transición continua de la electronegatividad de los elementos de la tabla periódica —desde la metalicidad hasta la covalencia— representada por un promedio de las electronegatividades de los compuestos homoatómicos. El compuesto ubicado a mayor altura será el más iónico. El compuesto situado más a la derecha será el más covalente mientras que el localizado más a la izquierda será el menos covalente ¿o el más metálico? Esto dependerá de quién opine. Un viejo proverbio inglés dice Demasiado hacia el este ya es el oeste.
Gordon Sproul es el autor que más ha trabajado y publicado sobre estos triángulos, por lo que sus puntos de vista son más ricos e interesantes que los de los otros autores. Deseamos señalar algunos: la escala de electronegatividades usada para graficar los triángulos marca una diferencia en la proporción del error obtenido al segregar los compuestos de acuerdo con su tipo primario; esta separación, por carácter primario del enlace en compuestos binarios, no excluye que el enlace sea mixto ya que pocos compuestos tienen enlaces puros; las gráficas de las variables de la electronegatividad indican las proporciones relativas de los tres tipos de enlace puro que se presentan en los enlaces de los compuestos binarios; y, salvo para los homoatómicos, todo los enlaces son una mezcla de los tres tipos de enlace ideales.
Hay tres aspectos que notamos en el triángulo de Meek y Garner (2005): 1) Si se proyecta la línea recta que segrega a los compuestos I de los C, ésta llega al origen. Con ello es más fácil observar que divide al triángulo en dos, entre el vértice I y el vértice C. Si éstos representan lo totalmente I y C, respectivamente, entonces los compuestos que caen a lo largo de esa línea tendrán un enlace mitad I y mitad C, esto es 50% de cada uno —después de descontar la parte metálica correspondiente— lo que coincidiría con el criterio de Pauling; 2) La ubicación que los autores hicieron de los compuestos intermedios, entre dos de los tipos primarios, cercanos al centro del triángulo es contraria a la de los demás autores que los ubican sobre los bordes del triángulo, como es lógico de acuerdo con el modelo, y 3) La ausencia de compuestos cercanos a los vértices y sobre los bordes, lo que estaría de acuerdo con la opinión de que los enlaces puros son estereotipos.
La realidad siempre es compleja y difícil de apreciar, sobre todo para niveles de estructura que no podemos ver. Un buen modelo debe de abstraer esa realidad y desde este punto de vista el triángulo cumple; no intenta explicar más, aunque pueda tener otras implicaciones. Como ningún modelo representa la realidad completa, para construir una imagen que se acerque a ella lo más posible, se requiere sumar todos los modelos existentes: matemáticos, termodinámicos, computacionales, visuales o de cualquier tipo. Unir todas las piezas permitirá entender mejor lo que se sabe —o lo que se cree que se sabe— para cuestionarlo y también para encontrar lo que no se sabe, para precisarlo. Dos caminos importantes para la ciencia.
Las figuras presentadas se han modificado ligeramente respecto a las originales para su fácil comparación.
Valores de una escala de electronegatividades referida a la de Pauling, obtenidos al multiplicarla por un factor que las hace comparables.