The present view of textbooks is that they are repetitive and without inspiration literature. The discovery of periodicity by Mendeleiev is an exception that confirms the rule, as he arrived to the periodic table while writing a General Chemistry book for his St. Petersburg University' students. In this work I am going to derive the same kind of contribution from what some French and German professors did, through the classifications of elements published in their books in the first half of XIX Century.
La visión actual de los libros de texto es que se consideran como si fueran literatura repetitiva y sin inspiración. En este sentido, el descubrimiento de la periodicidad por Mendeleiev en 1869 mientras escribía su libro de Química General para sus alumnos de la Universidad de San Petersburgo puede considerarse como la excepción que confirma la regla.
En esta editorial vamos a implicar en el descubrimiento de Mendeleiev a varios otros docentes franceses y alemanes de la primera mitad del siglo XIX que, sin quitarle méritos al ruso, contribuyeron sin duda a la hechura de la tabla periódica. Hasta ahora pocos son los que han considerado la relación entre la investigación y la escritura de libros de texto. No obstante, estos casos nos muestran que la docencia ha influido, en ocasiones notablemente, y se ha fundido con el trabajo de investigación de frontera (Bertomeu, García-Belmar y Bensaude-Vincent, 2002).
En FranciaLouis Jacques Thenard (ver la ilustración 1) fue contratado en el Collège de France en 1804. Cuatro años antes se había incorporado Nicolas Vauquelin (1763-1829) quien empezó a transformar el espacio ocupado por el fallecido profesor Jean Darcet (1724-1801), convirtiendo el anfiteatro de medicina en un anfiteatro químico. Allí Thenard siguió con los cambios, extendiéndolos a toda la planta del edificio e inclusive al primer nivel. El anfiteatro se convirtió en el escenario donde se daban las lecciones, con demostraciones experimentales.
Thenard ofrecía en sus cursos tres niveles diferentes de información: descripción, verificación y explicación. Para empezar, ofrecía una descripción de todos los aspectos relevantes de una sustancia, a lo que denominaba “le exposé [de] tous les faits qui sont connu”. La verificación o “Constater les faits”, comprendía la comprobación experimental de las propiedades físicas y químicas de la sustancia. Para concluir, procedía a la explicación de los fenómenos observados en las demostraciones: la “théorie des faits” ofrecía la explicación de qué sucedía y por qué pasaba bajo ciertas condiciones experimentales. La mayoría de las veces sus explicaciones se basaban en la teoría de las afinidades, un tema en el que los alumnos eran introducidos desde las primeras lecciones (García-Belmar, 2007).
Los experimentos fueron diseñados para apoyar las clases de Thenard y también significaron un entrenamiento sin par de sus “préparateurs”. En ocasiones, fueron el punto de partida de investigaciones relevantes que fueron publicadas en las revistas científicas de la época. En pocas palabras, la enseñanza era la base de la investigación en Thenard.
Una guía para estudiantes de medicina, escrita por el Profesor J. P. Maygrier (1818, p. 41-42) remarcaba que “la química no puede aprenderse en los libros, sino en las lecciones del profesor, donde los experimentos, que son frecuentemente repetidos y manejados hábilmente, les hablan a los ojos más que a sus mentes”.
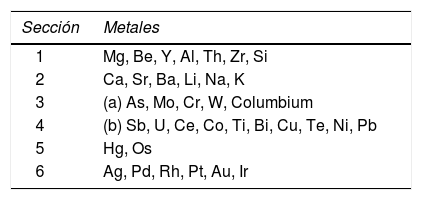
Thenard (1800) habló en un polémico artículo acerca de la “necesidad de reunir la práctica y la teoría de la química, para hacer aplicaciones útiles del arte”. En las lecciones de Thenard los fenómenos eran propiedades físicas y químicas, “propriétés”, que eran empleadas para identificar y clasificar las especies químicas. En este sentido, su trabajo de clasificación fue sumamente importante, lo cual se reflejó en la publicación en 1813 de la primera edición de su Traité de chimie élémentaire (ver la ilustración 2) en el cual insiste en el principio de proceder de lo simple a lo complejo, de lo sabido a lo desconocido, como una guía pedagógica conveniente. Por ejemplo, su clasificación de los metales se muestra en la tabla 1, que está basada en su afinidad por el oxígeno como principio líder organizador (Bertomeu, García-Belmar y Bensaude-Vincent, 2002).
Clasificación de Thenard de los metales en seis secciones, basada en sus reacciones con oxígeno a diferentes temperaturas.
| Sección | Metales |
|---|---|
| 1 | Mg, Be, Y, Al, Th, Zr, Si |
| 2 | Ca, Sr, Ba, Li, Na, K |
| 3 | (a) As, Mo, Cr, W, Columbium |
| 4 | (b) Sb, U, Ce, Co, Ti, Bi, Cu, Te, Ni, Pb |
| 5 | Hg, Os |
| 6 | Ag, Pd, Rh, Pt, Au, Ir |
L. J. Thenard en su texto Traité de chimie élémentaire. Teorique et practique. Essay sur la philosophie chimique (Paris: Crochard, 1835), fue el precursor de los grupos de los no metales (véase la ilustración 2) con los grupos de los halógenos: yodo, bromo, cloro y flúor; los calcógenos: telurio, selenio, azufre y oxígeno; el hidrógeno no asignado a ninguno de los otros dos grupos, encabezados por el carbono —boro, silicio y zirconio— y los pnicturos: nitrógeno, fósforo y arsénico.
Sin embargo, Marie André Ampère en 1816 había publicado una memoria en los Annales de chimie donde criticaba la sobreestimación del oxígeno en las clasificaciones químicas. Él sugirió que los químicos siguieran el ejemplo que los naturalistas designarían como una “clasificación natural”, i. e. “una clasificación que siguiera todos los caracteres de las sustancias a ser clasificadas”, opuesta a las “clasificaciones artificiales” basadas en un único carácter (ver la ilustración 3 y la tabla 2).
El diagrama muestra las tres familias mayores de elementos propuestas por Ampère (gazolitos, leucocitos y croicolitos), que fueron subdivididas en quince géneros (mostrados en esta ilustración y en la tabla 2), éstos subdivididos en especies.
Clasificación de Ampère de los elementos.
| Gazolitos | Leucocitos | Croicolitos |
|---|---|---|
| 1. Antrazuros: C, H | 5. Cassiteruros: Sb, Sn, Zn | 10. Ceriuros: Ce, Mn |
| 2. Tionuros: N, O, S | 6. Platinuros: Bi, Ag, Hg, Pb | 11. Sireruros: U, Co, Fe, Ni, Cu |
| 3. Cloruros: Cl, F, I | 7. Tefraluros: Na, K | 12. Crisuros: Pd, Pt, Au, Ir, Rh, Os |
| 4. Arsenuros: Te, P, As | 8. Calcuros: Ba, Sr, Ca, Mg | 13. Titanuros: Os, Ti |
| 15 Boruros: Si, B | 9. Zirconuros: Y, Be, Al, Zr | 14. Cromuros: W, Cr, Mo, Colombium |
Véase cómo aparecen cerca o de lleno alguna de las tríadas de Döbereiner (1817; 1829).
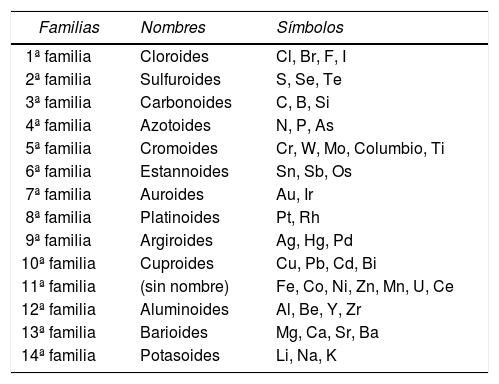
Thenard tuvo influencia en la clasificación natural de Despretz (1829) y en la de Hoefer (1845). Colocamos en las tablas 3 y 4 dichas clasificaciones, en donde puede observarse bastante claramente la influencia de Thenard y de Döbereiner y sus tríadas.
Clasificación natural de Despretz (1829).
| Familias | Nombres | Símbolos |
|---|---|---|
| 1ª familia | Cloroides | Cl, Br, F, I |
| 2ª familia | Sulfuroides | S, Se, Te |
| 3ª familia | Carbonoides | C, B, Si |
| 4ª familia | Azotoides | N, P, As |
| 5ª familia | Cromoides | Cr, W, Mo, Columbio, Ti |
| 6ª familia | Estannoides | Sn, Sb, Os |
| 7ª familia | Auroides | Au, Ir |
| 8ª familia | Platinoides | Pt, Rh |
| 9ª familia | Argiroides | Ag, Hg, Pd |
| 10ª familia | Cuproides | Cu, Pb, Cd, Bi |
| 11ª familia | (sin nombre) | Fe, Co, Ni, Zn, Mn, U, Ce |
| 12ª familia | Aluminoides | Al, Be, Y, Zr |
| 13ª familia | Barioides | Mg, Ca, Sr, Ba |
| 14ª familia | Potasoides | Li, Na, K |
Clasificación natural de los elementos químicos de Hoefer (1845).
| Nombre de la familia | Símbolos |
|---|---|
| Oxacéos | O, S, Se, Te |
| Cloracéos | Cl, Br, I, F, cianógeno |
| Carbacéos | C, B, Si, Ti, Ta, N, H |
| Fosfacéos | P, As, Sb |
| Kaliacéos | K, Na, Li, amônio |
| Bariacéos | Ba, Sr, Ca, Mg, Pb |
| Aluminacéos | Al, Be, Th, Zr, Ce, La |
| Ferracéos | Fe, Mn, Cr, Co, Ni, Zn, Cd, Cu |
| Hidrargiracéos | Hg, Bi |
| Estannacéos | Sn, Mo, W, U, V |
| Auracéos | Au, Ag, Pt, Pd, Rh, Ir, Os |
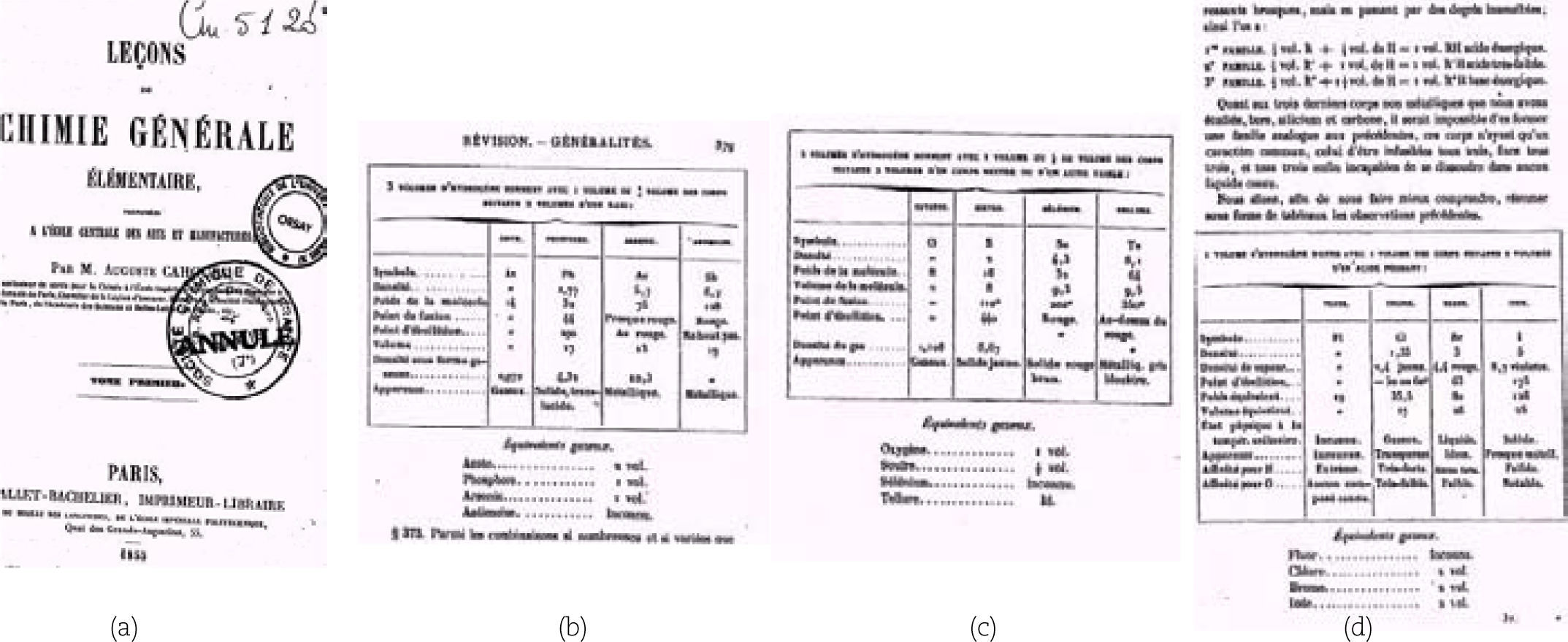
Luego Thenard influyó en otros textos, como los de Orfila y Cahours. En 1851, Mateu Orfila copió los resultados de Thenard en la clasificación de los no metales en su texto Elements de chimie (véase la ilustración 4).
(a) Mateu Josep Bonaventura Orfila i Rotger, pintura al óleo de A. M. Esquivel. Cortesía Del Concilio Mahón, tomada de la referencia de Bertomeu y Nieto (2006); (b) Portada del libro de Orfila en su edición tardía de 1851, y (c) tabla con los mismos grupos que Thenard para los no-metales, con la diferencia que ahora el hidrógeno se encuentra en el mismo grupo que el carbono, con boro y silicio.
El libro de Auguste Cahours Leçons de chimie générale élémentaire de 1855 lo tradujo Mendeleiev al ruso entre 1859 y 1862. Mucho del trabajo de sistematización de Mendeleiev se debió a estos profesores franceses de la primera mitad del siglo XIX.
En la lección 24 del libro de Cahours aparecen familias enteras de los elementos no metálicos, copiados de los de Thenard (ver la ilustración 5). Aunque también incluyó a los metales (ver la ilustración 6).
Y ahora demos una vuelta por Alemania. Frercks (2007) nos habla del libro de Johann Friedrich August Göttling (1798-1800), que es otro caso de un docente neto que acopla sus clases en la Universidad de Jena, poco a poco, con la investigación de frontera. Nos dice Frercks que en Alemania practicaban la química al inicio del siglo XIX tanto los apotecarios como los profesores universitarios. Los primeros se dedicaban a producir remedios para recuperar la salud y los segundos a enseñar el conocimiento químico, pero no tenían ambos a la investigación como una de sus principales armas.
El libro de Göttling, Handbuch der theoretischen und praktischen Chemie, puede catalogarse como un libro de química “teórica”, entendiéndose como tal un libro “no-práctico”. Este tipo de libros dejaba a un lado la parte práctica del laboratorio y se limitaba a reunir, seleccionar y arreglar los hechos químicos conocidos. Hay otros textos de Göttling dedicados a la parte práctica, como el de la ilustración 7.
Para compensar su abandono de la parte práctica, Göttling desarrolló lo que se denominó “laboratorio portátil”, que era un minilaboratorio en el que podían realizarse cuestiones sin visitar al apotecario. Estos laboratorios hicieron posible hasta cierto punto la generalización de la química como ciencia, además que proveyeron a Göttling de recursos extras a su limitado salario como universitario. El manual del primer laboratorio portátil se tituló Vollständiges chemisches Probir-Cabinet zum Handgebrauche für Scheidekünstler, Aerzte, Mine-ralogen, Metallurgen, Technologen, Fabrikanten, Oekonomen und Naturliebhaber (Laboratorio químico portátil completo para químicos, doctores en medicina, mineralogistas, metalurgistas, tecnólogos, propietarios de fábricas, economistas y amateurs). Se daba la señal de que cualquiera podía aprender y practicar la química fuera de los lugares donde tradicionalmente se le practicaba, la apoteca y las aulas universitarias.
El segundo caso memorable en Alemania es el de Johann Wolfgang Döbereiner, profesor de Química en Jena, desde donde propuso la ley de las triadas (Döbereiner, 1817; 1829). Döbereiner nació en 1780 en Hof an der Saale en Bavaria, al sureste alemán, cerca de la frontera actual con la república Checa y pronto pasó su familia a Bug am Weissdorf una pequeña villa donde están tomadas las fotos de la ilustración 8 (Marshall y Marshall, 2007).
Rittergut am Bug queda 1 km al norte de Weissdorf que está a 4 km al este de Münchberg, muy cerca de la villa natal de Döbereiner, Hof. La placa sobre la pared está ampliada arriba a la izquierda y dice: “A la memoria del pionero de la química experimental Johann Wolfgang Döbereiner, profesor de Química en Jena 13.12.1780 – 24.3.1849. Él pasó su infancia aquí y su juventud como el hijo del superintendente”. Abajo a la izquierda la señal que anuncia la villa de Bug.
En Bug auxilió a su padre en su trabajo agrícola, pero a los 14 años se volvió aprendiz del apotecario en Munchberg, que fue donde aprendió los fundamentos de la química. Luego, de los 17 a los 22 se dedicó al “Wanderjahre” (años de pasear o deambular) en Dillensburg, Karlsruhe, y particularmente en Estrasburgo donde aprendió ciencia gracias a su asistencia informal a clases universitarias y al estudio autodidacta.
Por aquellos años (1809) muere Göttling en Jena y le consultan a Johann Wolfgang von Goethe cómo suplirlo, quien le pregunta a su vez a Adolph Ferdinand Gehle el editor de Neues allgemeines Journal der Chemie, donde Döbereiner acostumbraba publicar sus investigaciones químicas. Gehle recomienda a Döbereiner, a pesar de que no contaba ni con el certificado del Bachillerato. Él aceptó el ofrecimiento y se mudó a Jena en 1810 y pasó el resto de su vida activa allí. Empezó a dar clase de química general experimental, tecnología química y farmacia. Recibía esporádicamente las visitas de su tocayo, Goethe, para revisar algunos experimentos químicos. Aunque Goethe se graduó de abogado se tornó activo en filosofía, poesía y ciencia. Sus conocimientos de alquimia quedaron revelados en sus descripciones del laboratorio de Fausto. Goethe escribió Farbenlehre una guía popular al estudio del color en donde escribió su famoso aforismo: “La historia de una ciencia es la ciencia misma”.
La más famosa aportación de Döbereiner (1817; 1829) fue su “ley de las triadas” (Kauffman, 1999). En 1817 demostró que el peso atómico del estroncio (42.5) era el promedio de los de calcio (20) y bario (65) y después, en 1829, extendió el mismo hallazgo para otras triadas, como S-Se-Te, Li-Na-K, Cl-Br-I y Os-Ir-Pt. Su tumba en el cementerio de Jena lleva la inscripción “Consejero de Goethe, creador de la regla de las triadas, descubridor de la catálisis por platino”
Un tercer caso memorable alemán es el de Justus von Liebig (1803-1873). La emergencia de nuevos métodos en la enseñanza de la química se ha mencionado como un asunto personal de este joven químico, quien concibió y montó un método revolucionario basado en la enseñanza en el laboratorio, concebido tradicionalmente como opuesto a la lección tradicional y la experiencia de cátedra. Resulta que von Liebig fue un alumno de Thenard, Gay-Lussac, Chevreul, y Vauquelin en París en 1822, y a sus 21 años, en Mayo 24 de 1824 fue contratado como profesor asistente en la Universidad de Giessen, en Alemania. Interesante este aspecto que no marca a von Liebig como el creador de la enseñanza basada en el laboratorio, sino en un ejecutor de las enseñanzas de Thenard.
Reat y Munley (2008) nos dicen que cuando tenía catorce años le preguntó su instructor en qué estaba planeando convertirse; él replicó: “en un químico”. “Esa profesión no existe todavía”, le dijo el instructor, a lo que von Liebig replicó con una carcajada convulsiva.
La visita a Darmstadt, el pueblo natal de Justus, de un vendedor ambulante fue decisiva en la temprana carrera del joven. Entre otras cosas, el vendedor vendía torpedos potenciados por fulminatos. Después de observar cómo se hacían los fulminatos con materiales fácilmente reconocidos, tales como mercurio, ácido nítrico y alcohol, pronto Liebig empezó a experimentar por sí mismo y produjo estupendos torpedos que eran vendidos en la tienda de su padre. Cuenta la leyenda que los fulminatos continuaron apareciendo en su vida: una inoportuna explosión de fulminato en su escuela lo condujo a su expulsión del gimnasio; más tarde volaron sus vidrios y las barras de sus ventanas a la calle y sus padres lo llevaron con el apotecario de Heppenheim en un esfuerzo por canalizar sus actividades experimentales hacia una dirección más positiva. En diez meses aprendió todo lo de la apoteca y continuó su estudio de los fulminatos en su tiempo libre. Alguna historia cuenta por ahí que Liebig fue echado de Heppenheim después de que otra explosión en su ático estremeció fuertemente la casa.
Ese mismo empuje hacia la experimentación lo caracterizó en los años que pasó en Giessen al frente de su laboratorio, que lo convirtieron en uno de los más influyentes químicos del siglo XIX. Tuvo alumnos de Estados Unidos, de Gran Bretaña y toda Europa, e inclusive un mexicano: Vicente Ortigosa (ver la ilustración 9).
El cuarto ejemplo alemán para recordar es el de Julius Adolph Stoeckhardt (Boeck, 2007; 2008), no sólo un eminente químico sino un gran maestro y divulgador de esta ciencia, autor de Schule der Chemie (ver la ilustración 10).
La siguiente frase, tomada del artículo sobre Stoeckhardt de Boeck (2008) revela los pensamientos de Ostwald sobre Schule der Chemie. Pronto aprendí a poner cuidado y fomentarlo como el más grande tesoro que cayó en mis manos hasta ahora. Porque este libro de química demostró ser una pieza maestra de la instrucción… Stoeckhardt llenó mi deseo de hacer todos esos excelentes experimentos acerca de los que yo mismo había leído… con relación a los dispositivos y la habilidad del alumno (en el libro) eran requeridos sólo un poco por el principiante, mientras que más tarde era guiado paso a paso con consideración hacia objetivos más complicados. (Ostwald, 1933, pp. 43-44).
Como un ejemplo notable de clasificación de los elementos (en esa ocasión por su tendencia a formar ácidos o bases) se presenta la ilustración 11 que muestra el “arreglo parabólico de Stoeckhardt”. A la derecha están los elementos positivos o primariamente formadores de bases y a la izquierda los negativos o primariamente formadores de ácidos. En la parte baja se encuentran los indecisos.
El elemento más arriba a la izquierda en la ilustración 11 es el Sauerstoff (O), le siguen los halógenos, Fluor (F), Chlor (Cl), Brom (Br) und Jod (I), y después Schwefel (S) und Selen (Se). Continúan Phosphor (P), Stickstoff (N), seguidos por Kohlenstoff (C), Bor (B) und Kiesel (Si), finalmente concluye la rama izquierda con Arsenik (As), Antimon (Sb) und Zinn (Sn). En la parte baja están Wasserstoff (H), Platin (Pt) und Gold (Au). En la rama derecha aparecen las siguientes parejas de elementos, de arriba a abajo: Kalium (K) und Natrium (Na); Calcium (Ca) und Magnesium (Mg); Barium (Ba) und Strontium (Sr). Continúan otros elementos metálicos hasta finalizar el lado derecho: Aluminium (Al); Chrom (Cr); Mangan (Mn); Eisen (Fe); Zink (Zn); Nickel (Ni) und Kobalt (Co); Blei (Pb) und Wismuth (Bi); Kupfer (Cu); Quecksilber (Hg) y Silber (Ag).
Toda una maravilla este arreglo parabólico de Stoeckhardt.
Concluimos esta editorial con la nota de que no solamente la tabla periódica de Mendeleiev fue uno de los productos didácticos de la factura de su libro de Química General para sus alumnos de la Universidad de San Petersburgo, sino que sin duda contribuyeron a su hechura todos los docentes franceses y alemanes a los que nos hemos referido aquí, pues Mendeleiev conoció sus textos. Hasta ahora pocos son los que han considerado la relación entre la clasificación y la escritura de libros de texto; dada la visión actual de los textos como literatura repetitiva y sin inspiración, el descubrimiento de Mendeleiev puede considerarse como la afortunada excepción. No obstante, ello nos muestra que la docencia ha influido, en ocasiones notablemente, y se ha fundido con el trabajo de investigación de frontera (Bertomeu, García-Belmar y Bensaude-Vincent, 2002).