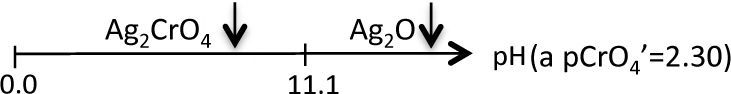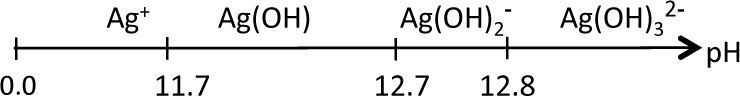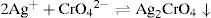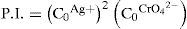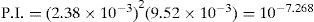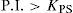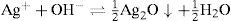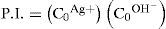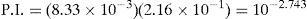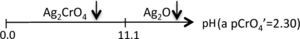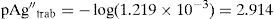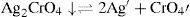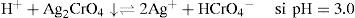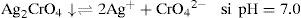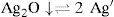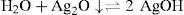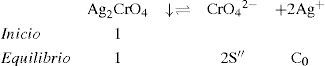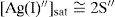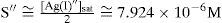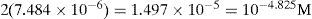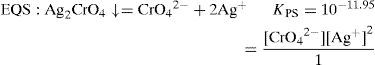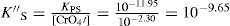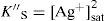The main goal of this study was to demonstrate the importance of acidity on precipitation process of Ag2CrO4 and Ag2O, which can be formed in Mohr's method. This can be explained through the interpretation of a Predominance-Existence Diagram, which shows reliable results of a didactic experiment. The first part of this study consists of identifying two kinds of solids, Ag2CrO4, which is reddish, and Ag2O brownish. The second part shows that acidity affects in speciation of Cr (VI) by changes in the color of the aqueous solution. Finally, it has been demonstrated that pH affects on absence or formation of certain solids. These changes can be explained by a predominance-existence diagram, which is useful to identify a logarithmic curve related with conditional solubility of Ag2CrO4 or Ag2O, the conditional solubility constant, and also concentration of silver at saturation. The finding of minimum solubility — without Ag2O can be formed-justifies that optimal interval pH to titrate on Mohr's method is 7.0
El propósito de este trabajo es demostrar la importancia que tiene la acidez en la formación de los precipitados Ag2CrO4 y Ag2O factibles de precipitar en el método de Mohr. La justificación se realiza a través de un diagrama existencia-predominio, y su relación congruente con los resultados de un experimento sencillo e ilustrativo. Una parte consiste en la identificación física de los precipitados Ag2CrO4, de color rojizo, y del Ag2O, de color café. Posteriormente se manifiesta, por cambios en la intensidad de color de la solución, que la acidez causa cambios en la especiación del Cr(VI). Por último, se demuestra que el pH influye en la presencia o ausencia de precipitado y en el tipo de sólido formado. En el diagrama de existencia-predominio, se identifica que la trayectoria de saturación está relacionada logarítmicamente con la solubilidad condicional, la constante condicional de solubilidad y la concentración de saturación de plata(I), siendo diferente para los sólidos Ag2CrO4 y Ag2O. El hallazgo del valor mínimo de la solubilidad sin la formación de Ag2O, es útil para demostrar que el intervalo 7
El método de Mohr involucra la determinación cuantitativa de iones cloruro, bromuro o cianuro por medio de la titulación con una solución estándar de nitrato de plata utilizando cromato de sodio o potasio como indicador químico de fin de valoración. El fundamento consiste en que el catión Ag+ reaccionará en primer lugar con el anión Cl− de la muestra; al consumirse cuantitativamente el Cl−, el ion reaccionará con el primer exceso de Ag+ proveniente del titulante formando el sólido rojizo Ag2CrO4, el cual marca el punto final de la titulación; el volumen de disolución de Ag+ requerido para que aparezca el Ag2CrO4 corresponde al punto de equivalencia. Así, la precisión y exactitud está señalada por la formación del sólido Ag2CrO4. Dado que este compuesto debe precipitar, la hidrólisis de ión cromato debe evitarse, así como la formación del Ag2O durante el análisis (Fischer y Peters, 1971).
Lo anterior puede explicarse a través de cálculos matemáticos. No obstante, el uso de diagramas en dos dimensiones que incluyen la especificación de la existencia de sólidos que coexisten en equilibrio con las especies en disolución ilustra ambos efectos. Este tipo de diagramas es útil porque permite explicar las condiciones bajo las cuales el método de Mohr es aplicable.
Materiales y métodosSe requieren las disoluciones siguientes:
- •
Nitrato de plata, AgNO3 5.0×10−2M
- •
Cromato de potasio, K2CrO4 1.0×10−2M
- •
Soluciones de ácido nítrico, HNO3 2.2M, 2.2×10−1M, 2.2×10−2M y 2.2×10−3M.
- •
Soluciones de hidróxido de potasio, KOH 2.6×10−1M, 1.0×10−3M y 5.0×10−4M.
- •
Agua desionizada
La experimentación se divide en tres partes:
Identificación de los precipitados Ag2CrO4 y Ag2O- 1.
En un tubo de ensaye agregar 2.0mL de la disolución de K2CO4 1.0×10−2M y añadir 0.1mL de AgNO3, 5.0×10−2M. Anotar las observaciones.
- 2.
En otro tubo de ensaye adicionar 1.0mL de solución de hidróxido de potasio 2.6×10−1M y adicionar lentamente 0.20mL de solución de AgNO3 5.0×10−2M. Registrar las observaciones.
- 1.
Preparar una serie de ocho tubos. Añadir 2.0mL de solución de K2CrO4 1.0×10−2M a cada uno.
- 2.
Al tubo núm. 1, añadir 2.0mL de la solución de HNO3 2.2M, al tubo núm. 2 la solución de HNO3 2.2×10−1M y así en lo sucesivo hasta incorporar todas las soluciones ácidas. Al tubo núm. 5 adicionar 2.0mL de agua desionizada. Al tubo núm. 6 agregar 2.0mL de la solución de KOH 5.0×10−4M y así sucesivamente hasta cubrir la zona alcalina. Con lo anterior se tendrá una serie de ocho disoluciones de pH aproximados a 0.0, 1.0, 3.0, 7.0, 9.1, 10.4, 10.7 y 13.1, respectivamente. Registrar las observaciones.
A la serie de tubos de la parte experimental B, adicionar 0.10mL de la solución de AgNO3 5.0×10−2M y registrar las observaciones correspondientes en lo referente a la formación del precipitado, el color de éste y grado de la turbidez.
Resultados y discusiónIdentificación de los precipitados Ag2CrO4 y Ag2OLa disolución de K2CrO4 inicialmente amarilla a causa del ion CrO4 2−, al mezclarse con la disolución incolora de AgNO3, forma un precipitado Ag2CrO4, de color rojo característico; lo anterior es debido a la reacción del catión Ag+ con el anión CrO4 2−, según la ecuación química 1:
El sólido Ag2CrO4 ↓ poco soluble tiene un valor de KPS=10−11.95, según Ringbom (1979). Su formación se justifica a través del cálculo del producto iónico (P.I.) definido por la Ecuación 1:Para ello se requiere el cálculo de la concentración inicial de cada ion en la mezcla considerando el volumen total. Al sustituirse esos valores en la Ecuación 1 se obtiene el P.I.:Se forma el precipitado si se cumple la desigualdad siguiente:Ya que el P.I. es mayor que la KPS (10−7.268>10−11.95) se confirma la precipitación del Ag2CrO4 bajo las condiciones experimentalmente descritas.Por otro lado, al adicionar AgNO3 en solución a la disolución incolora de KOH, se formó un precipitado color café pardo, que es Ag2O termodinámicamente estable:
El Ag2O ↓ tiene un valor de KPS=10−7.7 según lo descrito por Burriel y col. (1989). El P.I. para confirmar la precipitación de Ag2O ↓ está dado por la Ecuación 2:Sustituyendo las concentraciones iniciales de ambos iones en la Ecuación 2 se tiene:Como el P.I. es mayor que la KPS (10−2.743>10−77) se confirma la formación del precipitado Ag2O ↓ bajo las condiciones experimentalmente descritas.El ion cromato y su dependencia con la acidezEn todos los tubos se tiene al Cr(VI) bajo distintos valores de pH. De acuerdo con el nivel de concentración del Cr(VI) se advierte cambio en la coloración entre las disoluciones de los tubos, presentándose un color amarillo intenso a valores de pH 0, 1 y 3; pero en aquellos de pH 7 a 13.1 el color amarillo es menos fuerte que en los primeros. Queda demostrado, entonces, que la especiación del Cr(VI) es dependiente de la acidez. Si la [H+] es suficiente, el CrO42− acepta H+ favoreciendo la especie HCrO4−, el cual es de color amarillo más intenso que el presentado por el ion CrO42−, mas si el medio es altamente ácido, se forma ácido crómico H2CrO4, también intensamente amarillo.
Un diagrama de distribución de especies, DDE, relaciona la fracción molar de cada especie, α, en función del pH. Si el valor a de una especie es mayor que cualquier otra en un pH particular, se dice que predomina y es la responsable de las propiedades de un sistema.
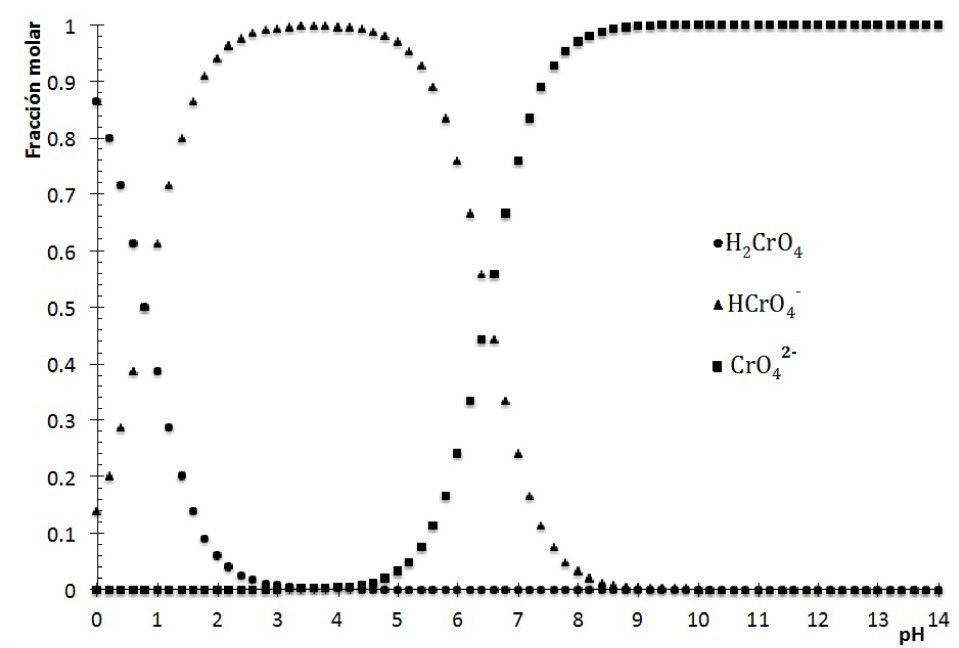
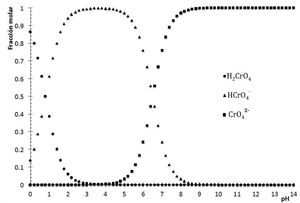
La figura 1 muestra el DDE para las especies cromato en función del pH. Se visualiza que si el pH<0.8, la especie predominante es H2CrO4, mientras que si el pH está en el intervalo 0.8<pH<6.5, predomina HCrO4 −, pero si 6.5<pH, lo hace el ión CrO4 2−. Así, los colores amarillo intenso se deben a H2CrO4 y HCrO4 −, mientras que la especie CrO4 2− es la responsable del amarillo claro en los tubos de menor acidez.
Diagrama de distribución de especies del ácido crómico en función del pH. Las constantes de disociación ácida utilizadas para el H2CrO4 son: Ka1=10−0.8 y Ka2=10−6.5 (Burriel, 1989).
Pese a que existe un equilibrio entre CrO4 2− y Cr2O7 2− (Burriel y col., 1989), la formación del dímero de Cr(VI) no tiene lugar bajo las condiciones del experimento, a causa de la baja concentración de cromato (5×10−3M). Ese equilibrio ha sido estudiado por Vicente (1985), quien demostró que la concentración total de Cr(VI) debe ser superior a 3.0×10−1.5M para considerarlo. En este trabajo, por tanto, el Cr2O72− puede omitirse, dada la baja concentración analítica utilizada.
Influencia del pH sobre la formación de los sólidos Ag2CrO4 y Ag2OEsta parte del experimento es crucial al exhibir la acidez como causa de: a) la presencia o ausencia de un sólido poco soluble, y b) el tipo de sólido formado, es decir Ag2CrO4 o Ag2O.
Al adicionar 0.10mL de la solución de AgNO3 a cada uno de los tubos que contienen cromato bajo diferentes valores de pH, se observa que a valores de pH de 0 y 1 no existe cambio aparente en relación a la coloración inicial de la solución, permaneciendo ésta como amarillo intenso sin precipitado.
Para valores de pH de 3.0, 7.0, 9.1, 10.4 y 10.7 se aprecia la presencia Ag2CrO4 por el color rojizo. Este sólido apenas perceptible a pH 3 difiere de los demás por la turbidez roja más apreciable en aquéllos. Sin embargo, a pH 13.1 se identifica la formación de Ag2O por el color café pardo.
Estas observaciones pueden justificarse a través del diagrama existencia-predominio.
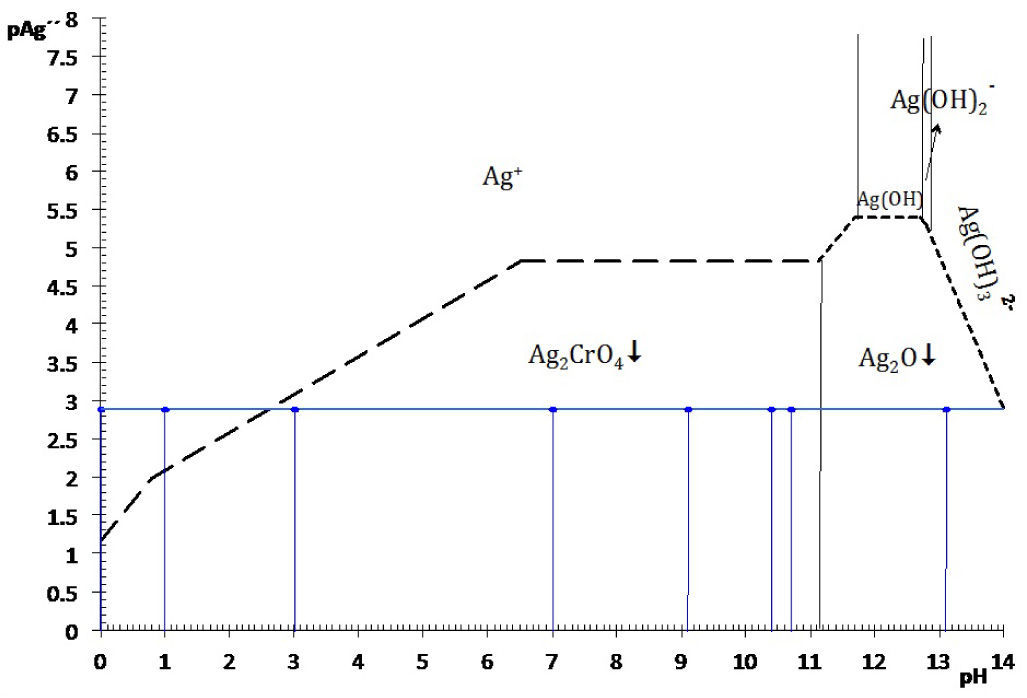
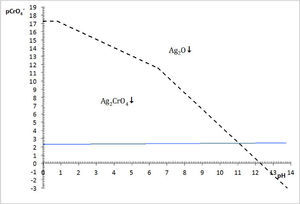
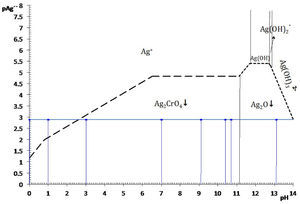
Diagrama existencia-predominioLos diagramas de existencia-predominio, DEP, permiten de una forma sencilla y práctica discernir si las condiciones químicas, como pH o pL, entre otras, causan la saturación de una fase condensada. Si la condición de saturación se favoreció, también es posible identificar el equilibrio químico de solubilidad entre el precipitado y la especie química predominante en la solución acuosa. Esto es particularmente importante para los sistemas en los que la formación de más de un sólido es posible. La identificación de la ecuación química de solubilidad bajo la condición establecida permite calcular con exactitud la constante condicional del proceso—ya que las constantes termodinámicas son conocidas—, la concentración de saturación del metal y la solubilidad condicional. Concretamente se dará la aplicación del diagrama existencia predominio para el sistema Ag+−CrO42−−H+ en el plano pAg″/pH a fin de explicar el motivo por el cual el sólido Ag2O es favorecido a pH alcalino en lugar del Ag2CrO4, y por qué el Ag2CrO4 no se forma si la acidez es elevada.
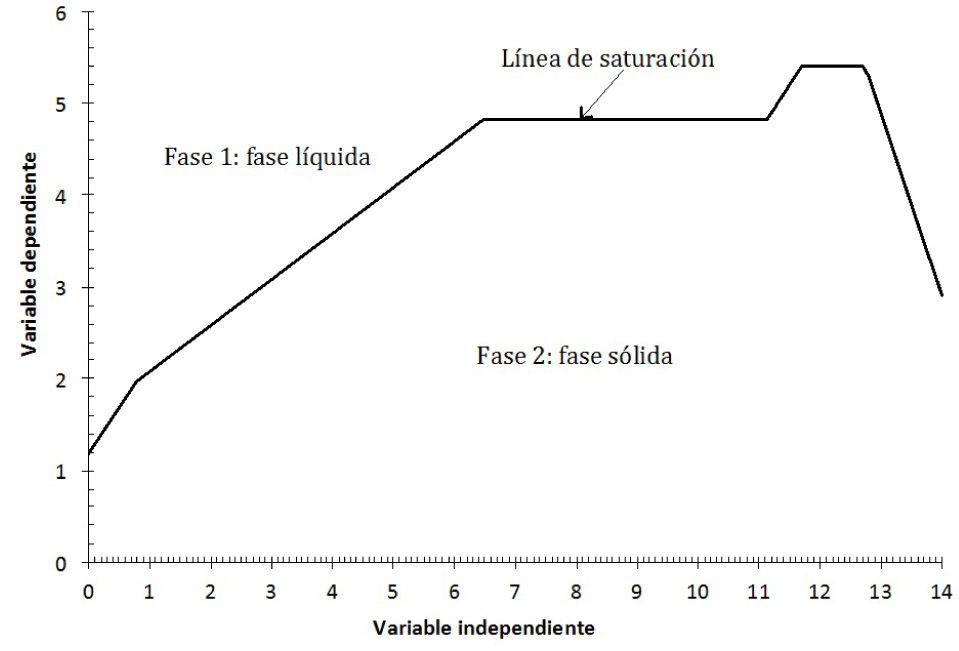
Si se favorece la saturación, entonces dos fases coexisten simultáneamente: la fase líquida —disolución acuosa— y la fase sólida —el precipitado—. La condición de saturación, señalada por la trayectoria, distingue la fase líquida de la fase sólida y se denomina línea de saturación; en esta situación se origina un tipo de equilibrio químico entre ellas: el de solubilidad (figura 2).
El DEP es una gráfica que representa el equilibrio químico que se establece entre un sólido con la especie disuelta en solución acuosa, según los eventos químicos en un sistema. Relaciona dos variables, cada una en un eje, los cuales corresponden al logaritmo negativo de la concentración de especies. La variable independiente corresponderá al factor de estudio, tal como pH, mientras que la dependiente es pAg. Para la elaboración de este diagrama fue necesario un análisis químico matemático previo basado en la predominancia de especies bajo el número de amortiguamientos en la fase acuosa según Rojas y Ramírez (1991) y en la existencia de precipitados, según los procesos químicos que ocurren en fase sólida —por medio de un diagrama de fases condensadas— de acuerdo con Trejo y col. (1996) (figura 3).
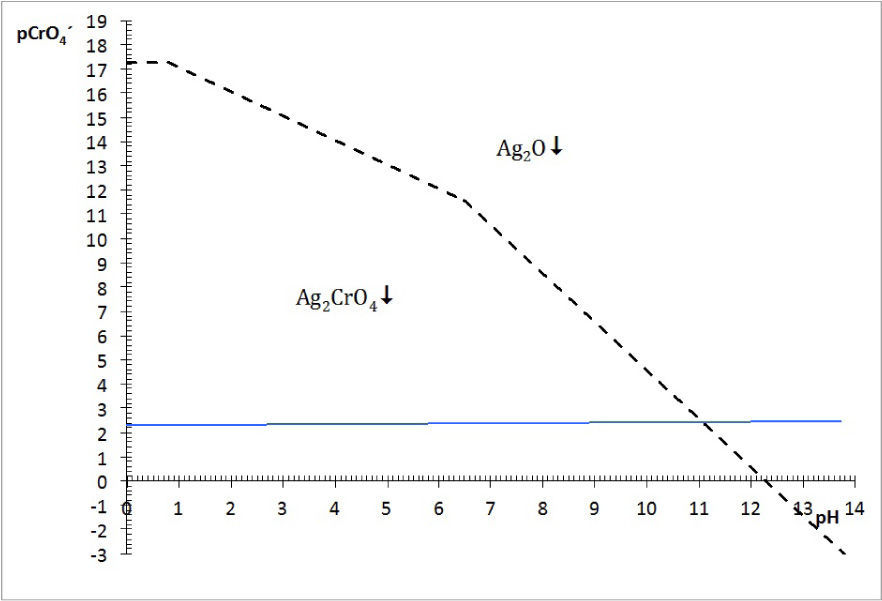
La figura 3 permite dilucidar cuál de los dos precipitados existentes en el sistema heterogéneo es el que participará en el equilibrio de solubilidad según el dominio de pH. Al trazar una línea que corresponda al del método (en este caso el pCrO4 2−=2.30). Se logra identificar que el Ag2CrO4 existe en el intervalo de pH 0 a 11.1, mientras que el Ag2O de 11.1 a 14, obteniéndose un diagrama lineal de existencia:
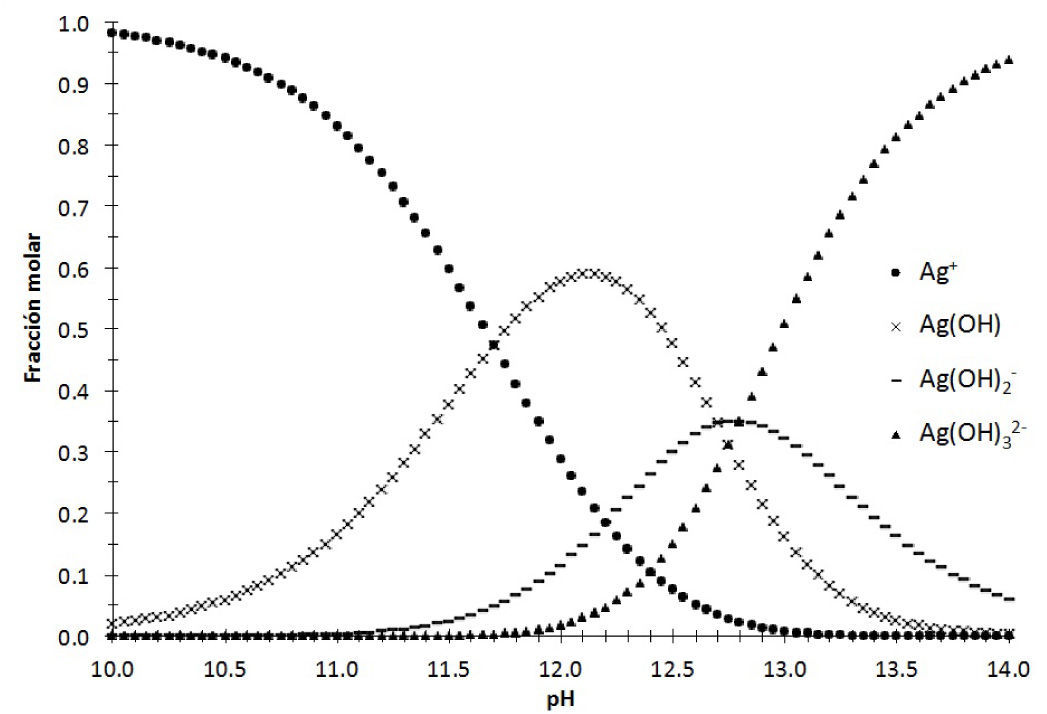
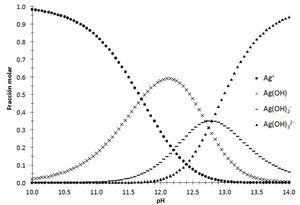
Por otro lado, para identificar cuál de las diferentes especies de plata(I) predomina en solución acuosa según el dominio de pH, se considera el diagrama de distribución de especies (figura 4).Diagrama de distribución de especies para el sistema Ag+−H2O en función del pH. Las constantes utilizadas son las mostradas en la escala de pH, Ka1=10−1.17, Ka2=10−12.7 y Ka3=10−12.8 (Ringbom, 1979).
Con base en la figura 4, se traza el diagrama lineal de zonas de predominio en función del pH:
Si en la figura 2 se colocan las especies de Ag(I)′ por su predominancia en la parte superior de la trayectoria de saturación y en la parte inferior las especies sólidas según su existencia, se obtiene la figura 5.La elección de pAg″ como variable dependiente se puede explicar por el razonamiento de la Ecuación 1. Para un valor propuesto de C0CrO4 2−, si el P.I.< KPS no se producirá precipitado y la [Ag+] en la solución acuosa es igual al valor C0 Ag+, a causa de que no hay reacción de precipitación. En contraste, si el P.I. > KPS implica que las especies Ag+ y CrO4 2− reaccionarán, y [Ag+] estará definida por lo que el equilibrio de solubilidad permite. Por tanto, la [Ag+] es una variable que depende del evento químico de precipitación. Al aplicar el logaritmo negativo a ese valor se obtiene pAg pero al depender de la acidez y del pCrO4′, entonces se definirá pAg″. La concentración de CrO4′ en el experimento es empíricamente constante y no constituye una variable.
Predicción de la condición de saturaciónPara interpretar el diagrama de existencia-predominio se requiere calcular el valor de pAg″ en la mezcla, en adelante “pAg de trabajo”, sin importar si el proceso de precipitación ha ocurrido:
La concentración de Ag+, considerando el volumen total de la mezcla para el cálculo de pAgtrab es:Este valor no constituye una concentración de equilibrio, solo permite identificar si existe sólido o no a determinado valor de pH.En la gráfica de la figura 5 se sitúa el valor anteriormente calculado a los valores de pH impuestos experimentalmente, observándose que el pAg″trab=2.9 se encuentra por:
- a)
Arriba de la línea de saturación a los valores de pH 0 y 1.
- b)
Debajo de la línea de saturación a valores de pH 3, 7, 9.1, 10.4, 10.7 y 13.1.
Por tanto, al ubicar el par coordenado (pH, pAg″trab), se observa que no existe precipitado a pH 0 ni a 1; esto es, que el catión Ag+ no precipita en esas condiciones, está totalmente soluble, la disolución no está saturada y no es posible escribir una ecuación química de precipitación. Esto concuerda perfectamente con los resultados experimentales de esta parte.
Por otro lado, en valores de pH 3, 7, 9.1, 10.4 y 10.7 se observa en el diagrama de la figura 5, que el precipitado formado es el Ag2CrO4 ↓; comparando esta información con los resultados experimentales se advierte perfecta concordancia. El sólido Ag2CrO4↓, al estar en contacto con la disolución acuosa, establece un equilibrio según la ecuación química de solubilidad siguiente:
Identificación de la ecuación química representativa de solubilidadLa ecuación química representativa se obtiene fácilmente al interpretar el diagrama. Para cada valor de pH en cuestión, ya sea 3.0, 7.0, 9.1, 10.4 y 10.7, hay que situar el punto en la línea de saturación —esto es posible porque existe sólido—. Se observa que para todos estos valores de pH, la especie de Ag(I) que colinda en la trayectoria es Ag+; sin embargo, el balance por cromo (VI) es diferente. La figura 1 permite identificar la predominancia del cromato como HCrO4 − a pH=3, pero a pH=7 está CrO4 2−. Sustituyendo estas especies en la Ecuación Química 3 se tiene:
El balance por H+ por tanteo se hace después de escribir las especies predominantes de Ag(I) y Cr (VI).En contraste, si el pH es mayor que 11.1, el precipitado formado es Ag2O ↓ según la figura 5. Al comparar esta información gráfica con el resultado experimental a pH 13.1 se corrobora la validez del diagrama. Aquí, la ecuación química de solubilidad no requiere del balance por Cr(VI) :
El balance por compensación de átomos de oxígeno y H+, si es que se requieren, se efectúa posterior a la especie predominante de Ag(I). Por ejemplo, a pH 12, la ecuación química de solubilidad es:Relación de la constante de solubilidad y la concentración de saturación del metalEl diagrama de existencia-predominio permite conocer el valor numérico de la solubilidad condicional (S″). Para ello, en el diagrama a cierto valor de pH se localiza el pAg″ sat en la trayectoria. Así, en el intervalo de pH 6.5 a 11.1, el pAg″ sat≈4.8, esto implica que [Ag(I)″]sat=10−4.8 M. La relación entre este valor con la S″ se deduce con la ecuación química de solubilidad al intervalo de pH asociado y su estado de equilibrio, considerando que la concentración de CrO42− es constante:
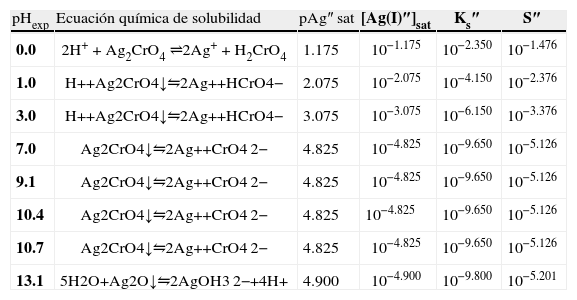
Del estado de equilibrio de la Ecuación Química 8 se deduce que [Ag+]sat se relaciona con la S″ así:La S″ en este intervalo se calcula al sustituir la [Ag(I)″]sat≈10−4.8 M, y dividirla por 2:El tratamiento formal sin considerar que la concentración de cromato es constante conduce a un polinomio de tercer grado en la solubilidad presencia de ion común (SI.C.)=7.924x10−6M. Si con éste se verifica la [Ag(I)″]sat con la Ecuación 4:Se corrobora que el valor exacto es pAg″ sat=4.825. Lo relevante de este dato es que gráficamente coincide con el pAg″ sat≅4.8, en el intervalo de pH 6.5 a 11.1. Asimismo, con el pAg″ sat se puede deducir la constante condicional de la ecuación química de solubilidad, EQS, para el mismo intervalo de pH:Como la concentración de CrO4 2− es constante, se agrupa del lado del término de la KPS definiendo la constante de solubilidad condicional, K″S, así:La concentración sustituida de 10−2.30 M es válida para HCrO4 − o H2CrO4. Al final, la expresión queda:Un razonamiento análogo a las Ecuaciones 5 y 6 se aplica a las demás EQS; si aparecen H+ y CrO4′, ambas concentraciones se considerarán constantes, obteniéndose así la tabla 1 a partir de los pH experimentales.Ecuaciones químicas de solubilidad, constantes y solubilidades condicionales a los valores de pH experimentales.
| pHexp | Ecuación química de solubilidad | pAg″ sat | [Ag(I)″]sat | Ks″ | S″ |
| 0.0 | 2H+ + Ag2CrO4 ⇌2Ag+ + H2CrO4 | 1.175 | 10−1.175 | 10−2.350 | 10−1.476 |
| 1.0 | H++Ag2CrO4↓⇋2Ag++HCrO4− | 2.075 | 10−2.075 | 10−4.150 | 10−2.376 |
| 3.0 | H++Ag2CrO4↓⇋2Ag++HCrO4− | 3.075 | 10−3.075 | 10−6.150 | 10−3.376 |
| 7.0 | Ag2CrO4↓⇋2Ag++CrO4 2− | 4.825 | 10−4.825 | 10−9.650 | 10−5.126 |
| 9.1 | Ag2CrO4↓⇋2Ag++CrO4 2− | 4.825 | 10−4.825 | 10−9.650 | 10−5.126 |
| 10.4 | Ag2CrO4↓⇋2Ag++CrO4 2− | 4.825 | 10−4.825 | 10−9.650 | 10−5.126 |
| 10.7 | Ag2CrO4↓⇋2Ag++CrO4 2− | 4.825 | 10−4.825 | 10−9.650 | 10−5.126 |
| 13.1 | 5H2O+Ag2O↓⇋2AgOH3 2−+4H+ | 4.900 | 10−4.900 | 10−9.800 | 10−5.201 |
Con los datos de la tabla 1 y analizando el diagrama de existencia-predominio es fácil encontrar los valores límite del intervalo de pH para que la valoración de Mohr tenga resultados precisos y exactos. La experimentación permite distinguir que a pH 3.0, 7.0, 9.1, 10.4 y 10.7 se forma el precipitado Ag2CrO4↓. En la figura 5 se aprecia que la mínima solubilidad del Ag2CrO4 está en el intervalo cerrado 6.5 a 11.1. Fuera de este intervalo aumenta S″ o precipita Ag2O, dificultando la detección del punto final de la valoración. Por ello, varios autores sugieren que intervalo de pH idóneo para trabajar el método de Mohr es de 7 a 10 (Sheen, 1938; Fischer, 1971), alejándose de los valores cota de pH “no deseables”.
Así se comprende que si el pH es ácido o ligeramente ácido, no se recomienda valorar, dado que la solubilidad está aumentada causando una sobreestimación del volumen de vire de Ag+ para detectar el punto final; el experimentador—quien puede ser de nivel técnico—, podría pensar que la muestra analizada tiene alto contenido de Cl−, lo cual sería un error craso. Es crucial ajustar el pH de un modo conveniente antes de empezar a titular (Christian, 2009).
ConclusionesDe acuerdo con lo realizado experimentalmente y la discusión presentada:
- a)
Se planteó la propuesta de un diagrama de existencia-predominio que involucra claramente la participación de dos sólidos, Ag2CrO4 y Ag2O. Hasta la fecha, no se ha publicado un diagrama que involucre la contribución de ambos sólidos en sólo un diagrama. El diagrama propuesto en este trabajo simplifica sobremanera los cálculos matemáticos más complicados. En él, dos efectos son notables: aumento de la solubilidad si el pH disminuye y la formación del Ag2O si el pH aumenta.
- b)
Se demostró experimental y gráficamente que el intervalo de pH 7.0 ≤ pH ≤ 10.0 favorece la formación del Ag2CrO4 sin la precipitación de Ag2O.
- c)
Con el DEP para el sistema Ag+−CrO4 2−−H+ en el plano pAg(I)″/pH a pCrO′4=2.30 se identificó el equilibrio químico de solubilidad, K″s, [Ag″]sat y la S″ del precipitado a pH empíricos.