Following the proposals of T. Kuhn and W. Jensen on scientific revolutions, in this article history of chemistry is split up into five great revolutions (1770-1790; 1845-1865; 1904-1924; 1945-1965 and 1973-1993) and the public image of chemistry around them is examined.
La química tiene una mala imagen. La gente desconfía de ella por considerarla una ciencia compleja e incomprensible. Existe la tradición de aprender la química de memoria en lugar de comprenderla. Los químicos aparecen como personas retraídas y un poco peligrosas, aislados en sus laboratorios, donde confeccionan mezclas elaboradas que son peligrosas al olerlas y quizá hasta venenosas. P. Lazlo y A. Greenberg
Hace veinte años apareció, en Educación Química, el artículo de los autores del epígrafe titulado “Falacias acerca de la Química”. En el mundo y las sociedades humanas han pasado muchas cosas desde entonces, pero las preguntas alrededor de este asunto siguen siendo las mismas. ¿Por qué la imagen pública de la química es la que Lazlo y Greenberg tan atinadamente allí describen? ¿Cuál es la causa? ¿Siempre fue así? ¿Hay un momento en la historia en que la química fue reconocida de otra manera? Veinte años, que como a continuación ejemplificaremos, corresponden al periodo que caracteriza a una revolución científica, y también lo fueron para permitir el regreso de los tres mosqueteros de Dumas, o como bien dice el tango y entendemos, aquellos que los hemos vivido de adultos…, ¡no son nada! Sin embargo, algo se podrá decir.
La periodización de la historia de las civilizaciones humanas en historia antigua, medieval y moderna proviene del siglo XVI. Desde entonces, y probablemente también desde antes, para dominar el tiempo y la historia y para satisfacer las propias aspiraciones a la felicidad y a la justicia o los temores frente al inquietante concatenarse de los acontecimientos (Le Goff, 2001, p. 11), hemos buscado la forma de dividir los tiempos históricos. Hay muchas maneras de hacerlo, los parámetros pueden ser y son diferentes. En algunos casos se hace a partir generalmente de la aceptación de un acontecimiento singular o el cambio de maneras de pensar y/o actuar.1 Sobre ello, hace más de medio siglo, el filósofo francés Gaston Bachelard nos dice (1979, p. 9): Si por razones de claridad, se nos obligara a poner groseras etiquetas históricas en las diferentes etapas del pensamiento científico distinguiríamos bastante bien tres grandes periodos. El primer periodo, que representa el estado precientífico, comprendería a la vez la antigüedad clásica y los tiempos del renacimiento y de nuevos esfuerzos, con los siglos XVI, XVII y aun el XVIII. El segundo periodo, que representa el estado científico, en preparación a fines del siglo XVIII, se extendería hasta todo el siglo XIX y comienzos del XX. En tercer lugar, fijaríamos exactamente la era del nuevo espíritu científico en 1905, en el momento en que la relatividad einsteniana deforma conceptos primordiales que se creían fijados para siempre.
A diferencia de Bachelard, cuyos textos son de difícil interpretación, en el estudio de la historia y la filosofía de la ciencia, las ideas de Thomas Kuhn sobre las revoluciones científicas han sido ampliamente aceptadas (Hoyningen-Huene, 2008), así como su uso en la enseñanza y la historia de la química (Jensen, 1998).
Para Kuhn, una revolución (1971, p. 277): es una clase especial de cambio, que abarca cierta índole de reconstrucción de los compromisos de cada grupo. Los compromisos que comparten los grupos o comunidades científicas se reconocen con la palabra paradigma que es (1971, p. 71): un criterio para seleccionar problemas que, mientras se dé por sentado el paradigma, puede suponerse que tienen soluciones. Las diferentes comunidades científicas comparten a lo largo de la historia un paradigma y alrededor del mismo trabajan haciendo “ciencia normal” que es (1971, p. 26): la actividad en que inevitablemente, la mayoría de los científicos consumen casi todo su tiempo, se predica suponiendo que la comunidad científica sabe cómo es el mundo. Gran parte del éxito de la empresa se debe a que la comunidad se encuentra dispuesta a defender esa suposición, si es necesario, a un costo elevado. Por ejemplo, la ciencia normal suprime frecuentemente innovaciones fundamentales, debido a que resultan necesariamente subversivas para sus compromisos básicos.
Cuando hay una revolución científica la comunidad cambia su paradigma, cambiando las actividades relacionadas con la ciencia normal.
Esta breve introducción de carácter histórico es útil para defender el valor de la historia de la química (Nieto-Galán, 2010) como uno de los lugares privilegiados para entendernos. Cuando una comunidad renuncia a recordar por su propia cuenta el relato del pasado, del suyo propio, abdicando a reconocer aquellos eventos que deben formar parte de la memoria colectiva de esa comunidad, esta imagen del pasado, y por qué no, la del presente y el futuro, es construida por otros. Con ello, y como diría el filósofo español José Ortega y Gasset, el que vence hace mundo, y es ese mundo configurado por los vencedores el que se trataría en todo caso de transformar (Cruz, 2005, p. 172).
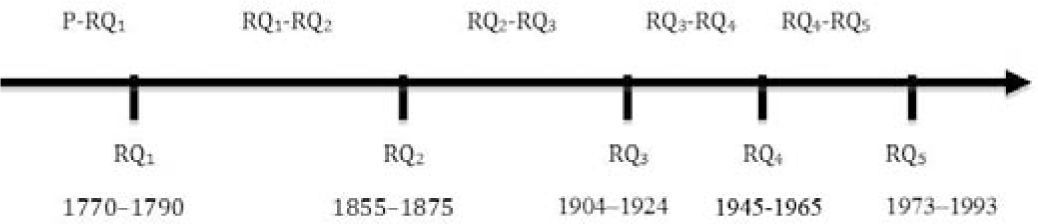
Las cinco revoluciones de la química modernaEl historiador de la química estadounidense William Jensen (1998) dividió la historia moderna de la química en tres revoluciones (1770-1790, 1855-1875 y 1904-1924), identificadas como tales, principalmente, por sus diferentes maneras de abordar la estructura de la materia. Antes de esta historia moderna reconoce una era protoquímica (P), estrechamente relacionada con la alquimia, y que se extiende hacia atrás hasta el comienzo de las actividades químicas. Para él, siguiendo las ideas de Kuhn, una revolución científica (que arbitrariamente se extiende por 20 años para caracterizar cada una de las revoluciones químicas y sólo tiene por objeto representar a esos periodos de rápido desarrollo y consolidación) ocurre cuando hay:
- •
Una reinterpretación radical del pensamiento existente.
- •
La resolución de un largo debate, y cuya solución revoluciona el tipo de problemas científicos que desde ese momento son capaces de atacarse con éxito de una manera rutinaria.
- •
La apertura de un nuevo nivel de comprensión teórica que subsume las viejas teorías y/o modelos como casos especiales.
El tipo de evidencias que respaldan su afirmación, de que cada uno de los periodos anteriores corresponde a una revolución química, con el consiguiente cambio de paradigma, considera cuatro aspectos principales:
- 1.
Relatos de la época, generalizados y persistentes, que hacen afirmaciones explícitas de que una revolución científica se está llevando a cabo.
- 2.
Cambios explícitos y significativos en el contenido, el vocabulario y la organización de los libros de texto antes y después del periodo en cuestión.
- 3.
Cambios significativos en el énfasis de la investigación y la práctica científica.
- 4.
Cambios significativos en la estructura de las organizaciones académicas y profesionales, incluyendo la fundación de nuevas cátedras, nuevos institutos de investigación, nuevas sociedades científicas y revistas nuevas.
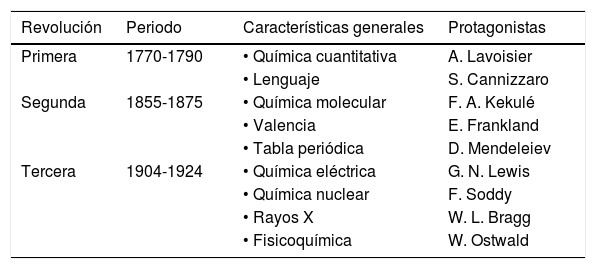
Como se cumplen uno o varios de estos cuatro aspectos en los periodos históricos antes indicados se demuestra que, efectivamente, la historia moderna de la química puede considerarse dividida en tres grandes revoluciones (RQ1, RQ2 y RQ3) que identifican importantes cambios en la concepción estructural de la materia y también de la energía y el tiempo asociado con los cambios químicos (tabla 1).
Las revoluciones químicas establecidas por Jensen
| Revolución | Periodo | Características generales | Protagonistas |
|---|---|---|---|
| Primera | 1770-1790 | • Química cuantitativa | A. Lavoisier |
| • Lenguaje | S. Cannizzaro | ||
| Segunda | 1855-1875 | • Química molecular | F. A. Kekulé |
| • Valencia | E. Frankland | ||
| • Tabla periódica | D. Mendeleiev | ||
| Tercera | 1904-1924 | • Química eléctrica | G. N. Lewis |
| • Química nuclear | F. Soddy | ||
| • Rayos X | W. L. Bragg | ||
| • Fisicoquímica | W. Ostwald |
En los últimos años el mismo Jensen (2010) y otros historiadores (Baird, 2000; Lazlo, 2006; Bensaude-Vincent, 2008) han reconocido una cuarta revolución química caracterizada fundamentalmente por la incorporación de nuevos instrumentos en las prácticas químicas. Dicha revolución que podría llamarse “instrumental”, corre siguiendo con la línea de pensamiento de Jensen, desde 1945 hasta 1965. En 1945, al finalizar la Segunda Guerra Mundial, el presidente de la National Science Foundation de los Estados Unidos, Vannevar Bush (1945), publicó un informe conocido como “Ciencia. La frontera infinita”, en el que solicitaba de manera abierta que el gobierno federal financiara la investigación de las ciencias en las universidades norteamericanas. Con ello, la forma en la que trabajaban los químicos cambió radicalmente al integrarse en los laboratorios nuevos equipos, como los espectrómetros de ultravioleta visible e infrarrojo, inicialmente, y al poco tiempo, los más importantes de todos, los de resonanciamagnética nuclear (RMN). Por otra parte, los cromatógrafos e inclusive el rotavapor ocuparon un lugar en las mesas de los laboratorios. Se crearon nuevas industrias de equipamiento siguiendo la lógica militar de la estandarización de las partes, lo que facilitó su consumo. Los laboratorios químicos cambiaron más en ese periodo que en los 300 años precedentes. Aparecieron las computadoras y con ellas los programas que permitieron hacer “cálculos químicos”, desde la incorporación del Extended-Hückel, en 1963, por Roald Hoffmann. En ese mismo año empezó a trabajar el QCPE (Quantum Chemistry Program Exchange) y un par de años más tarde John Pople introduce el CNDO y Walter Kohn los funcionales de la densidad. Todo lo anterior hizo que los químicos empezaran a pensar la estructura de la materia en términos de la mecánica cuántica que por entonces abanderaba de manera admirable Linus Pauling.2
La química sintética aprovechó la llegada de los nuevos instrumentos y se empeñó en la preparación de nuevos productos más complicados, muchos de gran importancia biológica y medicinal. La síntesis de la morfina, el colesterol, la cortisona, la estricnina, la penicilina y la clorofila compartieron la aparición en el mercado de los tranquilizantes (como el Librium y el Valium), así como de los anticonceptivos (originalmente mexicanos3). El estadounidense Robert B. Woodward se proclamó el campeón de la síntesis química. A lo anterior hay que añadir la manera en la que las macromoléculas comerciales cambiaron la forma literalmente de “constituir” el mundo (Brock, 1992). La posguerra marca el inicio de la era de los plásticos. La aplicación de la termodinámica y la cinética química al estudio sistemático de estos materiales fue tarea abordada por diferentes grupos de investigación, entre los cuales se destacó el dirigido en Alemania por Herman Staudinger.
La cuarta revolución química no se caracterizó por la resolución de una controversia, como fue el caso de las tres anteriores, sino por cambios significativos en el énfasis de la investigación y la práctica científica, así como en la estructura de las organizaciones académicas y profesionales. A partir de este momento la física y la biología ocupan un lugar preponderante en los intereses (bioquímicos) y en la forma de pensar (física cuántica) de los químicos.
En 1974 Sherwood Rowland y Mario Molina publicaron los resultados de sus investigaciones sobre el efecto de los clorofluoralcanos en la capa de ozono, con lo que se marcó el inicio de la quinta revolución química, la revolución ambiental. No fue la primera vez que la industria química enfrentaba dificultades públicas por su capacidad de contaminar el ambiente, pero en esta ocasión, a diferencia de todas las anteriores, inequívocamente el daño y el consiguiente riesgo eran globales. Un par de años antes, por ejemplo, ya se había prohibido el uso del DDT en los Estados Unidos. Rowland indicó que la química ambiental (atmosférica) “apareció” con el advenimiento de las técnicas de análisis capaces de detectar una parte en mil millones, es decir, cuando se estuvo en posibilidad de distinguir una molécula específica entre mil millones de moléculas distintas. La cuarta revolución y su corto periodo subsecuente de ciencia normal gestó la quinta revolución permitiendo “ver” del mundo lo que no se había visto antes. Más amplio y más complejo, las fronteras del mismo se pierden. La quinta revolución, al igual que la anterior, se caracteriza por cambios significativos en el énfasis de la investigación y la práctica científica, así como en la estructura de las organizaciones académicas y profesionales.
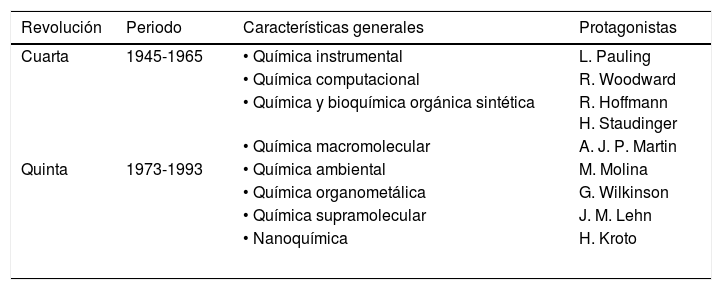
Las dos revoluciones químicas recientes
| Revolución | Periodo | Características generales | Protagonistas |
|---|---|---|---|
| Cuarta | 1945-1965 | • Química instrumental | L. Pauling |
| • Química computacional | R. Woodward | ||
| • Química y bioquímica orgánica sintética | R. Hoffmann H. Staudinger | ||
| • Química macromolecular | A. J. P. Martin | ||
| Quinta | 1973-1993 | • Química ambiental | M. Molina |
| • Química organometálica | G. Wilkinson | ||
| • Química supramolecular | J. M. Lehn | ||
| • Nanoquímica | H. Kroto | ||
Coincidente con el surgimiento de la química ambiental se reconocen y consolidan al menos tres nuevos territorios: la química organometálica, la supramolecular y la nanoquímica. En noviembre de 1973, antecediendo por unos meses lo que reconocemos marca el inicio de la quinta revolución, se entregó el premio Nobel de Química a Geoffrey Wilkinson y a Ernst Otto Fisher por sus investigaciones sobre los compuestos organometálicos tipo “sándwich” (James, 1993). A pesar de que para ese momento ya se contaba con una experiencia en el trabajo de compuestos con enlaces metal-carbón derivada principalmente de las investigaciones de Frankland en el siglo XIX y luego con los organomagnesianos de Víctor Grignard a inicios del siglo XX, y posteriormente por los estudios de los antidetonantes de la gasolina (tetraetilo de plomo) y catalizadores (Reppe, Ziegler y Natta, Wilkinson), el terreno no estaba plenamente consolidado. Desde entonces esta marginal rama del conocimiento químico, una vez que desde principios del siglo xix Jons J. Berzelius estableció las fronteras internas de la química como orgánica e inorgánica, no ha dejado de crecer. Se incorporó en los currículos de las carreras de química en prácticamente todo el mundo, se escribieron libros de texto específicos (tabla 3), se diseñaron prácticas de laboratorio, se fundaron nuevas revistas especializadas (por ejemplo en 1982 aparecieron Polyhedron y Organometallics, esta última una de las diez de química más citadas en la actualidad).
Libros de química organometalica publicados en diversos lugares del mundo durante la quinta revolución química
| G. E. Coates, M. L. H. Green, P. Powell y K. Wade, Principios de Química Organometálica. Barcelona, España, 1975. |
| J. P. Collman and L. S. Hegedus, Principles and applications of Organometallic Metal Chemistry. Oxford, Inglaterra, 1980. |
| C. M. Lukerhart, Fundamental Transition Metal Organometallic Chemistry. Belmont, California, EUA, 1985. |
| C. Elschenbroich and A. Salzer, Organometallics. A concise introduction. Weinheim, Alemania, 1992. |
Durante la quinta revolución los químicos aprendieron a hacerF reacciones en condiciones menos extremas (en términos de presión, temperatura y disolventes) que las que hasta entonces se utilizaban. Se trataba de acercarse a aquellas condiciones que permiten la vida y que disminuyen la generación de potenciales contaminantes. Cuando la química se vuelve biología las interacciones moleculares son menos intensas y se pueden reconocer agregados moleculares que conforman lo que se denominó química supramolecular. Así, el Premio Nobel de Química 1987 (James, 1993) fue otorgado conjuntamente a Donald J. Cram, Jean-Marie Lehn y Charles J. Pedersen “por el desarrollo y uso de moléculas con interacciones estructurales específicas de alta selectividad”. Lehn definió a la química supramolecular como la química más allá de la molécula, conteniendo entidades organizadas de mayor complejidad, que resultan de la asociación de dos o más especies químicas a través de fuerzas intermoleculares.
La nanoquímica se refiere a la posibilidad de utilizar los conocimientos de síntesis química para construir agregados moleculares de tamaño, forma, composición o superficie específica. Con múltiples aplicaciones en la actualidad, desde medicina, cosmética o materiales, el origen de la nanoquímica puede situarse con el descubrimiento del futboleno (C60) en 19844 por Robert F. Curl, Harold W. Kroto y Richard E. Smalley, y la posterior síntesis de nanotubos de carbono. Hay tres diferencias fundamentales entre la nanoquímica y la química convencional (Bensaude-Vincent, 2008, p. 217):
- •
A la escala de nanometros (10-9) es posible ver y manipular una sola molécula, en lugar de N0 (número de Avogadro) moléculas.
- •
A esta escala la frontera entre materia orgánica e inorgánica no importa. La nanoquímica y la biotecnología trabajan juntas.
- •
Las moléculas y las macromoléculas, así como los genes y las proteínas, son reconocidas como máquinas que realizan trabajos específicos, en lugar de bloques de materia.
Con el advenimiento de la quinta revolución y la posibilidad de manejar átomos de manera individual es prácticamente imposible distinguir entre ciencia pura y aplicada, así como entre física, química y biología.
Una representación esquemática de estos eventos con los periodos de “ciencia normal” entre las diferentes revoluciones (RQn–RQn+1) se muestra en la figura 1.
La imagen pública de la química a lo largo de la historiaLa química actual es heredera de una gran cantidad de oficios y tradiciones que influyeron en la vida cotidiana de todas las culturas. Los laboratorios, tal y como los conocemos hoy, son una de esas herencias compartidas con las otras ciencias, y que caracterizan el quehacer de la química como una ciencia experimental. Sin embargo, el experimento químico, como acto de creación y que identifica a la química como la actividad científica más productiva,5 lo vuelve prácticamente singular (Chamizo, 2011). Lo anterior ha llevado a proponer al filósofo de la química Joachim Schummer (2007) que la química no sólo domina la imagen pública de las ciencias, sino que también establece, de manera importante, su estrecha y conservadora representación popular.
En los laboratorios, como espacios dedicados al trabajo práctico, en lugar de a la investigación teórica, las actividades allí realizadas, desde hace miles de años han sido consideradas de menor nivel intelectual. La palabra latina laborare nos remite al trabajo manual, el cual era realizado, tanto en el imperio romano como en las ciudades griegas que le antecedieron, por los esclavos. El filósofo inglés del siglo XVII Thomas Hobbes, indicaba la inferioridad social de aquellos que se dedicaban al trabajo práctico: drogueros, jardineros, herreros o mecánicos. Aquellos que suponían que con dinero (con el cual se compran mejores materiales y/o equipamiento) podían obtener conocimiento, estaban equivocados. Para él, como para otros muchos académicos de su tiempo y aun hoy en día, una biblioteca era mucho mejor que un laboratorio. Desde la más remota antigüedad y en particular a partir de la Edad Media, la preparación de medicamentos, la fabricación de jabones, pigmentos, vidrio, materiales cerámicos y explosivos, y la extracción de metales fueron actividades prácticas, alejadas de la reflexión filosófica y realizadas alrededor de mercados y en lugares públicos. Sin embargo, desde esa época ya se identifica la característica más importante de un laboratorio: su aislamiento de la vida cotidiana.
Los venenos son conocidos por la mayoría de las sociedades humanas desde la más remota antigüedad. Es famosa la imagen que recuerda la ingestión de cicuta por Sócrates en el 399 a.C. Siglos antes los chinos ya usaban el opio tanto con propósitos benéficos como venenosos. En Roma, y posteriormente en las ciudades italianas del medioevo y renacimiento, hay diversas historias de príncipes y reyes que experimentaban venenos y antídotos con sus esclavos y prisioneros de guerra; de mujeres aristócratas que los usaban para escapar de los matrimonios arreglados y de la familia Borgia, que los usó para acceder al papado (Timbrell, 2005). De esa larga y oscura tradición destaca sobremanera la frase del médico, alquimista, viajero errante e irreverente Paracelso (figura 2), quien atravesó la herida y asolada Europa de principios del siglo XVI: todas las sustancias son venenosas. La dosis correcta diferencia el remedio del veneno. Hoy en los Estados Unidos un veneno es definido legalmente como aquella sustancia letal a una dosis de 50 mg/kg de masa de la persona… o menos.6
Así ya hace casi cinco siglos estaba claro que la dosis era el veneno y no la sustancia misma, y que eran sustancias naturales. Salvo el caso de algunos de los pocos metales y minerales que se conocían con potencialidades venenosas,7 los venenos venían principalmente de animales y plantas que los usaban a su vez para defenderse de sus depredadores. Extractos de hormigas, abejas, arañas, serpientes, hongos, etc., formaban parte de recetas de dudosa ambición, pero de probada eficacia.
La uroscopia, que es el examen de la orina como medio diagnóstico, se practica durante todo el periodo protoquímico (figura 1) y se vuelve el emblema de la medicina. Reconocer en y a través de un recipiente de transparente vidrio el color, el olor el sabor y la textura de la orina permite identificar, al que sabe hacerlo, el temperamento y la presencia de enfermedades de su dueño. Como lo demuestra Schummer (2007) a través de una rica iconografía, la uroscopia también se volvió el símbolo de los curanderos, de los fraudes que muchos de ellos cometían... y también de los alquimistas. Estos últimos son solitariamente representados en habitaciones oscuras rodeados de botellas y papeles (figura 3). Por su parte los alquimistas veían al mundo como un todo conectado estrechamente entre sí. En la Tierra se establecía una especie de correspondencia con el Cielo. Este mundo mítico que, como indica Malinowski (Campillo, 1998), “no es una explicación intelectual, ni imaginación artística, sino una pragmática carta de validez de la fe primitiva y de la sabiduría moral”, se caracteriza por ser una visión del mundo, con reglas morales, consejos técnicos y explicaciones del origen divino del cosmos. Los alquimistas, como los magos y curanderos y a diferencia de los sacerdotes, intervenían en el mundo (la diversidad de la preparación de venenos y remedios curativos es un claro ejemplo) y en eso se asemejan y son simiente de los químicos actuales. Sin embargo, en el mundo mítico el nombre es parte esencial de lo nombrado y conocer un nombre es apropiarse de algo propio de lo nombrado, poseer un medio para controlarlo.8 Esta manera particular de entender e intervenir en el mundo hizo que los alquimistas tuvieran a la Iglesia Católica como un fuerte enemigo, la que a través de la Inquisición a finales del siglo XV declaró fraudulentas sus prácticas.
Durante la primera revolución química, se terminan de escribir los 17 volúmenes de la Enciclopedia (Diccionario razonado de las ciencias, las artes y de los oficios) cuyo objetivo principal era difundir las ideas de la Ilustración Francesa. Denis Diderot, uno de sus editores, reconoce la imagen pública de los químicos: Los químicos son todavía un pueblo distinto, no muy numeroso, que tiene una lengua propia, sus leyes particulares, sus misterios y que vive prácticamente aislado en medio de un pueblo más grande, que muestra poca curiosidad por sus asuntos y que no espera casi nada de su industria.
Ésta no es muy diferente de la que se tiene hoy. Sin embargo, y en buena medida por la influencia de Antoine L. Lavoisier, la imagen del laboratorio químico que aparece en la Enciclopedia, a diferencia del de los alquimistas, es público, luminoso, limpio y ordenado (figura 4). Ya desde unos pocos años antes, en Oxford, Robert Boyle había conseguido que sus resultados experimentales sobre la bomba del vacío fueran aceptados en reuniones públicas, contra las ideas del anteriormente mencionado e influyente Hobbes. Con la introducción de un nuevo lenguaje, metafóricamente hablando, la luz llegó a la química y dejó de ser un asunto privado, oscuro y hermético.
Con la primera revolución, a través del Tratado Elemental de Química de Lavoisier se concreta la ambición de éste de “reformar y perfeccionar la nomenclatura química”, y se inicia lo que identificamos como química moderna.9 Hay que recordar que ya desde la remota antigüedad grecolatina, traducir era el derecho del conquistador (Durand, 2010), como también imponer su lengua. Nombrar ya no es poseer. El objeto se separa del sujeto. Con la primera revolución se construye el primer paradigma. De la diversidad se empieza a pasar a la unidad. El sociólogo francés Pierre Bordieu dos siglos después, coincidiendo seguramente sin saberlo con Diderot, ha indicado al respecto (2003, p. 35): El paradigma es el equivalente de un lenguaje o de una cultura: determina las cuestiones que pueden ser planteadas y las que pueden ser excluidas, lo que se puede pensar y lo que es impensable; al ser a un mismo tiempo una adquisición y un punto de partida, representa una guía para la acción futura, un programa de investigaciones a emprender, más que un sistema de normas. A partir de ahí el grupo científico está tan distanciado del mundo exterior que es posible analizar muchos problemas científicos sin tomar en consideración las sociedades en las que trabajan los científicos.10
En ese momento, particularmente en 1787, apareció en inglés la palabra responsibility y once años después la francesa responsabilité. Este dato filológico, como se verá más adelante, no es trivial. Desde entonces y poco a poco, a la par de muchas de las ideas y formas de ver el mundo derivadas de la Revolución Francesa y la Revolución Industrial fue adueñándose de las sociedades europeas la convicción de que debemos asumir, sin escusa ni remedio posible, nuestros propios horrores como algo de lo que debemos dar cuenta […] El mal […] tal vez pueda ser banalizado, pero nunca más podrá volver a ser ignorado (Cruz, 2005, p. 117). El filósofo catalán Manuel Cruz indica de manera muy clara este cambio en la mentalidad de las nacientes sociedades industriales: La responsabilidad no se puede pensar bajo la figura de la deuda, ni cabe convenirla en un gesto reactivo. Es más bien la actitud más afirmativa que estamos en condiciones de pensar. Por lo mismo, declararse responsable no es un imperativo cuya legitimidad última derive de ningún tipo de trascendencia. Antes bien al contrario, se pretende uno de los gestos seculares por excelencia. (Cruz, 2005, p. 143)
El paradigma lavoiseriano, los átomos de Dalton, la electroquímica que permitió descubrir nuevos elementos reconocidos a través de la simbología propuesta por Berzelius, la separación que éste hizo de la química en orgánica e inorgánica, los pesos equivalentes, las leyes de los gases, los tipos de Gerhardt, las moléculas, los trabajos de Avogadro, la isomería, la valencia y muchas otras novedades y dificultades químicas se dieron cita en la fronteriza ciudad de Karlsruhe11 a principios de septiembre de 1860 en el Primer Congreso Internacional de Químicos.12 Convocado por tres reconocidas personalidades de la época —Karl Weltzein, Friedrich A.Kekulé y Charles A. Wurtz— que ambicionaban, como Lavoisier años atrás, reformar y perfeccionar el lenguaje de la química.13 La carta a través de la cual convocaron a 127 personas, 56 provenientes de Alemania, 21 de Francia, 18 de Inglaterra, ocho de Rusia y Polonia, siete de Austria, seis de Suiza, dos de Italia y uno de España, Portugal y México es muy clara. En ella se puede leer que la razón de ser de esta reunión era lograr superar (Bensaude-Vincent, 1997, p. 116) las profundas divergencias acerca de las palabras y los símbolos, que dañan la comunicación y la discusión, motores esenciales del progreso científico. Fracasaron en su intento original pero salieron fortalecidos y compartiendo el paradigma que caracterizaría la segunda revolución (Kauffman, 2010). La química era una actividad pública europea que posteriormente perfeccionaría su lenguaje, a través de otros congresos y con la fundación de la IUPAC. Por otro lado, y a partir de la participación de Stanislao Cannizzaro en Karslruhe, las moléculas quedaron claramente diferenciadas de los átomos y Dimitri I. Mendeleiev, otro asistente al evento, construyó su famosa tabla periódica utilizando el ordenamiento de Cannizzaro, la valencia y los pesos atómicos. Muchas de las dudas teóricas se disiparon mientras que los avances industriales a partir del descubrimiento del colorante malva por William H. Perkin se aceleraban, particularmente en Alemania.
El modelo universitario alemán que relacionaba estrechamente la investigación “pura” con la “aplicada” fue copiado por otros países de Europa. Así, la segunda revolución es testigo del final del químico amateur, para dar paso al profesional. La química fue la primera, entre todas las otras ciencias, en la que el trabajo experimental durante su enseñanza se volvió obligatorio. En ese momento en muchos países de Europa se instala la educación obligatoria y las escuelas empiezan a ser construidas y gestionadas por los gobiernos locales. Como lo indica Knigth (1992, p. 155) Probablemente durante el siglo XIX la química fue la ciencia más enseñada […] la química era útil para cualquiera ya fuera que se interesara en ciencia pura o aplicada; las industrias requerían cada día más y más personas con conocimientos de química. Para todos era claro que los químicos pensaban no sólo con el cerebro, sino también con las manos.
El periodo entre la segunda y tercera revolución química ha sido considerado como la “época de oro de la química” (Knigth, 1992). La materia estaba compuesta de átomos (con valencia) y moléculas, que clasificados periódicamente como elementos, permitían predecir su comportamiento, lo que facilitaba copiar moléculas que se encontraban originalmente en plantas y animales, y posteriormente sintetizar moléculas completamente nuevas. Las sociedades europeas primero, pero posteriormente las del resto del mundo, fueron inundadas con nuevos colorantes (figura 5), materiales y medicamentos provenientes de las poderosas industrias químicas alemanas. En este país, el número de universidades con institutos y departamentos de química, con sus respectivos profesores, investigadores y alumnos creció de manera considerable […] los que poco a poco empezaron a cambiar sus actividades, siendo una de las más importantes el dejar fundamentalmente de pesar, por medir. La fisicoquímica estaba en camino.14
Fórmula desarrollada del índigo. A principios del siglo XIX existía en la India una próspera industria de colorante azul índigo, el cual se obtenía de una planta del género indigofera. Miles de años antes, esta planta ya se exportaba a Grecia para teñir de azul la ropa. La India era el único productor de este colorante en el mundo, muy apreciado por lo estable y vivos que resultaban los tejidos teñidos con él. Para producir 9000 T se utilizaban un millón de hectáreas de tierra y el trabajo de miles de personas. Cuando en 1882 el químico alemán A. von Baeyer determinó la estructura química de esta sustancia pudo años después sintetizarla en el laboratorio. En la siguiente década el método para obtenerla a partir de materias primas baratas se desarrolló de tal manera que pudo fabricarse a un precio mucho menor que el que costaba el índigo natural. La batalla entre el índigo natural y el sintético fue breve y violenta. El índigo natural, más caro que el sintético, perdió y, con ello, miles de personas en la India que vivían de él.
El reconocimiento de que los átomos podían dividirse, derivado del descubrimiento de los electrones y la radiactividad, inició a principios del siglo xx la tercera revolución química. Con la espectroscopia y los rayos X, la radiación electromagnética ocupó un lugar importante en el pensamiento químico, cada vez más influenciado por los avances que se estaban dando en la física. Era claro que debajo de la omnipresente materialidad de las sustancias, hasta entonces terreno prácticamente privado de los químicos, había una realidad a la que sólo bajo las técnicas que iban desarrollando los físicos podía accederse. De acuerdo con lo indicado anteriormente por Bachelard, se inicia el “espíritu científico” el estado abstracto (1979, p. 11), en el que el espíritu emprende informaciones voluntariamente sustraídas a la intuición del espacio real, voluntariamente desligadas de la experiencia inmediata y hasta polemizando abiertamente con la realidad básica, siempre impura, siempre informe. Quedaba por ver si eso representaba alguna ventaja en las actividades que se realizaban en los laboratorios y en las industrias.
Una figura central en esta revolución es el norteamericano Gilbert N. Lewis. Sus aportaciones a la fisicoquímica y su propuesta de un modelo atómico basado en la química marcan el desplazamiento del desarrollo profesional e industrial de la vieja chimica alejandrina, con su paso por Europa, al nuevo continente. La Primera Guerra Mundial en la que ya participan de manera decidida los Estados Unidos refrendan que la geopolítica mundial estaba cambiando. El modelo atómico de Lewis, generalizado posteriormente por Irving Langmuir, se enfrentaba al fisicocuántico europeo (Chamizo, 2009). Ambos productos de su época, con el primero se explicaba la química, con el segundo la espectroscopia. El mismo Langmuir lo indica claramente (1919): El problema de la estructura de los átomos ha sido estudiado principalmente por los físicos, quienes consideran de manera muy pobre las propiedades químicas, las que en última instancia deben ser explicadas por una teoría de la estructura atómica. La gran cantidad de conocimientos que sobre las propiedades químicas se tiene y las relaciones como las que resume la tabla periódica deben emplearse como un mayor fundamento para la estructura atómica que los relativamente escasos datos experimentales obtenidos únicamente con ideas físicas
Esta disputa duró hasta la cuarta revolución cuando el átomo químico cedió al físico su protagonismo (Izquierdo, 2010), lo cual fue acompañado por la entronización del positivismo lógico del círculo de Viena como la única manera de pensar la filosofía de la ciencia. Esta corriente filosófica, empírica en su contenido y lógica en su forma, asume que con la axiomatización de las teorías unifica todas las ciencias en una sola. Este proceso de unificación de la ciencia en el que se derivan principios de una ciencia a otra comúnmente se conoce como reduccionismo. La lógica positivista asume que las leyes de una determinada ciencia, como la química, pueden en principio derivarse de otras leyes más básicas, en este caso de la física, particularmente de la mecánica cuántica. Cuando en 1927 Fritz W. London, uno de los primeros físicos en aplicar la mecánica cuántica a la química escribió (Palmer, 1965): Si no existiera el spin electrónico, el principio de Pauli sólo permitiría la solución antisimétrica de la ecuación de Schroedinger, que corresponde a la repulsión entre los átomos y el enlace covalente no existiría. El hecho que constituye la química covalente parece depender por entero, desde el punto de vista del Principio de Pauli, de la existencia del spin electrónico.
Pero la química covalente también era explicada por el modelo de Lewis-Langmuir, como los químicos orgánicos de todo el mundo aún hoy atestiguan. Sin embargo, para muchos físicos esto se traduce en una posición absoluta, lamentablemente presente aún entre muchos de sus practicantes: sin el spin no hay química. El reconocido físico Paul A.M. Dirac va más lejos un par de años después en su famoso comentario (Lombardi, 2005): Las leyes físicas fundamentales necesarias para la teoría matemática de una gran parte de la física y la totalidad de la química se conocen completamente a partir de la mecánica cuántica. …la única dificultad [de derivar la química de la física] es que la aplicación exacta de las leyes de la mecánica cuántica da lugar a ecuaciones prácticamente imposibles de resolver.
Párrafo vigente aún hoy en día cuando contamos con las más poderosas supercomputadoras y que en esa época eran inimaginables (Chamizo, 2010). Separando en el quehacer científico los contextos de descubrimiento de los de justificación y avalando sólo este último, la ciencia pasó a ser en el imaginario colectivo de sus practicantes una parte de la física. A pesar de sus enormes éxitos en la construcción de nuevos objetos,15 la química se percibía como una disciplina desordenada, poco rigurosa, impura (Bensaude-Vincent, 2008) y la frase de Ernest Rutherford, resumiendo el espíritu de su tiempo, resultó contundente: la ciencia se divide en dos categorías: física y filatelia.
La cuarta revolución química está dominada en buena medida por la sumisión teórica a la física. Lo anterior a pesar de que los primeros modelos exitosos para explicar las reacciones químicas se diseñaron sin considerar la mecánica cuántica, a partir de iones moleculares (Nye, 1993). Sin embargo, la espectroscopia, con su multitud de instrumentos se hizo presente en los laboratorios de química y sus practicantes tuvieron que aprender su idioma, la mecánica cuántica. Los libros de texto en todo el mundo, bajo la concepción lógico-positivista de la ciencia cada vez se hicieron más fisicoquímicos, buscando los “principios” de la química en la física y abandonando la enorme cantidad de conocimiento empírico que se había acumulado durante siglos. Talanquer, caracteriza admirablemente la situación con el adjetivo “química agazapada” (2010, p. 145, 148): Sin negar la importancia y centralidad de la perspectiva fisicoquímica en el pensamiento químico moderno, uno podría cuestionar si estas ideas reflejan con fidelidad los principios e ideas que, de manera práctica y cotidiana, los químicos asumen y utilizan para resolver problemas, generar explicaciones o hacer predicciones […] Quizá la renuncia de los químicos a reconocer, de manera central y explícita, algunos de los conceptos e ideas que utilizan de manera práctica y cotidiana, es que algunos de ellos se refieren a propiedades “trascendentes” de las sustancias y los procesos en que éstas participan. Esto es, varios de estos conceptos identifican o describen entidades que están más allá de la esfera de lo perceptible y medible.
Las explicaciones derivadas de la naciente química-cuántica llenaron miles de hojas provenientes de las también entonces juveniles, enormes y asépticas computadoras. Los cálculos teóricos, aunque inicialmente resolvían poco, fueron la moda. Los químicos eran cada vez más fisicoquímicos o bioquímicos y los plásticos y los pesticidas empezaron a cubrir al mundo. La química “agazapada” y colonizada se volvió, además de impura, sucia.
Ya desde antes de la Segunda Guerra Mundial las industrias químicas se habían dedicado a “limpiar” la imagen de una química identificada socialmente con los explosivos y los gases venenosos utilizados en las trincheras europeas. La estado-unidense DuPont lanzó en 1930 su exitosa campaña “Mejores cosas, para vivir mejor […] gracias a la química” colocando a los polímeros y en particular al sintético nylon,16 en un pedestal (figura 6). Las palabras plástico y flexible se volvieron comunes e identificaron socialmente una actitud valiosa, aunque también caracterizaron, la primera de ellas, a la naciente sociedad de consumo mundial. Los plásticos eran baratos, fáciles de producir en todas partes y desechables. En la segunda mitad del siglo XX, al final de la cuarta revolución química, con los nuevos tejidos de plástico producidos por las cada vez más poderosas industrias químicas, lo artificial parece dominar a lo natural, aunque, como nos lo recuerda la historiadora de la química francesa Bernadette Bensaude-Vincent (2005, p. 44), siempre fue así: La historia de la civilización humana ha sido, en cierto sentido, la historia de lo artificial. Cuando los primeros humanos se apartaron de la caza por la agricultura, ya habían dominado muchas técnicas para la preparación de pieles animales para el vestido, y de plantas y productos minerales para la construcción. En algún punto la lana comenzó a reemplazar la desnudez, lo que representa un excelente ejemplo de lo artificial para sustituir a lo natural, aunque este periodo de transición ha sido durante mucho tiempo perdido en la memoria colectiva de la humanidad.
El nylon hace su seductora aparición. La invención por DuPont Co. de las medias de nylon causó una especie de revolución en la moda después de su debut en terrenos de la compañía en Wilmington, Delaware, EUA. En la foto, la actriz Marie Wilson, cuya pierna fue convertida en escultura en 1950 en Hollywood está colgada de un andamio por una grúa, como comparación. / Foto del museo Hagley.
Con la creciente presencia de materiales17 sintéticos, los químicos y su industria fracasaron en integrar en el imaginario colectivo lo que para ellos es evidente y bien sabido. Una sustancia química es lo que es, independientemente de su origen. Esta veneración popular, con resabios de nobleza, de identificar las genealogías materiales impide superar la absurda dicotomía de natural vs. sintético. Y peor aún la de asociar moralmente: “natural-bueno” vs. “sintético-malo”.
El corto tiempo que hay entre la cuarta y quinta revolución química está marcado por el impacto mundial del libro de Rachel Carson, Primavera silenciosa. El uso indiscriminado que durante la Segunda Guerra Mundial se hizo del DDT en los territorios disputados y posteriormente en las granjas norteamericanas llevó a reconocer que la toxicidad de éste y otros pesticidas y herbicidas no sólo afectaba a sus inmediatos destinatarios (los mosquitos que transmiten la malaria, en este caso), sino a muchos otros en la cadena alimentaria. La culpa de ello era la ignorancia de las industrias químicas y de los profesionales que allí trabajaban que no conocían suficientemente bien lo que sucedía con sus productos, una vez que los arrojaban en vastas cantidades al mundo. La imagen pública de que envenenar a unos envenenaba a todos fue profunda, extendida y, desde entonces en muchas sociedades, permanente. En Estados Unidos el impacto fue brutal y el presidente J. F. Kennedy creó por ello la EPA (Environmental Protection Agency). Sin embargo, venenosos o no,18 desde entonces la producción de pesticidas no ha hecho mas que crecer en todo el mundo.
En la mitología romana Jano es un dios que tenía dos caras mirando hacia ambos lados de su perfil (figura 7). Jano era el dios de las puertas, los comienzos y los finales. Por eso le fue consagrado el primer mes del año (que en español pasó del latín ianuarius a enero). Es el dios de los cambios y las transiciones, de los momentos en que se traspasa el umbral que separa el pasado y el futuro. Su protección, por lo tanto, se extiende hacia aquellos que desean variar el orden de las cosas. Se le honraba cada vez que se iniciaba un proyecto nuevo, nacía un bebe o se contraía matrimonio. Al igual que Prometeo, Jano es una suerte de héroe cultural, ya que se le atribuye, entre otras cosas, la invención del dinero, las leyes y la agricultura.
Con la quinta revolución química llegó el momento de las culpas. Como ya se dijo antes, la química “agazapada”, colonizada, impura y sucia se volvió un peligro planetario.19 Muchos departamentos y facultades de química e industrias químicas cambiaron de nombre, eliminando precisamente la palabra química y/o agregando el de biología. En los Estados Unidos Harvard fue de los primeros seguido por Cornell, donde muchos de los nuevos investigadores, en recambio de la primera nutrida y jubilada generación de químicos que ingresaron a las universidades después de la Segunda Guerra Mundial, fueron desplazándose hacia temas bioquímicos. La química pasó a ser una de las ciencias biológicas. Perdió, tal vez, su frágil identidad y el sentido épico que la caracterizaba un siglo antes. Ésa es una de las dos caras de la química-Jano,20 agazapada, subordinada y útil, sin olvidar los enormes beneficios económicos derivados de la preparación de nuevos materiales, que se usan mundialmente. El capitalismo es global y prácticamente ninguno de los 700021 millones de seres humanos que habitamos el planeta está fuera de su influencia, como tampoco de la de la química.
Por otro lado, parece que llegó lo que se anunciaba en la primera revolución, la responsabilidad. La química ambiental, al menos en su discurso, se asume finalmente responsable de sus actos. Socialmente promueve un código de conducta (ACS, 1994-2007), ayuda a diseñar leyes relacionadas con la contaminación y el manejo de materiales peligrosos, tímidamente cambia sus programas de estudio al incorporar temas relacionados con la historia, la filosofía y la sociedad (Chamizo, 2001) en pocas palabras se maquilla de “verde”. En una sociedad caracterizada por el riesgo (Sjöström, 2007) el conocimiento es fundamental, pero no un conocimiento exclusivamente endógeno,22 sino aquel que acepta su lugar en el mundo y participa activamente en la búsqueda de soluciones. Hace más de un siglo el filósofo francés Jean M. Guyau lo dijo así (Savater, 1990, p. 138): Quizá nuestra tierra, quizá la humanidad lleguen también a una meta ignorada que se habrán creado para sí mismas. Ninguna mano nos dirige, ningún ojo ve en nuestro lugar; el timón se ha roto hace ya mucho tiempo o, mejor, nunca ha existido: está aún por hacer. Es una gran tarea y es nuestra tarea.
La química moderna devino públicamente en ser, a lo largo de sus cinco revoluciones, útil, colonizada, impura y sucia. De manera muy general y abreviada los químicos, su industria, sus profesores, sus revistas, sus libros de texto, aislados del resto de la sociedad, volcados a resolver sus propios problemas, se han olvidado de reconocer su propia identidad. La imagen pública de la química que durante la primera revolución química se manifestó en la Enciclopedia sigue siendo vigente, en lo fundamental. Hemos sido incapaces de transmitir, compartir, inducir o convencer a los no-químicos (es decir la inmensa mayoría de la sociedad planetaria) dos ideas fundamentales:
- •
Una sustancia química es lo que es, independientemente de su origen. Las sociedades humanas, lo son, porque rodeadas de materiales, son artificiales.
- •
Vivir, y hoy los humanos viven más que nunca antes… ¡también gracias a la química!… rodeados de contaminantes, conservadores, alimentos preparados, medicinas y otras muchas y muchas más sustancias químicas, es un riesgo.
La conclusión del artículo de Lazlo y Greenberg (1991), veinte años atrás nos dice: Los estereotipos sobre la química y los químicos que hemos llamado aquí “falacias” son creencias muy extendidas en nuestra sociedad. Estas creencias surgen como simplificaciones y generalizaciones que tienen connotaciones más emocionales que de tipo racional. Es posible que la ciencia misma haya sido la causante de la aparición de estos estereotipos en el pensamiento occidental, y de las ideas totalitarias que las colectan […] ¿Qué puede hacerse contra estos estereotipos? Parece que poco ha cambiado desde Sócrates y que la función de la filosofía sigue siendo ayudar a liberarnos de los clichés, de las verdades absolutas y de los estereotipos.
Tal vez, más que nunca antes, Jano identifica la imagen pública de la química. Es el umbral… sabemos de dónde venimos, pero ¿a dónde vamos?
Por ejemplo, Garritz (1990) recoge la propuesta de clasificar el tiempo a partir de revoluciones tecnológicas y Pickstone (2000) a partir de formas de conocer.
Sobra decir que a partir de esta revolución todos los nombrados en el presente artículo fueron galardonados con el premio Nobel de Química.
Las investigaciones sobre hormonas esteroidales realizadas en el laboratorio mexicano Syntex y que dieron lugar a las pastillas anticonceptivas, pueden ser uno de los avances más significativos realizados por las sociedades humanas en el siglo XX. Las mujeres se hicieron cargo de su sexualidad de manera “segura”.
Siendo estudiante de doctorado en química organometálica tuve la suerte de oír a H. Kroto su primera discusión sobre el C60 en uno de los seminarios del Departamento de Química Inorgánica de la Universidad de Sussex. Lo impartió poco después de su regreso de Houston donde ya habían identificado al C60 como la primera molécula esférica, bautizada como futboleno.
Si se cuentan el número de artículos, libros y patentes, los de la química son equivalentes a los de todas las otras ciencias juntas (Schummer, 1999). El número de sustancias y de aplicaciones comerciales de las mismas ha crecido de manera impresionante a lo largo de los últimos 200 años. De algunos cientos en 1800 a hoy (7 de mayo de 2011) cuando se han identificado pocos más de 56 millones de sustancias diferentes (y se van añadiendo aproximadamente 6000 cada día), de las cuales se comercializan 48 millones.
Lo que significa que poco más de media cucharada de dicha sustancia es capaz de matar a un hombre de 70 kg de masa.
El plomo, el mercurio y el arsénico.
Por ejemplo, el nombre de Dios no se conoce. Cuando se le quiere “nombrar” se hace por sus atributos, El Misericordioso, El Eterno, yhv, El que ha sido, el que es y el que será (Campillo, 1998, p. 38).
No deja de ser curioso que Lavoisier, el gran químico del siglo XVIII, prefiera llamarse a sí mismo físico (Bordieu, 2003, p. 119)… ya estaba culturalmente colonizado.
De hecho Kuhn introduce la idea, aunque sin elaborarla como tal, de la autonomía del universo científico. Llega así a afirmar que ese universo escapa pura y simplemente a la necesidad social y, por lo tanto, a la ciencia social (Bordieu, 2003, p. 35).
En Alemania, cerca de la frontera con Francia. El lugar no se escogió al azar; se adelanta de alguna manera la integración cultural europea.
Que fue también el primero de cualquier otra disciplina.
Kekulé, por ejemplo, tenía 19 formas diferentes de escribir ácido acético en un libro que estaba preparando.
Van't Hoff y Ostwald crearon la revista Zeitschrift für Physikalische Chemie: Stöichiometrie und Verwandtshaftslehre en 1887, y Nye (1993) indica que es a partir de 1830 cuando ambas comunidades, la química y la física, se separaron claramente, 100 años antes de la fundación del Journal of Chemical Physics. Reconoce también la más antigua identidad química asociada a las prácticas experimentales con aplicaciones medicinales, agrícolas e industriales.
Es pertinente recordar la frase del decimonónico químico francés M. Berthelot: La química crea su objeto.
Como lo ha indicado Bensaude-Vincent (2005, p. 24): El mismo nombre de nylon ilustra esta transformación hasta bien avanzados lo años cuarenta. En lugar de silkon, silkex o silkene que habrían evocado con su nombre a la seda, DuPont escoge comercializar este polímero sin ninguna referencia a las sustancias naturales. Este material enteramente sintético habría de promocionarse en sus propios términos.
Un material es una sustancia o compuesto que se utiliza con un propósito determinado […] es una porción de materia a la cual le damos una utilidad intencional (Martínez, 2011, p. 9).
Y aquí hay que recordar de nuevo lo dicho por Paracelso […] la dosis es el veneno.
Por ello, otra idea que tanto los químicos como la industria y los libros de texto deberían extender socialmente es la de riesgo, que en el contexto de la química se define matemáticamente como riesgo = peligro · exposición. Por peligro se entiende la capacidad inherente de una sustancia química de causar un efecto adverso y exposición se refiere al nivel de la sustancia en el aire, el agua o la comida o también la dosis de una medicina o droga específica (Timberell, 2005).
Nye (1993) reconoce otras dos caras de la química: la filosófica, de la universidad, y la práctica, del laboratorio. Por su parte, Bensaude –Vincent (2008) indica: sirviente modesto y arrogante creador. Más allá de las precisiones, lo que nos queda claro a muchos es su carácter dual. Por su parte, Talanquer (2009), un poco a broma, nos habla de “cuatro personalidades” de la química: del análisis o “La Psicóloga”; de la síntesis o “La Artista”; de la transformación o “La Revolucionaria”, y del modelaje o “La Soñadora”.
Para algunos historiadores el invento más importante en la historia de la humanidad se llevó a cabo durante la tercera revolución química. La síntesis y producción industrial del amoniaco por los alemanes F. Haber y C. Bosch le permite comer hoy a más de la mitad de sus integrantes (Smil, 2001).
En términos estrictamente químicos, recientemente P. Ball (2006) publicó algunas de las preguntas que los químicos profesionales están intentando resolver en este periodo postrevolucionario: ¿Cómo diseñar moléculas con funcionamiento estático y dinámico específico? ¿Cuáles son las bases químicas del pensamiento y la memoria? ¿Cómo podemos explorar todas las posibles permutaciones de todos los elementos?