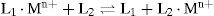Metallochaperones are proteins that specifically bind metal ions with high affinity and selectivity to deliver them to target proteins, acting in the intracellular trafficking of metal ions to guide and protect them toward their fnal destination, and consequently, protecting cell against free metal toxicity. Knowledge in this area is limited, nevertheless, some metallochaperones have been properly identified and are well characterized for their structure, their roles and the mechanisms involved in the molecular recognition and metal ion transfer between the metallochaperone and the target protein, therefore allowing a proper understanding of the way these macromolecules function. Metallochaperones of copper are the most studied metallochaperones and more information about them is found in the literature. However, information about those employed for other metals is also found, particularly those employed for delivering iron, followed by those employed for nickel, only scarce information is found on those related with zinc and even less for other metals. In this manuscript, a general view of information found in literature about the functions of metallochaperones involved in the trafficking of metal ion or assembly of metal centers and their mechanisms is given, with the aim of provide current educational material for bioinorganic undergraduate teachers and students about an emerging subject hard to find in bioinorganic textbooks.
Las metalochaperonas son proteínas que están diseñadas para unir metales específicos con gran afinidad y selectividad para entregarlos a proteínas que lo requieren en su estructura. El conocimiento en esta área es limitado; sin embargo, existen algunos casos bien identificados y caracterizados que permiten comprender cómo funcionan estas macromoléculas, cuál es su función y cuáles son los mecanismos involucrados en el reconocimiento molecular entre la metalochaperona y la proteína blanco, y cómo ocurre la transferencia del metal para realizar la entrega en el sitio adecuado. Las metalochaperonas de cobre son las más estudiadas y, por tanto, existe más información sobre ellas en la literatura. Sin embargo, existe también información sobre metalochaperonas para otros metales, particularmente aquellas que se encargan de la entrega de hierro, seguidas de las de níquel, solo escasa información acerca de las de zinc e incluso menos de otros metales. Esta revisión pretende documentar esos casos conocidos para proporcionar una visión general sobre las funciones de las metalochaperonas en el tráfico intracelular de metales o en el ensamblaje de centros metálicos y los mecanismos mediante los cuales trabajan, con el objetivo de generar material educativo actual para profesores y estudiantes de bioinorgánica acerca de un tema nuevo que es difícil de encontrar en los libros de texto de bioinorgánica.
Las metaloproteínas han sido muy estudiadas y caracterizadas por décadas; sin embargo, solo las investigaciones más recientes se enfocan en los mecanismos a través de los cuales los centros metálicos de estas metaloproteínas se ensamblan.
Las interacciones (·) entre algunas macromoléculas (L) y los iones metálicos que requieren para sus funciones (Mn+) se gobiernan simplemente por control termodinámico como se ilustra en la ecuación 1 (Kuchar, et al., 2004):
En esta situación, la especificidad de los ligantes y afinidad por el ión metálico, así como la geometría de coordinación del ión metálico dependen tanto de las propiedades del ión metálico como de los factores asociados con el ligante macromolecular. Los iones metálicos varían en su carga, radio, labilidad para intercambiar ligantes, preferencia por ligantes (dureza/blandura) y posición en la serie de Irving-Williams. De forma similar, la composición, el plegamiento de una proteína u otras macromoléculas biológicas, la rigidez y las propiedades fisicoquímicas de las cadenas laterales expuestas (pKa, polarizabilidad y localización en una estructura secundaria en particular) dictan sus interacciones con los iones metálicos (Kuchar, et al., 2004).
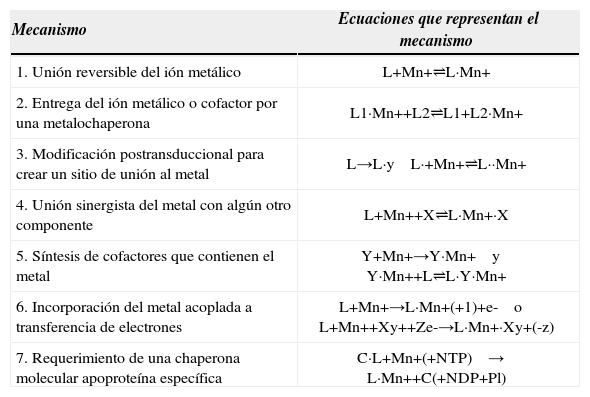
Podemos resumir el ensamblaje de los centros metálicos en las metaloproteínas como se indica en la tabla 1. Estos mecanismos no son mutuamente excluyentes, por lo que muchos ejemplos de síntesis de metalocentros utilizan más de uno de estos mecanismos al mismo tiempo. Adicionalmente, es importante notar que la energía necesaria que permite el ensamblaje de un centro metálico puede provenir de la hidrólisis de un nucleótido trifosfato.
Principales mecanismos de ensamblaje de centros metálicos. Traducida de Kuchar, J. y R. P. Hausinger, 2004 (Kuchar, et al., 2004).
| Mecanismo | Ecuaciones que representan el mecanismo |
|---|---|
| 1. Unión reversible del ión metálico | L+Mn+⇌L·Mn+ |
| 2. Entrega del ión metálico o cofactor por una metalochaperona | L1·Mn++L2⇌L1+L2·Mn+ |
| 3. Modificación postransduccional para crear un sitio de unión al metal | L→L·y L·+Mn+⇌L··Mn+ |
| 4. Unión sinergista del metal con algún otro componente | L+Mn++X⇌L·Mn+·X |
| 5. Síntesis de cofactores que contienen el metal | Y+Mn+→Y·Mn+ y Y·Mn++L⇌L·Y·Mn+ |
| 6. Incorporación del metal acoplada a transferencia de electrones | L+Mn+→L·Mn+(+1)+e- o L+Mn++Xy++Ze-→L·Mn+·Xy+(-z) |
| 7. Requerimiento de una chaperona molecular apoproteína específica | C·L+Mn+(+NTP) → L·Mn++C(+NDP+Pl) |
L* = ligante macromolecular covalentemente modificado; X = componente no metal del metalocentro: Y = componente requerido para la síntesis de un cofactor que contiene un metal; C = chaperona molecular.
Entre los mecanismos de ensamblaje de metalocentros se encuentra la entrega por parte de una metalochaperona del ión metálico o cofactor. El conocimiento de este mecanismo se restringe a casos muy específicos en donde el avance de los estudios necesarios ha permitido identificar y caracterizar adecuadamente a las metalochaperonas y sus interacciones con las proteínas blanco o compañeras.
MetalochaperonasLas metalochaperonas son proteínas (L1) que unen metales y están diseñadas para entregar el ión metálico apropiado o un cofactor que contiene un metal al ligante blanco (L2), es decir otra proteína que lo requiere en su estructura ya sea para un papel estructural o catalítico. Esta reacción se representa a continuación en la Ecuación 2.
Es importante hacer notar la distinción entre metalochaperonas y chaperonas moleculares. Estas últimas asisten a las proteínas para que logren alcanzar el plegamiento adecuado como parte de su biosíntesis. Las chaperonas moleculares mejor estudiadas son las GroEL, Hsp70 y Hsp40 (Hartl, 1996) que se encargan de prevenir plegamientos incorrectos o estimular la recuperación del plegamiento correcto después de una situación de estrés que puede ser, por ejemplo, el estrés oxidante o estrés térmico; de ahí que algunas chaperonas moleculares se conozcan como proteínas de choque térmico. Los procesos mediante los cuales las chaperonas moleculares realizan sus funciones generalmente requieren de la hidrólisis de un nucleótido trifosfato (Houry, et al, 1999). Estas chaperonas moleculares se conocen con el nombre generalizado de proteínas “housekeeping”, son una especie de red de control de calidad de la síntesis proteica y, desde luego, también juegan un papel importante en la síntesis de muchas metaloproteínas, pero no entregan el metal en la apoproteína como lo hacen las metalochaperonas.
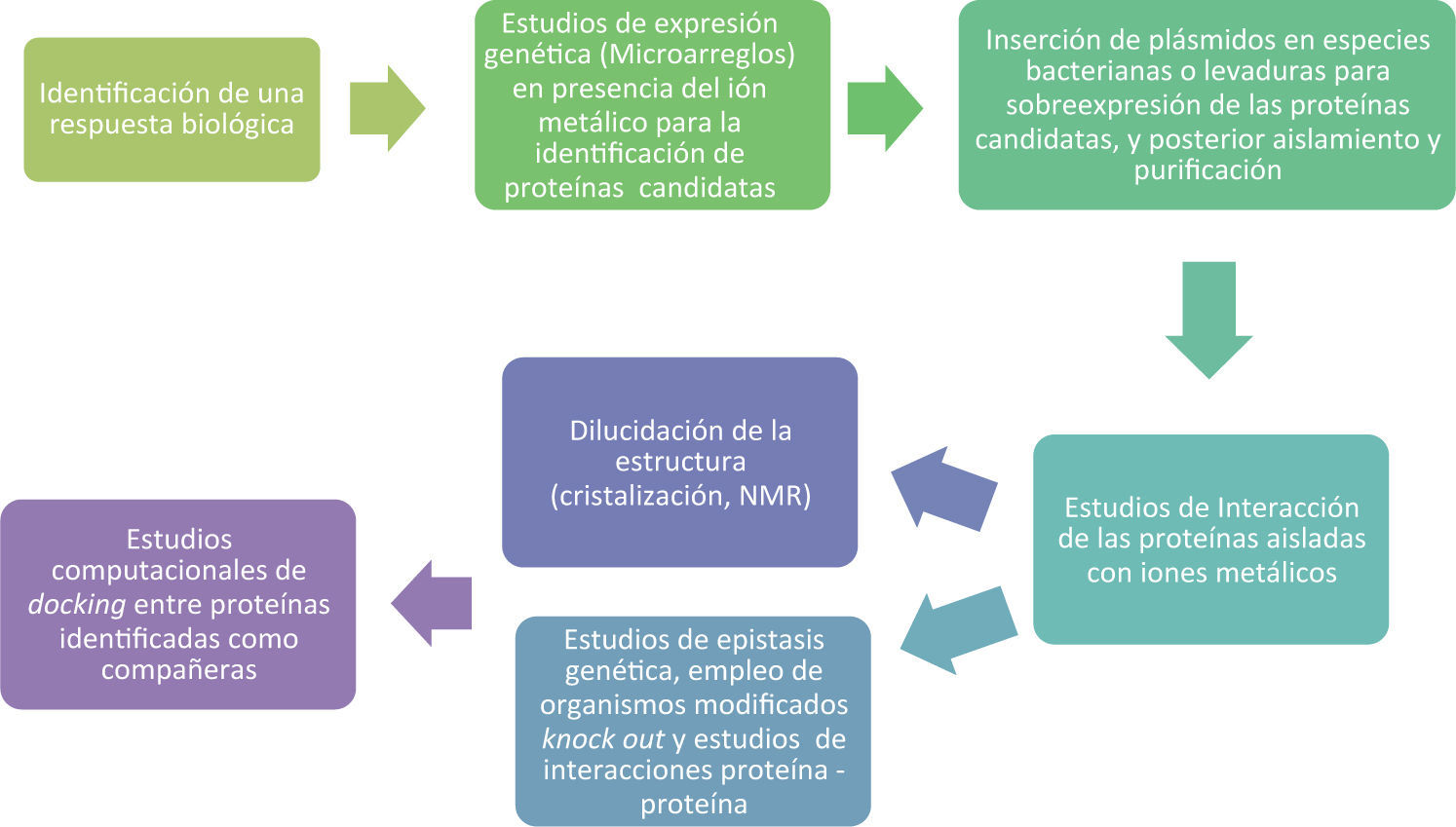
La identificación de las metalochaperonas y su posterior estudio para caracterizarlas y entender los mecanismos de transferencia del ión metálico y el acoplamiento con la proteína blanco o proteína compañera requieren de la intervención de muchas disciplinas. La figura 1 propone en un diagrama de flujo de forma muy general este proceso.
Debido a que el estudio completo para llegar a una caracterización adecuada de las propiedades de una metalochaperona y sus mecanismos de transferencia de los iones metálicos es complicado, los casos en donde se conoce la mayor parte de la información se limitan principalmente a las metalochaperonas de cobre, en segundo lugar a las metalochaperonas de hierro, en menor proporción a las de níquel y existe escasa información de las de zinc, la cual se centra en estudios biológicos más que de caracterización e interacciones químicas. Es por eso que el presente documento discutirá aquellos casos en donde la información es suficiente para comprender los mecanismos involucrados.
Metalochaperonas de cobreExiste una gran diversidad de enzimas conocidas que utilizan cobre como cofactor esencial. El cobre no solo es un metal esencial, también es un ión potencialmente reactivo y tóxico, su acumulación como ión libre es completamente perjudicial para las células. Es por esto que todos los organismos han desarrollado mecanismos celulares para secuestrar a este ión metálico y destoxificarlo con el objetivo de mantener sus concentraciones en niveles extremadamente bajos. Todas las células eucariotas han evolucionado para generar una familia especializada de proteínas que unen cobre y sirven para distribuirlo en las metaloenzimas que requieren de este metal. Estas pequeñas proteínas se conocen bajo el nombre de chaperonas de cobre (Pufahl, et al., 1997). Las chaperonas de cobre pueden quelatar al metal en condiciones donde las concentraciones son tan bajas que las metaloenzimas no pueden adquirirlo; por tanto, funcionan para distribuir y transferir directamente al cobre a blancos celulares específicos. En esencia, estas moléculas actúan como escoltas para los iones de cobre y los protegen de los mecanismos de destoxificación celular (O’Halloran, et al., 2000).
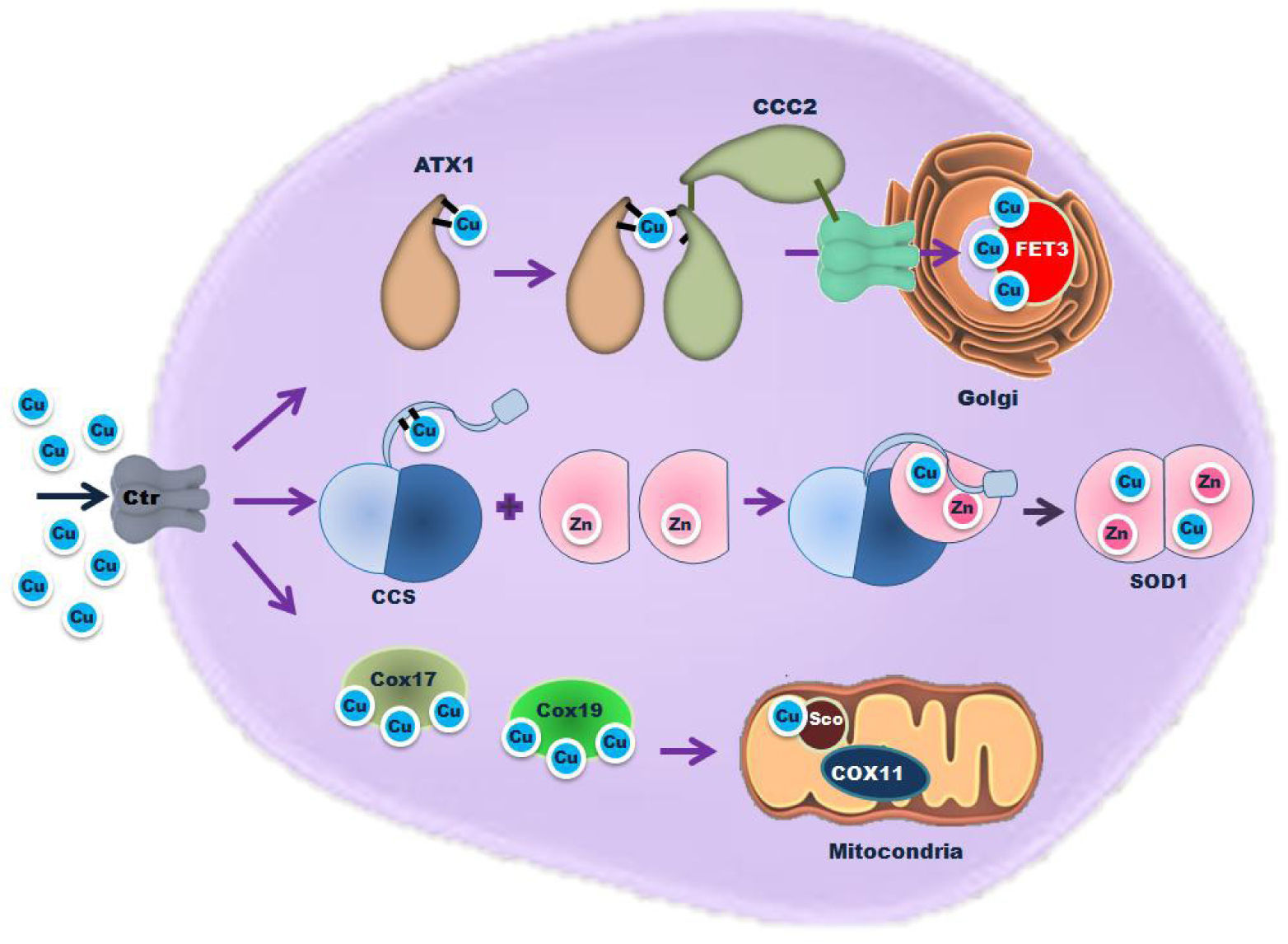
Hasta ahora se han identificado tres vías de tráfico de cobre que requieren de la acción de chaperonas (figura 2). Éstas incluyen: 1) ruta de entrega de cobre a la vía secretoria para la activación de enzimas destinadas a la superficie celular o el medio extracelular; 2) ruta de tráfico de cobre hacia la superóxido dismutasa (SOD1) en el citoplasma, y 3) ruta de entrega de cobre a la mitocondria para la activación de la citocromo oxidasa (Sturtz Field, et al., 2002). Es importante hacer notar que cada una de las chaperonas involucradas en estas tres vías de tráfico de cobre originalmente se identificaron en la levadura S. cerevisiae y se encuentran bien conservadas en los eucariontes (Sturtz Field, et al., 2002).
Tres vías de tráfico de cobre que requieren de la acción de chaperonas: 1) ruta de entrega de cobre a la vía secretoria para la activación de enzimas destinadas a la superficie celular o el medio extracelular; 2) ruta de tráfico de cobre hacia la superóxido dismutasa (SOD1) en el citoplasma, y 3) ruta de entrega de cobre a la mitocondria para la activación de la citocromo oxidasa. Modificada de Amy C. Rosenzweig, 2002 (Rosenzweig, 2002).
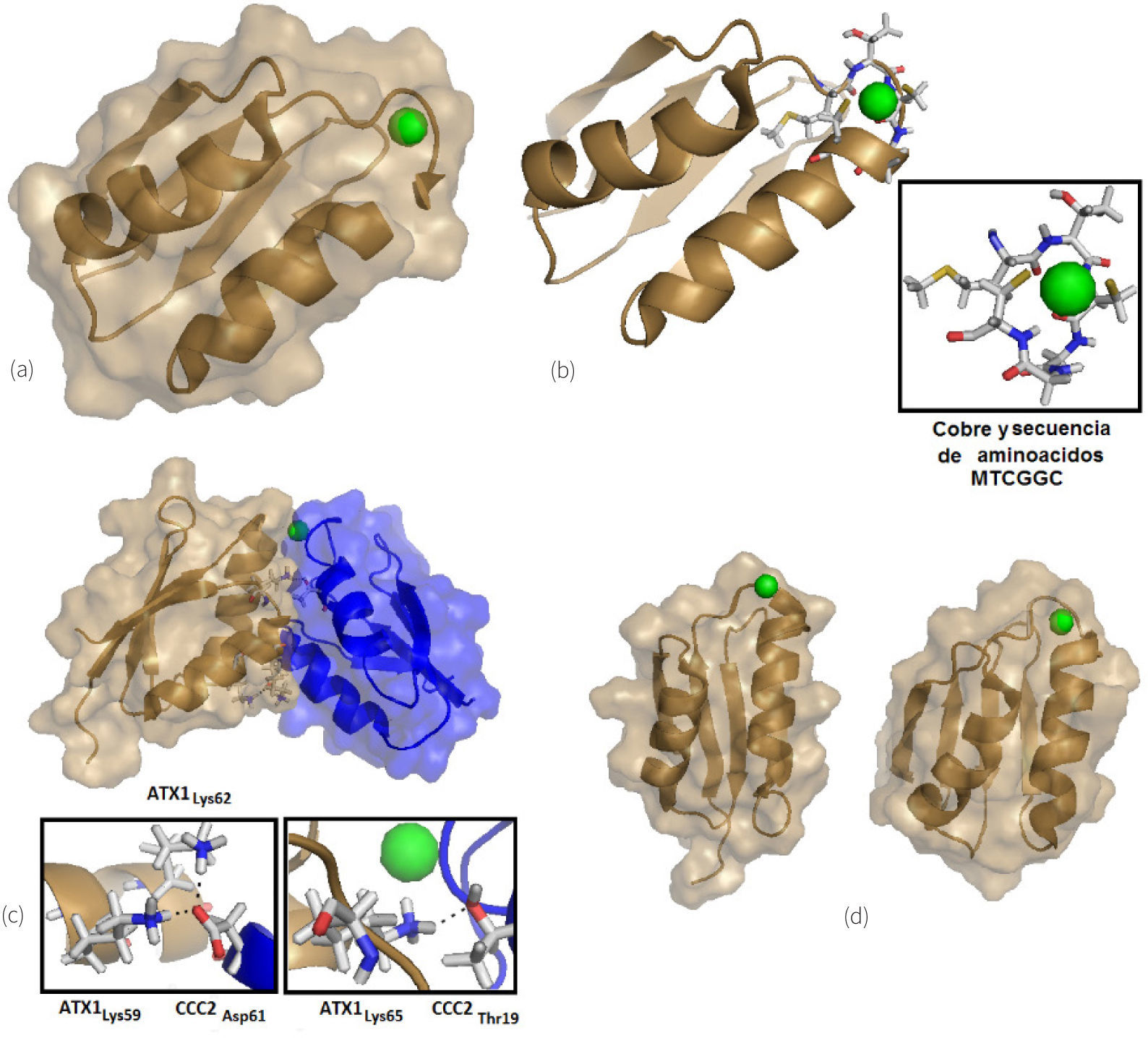
La ruta de entrega de cobre a la vía secretoria permite la activación de enzimas destinadas a la superficie celular o el medio extracelular. Esta ruta inicia con la metalochaperona ATX1, la cual se identificó por primera vez en S. cerevisiae como una molécula antioxidante (Culotta, et al., 1995). El gen atx1 codifica para un pequeño polipéptido de 8.2 KDa (figura 3a-b) que presenta homología con un gran número de transportadores de metales en bacterias, específicamente con el dominio de unión al metal N-terminal de estos transportadores.
a y b) Imágenes de HAH1 en representación de superficie molecular y listones respectivamente preparadas a partir del pdb 1TL4 (Anastassopoulou, et al., 2004) con Pymol (2008). En esta imagen se muestra al cobre expuesto en la superficie de la proteína, ubicado en la secuencia conservada de cisteínas MTCGGC. La superficie molecular alrededor del cobre contiene residuos básicos y ácidos que son complementarios con CCC2 para permitir la interacción molecular; c) Imagen del complejo ATX1-CCC2 en representación de superficie molecular y listones preparada a partir del pdb 2GGP (Banci, et al., 2006) con Pymol (2008), en donde se puede observar el acoplamiento entre estas dos moléculas y la transferencia del cobre de ATX1 a CCC2. Se destacan dos regiones enmarcadas para ejemplificar el acoplamiento molecular gracias a residuos ácidos y básicos complementarios, y d) Imagen comparativa, preparada a partir de los pdb 1TL4 y 2GGP en donde se observa la similitud entre HAH1 (derecha) y ATX1 (izquierda).
La forma purificada de esta enzima posee la capacidad de atrapar al radical superóxido, de ahí su actividad antioxidante; sin embargo, esta reacción in vitro no es catalítica en ausencia de un reductor. Este péptido, además de su actividad antioxidante, es el encargado de entregar al cobre a un transportador de cobre ATP-dependiente ubicado en el aparato de Golgi y denominado CCC2 en levaduras (Yuan, et al., 1995), que a su vez entrega este metal a la multioxidasa de cobre FET3 en la vía secretoria (Lin, et al., 1997; Pufahl, et al., 1997). Esta última está asociada a la absorción de hierro (figura 2).
Tanto CCC2 como su equivalente en humanos (transportadores Wilson y Menkes) contienen múltiples copias de dominios similares a los de ATX en el extremo N-terminal, particularmente en los dominios de unión a cobre donde la secuencia MTCXXC es única para los dominios de esta familia de proteínas. El cobre se transfiere desde el sitio CXXC en ATX1 a su sitio análogo en el siguiente transportador vía una interconversión entre dos y tres tioles coordinantes (Pufahl, et al., 1997) (figura 3c). La interacción física entre ATX1 y el dominio de unión al metal N-terminal en CCC2 se ve favorecida por interacciones electrostáticas entre una superficie expuesta de carácter básico (cargada positivamente) en ATX1 y una superficie ácida (cargada negativamente) en los dominios similares a ATX1 presentes en CCC2 (Portnoy, et al., 1999; Arnesano, et al., 2001) o sus transportadores equivalentes en humanos. El homólogo humano para ATX1 se denomina ATOX1 o bien HAH1 y contiene las mismas secuencias conservadas (figura 3D).
Tráfico de cobre hacia la superóxido dismutasa (SOD1) en el citoplasmaLa superóxido dismutasa 1 (SOD1) es una enzima citosólica que emplea cobre como cofactor para catalizar la dismutación de dos aniones superóxidos a peróxido de hidrógeno y oxígeno (McCord, et al., 1969). Esta enzima adquiere el cobre de una proteína denominada CCS (Chaperona de Cobre para SOD1).
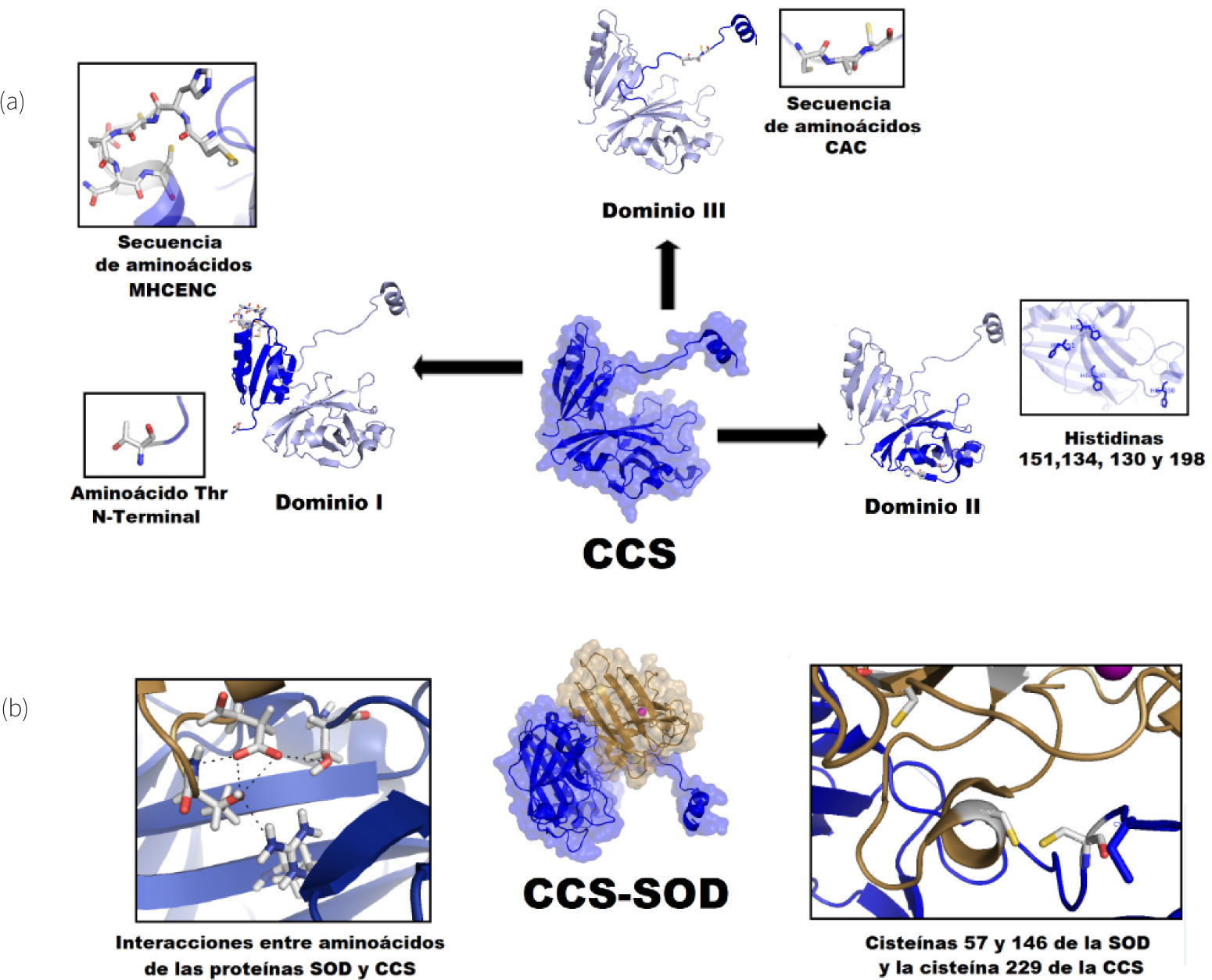
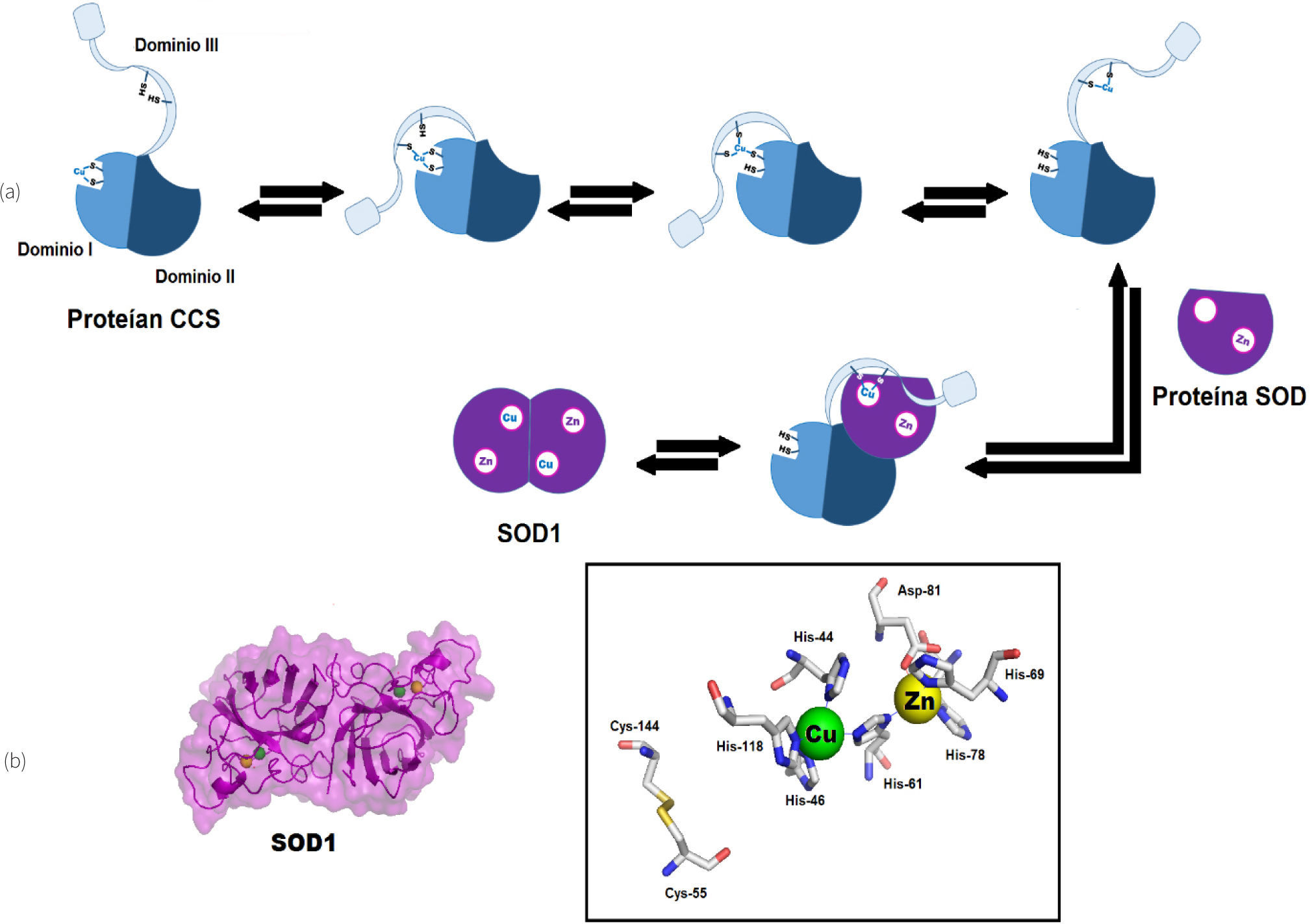
CCS tiene tres distintos dominios estructurales que tienen funciones separadas para: la unión de cobre, la transferencia de cobre y la interacción con SOD1 (Field, et al., 2002). En el extremo amino terminal el dominio I de CCS muestra homología con ATX1, incluyendo el sitio de unión a cobre MXCXXC que contiene los aminoácidos Cys 17 y Cys 20 (figura 4). Debido a que la eliminación de este dominio no detiene la transferencia de cobre en concentraciones biológicas normales, se propone que el dominio I de CCS solo facilita la unión de cobre bajo condiciones de inanición de este ión, pero no es el principal proveedor de cobre para la SOD1 (Schmidt, et al., 1999).
Imágenes de CCS y SOD de Saccharomyces cerevisiae en representación de superficie molecular y listones respectivamente preparadas a partir del pdb 1JK9 con Pymol (2008). a) Se muestra a la proteína CCS con su dominio I similar a Atx1 con motivo de unión al metal MXCXXC correspondiente a las cisteínas Cys17 y Cys20, respectivamente; el dominio II similar a SOD1 con estructura de barril β carente de los residuos catalíticos, se muestran las histidinas presentes, así como el dominio III con un asa flexible y un motivo conservado CXC (Cys229 y Cys231); b) Se muestra el complejo CCS-SOD, donde se destacan algunas interacciones entre regiones complementarias de estas proteínas (izquierda) y las cisteínas responsables de la formación de puentes disulfuro en el ensamblaje final del centro metálico de cobre en la SOD (derecha).
El dominio central de CCS (dominio II) es el más grande (16.0 kDa). Este dominio presenta una considerable homología con su enzima blanco, la SOD1 (Schmidt, et al., 1999). Esta homología llega a ser de casi el 50% para las enzimas humanas, caso en donde CCS preserva tres de las cuatro histidinas que coordinan al cobre en la SOD1. El aminoácido que corresponde a la cuarta histidina en la SOD es un ácido aspártico en la posición 200. A pesar de estas secuencias conservadas, CCS no tiene actividad catalítica como SOD (Schmidt, et al., 1999); sin embargo, esta homología facilita la formación de un heterodímero entre CCS y SOD1, el cual es un prerrequisito para la transferencia de cobre (figura 4).
El tercer dominio (dominio III) en el extremo C-terminal es el dominio más pequeño, solo consta de 30 aminoácidos en el caso de la levadura. Sin embargo, es la región más conservada de CCS entre las especies y tiene un dominio constante CXC (Cys 229 y Cys 231) que es capaz de unir cobre (Schmidt, et al., 1999) y se propone como el responsable de la transferencia de cobre a la SOD1 (Schmidt, et al., 1999) (figura 4).
En resumen, el dominio I se requiere para la activación de SOD1 solo cuando las concentraciones de cobre son limitadas, mientras que los dominios II y III son esenciales para la función de CCS en cualquier condición (Schmidt, et al., 1999). La SOD1 existe en el citoplasma como un homodímero; en un primer paso el dominio II de CCS reemplaza una unidad de SOD1 que ya contiene Zn para formar un heterodímero. Esta interacción favorece que el dominio I se desplace a una nueva posición y adquiera el Cu1+ de una fuente desconocida hasta el momento; el dominio III, el cual se vuelve más ordenado, también se desplaza a una nueva posición cercana al dominio I para recibir el cobre mediante un proceso ilustrado en la figura 5 y, posteriormente, rota para entregar al cobre al sitio activo de la SOD1. Resulta particularmente interesante que el dominio III forma un puente disulfuro entre la Cys229 de CCS y la Cys 55 de la SOD1. La transferencia de cobre requiere de un cambio en el ambiente de coordinación del cobre que en CCS está coordinado a Cys para coordinarse con His en la SOD1, paso que aparentemente requiere de oxígeno (Lamb, et al., 2001). Un escenario razonable podría ser que este paso involucre la oxidación tanto del metal como de las Cys involucradas en ambas proteínas para formar un puente disulfuro y de esta forma abrir el sitio activo, seguido de un intercambio de disulfuros para generar un nuevo puente entre Cys55 y Cys144 en la SOD1, dando origen así a la estructura final del centro activo (figura 5).
a) Mecanismo de transferencia de cobre entre dominio I y el dominio III en la CCS, y posteriormente hacia la SOD, y b) Imágenes preparadas a partir del pdb 2SOD de la SOD de la especie Bos taurus (toro) en representación de superficie molecular y listones. Se destaca en el recuadro el sitio catalítico de la enzima SOD1.
La citocromo c oxidasa cataliza el paso terminal de la respiración empleando electrones que provienen del citocromo c para reducir el oxígeno molecular a agua. Los estudios cristalográficos revelan que esta estructura está compuesta de múltiples subunidades. A pesar de que 13 proteínas diferentes están presentes en la citocromo c oxidasa en los eucariontes superiores, los metalocentros esenciales (dos hemo, tres átomos de cobre y uno de magnesio) están localizados solo en dos de estas subunidades, las cuales están presentes también en las enzimas bacterianas. En levaduras, la biosíntesis de la citocromo c oxidasa requiere de 30 grupos complementarios de genes (McEwen, et al., 1986) cuyo rol no se conoce por completo.
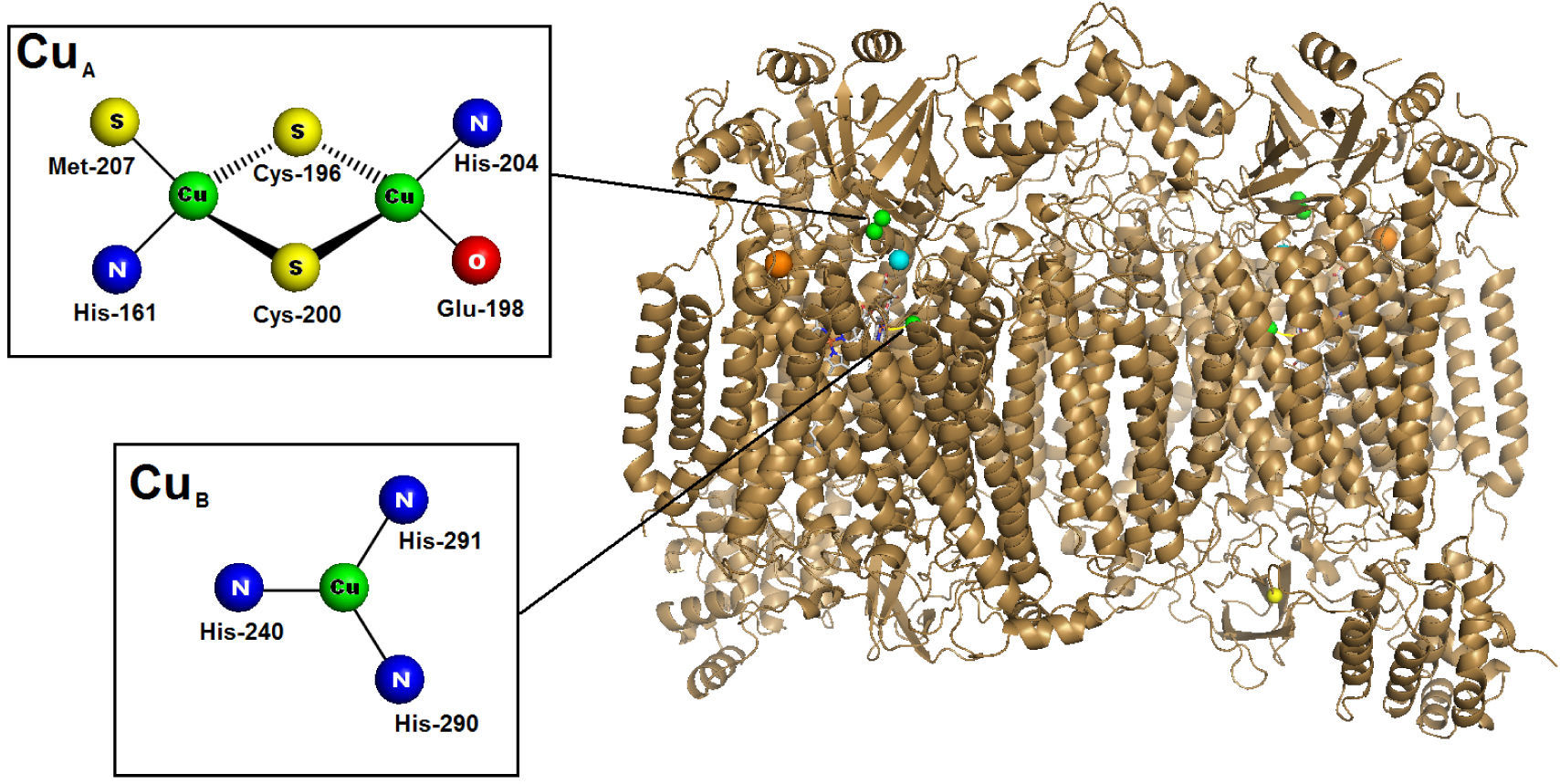
Específicamente, la síntesis del sitio CuB requiere de todo un sistema de distribución de cobre (metalochaperonas de cobre). La transferencia cobre a través del citoplasma desde el transportador de membrana (Ctrl1) a la mitocondria requiere de una metalochaperona, función que se atribuye a la Cox17 (Glerum, et al., 1996) o a la Cox19 (Nobrega, et al., 2002). Estas proteínas se encuentran ubicadas en el citoplasma y en el espacio intermembranal. Poco se sabe del sitio de unión de Cu para la Cox 19, excepto que posee cuatro residuos de Cys que pueden alinearse con los de Cox17; sin embargo, para la Cox 17 se ha identificado un cúmulo polinuclear de Cys que une seis átomos de Cu por dímero y 12 por tetrámero (Heaton, et al., 2001). Una vez que el Cu llega a la mitocondria, la proteína de membrana Cox 11 transfiere el cobre al sitio CuB de la Citocromo c oxidasa problablemente mediante una proteína interna llamada Sco1. Cox 11 es una proteína dimérica que une dos cobres en un cúmulo dinuclear donde cada uno de los metales se coordina a tres residuos de His (Yoshikawa, et al., 1998; Carr, et al., 2002). El sitio CuB en la citocromo c oxidasa también contiene tres ligantes histidina (Yoshikawa, et al., 1998).
Los dos átomos de cobre restantes en el centro activo de la citocromo c oxidasa se encuentran en un sitio dinuclear denominado centro CuA. La biosíntesis de CuA nuevamente requiere del transporte a través del citoplasma por Cox 17, Cox 19 o alguna otra proteína hasta llegar a la mitocondria. Una vez que el cobre llega a este organelo se transfiere a través de Sco1 o Sco2, proteínas de membrana que son homólogas y que unen un cobre por cada monómero vía un residuo de histidina y un motivo CXXXC (Glerum, et al., 1996). Estas proteínas subsecuentemente insertan el metal en el sitio CuA. Dos residuos de cisteína unen a través de un puente a los dos cobres en el centro CuA. Uno de ellos adicionalmente tiene coordinación a una Met y una His, mientras que el otro metal está coordinado a una His y un oxígeno proveniente de un carbonilo de un Glu (figura 6). El centro CuA sirve de entrada para los electrones que dona el citocromo c.
Metalochaperonas de hierroLas proteínas que controlan la homeostasis del hierro son esenciales para mantener los niveles apropiados y la disponibilidad del metal en las células. El hierro es esencial para la vida, particularmente en la naturaleza se emplea para realizar química de oxidación, promover el transporte y almacenamiento de oxígeno y transferir electrones (Andrews, et al., 2007). El hierro se absorbe de la dieta en promedio 1-2 mg diarios en nuestra especie (Andrews, et al., 2007). A pesar de que la cantidad que se obtiene de la dieta es baja, el estricto control de su regulación y la ausencia de vías fisiológicas para excretar el metal favorecen que las concentraciones se mantengan en el óptimo (Andrews, et al., 2007). El 60% del hierro absorbido se incorpora en la hemoglobina; su segundo y tercer destinos incluyen la proteína de almacenamiento ferritina y la transferencia (transferrina) para incorporación en metaloproteínas. Debido a la necesidad del cuerpo de mantener las concentraciones adecuadas de hierro, este metal se recicla a partir de sus fuentes degradadas. Cualquier alteración en alguna de estas vías lleva a condiciones perjudiciales para la salud. El exceso de hierro produce una patología hereditaria denominada hemocromatosis, en donde los pacientes absorben dos y tres veces más hierro que el normal. El exceso de hierro se acumula en el hígado provo cando estrés oxidante y muerte celular como consecuencia (Eisenstein, 1998). Por otra parte, la acumulación de hierro en las neuronas se presenta como consecuencia del fenotipo de varias enfermedades neurodegenerativas (Parkinson, Alzheimer, ataxia de Friedreich); en todas ellas la desregulación de las concentraciones y destino de un metal que es activo en la química redox, provoca su acumulación en regiones específicas del cerebro generando daño por estrés oxidante (Crichton, et al., 2011). Por otra parte, la deficiencia de hierro lleva a la disminución del desarrollo cognitivo en niños, y esta condición a largo plazo conduce a muchas enfermedades relacionadas como la anemia ferropénica (Andrews, 1999). Por tanto, es claro que las vías de control son fundamentales para mantener la homeostasis de este metal.
El hierro se importa a la célula a través de la endocitosis de transferrina (Tf) cargada de Fe3+, la cual interactúa con el receptor de transferrina (Tf-R). En eucariontes, el hierro se distribuye en el interior de la célula siguiendo varias rutas; de particular interés se han detallado dos que involucran metalochaperonas de hierro: 1) ruta de ensamblaje del cúmulo mitocondrial hierro-azufre (Fe-S), y 2) sistema de almacenamiento de hierro dentro de la ferritina para su uso posterior. A pesar de que los detalles estructurales y funcionales que describen cómo funcionan estas chaperonas apenas están emergiendo, ambas comparten afinidades similares hacia el hierro y estructuras metal-ligante parecidas que les permiten unir y liberar Fe2+ a proteínas específicas (Subramanian, et al., 2011).
Ruta de ensamblaje del cúmulo mitocondrial hierro-azufre (Fe-S)En eucariontes, la maquinaria de ensamblaje mitocondrial ISC (cúmulo hierro azufre) es la principal vía de producción del cúmulo Fe-S. Existen varias proteínas que participan en este ensamblaje; sin embargo, las clave son las proteínas de andamiaje (Isu1 o Isu2), la cisteína desulfurasa (Nfs1) que provee de azufre a Isu1, la proteína accesoria (Isd11) que funciona en conjunto con Nfs1, una ferredoxina (Yah1) que funciona como ferredoxina reductasa (Arh1) para proveer de electrones para la reacción y una proteína denominada frataxina (Yf1) que se propone como una metalochaperona de hierro (Lill, 2009). Nos centraremos solo en el papel de esta última proteína y el mecanismo propuesto para la entrega del hierro en el cúmulo.
In vivo, Yfh1 es esencial para la maduración del cúmulo Fe-S, y su interacción con Isu1/Nfs1/Isd11 es crítica para la biosíntesis del cúmulo (Gerber, et al., 2003). La deficiencia de Yf1 tiene severas consecuencias con respecto al estrés oxidante celular (Moreno-Cermeno, et al., 2010).
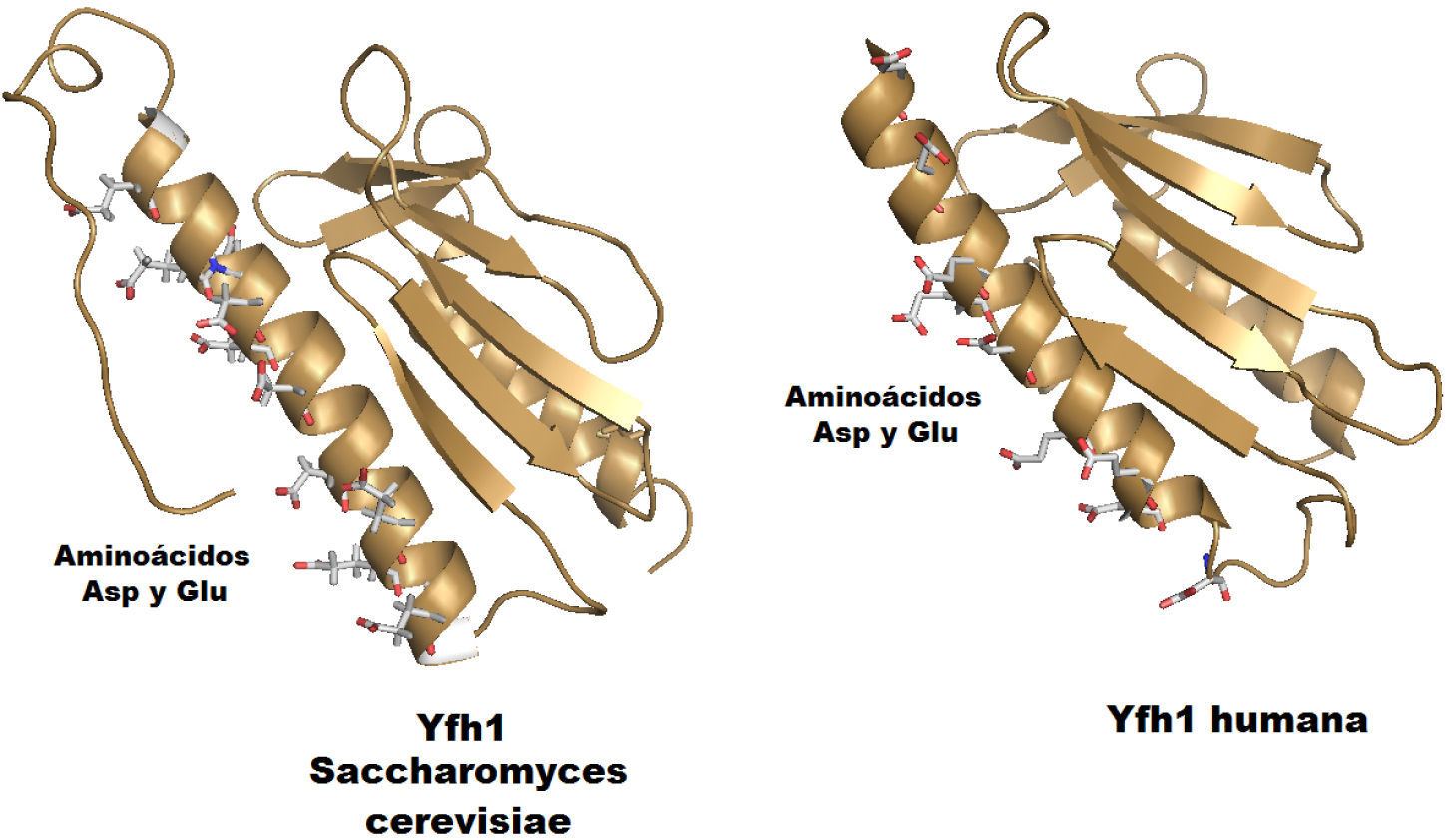
La frataxina es miembro de una familia de motivos sándwich a-b, contiene dos planos moleculares, el primero construido con las hélices N-terminal y C-terminal, y el segundo conformado por al menos cinco cadenas b antiparalelas (Dhe-Paganon, et al., 2000). Los ortólogos (genes que se encuentran en diferentes especies pero que son altamente similares debido a su origen en un ancestro en común) de la frataxina en las diferentes especies tienen una superficie expuesta muy conservada de residuos ácidos en la unión Héli-ce-1/cadena-1 (figura 7), una región corta carente de estructura en la región N-terminal solo presente en los ortólogos eucariontes —la cual se considera que está directamente involucrada en la unión al hierro (He, et al., 2004)—, y una región C-terminal que se considera que en los humanos y las bacterias confiere estabilidad (Adinolfi, et al., 2004). Los estudios estructurales confirman que la frataxina monomérica coordina Fe2+ de alto spin en un ambiente de coordinación hexacoordinado con ligantes donadores por oxígeno y nitrógeno (Cook, et al., 2006). Estos datos sugieren que el punto inicial para la entrega de hierro es que la frataxina capture Fe2+ usando como sitios de unión los carboxilatos de una cadena oxigenada de residuos conservados de Asp y Glu localizados en la hélice 1/cadena-1 (figura 7). En la frataxina bacterial, de levadura, de mosca y en la humana la afinidad por el hierro es del orden micromolar (Yoon, et al., 2003). El hierro queda expuesto en la superficie de la proteína y listo para su entrega en la Isu1; el acoplamiento entre Yf1 e Isu1 se lleva a cabo por la interacción de regiones cargadas complementarias entre estas proteínas (Ramazzotti, et al., 2004). Los estudios de interacción in vitro entre estas dos proteínas demuestran que este acoplamiento es dependiente del hierro, y ocurre empleando una de las superficies generadas por las hojas β en la frataxina y la hélice C-terminal de Isu1; esta interacción ocurre con afinidades del orden nM (Cook, et al., 2010).
Todas las proteínas pertenecientes a la maquinaria ISC forman un complejo macromolecular muy estable que ensambla el cúmulo, y la frataxina es una pieza fundamental de este complejo que requiere unirse a Isu1 a través de regiones complementarias de cargas electrostáticas localizadas en la superficie de sus hojas beta. La energía de unión se reduce una vez que Yf1 entrega el hierro y se disocia de su compañera Isu1 (Subramanian, et al., 2011), la cual queda lista para entregar al hierro durante la biosíntesis del cúmulo.
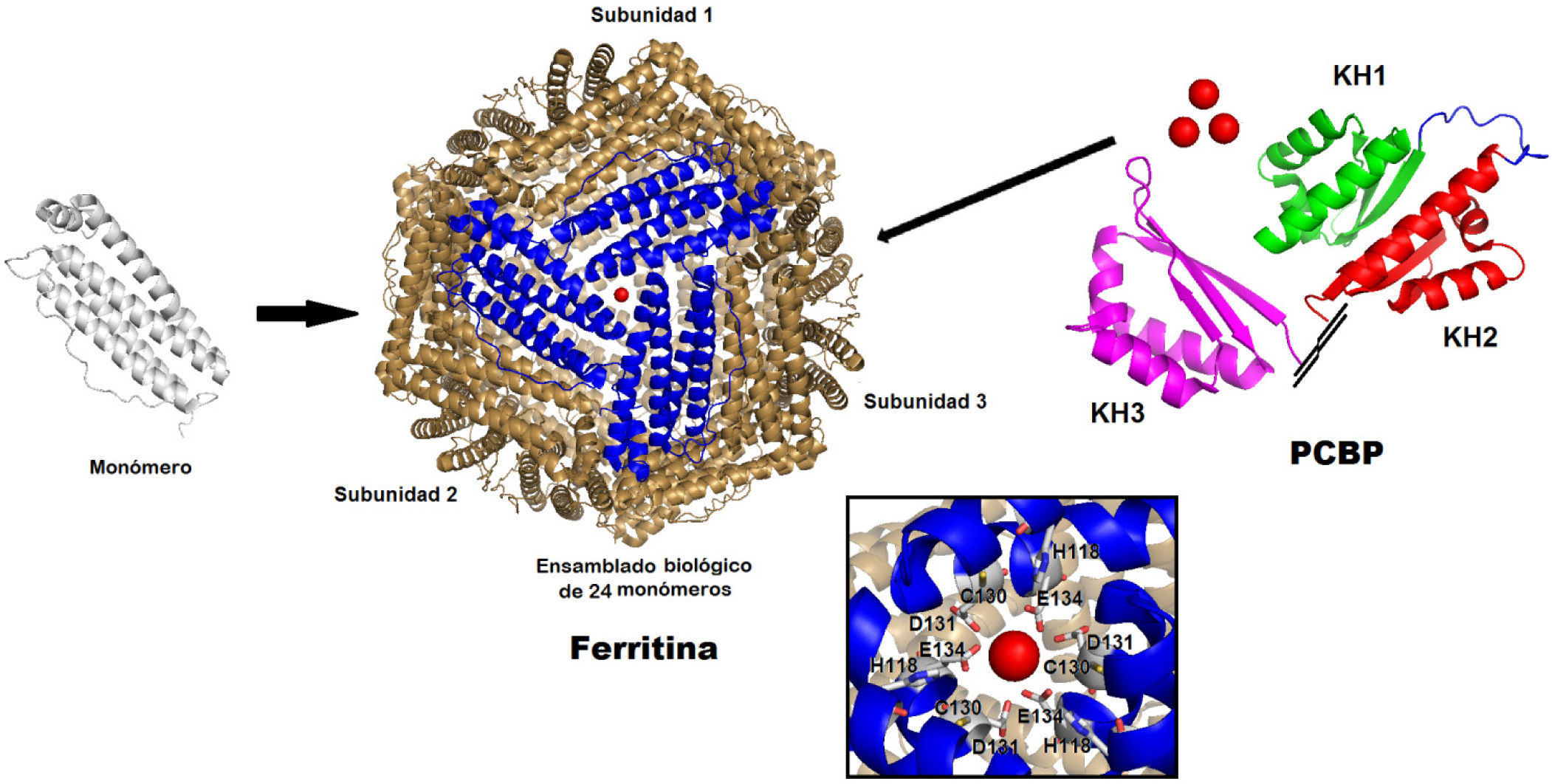
Sistema de almacenamiento de hierroEl almacenamiento de hierro es esencial para prevenir su toxicidad en condiciones de exceso de este metal y asegurar su disponibilidad durante los periodos de deficiencia. Su almacenamiento se lleva a cabo por una proteína de cuatro hélices llamada ferritina (Liu, et al., 2005). Las ferritinas citoplasmáticas existen como multímeros de 24 unidades de ferritina, cada una de ellas con dos subunidades: una cadena pesada (cadena H) de 21,000KDa, la cual tiene actividad ferroxidasa acoplada al almacenamiento de hierro, y una cadena ligera (cadena L) de 19,000 kDa. La Apo-ferritina ensambla una coraza esférica de proteínas (multímero de ferritinas) que pueden almacenar hasta 4,500 átomos de hierro en forma de ferroxihidrita en la cavidad central (figura 8). El almacenaje de hierro consta de dos pasos importantes: la oxidación del hierro para la formación de un intermediario μ-oxo(hidroxo) di-Fe(III), y posterior mineralización y depósito como ferrhidrita, mineral que es inerte. La entrega del ion ferroso se realiza en una entrada o canal constituido por un oligómero hidrofílico de la ferritina. La superficie de la cadena H expone los residuos His 118 y Cys 130, con un canal que tiene forma de embudo formado por los residuos Asp131 y Glu134 (Levi, et al., 1996). Es en esta entrada en la ferritina donde la metalochaperona de hierro llamada proteína de unión poly(rC) (PCBP) debe entrar en contacto directo para entregar Fe2+ a la ferritina (Shi, et al., 2008).
Imagen de la Ferritina preparada a partir del pdb 3AJO y su metalo chaperona PCBP preparada a partir de los pdb 2JZX (dominio 1 y 2) y 2P2R (Dominio 3) con Pymol (2008) en representación de listones. Adaptada de Subramanian, et al., 2011 (Subramanian, et al., 2011).
Los PCBPs tienen tres dominios, dos de los cuales son N-terminal (Du, et al., 2008). PCBP1 une tres átomos de hierro con afinidades micromolares comparables a la afinidad de la frataxina (Bencze, et al., 2006). Los sitios de unión al metal en PCBP se desconocen; sin embargo, datos recientes proponen la unión de Fe2+ en un ambiente de coordinación construido por átomos donadores por oxígeno y nitrógeno (Kuchar, et al., 2004) que se parece al sitio de unión a hierro de la frataxina; sin embargo, la caracterización de esta proteína aún se está estudiando (Subramanian, et al., 2011).
Metalochaperonas de níquelLas chaperonas de níquel a la fecha están menos estudiadas en comparación con las de cobre y hierro; sin embargo, describiremos un caso en donde se conoce una metalochaperona que inserta este metal en la ureasa.
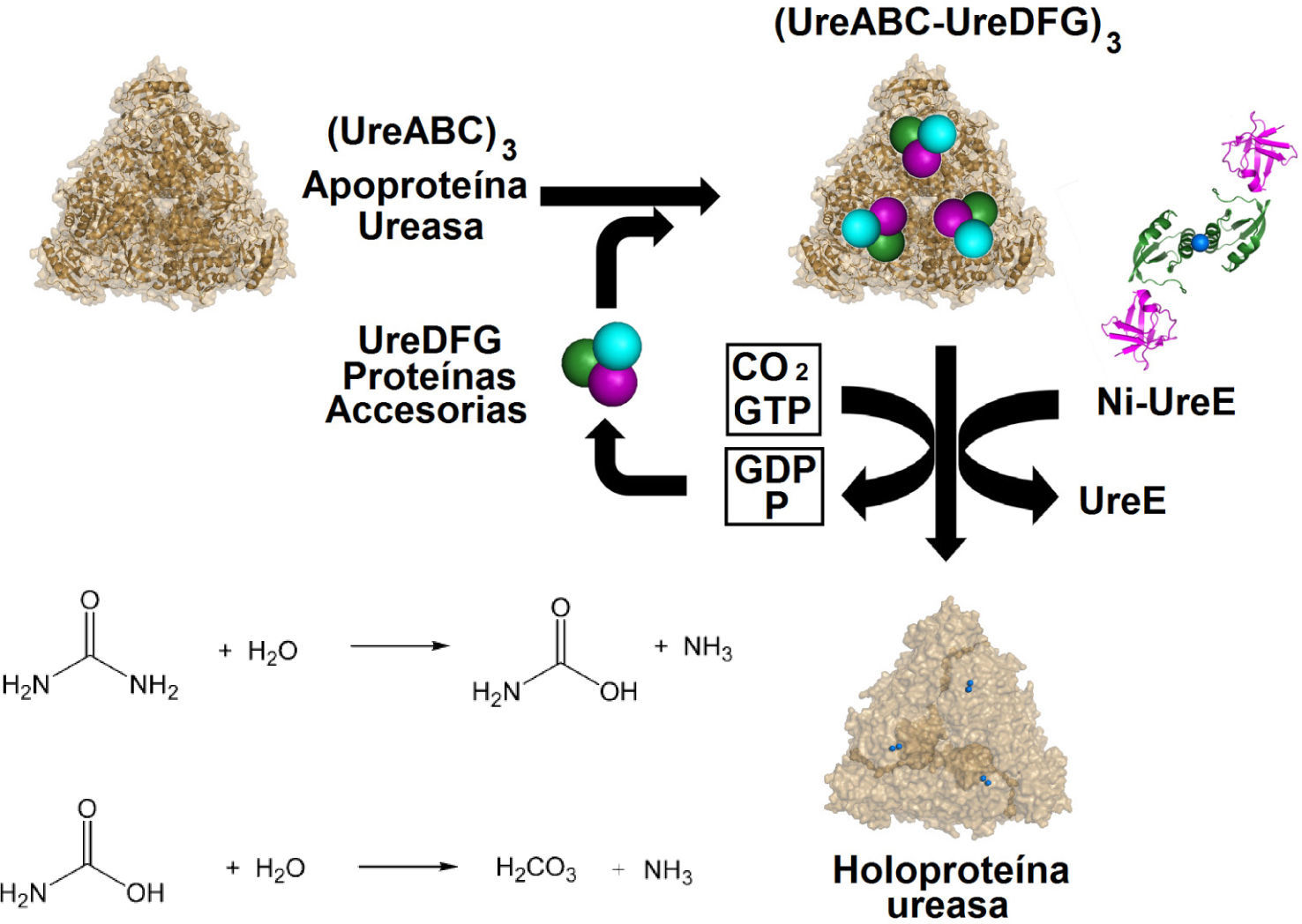
La ureasa cataliza la hidrólisis de urea para generar amoniaco y carbamato como productos de la reacción. Este último espontáneamente descompone en ácido carbónico y otra molécula de amoníaco (figura 9). Los estudios estructurales de enzimas de Klebsiella aerogenes (Pearson, et al., 1997), Bacillus pasteurii (Jabri, et al., 1995) y H. Pylori (Ha, et al., 2001) revelan que el sitio activo se encuentra en una zona muy interna de la estructura proteica y consta de un centro de Ni dinuclear con una cadena lateral de un residuo de lisina carbamilado (figura 9). El ensamblaje de este meta-locentro es un proceso complicado que requiere Ni, CO2 para la carbamilación, varias proteínas accesorias y la hidrólisis de GTP (Soriano, et al., 2000).
Reacción catalizada por la ureasa (inferior izquierda) y su biosíntesis (derecha). Adaptada de Kuchar J. y Hausinger R. P. 2004 (Kuchar, et al., 2004). La imagen de la metalochaperona Ni-UreE se preparó a partir del pdb 1GMU.
El proceso comienza con la síntesis ribosomal de la apoproteína (UreABC)3, la cual es estructuralmente idéntica a la enzima nativa pero carece de Ni y de carbamilación (Jabri, et al., 1996). UreABC se acopla con las proteínas accesorias UreD, UreF y UreG (Park, et al., 1994). El papel preciso de UreD, UreF y UreG en la activación de la ureasa aún no está claro pero una propuesta razonable es que estas proteínas accesorias actúen juntas como una chaperona molecular dependiente de GTP que altera la conformación de la apoproteína ureasa para incrementar la accesibilidad del centro activo el cual, como se mencionó antes, está muy interno en la estructura proteíca. Otras alternativas posibles incluyen su participación en la activación de CO2 y su participación en favorecer el acoplamiento con la metalochaperona UreE para la incorporación del metal.
La metalochaperona Ure E se presenta como un dímero que une de uno a seis átomos de Ni según la especie (Ciurli, et al., 2002); las diferencias en el número de átomos que puede unir radica en la presencia de una secuencia His-Asp-His en medio de una región rica en histidina en el extremo carboxilo terminal de la proteína localizado en la interfase del dímero. Sorprendentemente, el dominio de unión a Ni en la UreE se parece estructuralmente al dominio de unión a Cu en la metalochaperona ATX1 (Rosenzweig, et al., 1999). Adicionalmente, UreE contiene un segundo motivo que estructuralmente se parece al dominio de la chaperona molecular Hsp40 (Sha, et al., 2000). Se considera que probablemente este último módulo participe en el acoplamiento con alguna proteína compañera de entre las proteínas accesorias que se requieren para la síntesis de este centro metálico, mientras que el dominio de unión a Ni transfiere el metal a Ure ABC. Después de la activación de la ureasa, las proteínas accesorias se disocian y se reciclan.
ConclusionesLa biosíntesis de centros metálicos en las metaloenzimas es un proceso que se da a través de mecanismos que pueden llegar a ser muy complejos y sofisticados, en donde participan muchas proteínas que conforman la maquinaria de biosíntesis y ensamblaje, entre ellas: chaperonas moleculares, proteínas accesorias, enzimas que se encargan de realizar modificaciones postransduccionales, cofactores, y metalochaperonas. Estas últimas son las encargadas de entregar el ión metálico correcto para convertir la apoproteína en una metaloproteína funcional.
Este proceso de entrega en general depende en un primer paso del acoplamiento entre las dos macromoléculas a través de regiones ricas en residuos ácidos o básicos que generan zonas complementarias en la superficie protéica y que permiten el reconocimiento molecular entre ellas. La transferencia del metal se da a través de sitios coordinantes en regiones específicas de cada una de las macromoléculas participantes. Estos sitios de coordinación suelen ser muy conservados entre las metalochaperonas especializadas en el mismo metal y su arquitectura es responsable de su gran afinidad por ese metal. Debido a eso, en algunos casos la entrega del metal a la siguiente proteína requiere de cambios en el ambiente de coordinación y en ocasiones cambio del estado de oxidación del metal para favorecer el cambio de afinidad por el nuevo ambiente de coordinación en el que se alojará.
La identificación de una metalochaperona es un proceso de investigación complicado que requiere de muchas disciplinas y del empleo de técnicas bioquímicas, genéticas, microbiológicas, químicas, físicas y computacionales que permiten identificar y caracterizar a los candidatos para posteriormente estudiar sus interacciones con otras proteínas. Es por esto que existe escasa información sobre este tema con excepción de algunos casos bien identificados en donde se encuentran las metalochaperonas de cobre y hierro principalmente. Sin embargo, el estudio de este tipo de proteínas se está extendiendo poco a poco, y actualmente hay otras vías que se están estudiando como lo son las metalochaperonas de níquel (biosíntesis de ureasa e hidrogenasas NiFe), de molibdeno (biosíntesis de enzimas Moco) y zinc, por lo que seguramente el conocimiento en esta área crecerá en los próximos años.