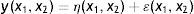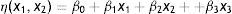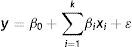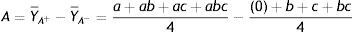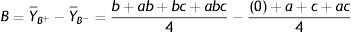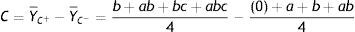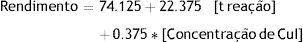Este trabalho trata do desenvolvimento de um sistema catalítico para a N‐arilação do imidazol, com CuI, através do planejamento experimental. A 1.10‐fenantrolina (ligante bidentado) foi utilizada e provou ser eficaz no acoplamento de iodo e bromoarenos com imidazol. Assim, o artigo aqui apresentado está destinado a servir como um tutorial para a otimização de novos sistemas catalíticos e pode ser aplicado como uma aula prática de baixo custo para estudantes universitários de química.
This work deals the development of a catalytic system for the N‐arylation of imidazole with CuI through experimental design. 1,10‐Phenanthroline (bidentate ligand) was used and proved to be efficient in the coupling of iodo‐ and bromoarenes with imidazole. Thus, the article presented here is intended to serve as a tutorial for optimization of new catalytic systems and may be applied as a low‐cost practical class for chemistry undergraduate students.
Muitos produtos farmacêuticos, herbicidas e componentes de diodos orgânicos emissores de luz (OLED) contêm aminas aromáticas. Por muitos anos esta classe de compostos era preparada via métodos clássicos, como nitração, redução e alcalinização redutiva ou substituição eletrofílica direta em particular de aromáticos ou heteroaromáticos deficientes em elétrons. Entretanto, durante a década de 1990, sistemas catalíticos à base de paládio e ligantes auxiliares como fosfinas promoveram o acoplamento N‐C de haletos de arila, inclusive cloroarenos, com aminas gerando excelentes resultados (Hamann e Hartwig, 1998). Assim, os métodos anteriores foram suplantados (Hartwig, 2007; Guram, Rennels e Buchwald, 1995; Louie e Hartwig, 1995; Wolfe, Wagaw e Buchwald, 1996; Driver e Hartwig, 1996), porém, o alto custo de compostos de paládio ainda é um fator impeditivo. Mais recentemente, a possibilidade de promover tal acoplamento usando um precursor catalítico à base de cobre foi descoberta (Zhu et al., 2009; Li, Yang, Jiang e Fu, 2010; Zhang, Cai e Ma, 2005); com isso os custos baixaram drasticamente, contudo, a eficiência para o acoplamento de cloretos de arila também fora reduzida (Mao, Hua, Guo e Shi, 2008; Huang, Gao, Ma, Miao e Xu, 2008).
A análise de dados, juntamente com a experimentação, são procedimentos essenciais que propiciam o uso de ferramentas quimiométricas, principalmente àquelas voltadas para otimização (Vicentini et al., 2011). A utilização de técnicas de planejamento experimental busca a redução do número de ensaios sem prejuízos da qualidade de informação, além de permitir o estudo simultâneo de diversas variáveis. Dessa forma, separam‐se seus efeitos como: a determinação da confiabilidade dos resultados, a realização da pesquisa em etapas num processo interativo de acréscimo de novos ensaios, seleção das variáveis que influem no processo e ainda a elaboração de conclusões a partir de resultados qualitativos. O planejamento experimental fatorial é uma estratégia analítica útil e sua principal aplicação reside na triagem das variáveis mais relevantes de um determinado sistema (Montgomery, 1991). Após este processo de triagem das variáveis mais significativas são executados experimentos que permitem refinamento e um melhor conhecimento do sistema em estudo (Barros‐Neto, Scarminio e Bruns, 1995).
Os experimentos de laboratório envolvendo acoplamentos catalíticos presentes nos currículos de estudantes de graduação e pós‐graduação são raros (Dalmás et al., 2013; Oliveira, Rosa, Silveira, de Moura, Rosa, 2015). Também há insuficiência de relatos que englobem planejamento experimental com aulas práticas de química orgânica, físico‐química e química analítica (Souza e Poppi, 2012). Portanto, urge a necessidade de desenvolver aulas que abordem tais conteúdos de maneira simplificada e não menos aprofundada. Com esse intuito, o presente trabalho trata do desenvolvimento de um sistema catalítico à base de cobre, capaz de promover a arilação de imidazol com iodetos e brometos de arila, para a contextualização do planejamento fatorial numa nova abordagem didática.
Parte experimentalSistema catalíticoTodas as reações foram conduzidas ao ar em reatores do tipo Schlenk com selo de teflon. Na falta desse reator poderá ser empregado um tubo de ensaio com tampa munido de barra agitadora magnética. Os solventes (marca Synth, Brasil) e reagentes empregados foram usados sem prévio tratamento. O imidazol, os haletos de arila e undecano são da marca Acros; o ligante 1.10‐fenantrolina e o catalisador CuI são da marca Vetec (Brasil); a base K2CO3 é do fornecedor Sigma‐Aldrich.
Ao reator foram adicionados, primeiramente, os reagentes sólidos e, posteriormente, os líquidos via microsseringa. As quantidades foram: imidazol (1.5mmol); K2CO3 (2mmol); haleto de arila (1mmol); solvente (2mL); undecano (10μL); 1.10‐fenantrolina (0.1mmol) e CuI (0.05 ou 0.1mmol). As reações foram conduzidas com agitação magnética em banho de óleo a 100°C, o tempo total oscilou entre 23‐50h.
Os produtos de reação foram isolados através da lavagem do reator com 5mL de acetato de etila e filtrados diretamente em coluna cromatográfica de sílica‐gel de diâmetro 1cm e altura 5cm. Posteriormente, a coluna foi lavada com 15mL de mistura de acetato de etila e hexano (1:1). O filtrado foi concentrado em vácuo resultando no produto desejado. As caracterizações foram feitas por cromatografia gasosa acoplada à espectrometria de massas (CG‐EM) num cromatógrafo Shimadzu GC‐17A equipado com coluna de DB‐1 (dimetilsiloxano) 30m, diâmetro 0.25mm. Gás vetor: He (1.5mL/min) acoplado a um espectrômetro de massas Shimadzu GCMS‐QP5050 operando no modo de impacto eletrônico (70eV). Programação de temperatura: início 100°C durante 1min; aquecimento de 15°C/min até 250°C e permanência nessa temperatura por 9min.
As análises de cromatografia gasosa foram realizadas em um cromatógrafo gasoso Hewlett‐Packard‐5890 com detector FID e uma coluna capilar DB‐1 de 30m, diâmetro de 0,2mm. Gás vetor: N2 (2,7mL/min); Phidrogênio: 2bar; Par: 3bar; temperatura do injetor: 250°C, temperatura do detector: 250°C. Programação de temperatura: início 100°C durante 1min; aquecimento de 15°C/min até 250°C e permanência nessa temperatura por 9min. Padrão interno: undecano.
1‐(4‐metilfenil)‐1H‐imidazol. Sólido. CG‐EM (IE, 70eV) m/z (%): 158 (100, M+), 130 (50), 131 (43), 104 (33), 65 (28), 91 (22), 159 (12), 103 (11). Ver espectro de massas na figura S1 do Material Suplementar.
Planejamento experimentalPara uma avaliação mais precisa da influência das variáveis sobre o rendimento do sistema catalítico à base de cobre, capaz de promover a arilação de imidazol com iodetos e brometos de arila, utilizou‐se um planejamento fatorial completo, 23, com 3 fatores e cada fator foi avaliado 2 níveis codificados (‐1 e +1). Sendo que as variáveis avaliadas foram: concentração molar percentual de CuI (variável independente quantitativa), tipo de solvente (variável independente qualitativa) e tempo de reação (variável independente quantitativa) no rendimento do processo (variável resposta). As variáveis quantitativas serão ajustadas segundo modelo empírico adequado. A variável qualitativa, tipo de solvente, posteriormente a análise estatística, deve ser fixada no solvente que forneça benefícios econômicos ou na segurança de seu manuseio, caso seja essencial a sua presença na reação e não seja significativa no processo. Caso a variável seja significativa no processo, deve ser fixada no solvente que propicie maior rendimento na reação.
Com os resultados do planejamento fatorial completo 23 foi obtido o modelo estatístico empírico, para ser utilizado na previsão dos valores da variável resposta rendimento da reação, sendo considerada uma variável aleatória y, que se distribui em torno de uma média populacional η(x1,x2), com uma variância populacional σ2(x1,x2) (Equação 1), ou seja:
onde ¿ é o desvio aleatório (resíduos) com que as observações flutuam em torno da média.Para este teste estatístico utilizou‐se a metodologia descrita por Box (Box, Hunter e Hunter, 2005), supondo que os desvios variam segundo uma distribuição normal, sendo que para o planejamento fatorial utilizado a média populacional η(x1, x2) pode ser representada por uma combinação linear das variáveis x1, x2 e x3 (Equação 2).
Ou através da Equação 3.onde β0 é o valor da média global das respostas e β1, β2e β3 representam os valores populacionais dos efeitos lineares dos efeitos principais por unidade de x1, x2 e x3.Os modelos estatísticos testados no ajuste dos valores obtidos experimentalmente foram avaliados segundo análise de variância (teste Fisher) e coeficiente de determinação (R2). Também foi realizada a localização dos níveis de x1, x2 e x3 que maximizam a resposta estimada (predita). Este ponto representa um conjunto de x1, x2 e x3 para o qual as derivadas parciais são iguais a 0 (Equação 4).
O tratamento estatístico da etapa do planejamento experimental foi realizado utilizando o software Microsoft Office Excel® versão 2003 for Windows.Resultados e discussãoPartindo‐se da literatura anteriormente citada, desenvolveu‐se um sistema catalítico de baixo custo contendo Cu(I) coordenado em 1.10‐fenantrolina. Tal sistema mostrou‐se eficiente no acoplamento N‐C de haletos de arila com imidazol. Optou‐se por trabalhar com o ligante bidentado 1.10‐fenantrolina por ser um produto químico popular em laboratórios devido a sua aplicação em determinação fotométrica do cátion ferroso (Belcher, 1973) ou como indicador para reagentes alquil‐lítio. A base K2CO3 e os solventes dimetilsulfóxido (DMSO) e N,N‐dimetilformamida (DMF) tiveram sua escolha baseada na literatura (Hartwig, 2007; Guram et al., 1995; Louie e Hartwig, 1995; Wolfe et al., 1996; Driver e Hartwig, 1996) e na sua disponibilidade em nosso laboratório. Assim, escolheu‐se a reação de imidazol com 4‐iodotolueno para otimizar o sistema catalítico (fig. 1).
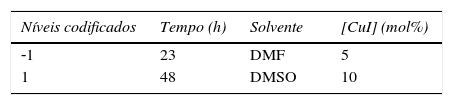
No estudo realizado, 2 níveis de tempo de reação foram necessários: 23 e 48h. O primeiro é designado como ‐1 (nível inferior) e o segundo +1 (nível superior), e assim estão decodificados na tabela 1 para cada uma das 3 variáveis. Dessa forma, para as 3 variáveis envolvidas – tempo de reação, tipo de solvente e concentração de CuI – são necessários 8 experimentos para que se possa conjugar todos os fatores propostos no trabalho e assim buscar os resultados pretendidos.
Com os níveis inferior (‐1) e superior (+1), pode‐se montar a sequência que busca conjugar todas as variáveis envolvidas no estudo (tabela 2) formando assim a matriz do planejamento experimental com os valores codificados. A disposição dos níveis é sempre em progressão aritmética, na primeira variável é 1 (de 1 em 1, ‐1, +1...), na segunda é 2 (de 2 em 2, ‐1, ‐1, +1, +1...), na terceira é 4 (de 4 em 4, ‐1, ‐1, ‐1, ‐1, +1, +1, +1, +1) e assim sucessivamente, partindo‐se sempre primeiro do nível inferior (‐1) (Rodrigues e Iemma, 2009).
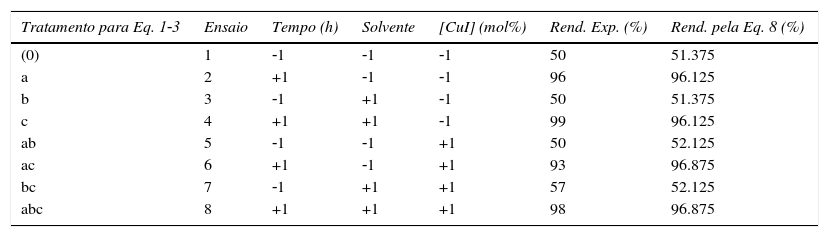
Matriz do planejamento fatorial completo 23 e rendimento experimental obtido
| Tratamento para Eq. 1‐3 | Ensaio | Tempo (h) | Solvente | [CuI] (mol%) | Rend. Exp. (%) | Rend. pela Eq. 8 (%) |
|---|---|---|---|---|---|---|
| (0) | 1 | ‐1 | ‐1 | ‐1 | 50 | 51.375 |
| a | 2 | +1 | ‐1 | ‐1 | 96 | 96.125 |
| b | 3 | ‐1 | +1 | ‐1 | 50 | 51.375 |
| c | 4 | +1 | +1 | ‐1 | 99 | 96.125 |
| ab | 5 | ‐1 | ‐1 | +1 | 50 | 52.125 |
| ac | 6 | +1 | ‐1 | +1 | 93 | 96.875 |
| bc | 7 | ‐1 | +1 | +1 | 57 | 52.125 |
| abc | 8 | +1 | +1 | +1 | 98 | 96.875 |
O rendimento experimental mostrado no exemplo apresentado na tabela 2 é referente ao determinado por isolamento do produto reacional conforme descrito na Parte Experimental. As reações que apresentam baixo rendimento (ensaios 1, 3, 5 e 7) são decorrentes do sistema catalítico escolhido promover uma conversão incompleta dos reagentes.
Estabelecido o cenário de experimentos a serem realizados e, se dispondo dos resultados esperados, nesse caso, rendimento, pode‐se alocar os dados codificados (na forma ‐1, +1) na planilha de um programa computacional como Microsoft Office Excel. Assim, basta realizar as análises de efeitos principais e de variância (ANOVA) dos dados coletados experimentalmente para a N‐arilação do imidazol via CuI. A tabela 2 apresenta as respostas para o rendimento para cada um dos ensaios propostos e valores estimados pelo modelo empírico (Equação 8) para fins de comparação dos desvios entre os valores observados experimentalmente e os valores preditos pelo modelo. Para o cálculo dos efeitos utilizou‐se as Equações 5 a 7.
Onde: A é o valor do efeito do fator principal A, Y¯A+ é a média dos valores dos rendimentos da reação para o nível +1 de A, Y¯A− é a média dos valores dos rendimentos da reação para o nível ‐1 de A, B é o valor do efeito do fator principal B, Y¯B+ é a média dos valores dos rendimentos da reação para o nível +1 de B, Y¯B− é a média dos valores dos rendimentos da reação para o nível ‐1 de B, C é o valor do efeito do fator principal C, Y¯C+ é a média dos valores dos rendimentos da reação para o nível +1 de C, Y¯C− é a média dos valores dos rendimentos da reação para o nível ‐1 de C, (0) ambos os fatores estão ausentes (ambos em sinal ‐1), as letras minúsculas de a, b e c indicam quais os fatores que se encontram no nível +1, por exemplo, «ac» os fatores A e C se encontram com nível +1 e B com nível ‐1.Os resultados mostraram que, aumentando o tempo reacional para 48h, o K2CO3 com DMF ou DMSO produziu excelentes rendimentos, mesmo reduzindo‐se a quantidade de CuI pela metade. Para esse estudo, a tabela 3 e a planilha do software Excel com os cálculos dos efeitos (vide Figura 2S do Material Suplementar) mostram os efeitos das variáveis estudadas e suas interações sobre a variável dependente ou resposta, rendimento. Verificou‐se que, com 95% de confiança, a mudança do nível −1 para o nível +1 do tempo reacional exerceu um efeito positivo sobre o rendimento. Dessa forma, o incremento do tempo de reação ocasionou um aumento no rendimento do processo. O mesmo comportamento foi verificado em relação ao tipo de solvente e a concentração molar percentual de CuI.
Efeitos principais das variáveis tempo de reação (h), tipo de solvente e concentração molar percentual de CuI no rendimento do processo
| Variável de entrada | Efeitos principais sobre o rendimento | p |
|---|---|---|
| Tempo | 44.75 | 0.00002 |
| Solvente* | 3.75 | 0.11788 |
| [CuI] (mol%) | 0.75 | 0.71139 |
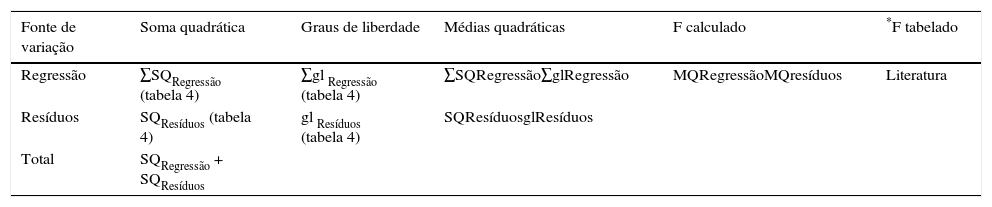
A variável de entrada tempo de reação foi estatisticamente significativa com 95% de confiança, ou seja, essa possui um valor de p, probabilidade de significância, inferior ao α (nível de significância) considerado. Nesse trabalho, como se considerou o α como 5%, os valores de p para as variáveis tempo de reação e tipo de solvente foram inferiores à 0.05. A segunda análise, a da variância, pode ser acompanhada a partir da tabela ANOVA (tabelas 4 e 5), cujas notações e respectivos conceitos são os que seguem: soma quadrática (SQ), graus de liberdade (gl), média quadrática (MQ). Para o teste F, deve‐se inicialmente determinar a SQ e os gl do resíduo e da regressão. Posteriormente, a MQ é encontrada, sendo MQ=SQ/gl, para o resíduo e para a regressão. Finalmente, F é calculado pela razão entre MQ da regressão pela MQ do resíduo.
Tabela de análise de variância para experimentos fatoriais do tipo 23 para o ajuste de um modelo empírico com efeitos principais lineares (tempo, solvente e concentração de CuI)
| Fonte de variação | Soma quadrática (SQ) | Graus de liberdade (gl) | |
|---|---|---|---|
| Regressão | A | SQA | a‐1 |
| *B | SQB | b‐1 | |
| C | SQC | c‐1 | |
| Resíduos | **Erro | SQE | abc(r‐1) |
| *Total | SQT | abcr‐1 | |
A, B, C apresentam o valor de 2, que correspondem ao número de níveis utilizados (+1 e ‐1). *A fonte de variação B, não foi utilizada no ajuste do modelo empírico, por se tratar de uma variável qualitativa. **Onde o r é o tratamento para os resíduos de origem da falta de ajuste do modelo empírico e dos desvios de origem experimental.
Memória de cálculo para elaboração da tabela de análise de variância de uma matriz experimental 23
| Fonte de variação | Soma quadrática | Graus de liberdade | Médias quadráticas | F calculado | *F tabelado |
|---|---|---|---|---|---|
| Regressão | ∑SQRegressão (tabela 4) | ∑gl Regressão (tabela 4) | ∑SQRegressão∑glRegressão | MQRegressãoMQresíduos | Literatura |
| Resíduos | SQResíduos (tabela 4) | gl Resíduos (tabela 4) | SQResíduosglResíduos | ||
| Total | SQRegressão + SQResíduos |
Para o estudo de caso, optou‐se pelo modelo empírico com os termos principais, tempo e concentração de CuI, para a análise de variância gerou os dados apresentados na tabela 6. Os valores da tabela ANOVA foram fornecidos pelo software Excel, através do seguinte procedimento: acesso ao menu FERRAMENTAS, após o submenu ANÁLISE DE DADOS e a opção REGRESSÃO. Como apresentado na planilha (Figura 3S do Material Suplementar), se define no campo INTERVALO Y DE ENTRADA, as coordenadas das células com os valores obtidos para a resposta (Rendimento) e no campo INTERVALO X DE ENTRADA, as coordenadas das células com a matriz experimental codificada (valores ‐1 e +1 para os 3 fatores em estudo. Sendo que com o valor do F calculado foi realizada a comparação com o valor de F tabelado para o α pré‐determinado (5%), conjugando os gl da regressão versus do resíduo.
No teste de Fisher na tabela 6 e figura 3S do Material Suplementar), o valor de F calculado (176.8764) é superior a 30 vezes maior que o valor tabelado (5,79) com 95% de confiança (Box et al., 2005). Deste modo entende‐se que a regressão é significativa, podendo ser usada para fins de predição. Do mesmo modo, os valores dos resíduos frente à regressão não são significativos. Todos os índices estatísticos mostram que o modelo ajustado descreve bem os resultados experimentais. Dado que é válido estabelecer um modelo que descreva o comportamento das variáveis de efeito na resposta obtida, poder‐se‐ão considerar as variáveis quantitativas no modelo (tempo de reação e concentração de CuI) e a variável qualitativa ser fixada no solvente que forneça benefícios econômicos ou na segurança de seu manuseio, caso seja essencial a sua presença na reação. Assim, tem‐se para esse caso a Equação 8 que correlaciona as 2 variáveis independentes quantitativas no rendimento do processo, através de um modelo codificado, linear e simples.
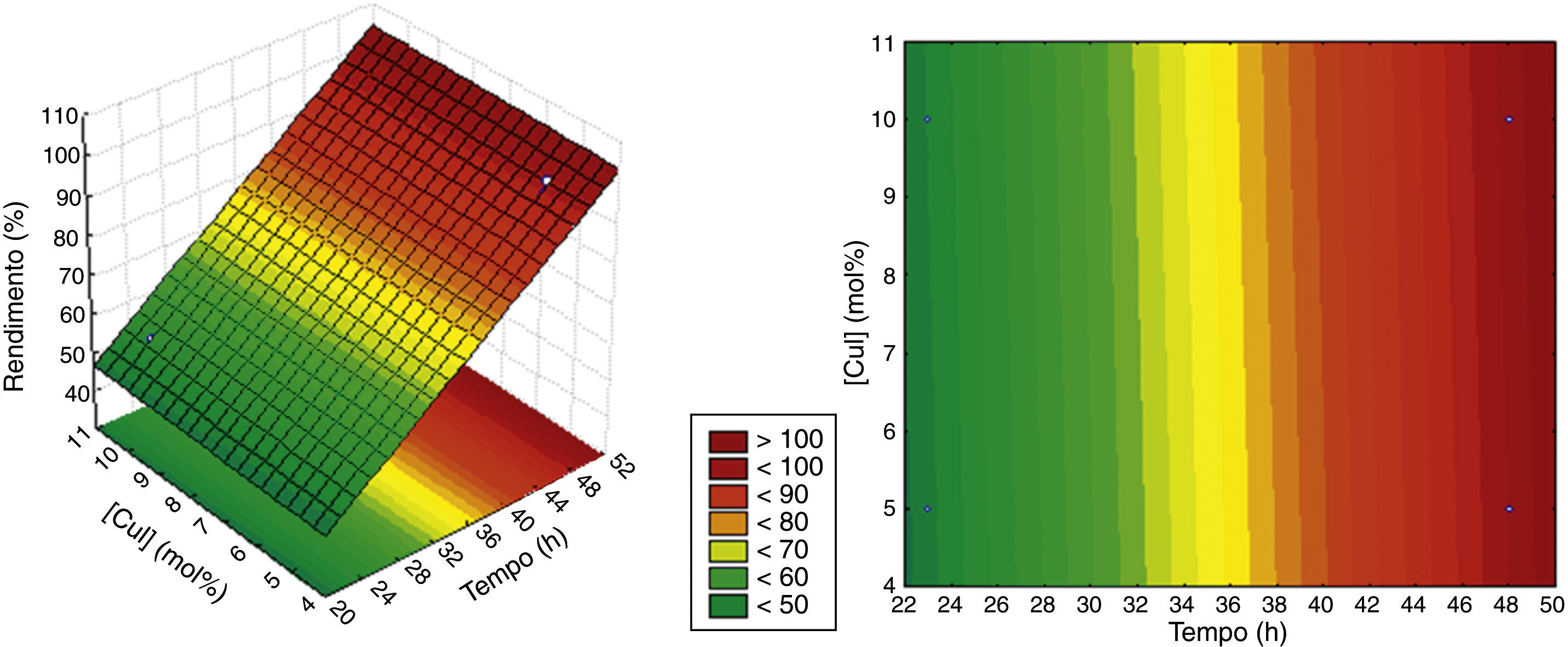
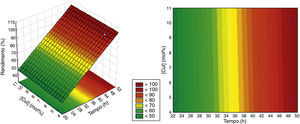
O modelo codificado é aquele cujos coeficientes de regressão são obtidos a partir da matriz das variáveis na forma codificada (−1, +1) e, consequentemente, para se obter um valor previsto pelo modelo é necessário substituir os valores na Equação 8 na forma codificada (Rodrigues e Iemma, 2009). O coeficiente de determinação (R2) obtido é de 0.986, e o resultado da distribuição F validaram estatisticamente o modelo e permitiram a construção da superfície de resposta e das curvas de contorno apresentadas na figura 2 A superfície de resposta é a descrição gráfica do modelo ajustado bem como a curva de contorno é a projeção de seus cortes sobre o plano dos fatores, que é uma forma opcional e simplifica a interpretação dos resultados, as quais podem ser obtidas em softwares como o Statistica ou Minitab (Rodrigues e Iemma, 2009). Nesse trabalho se optou pela utilização do software Statistica na obtenção da superfície de resposta e seu respectivo gráfico de curvas de contorno, com os fatores quantitativos tempo de reação e concentração de CuI.
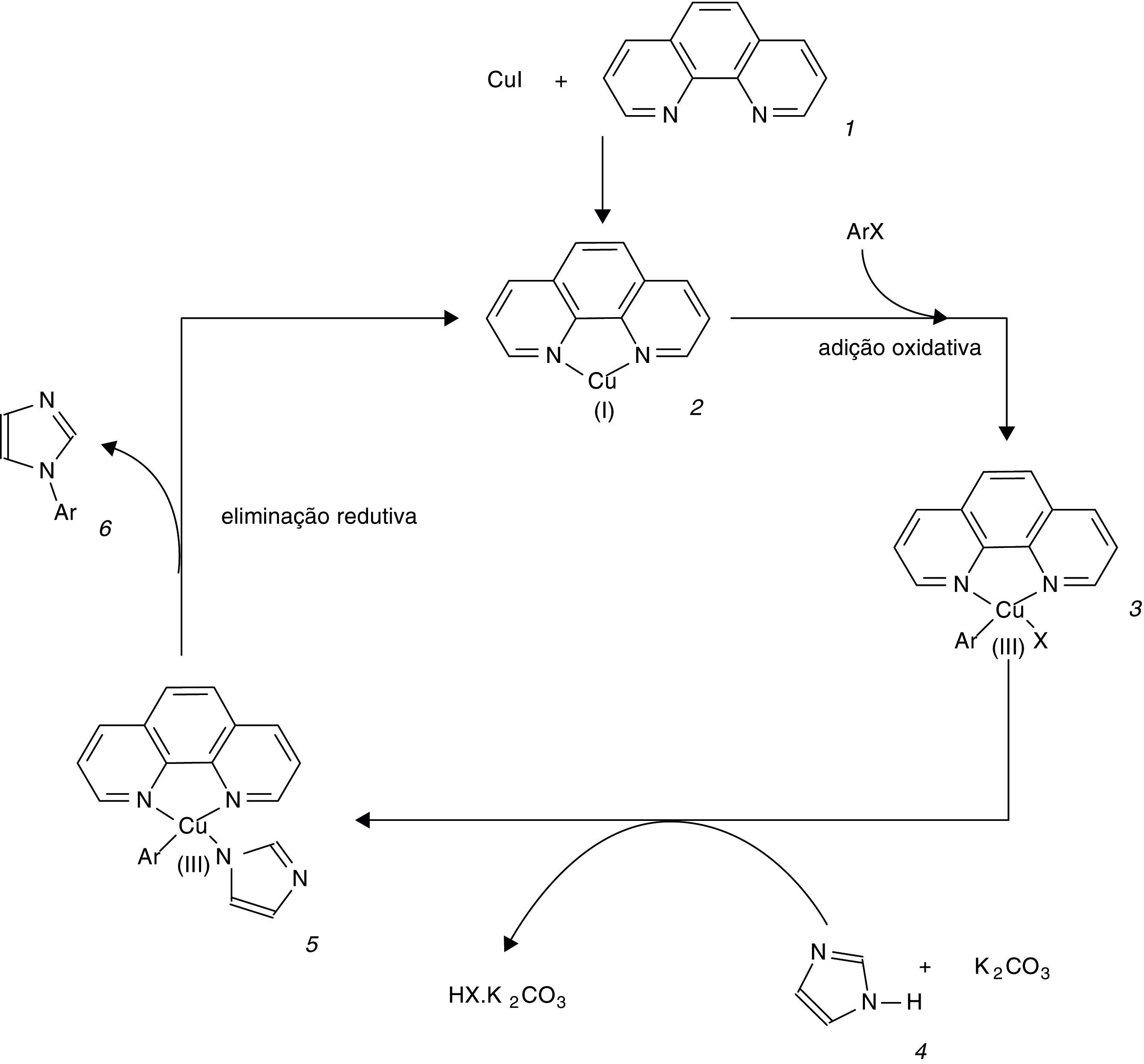
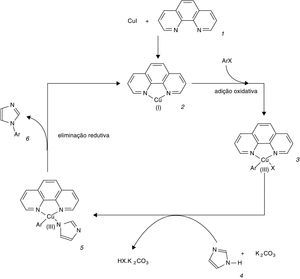
Com o sistema otimizado, testou‐se com os haletos 1‐cloro‐4‐iodobenzeno e 1‐bromo‐4‐nitrobenzeno, resultando após 50h de reação nos rendimentos de 98 e 87%, respectivamente. Assim, o sistema aqui relatado mostra capacidade de operar com diferentes grupos substituintes no anel aromático do haleto de arila. O mecanismo plausível para o sistema desenvolvido (fig. 3) é baseado na adição oxidativa do haleto de arila ArX no complexo 2 de Cu(I) com 1.10‐fenantrolina 1, gerando o intermediário 3 contendo Cu(III) (Giri e Hartwig, 2010). Pela ação da base K2CO3 e do imidazol 4 ocorre a substituição do halogeneto X de 3 pelo radical aromático produzido por 4, formando um novo intermediário 5 contendo Cu(III). Na última etapa do ciclo catalítico ocorre a eliminação redutiva de 5 gerando o produto de acoplamento 6 e regenerando o complexo 2 de Cu(I). Essa proposta se encontra fundamentada na capacidade dos cátions Cu de formar quelatos com os átomos de nitrogênio do ligante 1.10‐fenantrolina (Giri e Hartwig, 2010; Greenstein e Winitz, 1961), resultando em espécies de Cu mais reativas na adição oxidativa e/ou intermediários mais estáveis do que o metal sem o ligante auxiliar.
A ordem de velocidade dos haletos de arila na etapa de adição oxidativa evidenciada é I>Br, fato esse comprovado pelo maior tempo necessário para o acoplamento de 1‐bromo‐4‐nitrobenzeno (50h). Grupos substituintes eletrodoadores (OCH3, CH3) no anel benzênico deverão dificultar a referida etapa do acoplamento, implicando num maior tempo reacional. Para cloretos de arila a reação não foi testada, entretanto, o rendimento previsto deverá ser baixo, se o acoplamento ocorrer.
Aula práticaO tema catálise é interdisciplinar, portanto o experimento pode ser usado em disciplinas experimentais de Química Orgânica, Inorgânica ou Físico‐Química. Como é proposta a realização de 8 experimentos, sugere‐se a divisão das turmas em pelos menos 8 grupos para cada grupo realizar o experimento em uma condição diferente. A dinâmica de execução da atividade prática deve seguir o formato de miniprojeto de investigação de 4 semanas: semana 1 – explanação teórica (sala de aula); semana 2 ‐ montagem da reação (laboratório de química); semana 3 – determinação do rendimento reacional (laboratório de química); e semana 4 – tratamento estatístico dos dados obtidos experimentalmente (laboratório de informática). Visto que os tempos reacionais são longos (23 e 48h), os membros do grupo de trabalho deverão retirar a reação num horário extra ao da aula.
ConclusãoComo mencionado anteriormente, a falta de orientação didática sobre a aplicação do planejamento experimental no desenvolvimento de sistemas catalíticos é visível. Assim, a síntese orgânica catalítica por acoplamentos cruzados ainda é pouco vista nas universidades por um preconceito infundado de ser algo difícil e extremamente oneroso. Referente ao sistema catalítico em estudo, verificou‐se sua eficiência na N‐arilação do imidazol por iodetos e brometos de arila, mesmo em condições adversas tais como: reagentes sem prévia purificação ou secagem e isenção de atmosfera inerte. Dessa forma, usando o software Microsoft Office Excel foi possível desmistificar tanto o desenvolvimento do sistema catalítico quanto as técnicas de planejamento experimental, servindo tal tutorial apresentado de suporte para futuros estudos.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Os autores agradecem ao CNPq e FAPERGS pelo suporte financeiro.
O material suplementar refere‐se ao espectro de massa do produto isolado 1‐(4‐metilfenil)‐1H‐imidazol (Figura 1S), bem como, às planilhas do software Excel (Figuras 2S e 3S) utilizadas na construção das tabelas 3 e 6, e está disponível na forma de arquivo PDF, com acesso livre.
A revisão por pares é da responsabilidade da Universidad Nacional Autónoma de México.