The dehydration of alcohols to obtain alkenes is commonly performed in the presence of an acid as the catalyst at high temperature. This reaction is an important method in basic Organic Chemistry. Green Chemistry pursues the chemical production of compounds preventing the generation of hazardous waste, as well as minimizing the impacts to health and the environment. In this sense, the incorporation of the most of the principles of the Green Chemistry into the teaching of undergraduate lab-work is now desirable. Thus, the goal of this work is to offer an interesting green approach for the reaction of alcohol dehydration using as, primary alcohols: 1-heptanol and 1-octanol; as secondary alcohols: cyclohexanol and 2-methylcyclohexanol, and as tertiary alcohol 1-methylcyclohexanol, using an activated bentonitic clay (Tonsil) as the catalyst. The reactions proceed with good yields and shorter times.
La deshidratación de alcoholes es un método ampliamente utilizado para obtener alquenos; sin embargo, la reacción requiere de un medio ácido y temperaturas elevadas, siendo esta reacción un ejemplo obligado en la enseñanza de la química de los compuestos orgánicos y que ha formado parte de los cursos de laboratorio durante muchos años.
Los alquenos, frecuentemente llamados olefinas, son hidrocarburos insaturados que pueden ser acíclicos y cíclicos. Se caracterizan por tener al menos un doble enlace con cero a cuatro sustituyentes y, dependiendo de éstos, pueden formar estereoisómeros. El doble enlace se encuentra formado por un enlace σ y uno π. Este doble enlace puede favorecer diferentes reacciones de adición, muy útiles para la construcción de una gran cantidad de compuestos de interés biológico e industrial.
Una nueva visión de la enseñanza de la química orgánica se dirige a la aplicación de los principios de la Química Verde; es decir, realizar transformaciones químicas con un mínimo de residuos peligrosos —o sin generarlos—, y en lo general con un menor impacto en el ambiente.
Es bien conocido que en algunos cursos experimentales se han incorporado métodos sistemáticos para tratamiento de residuos (Ávila et al., 2001), como una medida de control, que no de prevención. En este trabajo se proponen una serie de experimentos bajo la filosofía de la Química Verde, en los cuales no se generan residuos peligrosos, evitando con esto los impactos en la salud y en el ambiente.
Nuestra propuesta considera la deshidratación de alcoholes (primarios, secundarios y un terciario) en la que se aplican algunos de los 12 principios fundamentales de la filosofía de la Química Verde (Anastas and Warner, 2000), de tal manera que el alumno vea que sí es posible hacer química limpia.
AntecedentesA continuación se describen algunos métodos de deshidratación de alcoholes primarios en los cuales se ha obtenido el correspondiente alqueno; para el caso del 1-heptanol se usaron: a) alta temperatura y silicatos de aluminio (Ballantine et al., 1984); b) Al2O3 como catalizador y 310 °C de temperatura (Blouri et al., 1967), y c) un proceso heterogéneo en fase vapor sobre alúmina activada (Appleby et al., 1967). Otros métodos con los que se obtiene el 1-octeno a partir del 1-octanol: d) colocar el alcohol en presencia de Al2O3 a 350 °C (Komarewsky et al., 1945), y e) utilizar silicatos de aluminio y silicatos de aluminio que contienen platino (Shchekin, 1952).
Uno de los alquenos sintetizados más frecuentemente en el laboratorio de enseñanza experimental de Química Orgánica es el ciclohexeno, cuya obtención se informó a partir de diferentes métodos: a) utilizando como catalizador Cu-ZnO/ SiO2 en un reactor de flujo continuo en fase gas (Ji et al., 2007); b) en otro caso el catalizador es a base de tierras raras superácidas SO42- / TiO2-Nd2O3 en reflujo (Fang et al., 2007); c) con ácido fosfotúngstico soportado sobre carbón activado como catalizador (Rongxuan, 2006); d) aplicando un líquido iónico el cual contiene un ácido de Brönsted (Fang et al., 2006); e) ácido fosfotúngstico soportado sobre carbón activado irradiando con microondas (Yuan et al., 2005); f) en dióxido de carbono supercrítico catalizado por polioxometalato H5PV2Mo10O40 (Mallan et al., 2006); g) CuCl2 en agua supercrítica (Crittendon and Parsons, 1994).
La deshidratación de otro alcohol secundario, como el 2-metilciclohexanol, se ha descrito por diferentes métodos, de los cuales destacamos los siguientes: a) el uso de un radical catiónico (Shine et al., 1992); b) la reacción por microondas con zeolitas (Ipaktschi and Brueck, 1990); c) también se ha efectuado la deshidratación catalizada por sulfato de cobre (II) sobre gel de sílice (Nishiguchi et al., 1987); d) la formación de olefinas se puede efectuar por la pirolisis de carbamatos (Atkinson et al., 1981), o bien, e) utilizando sulfuranos (Martin and Arhart, 1971).
Para el caso de la deshidratación de un alcohol terciario se informa la deshidratación del 1-metilciclohexanol, el cual se transforma a la olefina correspondiente bajo las siguientes condiciones: a) por la reacción de complejos de alil-Pd (Ryadinskaya et al., 2002); b) a través de un proceso heterogéneo gas-fosfatos (Johnstone et al., 2001); c) por un método suave y eficiente con una mezcla de cloruro de oxalilo, dimetilsulfóxido y trietilamina (Gleiter et al., 1996); d) utilizando triflato de cobre (II) (Laali et al., 1987).
Como podemos observar existe una gran variedad de métodos para obtener los alquenos a través de la deshidratación de los alcoholes correspondientes. Sin embargo, los métodos utilizan condiciones de reacción muy agresivas tales como altas temperaturas y catalizadores complejos, condiciones que no se pueden efectuar en los laboratorios de enseñanza experimental.
En este trabajo demostramos que se pueden obtener diferentes alquenos por la deshidratación de alcoholes en condiciones menos severas y mediante el uso de catalizadores menos complejos (química verde), utilizando equipo y reactivos de laboratorio de enseñanza experimental.
Desarrollo experimentalA continuación se describen los métodos desarrollados para la obtención de alquenos y los resultados obtenidos para cada caso. En primer lugar se presenta el método tradicional, en el que se utiliza como catalizador el ácido sulfúrico o ácido fosfórico; posteriormente se presenta la alternativa de química verde en la cual la deshidratación se efectuó catalizada con Tonsil SSP, el cual está formado por una serie de óxidos metálicos (SiO2, 73%; Al2O3, 9.1%; MgO, 2.9%; Na2O, 1.1%; Fe2O3, 2.7%; K2O, 1.0%; CaO, 2.0% y TiO2, 0.4%). Los dos catalizadores, ácido sulfúrico y Tonsil, se utilizaron en diferentes proporciones. En ambos casos se utilizaron alcoholes primarios y secundarios, y sólo se utilizó el Tonsil para el terciarios (figura 1).
Alcoholes primariosReacción de deshidratación de 1-heptanola) Método tradicional
En el método tradicional debe considerarse que el ácido sulfúrico usado como catalizador se descompone en trióxido de azufre, el cual es un gas muy tóxico, de ahí que sea necesario atraparlo en una solución de hidróxido de sodio
b) Método verde
Reacción de deshidratación de 1-octanolb) Método verde
Alcoholes secundariosReacción de deshidratación de ciclohexanola) Método tradicional
b) Método verde
Reacción de deshidratación de 2-metilciclohexanola) Método tradicional
b) Método verde
Alcohol terciarioReacción de deshidratación de 1-metilciclohexanola) Método tradicional
b) Método verde
Análisis de resultadosComo se observa en la deshidratación de alcoholes primarios, la formación de 1-hepteno es de 70.5% con el método tradicional y de 82.2% con el método verde (tabla 1); asimismo, se lograron resultados semejantes en la obtención de 1-octeno, formándose 7.3% y 65.5% respectivamente (tabla 2). En ambos alquenos se consiguen los mejores resultados con el método verde.
Condiciones experimentales para el heptanol.
| Heptanol (mL) | Tonsil (g) | Modalidad | Tiempo (min) | Temperatura(°C) | Alqueno (mL) | Rendimiento(%) |
|---|---|---|---|---|---|---|
| 4 | — | a) Método tradicional | 120 | 60-76 | 2.1 | 52.87 |
| 4 | — | a) Método tradicional | 120 | 60-65 | 2.8 | 70.49 |
| 4.8 | 0.48 | Reflujo + destilación fraccionada | 90 + 70 | 85-90 | 4 | 82.23 |
| 4 | 2.00 | Reflujo + destilación fraccionada | 90 + 70 | 89 | 2.9 | 73.01 |
Condiciones experimentales para el octanol.
| Octanol (mL) | Tonsil (g) | Modalidad | Tiempo (min) | Temperatura (°C) | Alqueno (mL) | Rendimiento(%) |
|---|---|---|---|---|---|---|
| 4 | — | a) Método tradicional | 120 | 135-150 | 0.3 | 7.36 |
| 4.8 | 0.24 | Reflujo + destilación fraccionada | 90 + 70 | 115-120 | 3.2 | 65.48 |
| 4 | 2.00 | Reflujo + destilación fraccionada | 90 + 70 | 94-140 | 2.1 | 51 |
En la deshidratación de alcoholes secundarios, el ciclohexanol (tabla 3) presenta rendimientos de 30.8% y 81.2% con el método tradicional y el verde respectivamente, con tiempos más cortos para el segundo. Con estos resultados se observó que los mejores rendimientos se lograron con el método verde, por lo que se decidió efectuar la deshidratación de otro alcohol secundario y un terciario sólo con el método verde. Así, para el 2-metilciclohexanol se logró un rendimiento de 74.97% del alqueno correspondiente (tabla 4). Finalmente se efectuó la deshidratación del alcohol terciario, 1-metilci-clohexanol, con la obtención del alqueno correspondiente (tabla 5), en el que se observó un rendimiento de 73.1% en tiempo semejante al de los alcoholes secundarios. También es notable que la cantidad de catalizador fue la mínima necesaria para poder realizar eficientemente la deshidratación, excepto en el caso de 1-heptanol (tabla 1), en la que se utilizaron 0.48 g.
Condiciones experimentales para el ciclohexanol.
| Ciclohexanol(mL) | Tonsil (g) | Modalidad | Tiempo (min) | Temperatura(°C) | Alqueno (mL) | Rendimiento(%) |
|---|---|---|---|---|---|---|
| 10 | — | Método tradicional | — | 70-90 | 3 | 30.8 |
| 4.8 | 0.239 | Reflujo | 90 | 30 | 1 | 21.39 |
| 4.8 | 0.243 | Destilación fraccionada | 90 | 70-85 | 2.1 | 44.92 |
| 4.8 | 0.239 | Destilación simple | 40 | 60-140 | 1.8 | 38.50 |
| 4.8 | 0.244 | Reflujo + Destilación simple | 90 + 40 | 70-95 | 3.1 | 66.30 |
| 4.8 | 0.241 | Reflujo + Destilación fraccionada | 90 + 70 | 75-90 | 3.4 | 72.72 |
| 4.8 | 0.240 | Reflujo + Destilación fraccionada | 90 + 70 | 60-72 | 3.8 | 81.28 |
| 4.8 | 0.240 | Reflujo + Destilación fraccionada | 90 + 70 | 60-72 | 3.55 | 75.93 |
Condiciones experimentales para el 2-metilciclohexanol.*
| 2-metilci-clohexanol(mL) | Tonsil (g) | Modalidad | Tiempo (min) | Temperatura(°C) | Alqueno (mL) | Rendimiento(%) |
|---|---|---|---|---|---|---|
| 4 | 0.240 | Reflujo + destilación fraccionada | 90+70 | 72 | 2.3 | 59.44 |
| 4 | 0.243 | Reflujo + destilación fraccionada | 90+70 | 70 - 79 | 2.9 | 74.97 |
Condiciones experimentales para el 1-metilciclohexanol.*
| 1-metilci-clohexanol(mL) | Tonsil (g) | Modalidad | Tiempo (min) | Temperatura (°C) | Alqueno (mL) | Rendimiento(%) |
|---|---|---|---|---|---|---|
| 4 | 0.24 | Reflujo + destilación fraccionada | 90 + 70 | 80-85 | 2.3 | 60.10 |
| 4 | 0.24 | Reflujo + destilación fraccionada | 90 + 70 | 78-80 | 2.4 | 62.71 |
| 4 | 0.245 | Reflujo + destilación fraccionada | 90 + 70 | 74-80 | 2.8 | 73.17 |
Como parte de la aplicación de los principios de Química Verde se debe considerar que en una reacción se alcance la máxima transformación, midiendo la eficacia y la eficiencia de ésta en términos porcentuales de rendimiento; en otras palabras, conocer la economía atómica (Cann, 2009), de tal manera que se evalúe la ruta que genera menos residuos y con mayor porcentaje de transformación.
A continuación mostramos un proceso de cálculo de economía atómica para la deshidratación de ciclohexanol en la obtención de ciclohexeno; consideramos tres casos utilizando como catalizadores: ácido sulfúrico, ácido fosfórico y Tonsil, en los cuales se evaluaron los rendimientos de economía atómica tanto teóricos como experimentales.
% de economía atómica = (PM de átomos utilizados / PM de reactivos) × 100
% de economía atómica = (82.15 / 198.15) × 100 = (41.45) 42%
Dado que la cantidad de ácido sulfúrico es catalítica, el modelo de la economía atómica no refleja una realidad experimental, por lo que necesitamos el dato de economía atómica experimental.
| Total | |||
|---|---|---|---|
| Fórmula de reactivos | C6H12O | H2SO4 | 6C, 14H, 5O |
| Peso de reactivos (PM) (moles usados) | (100.15)(0.094) = 9.48 | (98)(0.0091) = 0.9 | 10.38 |
| Átomos utilizados | 6C, 10H | — | 6C, 10H |
| Peso de átomos utilizados (PM)(moles) | (82.15)(0.094) = 7.7 | 0.0 | 7.7 |
| Átomos no utilizados | 2H, O | 2H, 4O, S | 4H, 5O, S |
| Peso de átomos no utilizados (PM)(moles) | (18)(0.094) = 1.7 | (98)(0.009) = 0.9 catalizador | 2.6 |
EAE = % Economía atómica experimental = (Rendimiento teórico/masa total de reactivos) × 100
EAE = % Economía atómica experimental = (Masa de reactivos utilizados en el producto deseado / masa total los reactivos) × 100
EAE = (7.7 g / 10.38 g) × 100 = 74%
%RE = % Rendimiento experimental = (Rendimiento obtenido / Rendimiento teórico) × 100
(%RE)(EAE) = (Rendimiento obtenido / Rendimiento teórico) (Rendimiento teórico/masa total de todos los reactivos)
(%RE)(EAE) = (Rendimiento obtenido / masa total de todos los reactivos) × 100
(%RE)(EAE) = (2.4 /10.38) 100 = 23%
Como se puede observar, este último valor de la masa del producto deseado obtenida experimentalmente, dividida entre la masa total de todos los reactivos, proporciona un dato más congruente experimentalmente que hace reflexionar. Así, surge la duda de si ésta es una medida de la eficiencia real de la reacción, ya que el rendimiento es pobre y el porcentaje restante de átomos involucrados, el 67%, se encuentra en los residuos de la reacción, constituidos en su mayor parte por ácido sulfúrico; debido a las condiciones de la reacción, éste se descompone propiciando la liberación de SO3, el cual se trata con una trampa de hidróxido de sodio. En resumen, la reacción no es eficiente y, además, es un método poco amigable con el medio ambiente.
Para mejorar esta situación puede cambiarse el catalizador y utilizar el ácido fosfórico (H3PO4). Con esta modificación se realizan nuevamente los cálculos de economía atómica.
% de Economía atómica = (PM de átomos utilizados / PM de reactivos) × 100
% de Economía atómica = (82.15 / 198.15) × 100 = (41.45) 42%
Como se observa claramente, el cálculo directo de la economía atómica nos proporciona el mismo valor utilizando tanto ácido sulfúrico como ácido fosfórico; necesitamos el valor experimental para tener un valor real de la eficiencia del proceso.
Ahora necesitamos el dato de economía atómica experimental.
| Total | |||
|---|---|---|---|
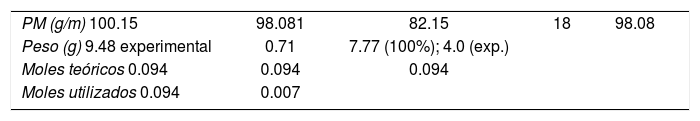
| Fórmula de reactivos | C6H12O | H3PO4 | 6C, 15H, 5O |
| Peso de reactivos (PM) (moles usados) | (100.15)(0.094) = 9.48 | (98)(0.007) = 0.71 | 10.19 |
| Átomos utilizados | 6C, 10H | — | 6C, 10H |
| Peso de átomos utilizados (PM)(moles) | (82.15)(0.094) = 7.7 | 0.0 | 7.7 |
| Átomos no utilizados | 2H, O | 3H, 4O, P | 4H, 5O, P |
| Peso de átomos no utilizados (PM)(moles) | (18)(0.094) = 1.7 | (98)(0.007) = 0.71 catalizador | 2.41 |
EAE = % Economía atómica experimental = (Rendimiento teórico/masa total de reactivos) × 100
EAE = % Economía atómica experimental = (Masa de reactivos utilizados en el producto deseado / masa total de reactivos) × 100
EAE = (7.7 g / 10.19 g) × 100 = 76%
%RE = % Rendimiento experimental = (Rendimiento obtenido / Rendimiento teórico) × 100
(%RE)(EAE) = (Rendimiento obtenido / Rendimiento teórico) (Rendimiento teórico / masa total de todos los reactivos)
(%RE)(EAE) = (Rendimiento obtenido / masa total de todos los reactivos) × 100
(%RE)(EAE) = (4.0 / 10.19) 100 = 39%
El cambio de ácido fosfórico sí modificó sustancialmente la eficiencia atómica experimental y, mejor aún, en las condiciones de reacción no libera gases ácidos de descomposición; es decir, es un residuo más sencillo de manejar y tratar mediante una neutralización.
Ahora bien, ¿se puede mejorar este método para no sólo hacer más eficiente la reacción de deshidratación sino también utilizar un catalizador que no se descomponga y que no genere residuos que requieran un tratamiento posterior a su uso?
Después de explorar esta situación se procedió a la tarea de cambiar el ácido fuerte a un catalizador, el cual cumpliera las condiciones anteriores y se logró encontrar que el Tonsil SSP, formado por una serie de óxidos metálicos (SiO2, 73%; Al2O3, 9.1%; MgO, 2.9%; Na2O, 1.1%; Fe2O3, 2.7%; K2O, 1.0%; CaO, 2.0% y TiO2, 0.4%) en proporciones definidas es una buena opción, además de que en suspensión acuosa presenta pH ácido. A continuación se muestran los resultados.
| Fórmula de reactivos | C6H12O | Tonsil SSP | 6C, 12H, O Tonsil (cat) |
| Peso molecular | 100.15 | 393.36 | 493.51 |
| Átomos utilizados | 6C, 10H | — | 6C, 10H |
| PM de átomos utilizados | 82.15 | 0.0 | 82.15 |
| Átomos no utilizados | 2H, O | Tonsil | 2H, O, Tonsil |
| Peso de átomos no utilizados (PM)(moles) | 18 | 393.36 | 511.51 |
Tonsil SSP: peso molecular porcentual 393.36.
% de Economía atómica = (PM de átomos utilizados / PM de reactivos) × 100
% de Economía atómica = (82.15 / 393.36) × 100 = (20.88) 21%
Economía atómica experimental
| Total | |||
|---|---|---|---|
| Fórmula de reactivos | C6H12O | Tonsil SSP | 6C, 12H, O Tonsil |
| Peso de reactivos (PM) (moles usados) | (100.15)(0.094) = 9.48 | (98)(0.0012) = 0.5 | 9.98 |
| Átomos utilizados | 6C, 10H | — | 6C, 10H |
| Peso de átomos utilizados (PM)(moles) | (82.15)(0.094) = 7.7 | 0.0 | 7.7 |
| Átomos no utilizados | 2H, O | 2H, O, Tonsil | 2H, O, Tonsil |
| Peso de átomos no utilizados (PM)(moles) | (18)(0.094) = 1.7 | (98)(0.0012) = 0.5 catalizador | 2.2 |
EAE = % Economía atómica experimental = (Rendimiento teórico / masa total de reactivos) × 100
EAE = % Economía atómica experimental = (Masa de reactivos utilizados en el producto deseado / masa total de reactivos) × 100
EAE = (7.7 g / 9.98 g) × 100 = 77.2%
%RE = % Rendimiento experimental = (Rendimiento obtenido/Rendimiento teórico) × 100
(%RE)(EAE) = (Rendimiento obtenido / Rendimiento teórico) (Rendimiento teórico / masa total de todos los reactivos)
(%RE)(EAE) = (Rendimiento obtenido / masa total de todos los reactivos) × 100
(%RE)(EAE)= (6.40 / 9.98) 100 = 64.2%
Este último procedimiento de la deshidratación resulta ser el mejor no sólo porque el catalizador es no tóxico y no necesita de ningún tratamiento para su desecho, sino porque es el que presenta mayor eficiencia real.
Es decir el proceso es el más amigable con el ambiente de los tres métodos desarrollados experimentalmente, así que podemos asegurar, de acuerdo con los resultados, que la deshidratación de alcoholes con Tonsil es efectivamente un proceso de deshidratación verde. El catalizador se puede recuperar secándolo después de usarlo, en una estufa a 150 °C por cuatro horas. Además, es conveniente señalar que el Tonsil SSP es un producto comercial económico.
A continuación se describen en forma resumida los pasos generales de los dos métodos desarrollados para la obtención de alquenos: 1) por el método tradicional, utilizando como catalizador ácido sulfúrico o fosfórico, y 2) la nueva alternativa de Química Verde, en la cual se efectuó la deshidratación utilizando Tonsil como catalizador.
1) Método tradicional
- a)
Montar un equipo de reflujo directo.
- b)
Mezclar en un matraz de bola de 25 mL: ácido sulfúrico 98% (0.9 g, 0.5 mL, ρ = 1.8 g / cm3) o ácido fosfórico 85% (0.71 g, 0.42 mL, ρ = 1.68 g / cm3) y el alcohol seleccionado de acuerdo con las cantidades señaladas en las tablas 1 a 3.
- c)
Agitar la mezcla con ayuda de una parrilla con agitación y calentamiento.
- d)
Calentar a reflujo durante 90 min.
- e)
Montar un equipo de destilación fraccionada.
- f)
Calentar moderadamente y recibir el destilado en un matraz Erlenmeyer enfriando en baño de hielo.
- g)
Suspender el calentamiento cuando quede en el matraz de bola un pequeño residuo líquido, o cuando aparezcan vapores blancos producto de la descomposición de la mezcla de reacción.
- h)
Saturar el destilado con cloruro de sodio y decantar en un embudo de separación.
- i)
Lavar 3 veces con una solución de bicarbonato de sodio al 5%, empleando porciones de 5 mL cada vez.
- j)
Recibir la fase orgánica en un matraz enfriando en un baño de hielo.
- k)
Secar con sulfato de sodio anhidro y decantar (la fase orgánica es el alqueno correspondiente).
- l)
El residuo de la reacción es un líquido negro (índica la descomposición de la materia orgánica), el cual se deberá tratar con medio básico hasta neutralización.
2) Método verde
a) Montar un equipo de reflujo directo.
b) Colocar en un matraz de bola de 25 mL, el alcohol seleccionado y el catalizador de acuerdo con las cantidades señaladas en las tablas 1 a 5.
Repetir los incisos (c) al (f) del método tradicional.
g) Suspender el calentamiento cuando queden en el matraz de bola un pequeño residuo líquido y el catalizador.
h) Secar el destilado con sulfato de sodio y decantar (la fase orgánica es el alqueno correspondiente).
Efectuar la identificación de los productos obtenidos de acuerdo con la disponibilidad de recursos:
1. Técnicas instrumentales:
- a)
Espectrofotometría de infrarrojo.
- b)
Resonancia magnética nuclear.
2. Pruebas a la gota (considerar la toxicidad de los reactivos).
- a)
Solución de Br2/CCl4
- b)
Solución de KMnO4/agua.
Sí es posible hacer propuestas de experimentos de Química Orgánica con enfoque de Química Verde, que son eficientes, viables y factibles de llevarse a cabo con la infraestructura actual de los laboratorios de enseñanza, proporcionando a los estudiantes ejemplos reales de que la filosofía de la Química Verde se puede llevar a la práctica fortaleciendo el proceso enseñanza aprendizaje.
Los principios de Química Verde que se cumplieron en los experimentos propuestos, apegados a los descritos en la literatura (Anastas and Warner, 2000), se resumen a continuación:
- 1.
Se evitó la generación de residuos peligrosos ya que sólo se genera agua.
- 2.
La economía atómica es mejor que el método tradicional.
- 3.
Con el diseño adecuado del experimento se eliminó la generación de residuos tóxicos.
- 4.
Se utilizaron sustancias seguras; las materias primas son de baja toxicidad.
- 5.
Se eliminó el uso del disolvente (recordar que la identificación se puede hacer sin el uso de disolventes).
- 6.
No se cumple ya que los productos se obtienen por destilación, la cual consume energía.
- 7.
El Tonsil es un producto comercial utilizado para la clarificación de aceites comestibles, es una materia prima renovable, aunque los alcoholes no lo son.
- 8.
Los experimentos propuestos no generan productos intermediarios, la transformación es directa.
- 9.
El Tonsil es un catalizador que proporciona la acidez requerida para la deshidratación de alcoholes permitiendo su reutilización.
- 10.
Los productos obtenidos son alquenos que potencialmente son materias primas para otras transformaciones (incluso para obtener el mismo alcohol que lo generó).
- 11.
Los experimentos que se proponen pueden monitorear la transformación sólo mediante los puntos de ebullición.
- 12.
El proceso de elección es un método seguro ya que se elimina el uso de ácidos fuertes que con frecuencia provocan quemaduras en su manipulación.
Este trabajo fue desarrollado en la Facultad de Química, unam, con el financiamiento del proyecto papime: pe 204306, unam.