Por este medio me permito felicitar a todo el equipo que hace posible a Educación Química, por su reciente inclusión en Scopus. Ello se debe sin lugar a dudas, al gran liderazgo que ejerces en todos nosotros y a los más de 22 años que le has dedicado a la revista, hecho que la ha llevado a ser una de las mejores en América Latina, en lo que a enseñanza de la química se refiere.
Al mismo tiempo, el reconocimiento de Scopus nos obliga a ser más cuidadosos con la escritura, la selección, la revisión y la edición de los artículos que publicamos. Por esa razón me atrevo a comentarte que he detectado algunos errores en el artículo “Um estudo em química analítica e a identificação de cátions do grupo III”, que apareció en las páginas 32 a 37, del número 1, volumen 22, de enero de 2011, firmado por Dantas, da Silva y dos Santos (Dantas et al., 2011), quienes debieron corregirlos durante la escritura, el arbitraje y/o las pruebas de imprenta del artículo.
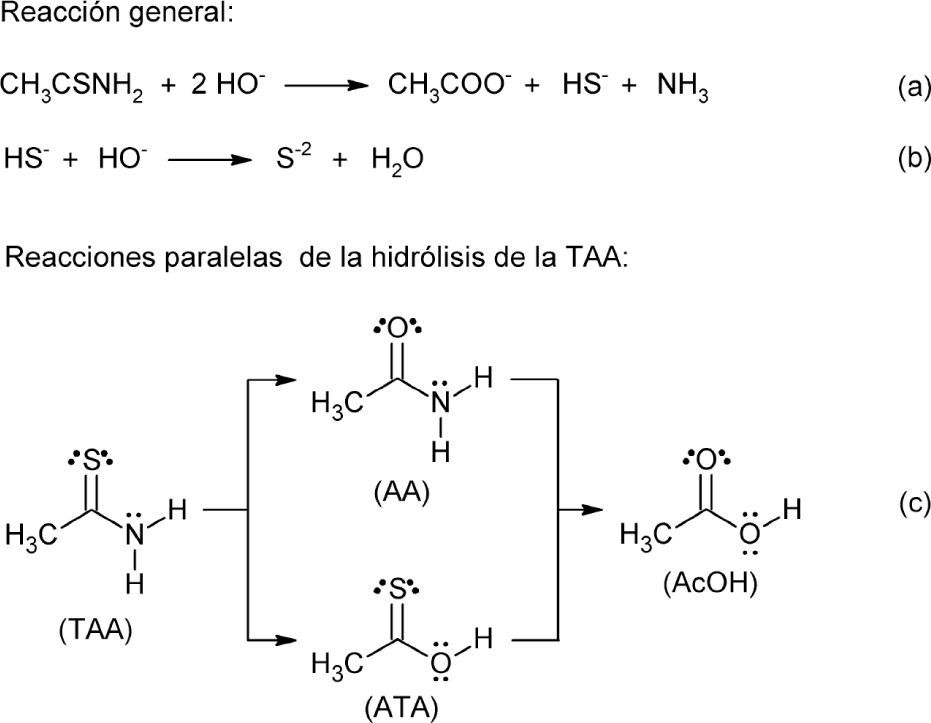
Dado que el objetivo de dicho artículo es servir como material de apoyo para un aprendizaje razonado, en este caso de una actividad experimental, los puntos tratados en él deben ser lo más claros posible para los alumnos. Eso no se ve reflejado en el “mecanismo simplificado para reação de tioacetamida en meio alcalino” que los autores describen en la página 36.
En su definición más sencilla, un mecanismo de reacción es la secuencia de etapas más simples (reacciones elementales) que ocurren en la transformación de reactivos a productos (Atkins, 2008). Así, los químicos orgánicos gustamos de expresar dicho proceso mediante flechas curvadas que indican los desplazamientos electrónicos que provocan la ruptura y la formación de enlaces, considerando implícita o explícitamente, conceptos tales como carga formal, efecto inductivo, efecto de resonancia y balance de carga, entre otros. Varios de estos conceptos no se tomaron en cuenta en el mecanismo propuesto por los autores (esquema 1).
Obsérvese además, que en ese mecanismo se usaron dos grupos hidroxilo para realizar la hidrólisis de la tioacetamida, TAA, lo cual es incongruente con la estequiometria de la reacción general planteada, en la que se implica la participación de tres de ellos. Según varios autores (i. e.Buscarons, 1986; Hodes, 2002), la hidrólisis de un equivalente de tioacetamida consume dos equivalentes de hidróxido (esquema 2a), por lo que el tercer equivalente se utiliza en la reacción ácido-base con el HS– para liberar al anión S2– (esquema 2b) implicado en la precipitación de los cationes en estudio.
Ese mecanismo es más complicado de lo que parece a simple vista, pues experimentalmente se ha encontrado la existencia de dos reacciones competitivas que producen la acetamida, AA, y el ácido tioacético, ATA, como productos intermedios (esquema 2c). O. M. Peeters y C. J. De Renter demostraron que en medio ácido la reacción procede mayoritariamente a través de la hidrólisis del grupo tioxo, en tanto que E. A. Butler y colaboradores encontraron que en medio alcalino la hidrólisis transcurre mayoritariamente vía la hidrólisis del grupo amino (Butler, 1958; Peeters, 1976).
Así que retomando el espíritu del documento fuente y los datos obtenidos de la literatura, se puede reescribir el mecanismo, o mejor dicho, los mecanismos de la reacción de la TAA presentada en el esquema 2a, a través de las rutas (a) y (b) que implican las estructuras hipotéticas [1-7] y [1-2, 8-11, 7], respectivamente (esquema 3). Cabe mencionar que las estructuras 3 y 8 fueron propuestas originalmente por Peeters y que la ruta (b) es el mecanismo al que más se acerca el descrito por Dantas et al.
Asimismo, siento que es muy importante corregir las fórmulas usadas para describir la síntesis y la estructura del bis(dimetilglioximato)níquel(II) descritas en la ecuación 18, página 36, pues en ésta inexplicablemente aparecen hidrógenos divalentes (esquema 4a). Al respecto te comento que he encontrado estudiantes con este tipo de ideas alternativas, las cuales muchas veces se generan debido a que en los cursos de química general de bachillerato y de licenciatura, se hace más caso a la enseñanza de la nomenclatura que a la escritura de las fórmulas desarrolladas.
Cabe mencionar que el grado de información que proporcionan las fórmulas químicas es directamente proporcional a su grado de complejidad y que desafortunadamente la conectividad entre los átomos indicada por los autores es incorrecta en dicho esquema. Ya que para muchos es engorroso el uso de las fórmulas con mayor grado de desarrollo, en el esquema 4b se han cambiado a fórmulas de líneas, en donde las líneas punteadas indican los puentes de hidrógeno intramoleculares y las flechas indican los enlaces de coordinación ligante-metal, según la representación propuesta por Dhawan (2008).
Por otra parte, las ecuaciones de reacción 22-23 contienen errores que debieron corregirse en las pruebas de imprenta; específicamente me refiero a los números 2 y 3 de los iones nitrito y nitrato que deben ser subíndices (esquema 5A). No obstante, lo que me parece más grave es que en esas ecuaciones se presenta la ionización del ácido nitroso, HNO2, a voluntad (4H+ + NO2 – y 2H+ + NO2–) para lograr el balance de materia, cosa que de ninguna manera se cumple en la ecuación 24. En esa misma ecuación tampoco se logra el balance de carga, ni con los 14e– agregados artificialmente por los autores, como si se tratara de una reacción electroquímica. Hay que recordar que esos electrones provienen de la reducción del plomo contenido en el PbO2 y que con balancear la ecuación es más que suficiente para lograr el balance de carga.
Al intentar corregir las ecuaciones 22 y 23, me di cuenta de que hay una inconsistencia entre lo dicho en el texto y lo indicado en el diagrama de flujo presentado en la figura 1 de su artículo, en el que no se muestra el uso de HNO2 (un gas poco estable que debe generarse in situ) sino de HNO3. A falta de una técnica experimental precisa, encontré en la literatura que el Mn(OH)2 obtenido en el paso anterior, se disuelve en HNO3 para dar Mn(NO3)2, el cual posteriormente se calienta en presencia de PbO2 para favorecer la oxidación del Mn+2 a Mn+7. La presencia de una coloración violeta debida al ión MnO4– al enfriarse la solución es prueba positiva para el ión Mn+2 (Eagleson, 1994; Satake, 2003; Tata, 2009). Por lo tanto, las ecuaciones correspondientes serían (esquema 5B).
La reacción 5B.b se ha dejado intencionalmente sin balancear para invitar a los estudiantes a resolver el problema de balanceo por el método de ión electrón, tomando como base las ecuaciones redox 5B.c-d. Una vez resuelto el problema, el balanceo se puede comprobar mediante el uso del programa “On-line balancer” del portal WebQC.Org (Vanovschi, 2011).
En contraste, las ecuaciones 14 y 15 (esquema 6A) que parecen tener el mismo problema, pueden ser explicadas si se consideran las reacciones completas (esquema 6B: Ahluwalia, 2005).
Otros detalles menores, si se quiere hasta insignificantes, como la presencia y omisión de un signo menos para expresar respectivamente, unidades de tiempo en s–1 (primera columna, cuarto párrafo, p. 36) y al anión permanganato como MnO4 (segunda columna, primer párrafo, p. 37), también pudieron haberse evitado.
Finalmente, me permito manifestarte un par de reflexiones. La primera es recordar a los alumnos que deben hacer lecturas críticas que les permitan detectar errores que, por un motivo o por otro, siempre aparecen en los libros de texto y otros documentos formales; el segundo es recomendar a los profesores dedicados a la investigación para la educación, que no sólo atiendan a los discursos de los líderes en educación: desde mi punto de vista, antes que todo, el conocimiento disciplinario debe quedarles claro.
Rio Grande do Norte, 30 de junho de 2011 Ilmo. Sr. Andoni Garritz Diretor de Educación Química
Dirijo-me a V. Sa. a fim de comentar alguns aspectos sobre o artigo “Um Estudo em Química Analítica e a Identificação de Cátions do Grupo III” publicado no número 1 do volume 22 desta revista, bem como os comentários que constam na carta “Precisiones al artículo” do Sr. Aarón Pérez Benítez dirigida ao Diretor desta revista. Inicialmente, gostaríamos de agradecer pelos comentários emitidos nesta carta e pela leitura minuciosa feita pelo autor da mesma. Lamentavelmente, erros de simbologia e representação de fórmulas estruturais não foram detectados nas provas de impressão do artigo; infelizmente, estes erros permaneceram até a impressão final da revista e devem ser corrigidos através de uma errata. Concordamos plenamente com o autor da carta quando afirma que o conhecimento químico deve estar acima de tudo e deve se sobrepor ao discurso de alguns líderes em educação. Mesmo assim, alguns trechos da carta merecem algum comentário.
Na figura 2, em que a carga negativa encontra-se no átomo de enxofre e não no nitrogênio, o que pretendemos mostrar ao leitor foi apenas uma idéia simplificada de como ocorre a hidrólise da tioacetamida em meio básico. Imaginamos que como esta reação já fora discutida, não seria necessário repetir os mesmos argumentos já descritos na literatura, mas apenas e tão somente ilustrar os passos importantes de como a tioacetamida é convertida no correspondente acetato. Por esta razão, o passo em que o terceiro hidróxido é consumido foi omitido. Observe que na seqüência de reações mostradas no esquema 3 da carta, o autor utiliza-se desta mesma estratégia e mostra o consumo de apenas dois hidróxidos, e que na passagem de (8) para (9) a dupla deve se formar com o oxigênio e não com o enxofre. Não pretendemos desmerecer o comentário, mas apenas reiterar que esta é uma prática muito comum, uma vez que o foco do trabalho não é a discussão minuciosa deste mecanismo, já descrito na literatura. Por isso, cremos que o mesmo possa permanecer desta forma simplificada.
Com relação à equação 18, na página 36, desafortunadamente, a mesma aparece com erros que deverão ser corrigidos na errata. Concordamos que a representação mostrada no esquema 4b seja a mais adequada tanto para o reagente quanto para os produtos. Entretanto, gostaríamos de salientar que optamos por não representar a coordenação do ligante ao metal através de flechas porque acreditamos que isto acaba confundindo os alunos. A ligação covalente entre estas espécies, tratada tanto pela teoria da ligação de valência quanto pela teoria do orbital molecular, não deve ser diferenciada de qualquer outro tipo de ligação covalente, independentemente da origem dos elétrons envolvidos na mesma. Por outro lado, a ligação hidrogênio continua sendo representada por linhas pontilhadas, como aparece em todos os livros didáticos.
As equações 22-24 serão corrigidas na errata, enquanto que as equações 14 e 15 permanecem da mesma forma, pois estão corretas.
Finalmente, gostaria mais uma vez de agradecer a leitura criteriosa feita em nosso trabalho e lamentar o fato destas incorreções terem passado pela minha correção final feita no manuscrito. Espero ter esclarecido o nosso ponto de vista e satisfeito as sugestões apresentadas na carta. Sendo o que se apresenta para o momento, Atenciosamente, Josivânia Marisa Dantas
El siguiente artículo requiere considerar las correcciones señaladas más abajo: Dantas, Josivânia Marisa; Silva, Márcia Gorette Lima da; y Santos Filho, Pedro Faria dos, Um estudo em química analítica e a identificação de cátions do grupo III, Educ. quím., 22(1), 32-37, 2011.
- 1)
A Figura 2, página 36, deve ser desconsiderada.
- 2)
A equação 18, página 36, deve ser substituída pela equação a seguir:
- 3)
As equações 22-24, página 37, devem ser substituídas pelas equações, tornando-se a correcção correspondente no texto:
Estimado Andoni:
Me gustó haber escrito la carta y me gusta la respuesta de los autores; es una salida muy elegante y muy digna.
Sin embargo, no entendieron que no es la simplicidad del mecanismo lo que critico, sino que no calcularon bien la carga formal de los átomos. La carga formal de un átomo = Núm. de electrones de valencia – núm. de electrones libres – ½ electrones compartidos (Domínguez R. M. A, Química, la ciencia básica. Madrid: Thomson, pp. 385-387, 2006); por esa razón le puse todos los puntitos (electrones) a los átomos en mis esquemas.
Su segundo error fue no haber sustentado dicho mecanismo con una cita bibliográfica, lo cual indica, obviamente, que la falla es de su autoría.
Para evitar que tengan un nuevo error por favor pregúntales si no hay una ecuación 24. Si no la hay que especifiquen en la errata (ítem 3) que 22-24 se sustituyen por 22 y 23.
En cierto descargo de los autores creo, de paso, que los árbitros también se equivocaron si es que en el documento que recibieron para revisar ya estaban mal las figuras. Un abrazo Aarón Pérez-Benítez