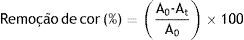Neste trabalho foi realizado o estudo da remoção do negro de eriocromo T em um efluente real (gerado a partir do teste para determinar a dureza da água por titulação complexométrica) usando a perlita modificada com ortofenantrolina por meio da técnica de adsorção. Inicialmente o estudo da remoção do negro de eriocromo T em um efluente sintético (solução aquosa de negro de eriocromo T) foi realizado para posterior aplicação das condições otimizadas em águas residuais reais (resíduo da titilação de complexação). A remoção do corante a pH 10, ou seja, pH natural do efluente real, não foi significativa atingindo o valor máximo de percentagem de remoção de cor de 8.12%, já a pH 3 foi alcançada a máxima remoção de cor (remoção de 100%), indicando que o negro de eriocromo T interage mais efetivamente com o adsorvente em valores de pH ácido (pH 5 ou 3), e mais eficientemente em pH 3. Assim, pode‐se mencionar que a perlita expandida (um aluminossilicato amorfo e naturalmente ácido), modificada com ortofenantrolina (uma base de Bronsted), é um material fácil de preparar, barato e eficaz para a remoção de corantes do tipo ácido (negro de eriocromo T) em condições estabelecidas no presente estudo, aplicado para resíduos contendo negro de eriocromo T gerado durante as aulas práticas de química.
In this paper, an approach to the removal of the eriochrome black T in an actual effluent (generated from the test to determine the water hardness by complexometric titration) using perlite modified with orthophenanthroline by the adsorption technique is proposed. A preliminary assessment of the removal of eriochrome black T in a synthetic effluent (aqueous solution of eriochrome black T) was executed for subsequent application of the optimized conditions in actual residual water (titration residue of complexation). The removal of dye at pH 10, the natural pH of the actual effluent, was not significant reaching 8.12% of color removal, on the other hand, the removal of dye at pH 3 achieved the maximum color removal (100%), indicating that the eriochrome black T interacts more effectively with the adsorbent at acidic pH (pH 5 or 3), and more efficiently at pH 3. Therefore, by the results obtained under conditions established in this present study were concluded that expanded perlite (an amorphous and naturally acidic aluminosilicate) modified with orthophenanthroline (a Bronsted base) is an easy to prepare, cheap and effective material for removal of acid dyes (eriochrome black T) applied to residues containing eriochrome T black generated during practical chemistry classes.
O despejo de resíduos químicos em meios aquáticos por indústrias e laboratórios de pesquisa e ensino é indubitavelmente um dos maiores problemas ambientais que se pode destacar na atualidade (Jardim, 1998). A crescente demanda de diversos cursos técnicos ou de ensino superior, que fazem uso de substâncias nocivas (corantes, solventes orgânicos e metais) durante a realização de suas aulas experimentais, contribuem para uma maior produção de rejeitos daninhos ao meio ambiente e consequentemente à saúde humana.
Inserido neste contexto de poluição ambiental, não considerando apenas as unidades altamente geradoras de resíduos químicos como as indústrias, as instituições de ensino e pesquisa, também devem ser consideradas como unidades micro e, até mesmo, macro produtoras de resíduos potencialmente perigosos para o meio ambiente e consequentemente para a vida dos seres vivos. Neste cenário faz‐se necessário o impulsionamento as instituições geradoras de resíduos a gerenciarem e tratarem seus materiais nocivos ao ecossistema, principalmente durante o manuseio e preparo de substâncias químicas durante aulas experimentais (Micaroni, 2002).
As intituições publicas e privadas de ensino devem ser responsabilizadas não só pela formação acadêmica dos discentes que as ocupam, mas também pela implantação da consciência ambiental nos alunos e gestores destas instituições, já que a produção de resíduos químicos durante as aulas experimentais ou ensaios de pesquisa científica geram em demasia resíduos nocivos (Amaral et al., 2001).
Nos cursos de graduação como Química, Engenharia Química, Engenharia de Alimentos e Geologia várias disciplinas são de natureza experimental e, especificamente na área de Química Analítica, são ofertadas semestralmente por diversas instituições públicas e privadas de ensino, indicando a ocorrência de várias aulas em laboratório.
Os resíduos produzidos durante essas aulas experimentais acarretam uma significativa quantidade de material muitas vezes tóxicos, carcinogênicos e nocivos à fauna e flora se descartados de forma irregular, como por exemplo diretamente na rede de esgoto. Algumas universidades possuem centrais de gerenciamento e tratamento de resíduos químicos como a Universidade Federal do Rio Grande do Sul (UFRGS) que possui um programa de intercâmbio de resíduos químicos em seus laboratórios e iniciaram uma plena conscientização de alunos e professores ao redor desta problemática ambiental no tocante a gerenciar e tratar seus resíduos. Este processo tem como objetivo moral: «O resíduo de hoje pode ser o reagente de amanhã e o prejuízo ao meio ambiente pode ser reduzido» (Amaral et al., 2001).
Ainda neste contexto, diversas universidades não possuem centrais de tratamento de resíduos químicos, em que estes contaminantes são geralmente lançados diretamente na rede de esgoto ou armazenados em locais inadequados sem um fim específico ao fim de cada aula experimental. Um outro exemplo é a Universidade Federal do Rio Grande do Norte (UFRN) que não há um controle/gerenciamento dos resíduos gerados em aulas experimentais, e estes são apenas armazenados sem uma finalidade adequada em uma unidade de armazenamento temporária de resíduos (UATR) (Almeida, 2015).
Altivamente da unidade geradora do resíduo químico (ensino, pesquisa ou indústria) deve‐se adotar o termo de responsabilidade objetiva, ou seja, quem gerou o resíduo deve ser responsável pelo mesmo e tratar ou armazenar de forma adequada. Além desta prática de responsabilidade pelo resíduo gerado, as istituições também poderiam aplicar práticas experimentais minimalistas ou mesmo análises químicas em microescala utilizando equipamentos ou instrumentos como micropipetas e microburetas e minimizam o uso de altas quantidades de reagentes (Jardim, 1998).
A opção de minimizar a quantidade de resíduos químicos gerados durante experimentos de química podem ser implementados a partir da substituição de experimentos em macroescala para microescala (ABNT, 2004).
Tomando‐se como base o Instituto de Química da UFRN, em cada semestre aproximadamente 5 turmas de componentes curriculares da área de química analítica que são ofertadas regularmente. Tais componentes curriculares fazem uso de aulas experimentais para um melhor aprendizado e vivência de temas da química.
O assunto envolvendo a volumetria de complexação está presente nas disciplinas de química analítica e uma das aplicações descritas nos roteiros de aulas práticas dessas disciplinas é a determinação da dureza da água utilizando como indicador metalocrômico, o corante negro de eriocromo T.
Dentre as aulas experimentais, em torno de 30 alunos, divididos em 10 grupos, realizam o experimento de determinação da dureza da água por titulometria de complexação. Sendo assim, aproximadamente 15 litros de resíduos provenientes dessas aulas experimentais são gerados semestralmente.
A volumetria de complexação consiste em uma reação de um íon metálico com um determinado ligante, formando‐se um complexo de relativa estável. Para observação da formação deste complexo é necessária a utilização de indicadores metalocrômicos. Estes indicadores são geralmente corantes, por exemplo, o negro de eriocromo T (Luna e Schuchardt, 1998; Hamed, Ismail e Ibrahim, 1994).
Visando que ao término de cada aula prática de volumetria de complexação os rejeitos de cada titulação são lançados, na maioria das vezes, diretamente na pia ou em recipientes para armazenamento de resíduos, sem nenhum tratamento prévio, faz‐se necessário o estudo e o desenvolvimento de técnicas e materiais que possam tratar total ou parcialmente os efluentes gerados durante essas aulas, tornando‐os aptos a serem armazenados ou lançados na rede de esgoto.
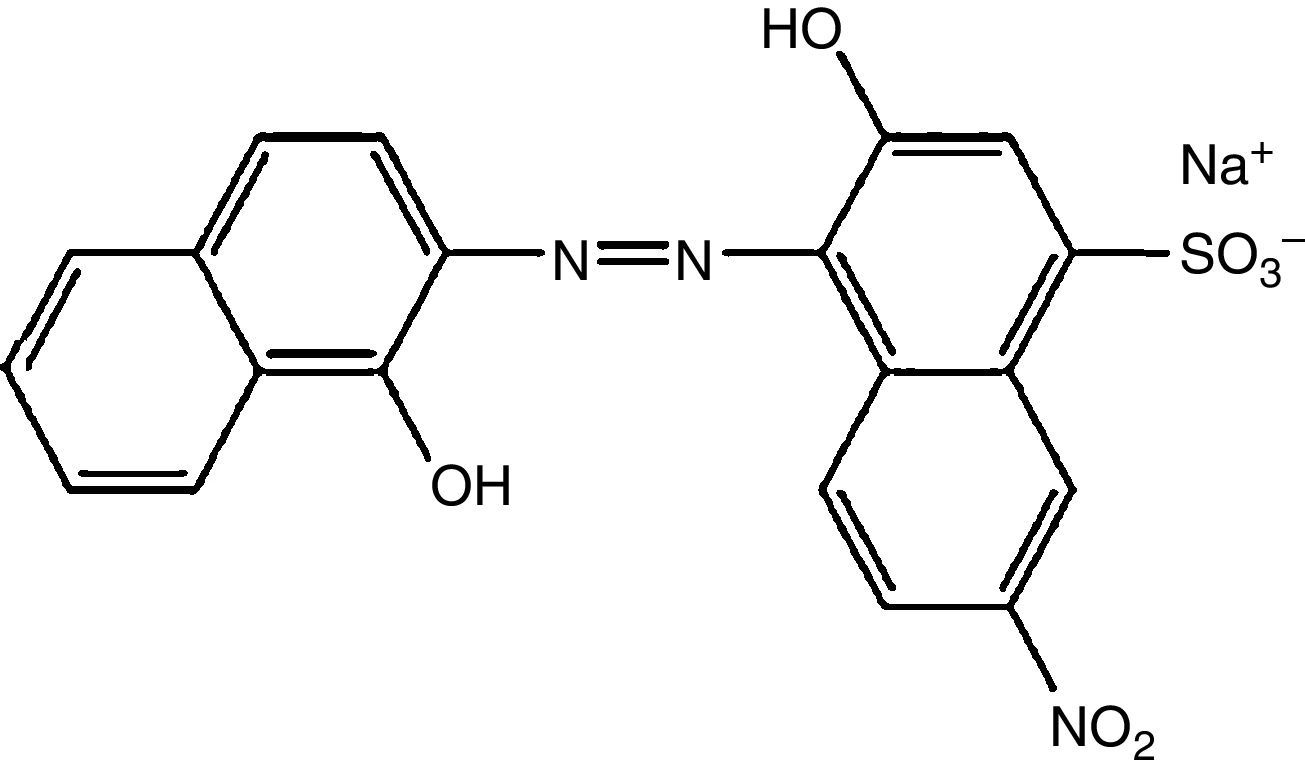
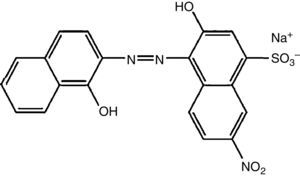
O negro de eriocromo T é um corante azo (fig. 1), utilizado em grande escala tanto em indústrias têxteis como em laboratórios de pesquisa e ensino principalmente como indicador metalocrômico em titulações de complexação para determinação da dureza da água. Por apresentar uma estrutura química complexa, o negro de eriocromo T apresenta uma grande resistência à fotodecomposição, à água e também a certos reagentes químicos, dificultando a remoção ou diminuição da sua cor durante o tratamento do efluente contaminado (Barka, Abdennouri e El Makhfouk, 2011). Os corantes são os resíduos de mais baixo nível de degradação e, consequentemente, muito resistentes a tratamento (Dellamatrice, 2005).
A literatura traz inúmeras contrubuições em estudos que utilizam materiais imobilizados em argilas, bem como aluminossilicatos para o tratamento fotodegradativo de corantes azo, como o negro de eriocromo T. É enfatizado que estes materiais altamente coloridos são uma fonte perigosa de poluição ambiental e que necessitam de atenção para redução desses impactos ao meio ambiente. Alguns trabalhos trazem materiais como óxido de titânio e íon ferro imobilizados na superficie dos aluminossilicatos para aplicação em fotocatálise, e consequente degradação do contaminante corante azo (Cheng et al., 2008 e Marchena, Lerici, Renzini, Pierella e Pizzio et al., 2016).
A aplicação de modificações em aluminossilicatos para processos de remediação ambiental também vem sendo relatada usando compostos orgânicos como a ortofenantrolina. Bouwe, Tonle, Letaief, Ngameni e Detellier (2011) realizaram um estudo da intercalação da ortofenantrolina aplicada na argila montmorillonita. Foi feita uma intercalação da ortofenantrolina na montmorillonita como proposta para sensores eletroquímicos de chumbo (Pb2+).
Muitas pesquisas são realizadas envolvendo o tratamento de efluentes a partir da utilização de adsorventes (Dotto, Garcia Vierira, Oliveira Gonálvez e De Almeida Pinto, 2011; Hernandéz‐Montoya, Pérez‐Cruz, Mendoza‐Castillo, Moreno‐Virgen e Bonilla‐Petriciolet, 2013). Um exemplo de material adsorvente é a da perlita expandida, caracterizado como um aluminossilicato que apresenta de 71‐75% de SiO2 em sua composição. A perlita expandida é um aluminossilicato com superfície potencialmente ácida, e que por isso interagem melhor com corantes do tipo básico em processos de adsorção (Dogan e Alkan, 2003).
Alguns trabalhos na literatura fizeram o uso da perlita expandida como adsorvente de corantes catiônicos ou metais, dentre eles: azul de metileno (Dogan, Alkan, Türkyilmaz e Özdemir, 2004; Acemioglu, 2005), azul básico 41 (Roulia e Vassiliadis, 2005) e os metais Ag+, Cu2+ e Hg2+ (Ghassabzadeh et al., 2010).
Com o objetivo de melhorar a capacidade de adsorção da perlita expandida, visto que a mesma, sem modificação, não possui afinidade por moléculas de corantes do tipo ácido, neste trabalho fez‐se o uso da ortofenantrolina, com intuito de modificar a perlita expandida para que o material adsorvente possa favorecer a adsorção do negro de eriocromo T (corante ácido).
Assim, o tratamento de efluentes contaminados por corantes ganha destaque no âmbito da pesquisa. Como uma proposta de aula experimental e a tentativa de tratar os efluentes gerados durante as aulas práticas de determinação da dureza da água que utiliza o corante negro de eriocromo T como indicador metalocrômico, o presente trabalho apresenta a aplicação da técnica de adsorção (rápida e eficaz) utilizando como adsorvente a perlita expandida modificada (aluminossilicato, adquirido de uma empresa comercial) com ortofenantrolina (uma base orgânica fraca) para remover o negro de eriocromo T do resíduo gerado durante as aulas experimentais. Sendo esta uma proposta nova de incentivo aos discentes ao tratamento dos próprios rejeitos gerados nos seus experimentos.
Parte experimentalMateriais e métodosComo material adsorvente para remoção do negro de eriocromo T em resíduos de titulometria de complexação, usou‐se a perlita expandida comercial adquirida pela Schumacher insumos, empresa localizada no Rio Grande do Sul–Brasil. O assunto envolvendo a volumetria de complexação está presente nas disciplinas de química analítica, e uma das aplicações descritas nos roteiros de aulas práticas dessas disciplinas é a determinação da dureza da água utilizando como indicador metalocrômico, o corante negro de eriocromo T. A perlita expandida (comercial) foi previammente lavada com água, usando 200mL de água destilada para 10g de perlita expandida, em agitação por 24h e posteriomente foi seca em estufa com circulação forçada de ar por 4h a 110°C. Depois deste procedimento de limpeza do aluminossilicato (perlita expandida), misturou‐se 6g da perlita expandida limpa e seca, com 250mL de solução de ortofenantrolina monohidratada 0.1mol.L−1, deixando esta solução em agitação constante por 4h. No fim do procedimento filtrou‐se a perlita em papel filtro quantitativo através de filtração a vácuo, lavando‐se a perlita com bastante água para retirada do excesso de solução ortofenantrolina, observando o valor de pH (com papel indicador), após cada lavagem da perlita com água destilada. Esta lavagem foi feita até observação de um pH aproximadamente constante e o mais próximo possível da neutralidade. Secou‐se o material adsorvente em estufa com circulação forçada de ar a 60°C por 4h.
Ensaios de adsorçãoPara os ensaios de adsorção utilizou‐se Erlenmeyer de 125mL cada um contendo 20mL de solução de negro de eriocromo T e 50mg de perlita modificada com ortofenantrolina, onde cada Erlenmeyer representou tempos de contato de 10, 20, 30, 40, 50 e 60min de adsorção.
Todos os ensaios foram procedidos em agitação constante de 170rpm em uma mesa agitadora sob temperatura ambiente (25.0±1.0°C). Ao final de cada tempo de contato uma alíquota de 5mL foi retirada com o auxílio de uma seringa de vidro polido, transferida para um tubo de ensaio e centrifugada por 15min em 4,000rpm para que ocorresse a separação de todo adsorvente em suspensão.
Posteriormente foi realizada a leitura da absorbância de cada alíquota em um espectrofotômetro de absorção molecular na região do ultravioleta‐visível, em um comprimento de onda máximo de 530nm, correspondente ao comprimento de absorção máxima do negro de eriocromo T. Para as varreduras usou‐se cubetas de quartzo, sendo utilizada a água como branco para obtenção da linha base.
Os valores de porcentagem de remoção da cor do negro de eriocromo T foram calculados usando a equação 1:
Onde, A0 e At são os valores da absorbância no tempo 0 e absorbância no tempo t respectivamente.
Otimização das condições experimentais de adsorção em um efluente sintético (solução aquosa de negro de eriocromo T) para aplicação em um efluente real (titulometria de complexação/determinação da dureza da água)Estudo do efeito da concentração inicial do negro de eriocromo T no processo de adsorçãoPara todos os ensaios de adsorção realizados neste trabalho a massa de adsorvente e volume de adsorbato usados foram de 50mg e 20mL, respectivamente, nas condições expressas nesta metodologia experimental.
O valor da concentração do poluente, no caso, o azo corante negro de eriocromo T, é um fator relevante e foi investigado. Para tal teste foram realizados ensaios de adsorção usando como efluente sintético soluções aquosas de negro de eriocromo T de concentrações: 2.0×10−4, 1.5×10−4, 1.0×10−4, 3.5×10−5 e 3.0×10−5 molL−1, em pH natural da solução (pH 5.0), mantendo‐se constante a massa de adsorvente utilizada (50mg) de perlita expandida modificada com ortofenantrolina e as mesmas condições de estudos já mencionadas nesta metodologia e tempo de contato total foi de 60min.
Estudo do efeito do pH das soluções de negro de eriocromo T no processo de adsorçãoA dependência de pH é um dos parâmetros mais relevantes no processo de adsorção porque as propriedades da superfície do adsorvente e a estrutura do adsorbato podem ser afetadas e alterar a eficiência do processo de remoção do adsorbato através do tratamento em questão.
Para este estudo de influência do pH no processo de remoção do negro de eriocromo T, variou‐se o pH da solução aquosa de negro de eriocromo T para as concentrações de 2.0×10−4mol.L−1 (concentração mais alta) e 3.5×10−5mol.L−1 (menor concentração, dentre as estudadas no presente trabalho), em valores de pH 3.0; 5.0 (pH natural da solução aquosa de negro de eriocromo T) e 10.0 (pH cujo valor é o do efluente real tratado neste trabalho), sendo o tempo de contato de 60min.
Para este estudo do efeito de pH usou‐se os valores de massa de adsorvente e volume de adsorbato de 50mg e 20mL, respectivamente, para cada tempo de contato estudado durante o ensaio de adsorção.
Para o estudo do parâmetro pH, usou‐se um modelo de pHmetro modelo TECNOPON PA2010, em que antes de cada leitura calibrou‐se o aparelho com soluções tampões de pH 4 e 7, com temperaturas de medições de 25, 0±1.0°C.
Os valores de pH foram ajustados com soluções aquosas de HCl (1.0 molL−1) para valores de pH na faixa ácida, e NaOH (1.0 molL−1) para pH na faixa alcalina.
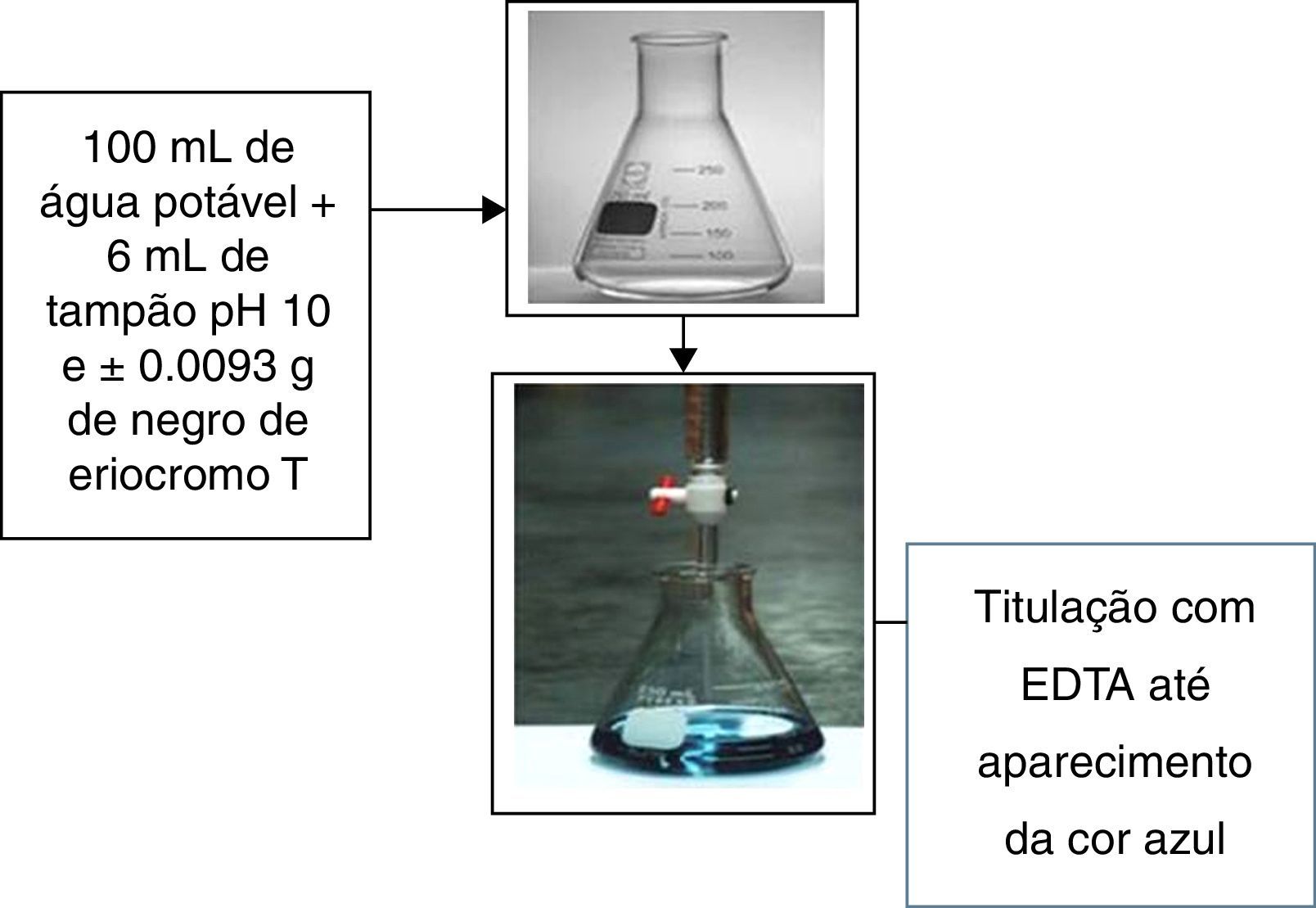
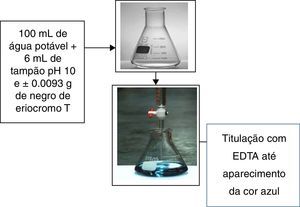
Preparo do efluente real por titulação complexométricaO efluente real usado neste estudo será obtido a partir do ensaio de determinação da dureza da água, procedida de acordo com o roteiro de aulas práticas da disciplina de Química Analítica Quantitativa, ofertada pelo instituto de química da UFRN, ilustrado na figura 2.
Uma solução tampão pH 10 (NH3/NH4Cl) foi preparada dissolvendo‐se 65g de NH4Cl em água destilada e adicionada a 570mL de uma solução de NH3 concentrada e diluir para 1L. Esta solução deve ser armazenada em frasco de polietileno para evitar a passagem de íons metálicos do vidro para solução (Rosa, Gauto e Gonçalves, 2013).
Colocou‐se 100mL de água potável em um Erlenmeyer de 250mL. Adicionou‐se 6mL de solução tampão pH 10 (NH4OH/NH4Cl) e aproximadamente 0.0093g de negro de eriocromo T, valor de massa correspondente para 100mL de uma solução aquosa 2.0×10−4mol/L de negro de eriocromo T.
Titulou‐se com a solução de sal dissódico di‐hidratado de ácido etilenodiaminotetracético (EDTA), previamente padronizado com solução ácida de carbonato de cálcio até a mudança de cor de vermelho para azul. A padronização do EDTA foi proceguida da seguinte forma: pesou‐se com exatidão entre 0.1‐0.15g de CaCO3 previamente seco em um Becker. Adicionou‐se 1mL de HCl 1:1 para solubilizar o sal. Transferiu‐se essa solução para um balão volumétrico de 100mL aferindo‐o. Pipetou‐se 3 alíquotas de 25mLda solução de CaCO3 (do balão) para frascos Erlenmeyer de 250mL. Adicionou‐se na sequência aproximadamente 25mL de água destilada, 5mL de solução tampão pH 10 e 3 gotas de indicador negro de eriocromo T. Titulou‐se cada alíquota de solução de EDTA até o aparecimento da cor azul nítida, podendo agora calcular sua real concentração da solução de EDTA sabendo que a proporção estequiométrica entre EDTA e íon cálcio é de 1:1 (Rosa et al., 2013).
A figura 2 esquematiza o preparo do efluente real. O efluente real gerado pela determinação da dureza da água por titulação complexométrica com sal de EDTA também foi monitorado via espectroscopia UV‐Vis, da mesma forma que a solução sintética do negro de eriocromo T.
Foram tituladas 10 amostras de água potável e os rejeitos das titulações foram armazenadas em um recipiente de plástico e guardadas por um dia (24h), obtendo‐se assim o efluente real deste estudo.
No dia seguinte do preparo do efluente real foi coletada uma parte desse rejeito para alteração do pH, de 10 para 3, aplicando‐se a mesma metodologia que fora realizada para o efluente sintético. Na sequência realizou‐se o ensaio de adsorção para o efluente com as especificações: concentração de negro de eriocromo t na faixa de 2.0×10−4mol.L−1 em pH 10 (natural do efluente) e 3; tempo de contato de 60min. Os parâmetros do ensaio de adsorção (massa de adsorvente e volume de adsorbato) foram procedidos de acordo com esta metodologia aplicada ao efluente sintético (50mg de adsorvente e 100ml de adsorbato).
Os ensaios de adsorção foram realizados em duplicata para observar‐se a reprodutibilidade do processo ao tratar‐se de um rejeito real e os valores de porcentagem de remoção da cor foram expressos através do valor médio de porcentagens para este ensaio, calculado pela média aritmética simples.
Ensaio de recuperação do adsorvente (perlita expandida) e do adsorbato (negro de eriocromo T): teste de dessorçãoO ensaio de recuperação do adsorvente e do adsorbato foi procedido usando o método de extração usando solvente orgânico, que acarreta em uma remoção excelente de corantes do tipo ácido de matrizes em que estão inseridos (Laing et al., 1991). O solvente extrator utilizado foi uma solução de ácido acético (CH3COOH) a 1mol.L−1. Foi utilizado aproximadamente 50mg do adsorvente já com negro de eriocromo T adsorvido, ou seja, após os ensaios de adsorção, em 50mL do ácido acético. A mistura foi deixada em agitação magnética por 60min. Durante esse processo a cada 10min uma liquota de 4mL era retirada da solução e sendo centrifugada (4,000rpm) por 20min, retirado o sobrenadante e realizada a leitura da sua absorbância em um espectrofotômetro de absorção molecular na região do UV‐Vis, no comprimento de onda máximo de absorção do negro de eriocromo T (530nm), com intuito de verificar o processo de dessorção do corante, portanto, quanto do corante saiu do adsorvente e retornou à solução. Como observação, a cada aliquota de líquido extrator retirado durante o teste, o volume de ácido acético era sempre reposto, para garantir o volume constante a todo o ensaio.
Resultados e discussãoResultados ótimos para o efluente sintético (solução aquosa de negro de eriocromo T)Estudo do efeito da concentração inicial do negro de eriocromo T no processo de adsorçãoPara o valor maior de concentração do negro de eriocromo T, no caso 2.0×10−4mol.L−1, obteve‐se o maior valor de porcentagem de remoção da cor do negro de eriocromo T, com 63.74% de remoção em 20min de contato, onde este corresponde a remoção de 25.06mg/g de negro de eriocromo T. Este foi o melhor valor de remoção da cor se comparado aos valores das demais concentrações deste estudo, portanto esta concentração foi aplicada no preparo do efluente real (Almeida et al., 2017).
Observou‐se que ao aumentar a concentração de adsorbato aumentou‐se também a porcentagem de remoção do corante pela perlita expandida modificada com ortofenatrolina, pois em concentrações de adsorbato baixas a razão entre o número de moléculas por área específica disponível para adsorção de corante é mínima, consequentemente um aumento da concentração inicial de corante elevou a quantidade de corante adsorvida pelo adsorvente (perlita expandida modificada com ortofenatrolina), fato também observado em outro trabalho na literatura em que avaliou‐se a remoção do corante verde de malaquita usando perlita expandida como adsorvente (Govindasamy, Sahadevan, Subramanian e Mahendradas, 2009).
Estudo do efeito do pH das soluções de negro de eriocromo T no processo de adsorçãoA influência do pH da solução de negro de eriocromo T foi investigada em 3 valores de pH: 3.0; 5.0 (pH natural da solução aquosa de negro de eriocromo T) e 10.0. Como resultado que o processo de adsorção é bem mais eficaz quando o pH da solução é alterado para faixa mais ácida, precisamente, no valor de pH 3 para as 2 concentrações estudadas, chegando a remover‐se 100% da cor do corante em uma concentração de negro de eriocromo T 3.5×10−5mol/L em pH 3. Esta remoção máxima ocorreu em 40min de adsorção.
Em meio alcalino (pH 10) não se obteve um bom resultado de remoção da cor do corante. O valor máximo de remoção da cor para este pH foi de 28.50% em 15min de adsorção para concentração de 2.0×10−4mol/L.
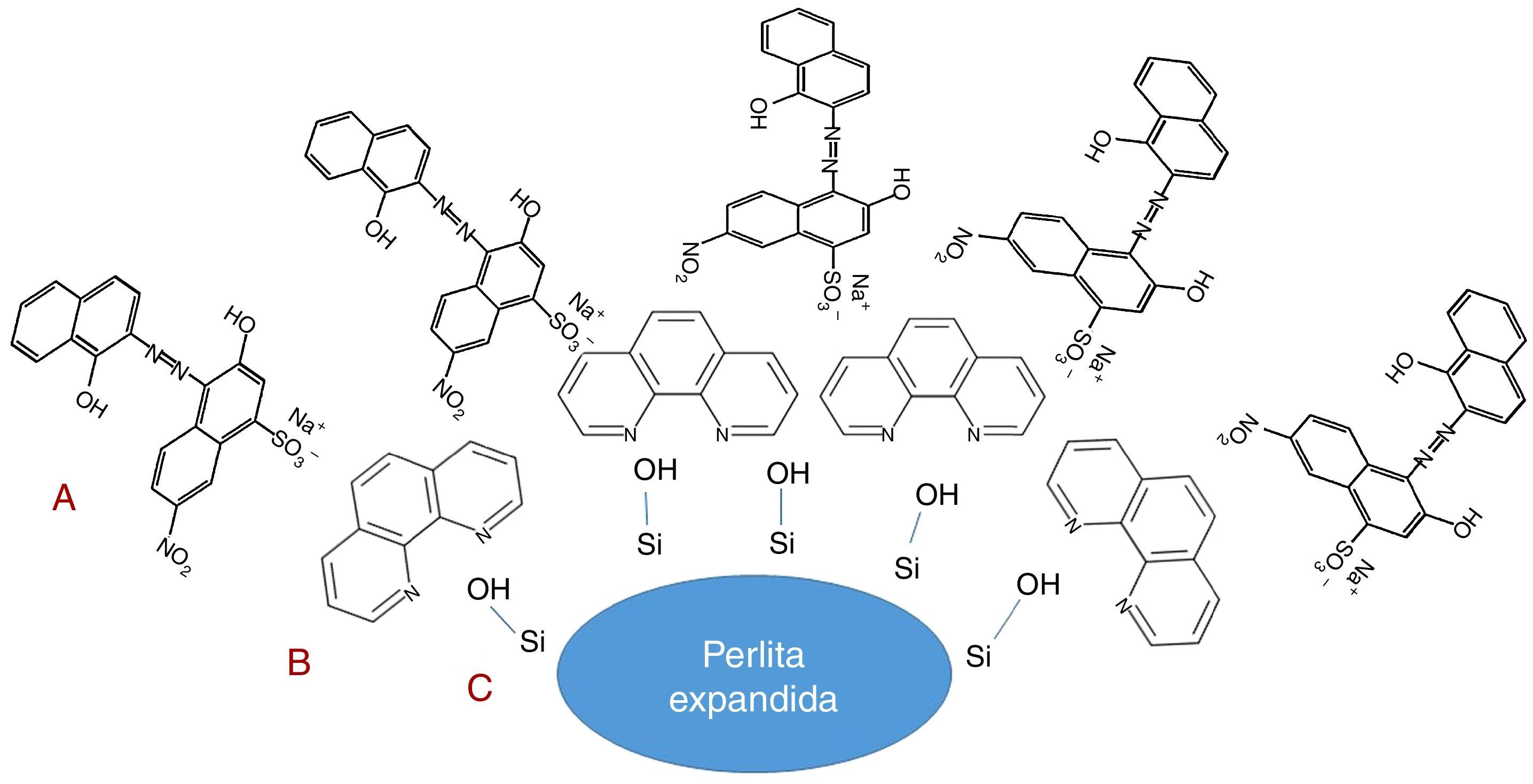
A remoção eficaz do negro de eriocromo T em pH 3 pela perlita modificada com ortofenantrolina é resultado de uma interação ácido‐base entre o adsorbato e o adsorvente, já que em meio muito ácido o negro de eriocromo T encontra‐se na forma azo/protonada com interações entre os grupos sulfônicos (protonados) do corante e os sítios básicos da perlita modificada com ortofenantrolina. Portanto, a acidez do meio é um fator importante, influenciando as interações entre adsorvente e adsorbato no que diz respeito às interações eletrostáticas. Um maior detalhamento do efeito do pH na extensão da adsorção já foi relatado anteriormente neste trabalho.
Estes resultados demonstram que quanto menor o pH da solução de negro de eriocromo T (ou seja, quanto mais ácido estiver o meio), mais eficiente o processo de remoção da cor do corante por adsorção com perlita expandida modificada com ortofenantrolina.
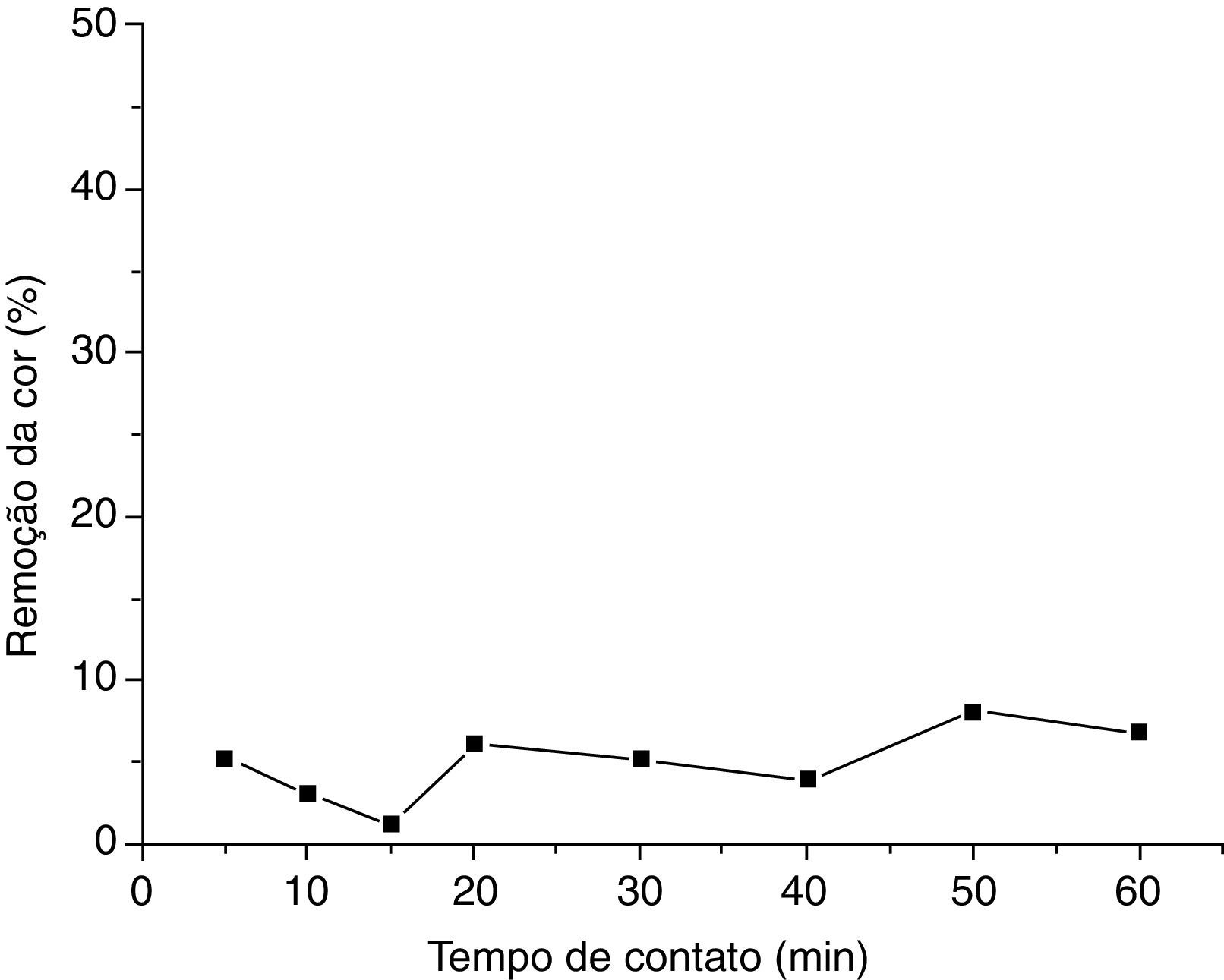
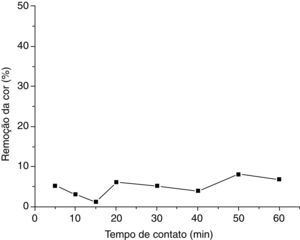
Tratamento do efluente real gerado a partir do ensaio de determinação da dureza da água por titulometria de complexaçãoRemoção do negro de eriocromo T em pH 10 (efluente com pH natural)O estudo do percentual de remoção do negro de eriocromo T em um efluente real gerado por um ensaio de determinação da dureza da água por titulometria de complexação foi analisado. A figura 3 mostra a curva de remoção da cor versus o tempo de contato em pH 10. O gráfico foi obtido usando o valor das médias aritméticas das porcentagens de remoção do negro de eriocromo T para as duplicatas dos ensaios de adsorção.
Para este teste de adsorção observou‐se que houve remoção mínima do corante no pH natural do efluente.
Nota‐se que a porcentagem de remoção do negro de eriocromo T nestas condições (pH 10) é pouco significante, atingindo um máximo de 8.12%. Essa escassa remoção do corante em pH 10, cujo valor é o natural do efluente, já era esperada já que em em meio muito alcalino a perlita modificada com ortofenantrolina não é tão eficaz, como já foi visto nos testes preliminares com o efluente sintético (Almeida, Oliveira, Silva, Souza e Fernandes, 2017).
Em pH 10 os dois hidrogênios fenólicos ionizáveis presentes na estrutura química do negro de eriocromo T serão desprotonados, não havendo, então, prótons disponíveis na estrutura química do corante para interagirem com os sítios básicos da ortofenantrolina. Assim, ocorrerá uma repulsão entre as moléculas de adsorbato e os sítios ativos do adsorvente.
A figura 4 mostra as fotografias do processo de adsorção do efluente real em pH 10, na qual pode‐se visualmente observar que não houve uma significante remoção da cor do corante neste ensaio de adsorção.
Remoção do negro de eriocromo T no efluente real em pH 3Os valores de pH aplicados a estes ensaios são advindos dos ensaios preliminares de otimização do processo de remoção do corante em um efluente sintético (solução aquosa de negro de eriocromo T) usando a perlita expandida Q13 modificada com ortofenantrolina como adsorvente (Almeida et al., 2017). Foram estudados 3 valores de pH (3, 5 e 10) para o efluente sintético e aplicado para o efluente real apenas o pH ótimo de remorção do corante (pH 3) e o pH natural do efluente real (pH 10).
O estudo do percentual de remoção do negro de eriocromo T no efluente real em meio ácido se fez necessário, uma vez que em pH 10, valor de pH natural do efluente, não houve remoção significativa do corante pelo adsorvente, fato também evidenciado nos testes de adsorção com o efluente sintético.
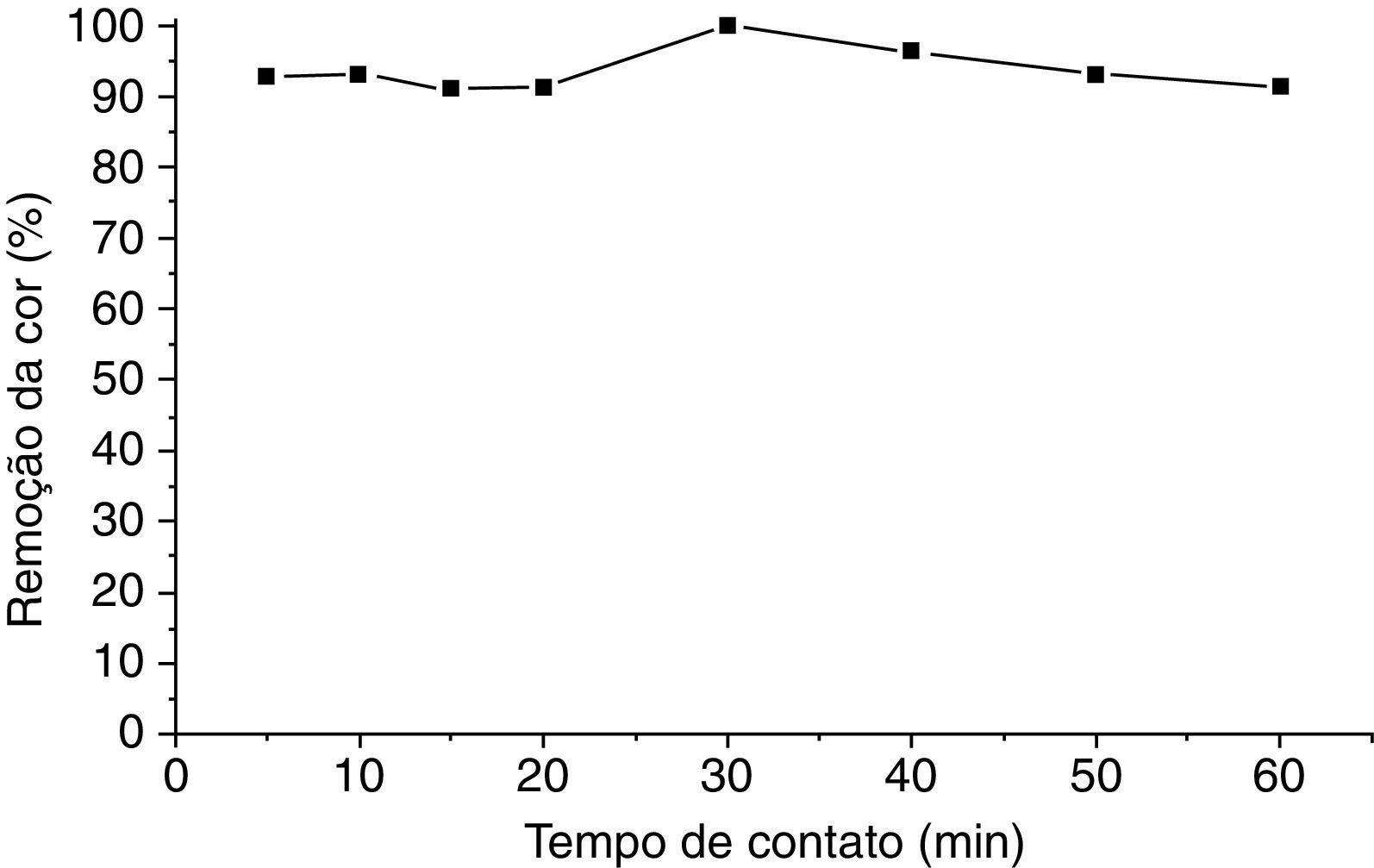
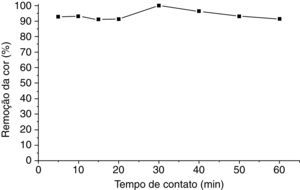
Na figura 4 mostra a curva de remoção da cor do negro de eriocromo T versus o tempo, onde também se utilizou os valores da média aritmética da porcentagem de remoção, visto que este experimento também foi feito em duplicata.
Através da curva mostrada na figura 5 pode‐se afirmar que houve uma remoção favorável do negro de eriocromo T em pH 3 no efluente estudado, usando a perlita expandida modificada com ortofenantrolina, alcançando 100.00% de remoção da cor do corante em 30min de tempo de contato.
O resultado apresenta a mesma justificativa informada para o efluente sintético, onde em pH 3, o grupo sulfônico presente na estrutura química do negro de eriocromo T será devidamente protonado, aumentando ainda mais seu caráter ácido, sendo então mais atraído e também interagindo mais facilmente com a superfície da perlita expandida modificada com ortofenantrolina, já que mais prótons estão disponíveis para serem doados aos sítios básicos do agente modificante.
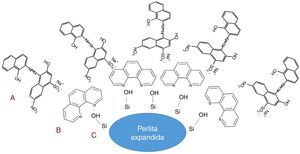
A figura 6 ilustra a possível interação entre os grupos silanóis da superfície da perlita expandida (C) com os grupamentos básicos de Bronsted da ortofenantrolina (B) e após a adsorção os grupamentos sulfônicos do negro de eriocromo T são protonados em meio ácido, neste caso pH 3, e consequentemente inreragem com os grupos básicos (A) na superfície da perlita espandida devido a incorporação da ortofenantrolina. Nota‐se que a presença da ortofenantrolina propiciou a perlita expandida sitios básicos para proporcionar o processo de adsorção do negro de eriocromo T na superfície do material modificado.
A figura 7 mostra as fotografias dos ensaios de adsorção para cada tempo de contato. Através destas imagens fica evidente o processo de remoção da cor do negro de eriocromo T no efluente real em pH 3.
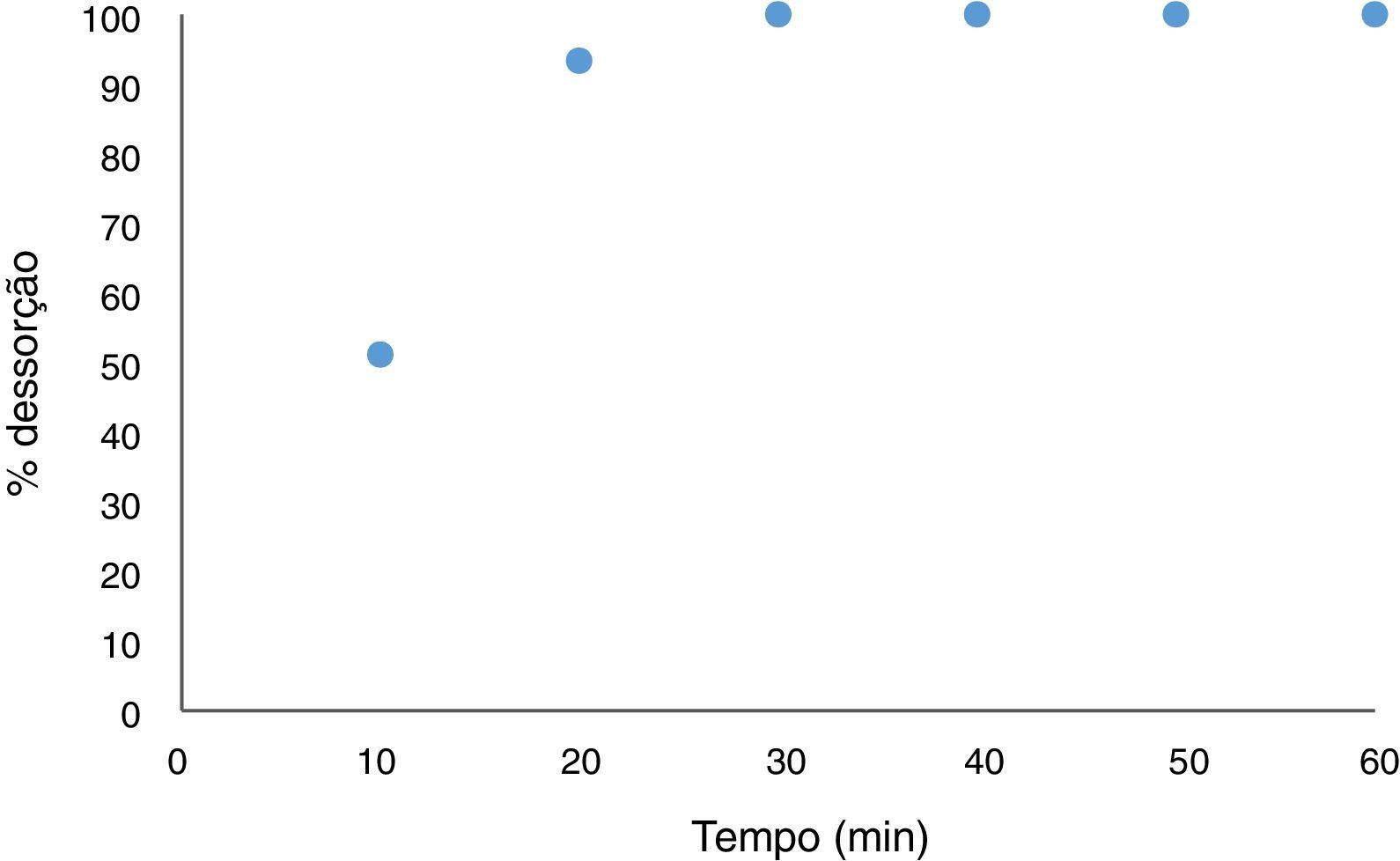
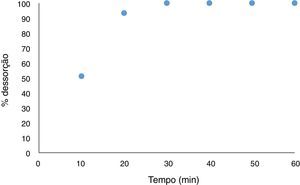
Ensaio de recuperação do adsorvente (perlita expandida) e do adsorbato (negro de eriocromo T): teste de dessorçãoO ensaio de recuperação dos materiais submetidos ao ensaio de adsorção, com intuito de tratar os resíduos gerados durante a aula experimental de determinação da dureza da água, teve um excelente resultado. A figura 8 mostra a curva de dessorção do corante negro de eriocromo T após ser submetido a uma extração com ácido acético.
Como pode‐se observar na figura 8 o corante foi totamente removido do material adsorvente, podendo ambos os materiais (perlita expandida e negro de eriocromo T) ser reutilizados em outros ensaios. O ácido acético, como já descrito anteriormente na metodologia do presente estudo, mostrou‐se eficaz na extração do corante do material adsorvente. Este resultado é de suma relevância já que, assim, é garantida a não geração de mais resíduos que o material de partida, e assegurando o reaproveitamento dos mesmos em outros ensaios de remoção do negro de eriocromo T em tratamentos de resíduos de aulas experimentais.
ConclusõesNo presente estudo, realizou‐se o estudo da remoção do negro de eriocromo T usando a perlita expandida modificada com ortofenantrolina, através da técnica de adsorção.
O estudo do processo de adsorção foi realizado através da averiguação do efeito da concentração inicial do corante, tempo de contato e variação de pH da solução (faixa ácida e alcalina) no processo de adsorção, para um efluente denominado sintético (solução aquosa do negro de eriocromo T) e um efluente real (gerado a partir do ensaio de determinação da dureza da água, por titulometria de complexação).
No estudo da remoção do negro de eriocromo T no efluente real empregou‐se as condições otimizadas através do estudo com efluente sintético. A remoção do corante em pH 10, ou seja, pH natural do efluente, não foi significante alcançando‐se o valor máximo de porcentagem de remoção da cor de 8.12%, já em pH 3 obteve‐se remoção de cor máxima de 100.00% da cor, mais uma vez provando que o negro de eriocromo T interage melhor e eficazmente com o adsorvente em valores de pH ácido (pH 5 ou 3), mais precisamente em pH 3. Assim, temos que o material adsorvente preparado neste trabalho (perlita expandida modificada com ortofenantrolina) mostrou‐se altamente eficaz no tratamento do resíduo gerado a partir de ensaios de determinação da dureza da água por titulometria de complexação, removendo até 100% da cor do resíduo contendo o corante e indicador metalocrômico negro de eriocromo T.
O presente trabalho estimulará os discentes a aprenderem um pouco mais alguns conceitos da química, observando uma aula experimental diferenciada e estimulando a vivência da importância do tratamento de resíduos para o processo de remediação ambiental.
Conflito de interessesOs autores declaram não haver conflito de interesses.
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pelo apoio financeiro e a FINEP, CNPq e PETROBRAS pelo apoio instrumental.
A revisão por pares é da responsabilidade da Universidad Nacional Autónoma de México.