The reduction of nitro compounds to obtain the corresponding amines is one of the most useful reactions in organic synthesis. Of the various methods for achieving such reductions, those based on the transfer of atoms using Hydrogen donors have several advantages over catalytic hydrogenation or reductions via metal/acidic medium, especially due to low complexity involved in experimental development, and in addition to low toxicity of the products. In addition to this and taking the precepts of green chemistry, it is preferred the production of new compounds preventing the generation of hazardous wastes and minimizing the impact on health and the environment. Thus, the goal of this paper is to provide an alternative process for the reduction of nitro compounds by using: a) the Pd/H2N-NH2 system in very easy conditions, and b) alternative heating such as microwave energy, with good yields and very short reaction periods.
La reducción de nitrocompuestos a aminas es un paso esencial en lo que quizá sea la vía de síntesis más importante en la química aromática.
Los nitrocompuestos aromáticos tienen pocos usos directos; sin embargo, las aminas aromáticas resultantes de la reducción de dichos nitrocompuestos se pueden convertir en una amplia gama de productos (Burke y Danheiser, 1999; Li et al., 2006) con aplicaciones tan diversas como: colorantes, productos farmacéuticos, materias primas para la formación de diversos grupos funcionales.
Los nitrocompuestos pueden reducirse de dos maneras generales: a) por hidrogenación catalítica (Rylander, 1985; Tafesh y Weigunty 1996), y b) por reducción química vía la transferencia de hidrógeno proveniente de un donador adecuado (Brieger y Nestick, 1974). Al comparar la reducción catalítica utilizando hidrógeno molecular con la reducción química vía transferencia de donador de hidrógeno, esta última tiene varias ventajas como el evitar el uso de gases inflamables y la mayor quimioselección que puede obtenerse en las reacciones.
Nuestra propuesta considera la reducción de nitrocompuestos utilizando sistemas de reacción sumamente sencillos e incorporando medios alternativos de suministro de energía como las microondas, lo cual además tiene la ventaja de reducir sustancialmente los tiempos de reacción y rendimientos superiores.
AntecedentesExisten diversas formas de reducción para la formación de aminas a partir de nitrocompuestos, entre ellas: a) reducción con un metal en medio ácido (Burke y Danheiser, 1999); b) utilización de sulfuros de amonio (Wingrove y Caret, 1990), y c) hidrogenación de transferencia catalítica, dentro de la cual se conocen sistemas como: 1) NH4C1/Zn en medio acuoso (Kamm, 1941; Tsukinoki y Tsuzuki, 2001), 2) ci-clohexano/Pd (Entwistle, Johnstone y Povall, 1975) e inclusive 3) Mg/H2N-NH2 (Abiraj y Gowda, 2002). Si bien es cierto que varios de los métodos mencionados presentan una alta selectividad (Entwistle, Johnstone, Povall, 1977) y elevados rendimientos de conversión, algunos requieren de medios ácidos muy fuertes o bien generan productos altamente tóxicos, como el amoniaco o los sulfuros que tienen un impacto negativo en el ambiente o bien presentan dificultades en su manejo experimental, como por ejemplo: la hidrogenación catalítica (Rylander, 1985; Tafesh y Weigunty 1996). La alta difusión presentada por el H2 puede conducir a largos periodos de reacción debido al tiempo tan corto en que el H2 permanece en contacto con la solución y el catalizador; además, el H2 es un gas inflamable y su manipulación presenta riesgos considerables.
Se conocen antecedentes del uso del sistema Pd/H2N-NH2 con calentamiento convencional en la reducción de grupos nitro (Kamm, 1973) con buenos resultados. También existen estudios de reducciones de este tipo utilizando sistemas con microondas (Quinn et al., 2010), y ultrasonido (Ung et al., 2005), pero en ningún método se utiliza el sistema de Pd/H2N-NH2 y en varios de ellos se propone el uso de catalizadores sumamente complejos (Spencer et al., 2007; Spencer et al., 2008), por lo cual se decidió estudiar el sistema Pd/H2N-NH2/microondas y efectuar una reducción de una serie de nitrocompuestos y así obtener las aminas correspondientes. En este trabajo demostramos que se pueden obtener diferentes arilaminas por reducción de grupos nitro en condiciones menos severas y mediante el uso de Pd/C como catalizador de fácil recuperación, además de usar sistemas de calentamiento alternativos basados en hornos de microondas de tipo doméstico, muy económicos, lo cual reduce sustancialmente los tiempos de reacción. Todo ello, cumpliendo algunos de los principios de química verde y siguiendo un protocolo de química amigable con el medio ambiente (Ávila et al., 2011).
ResultadosA continuación se describen dos métodos utilizados para la obtención de aminas por reducción de nitrocompuestos.
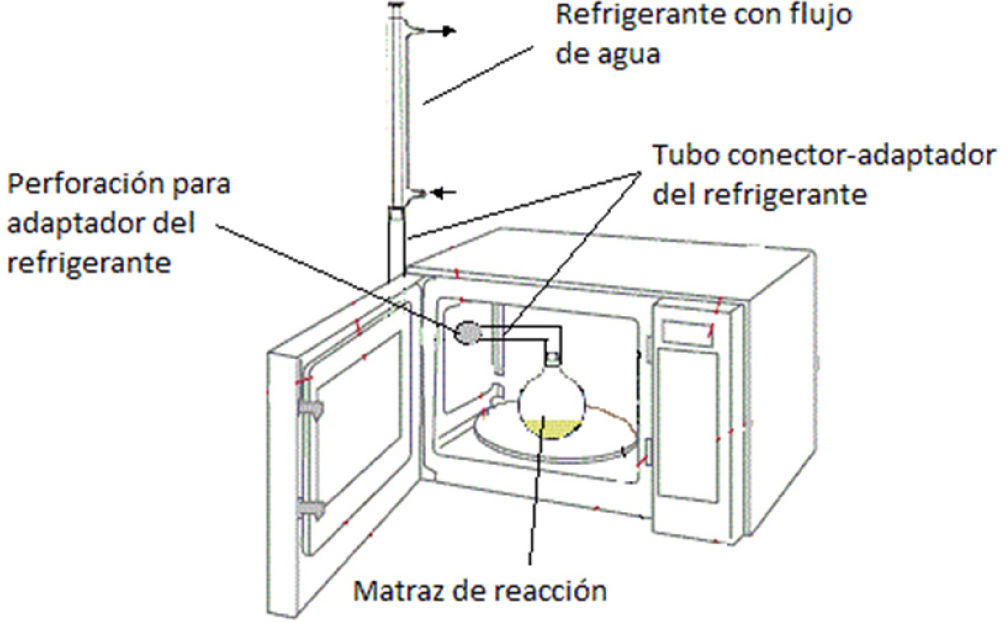
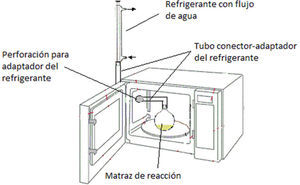
Se realizaron dos ensayos clave: a) uso del sistema Pd/ H2N-NH2 con calentamiento convencional a reflujo de etanol, y b) sistema Pd/H2N-NH2 con calentamiento por horno de microondas doméstico con adaptación de sistema de reflujo (figura 1).
Las condiciones de reacción se muestran en la tabla 1.
En primer lugar se desarrollaron los protocolos denominados convencionales, los cuales involucran un calentamiento por método clásico (mantilla de calentamiento) hasta lograr mantener en reflujo el disolvente utilizado, en este caso etanol, durante una hora. A continuación, se desarrollaron los protocolos por calentamiento con microondas y sistema de reflujo; para ello se utilizó un horno de microondas de tipo doméstico de 1000 W de potencia irradiado por 2 minutos a su máxima potencia (figura 1). En ambos casos se utilizaron las mismas cantidades de disolvente, de agente reductor y de catalizador. Los resultados obtenidos se muestran en la tabla 2.
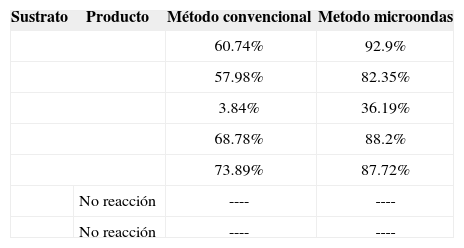
Resultados experimentales para la reducción de nitrocompuestos con el sistema NH2-NH2 · H2O.
| Sustrato | Producto | Método convencional | Metodo microondas |
|---|---|---|---|
| 60.74% | 92.9% | ||
| 57.98% | 82.35% | ||
| 3.84% | 36.19% | ||
| 68.78% | 88.2% | ||
| 73.89% | 87.72% | ||
| No reacción | ---- | ---- | |
| No reacción | ---- | ---- | |
*Todos los compuestos fueron identificados por 1H-RMN y espectrometría de masas.
Como puede observarse, los rendimientos de conversión son mayores cuando se utiliza la técnica de calentamiento por medio de microondas, lo cual puede deberse a diversos factores mencionados a continuación.
Cuando se utiliza el sistema de calentamiento convencional, la distribución de la energía se basa en la convección, la cual depende del fluido en cuestión. Éste es un método más lento de transmisión de la energía, que además tiene como consecuencia pérdida de la misma también debido a la conducción a través de la mantilla de calentamiento, así como en todo el material utilizado; por ello, la cantidad de energía neta que llega a los reactivos es menor y poco homogénea, lo cual retrasa sustancialmente el avance de la reducción.
En relación con el uso de microondas, éstas permiten un calentamiento muy rápido en todas las moléculas polares presentes desde el seno de la reacción, lo cual se traduce en una mayor eficiencia, y que entre el 50 y el 90% de la energía suministrada se convierte en calor. La energía es trasmitida por radiación ya no depende del medio para dispersarse, por lo que de manera muy rápida puede excitar las moléculas en la reacción, lo cual se traduce en un mayor número de colisiones efectivas que derivan en rendimientos más elevados.
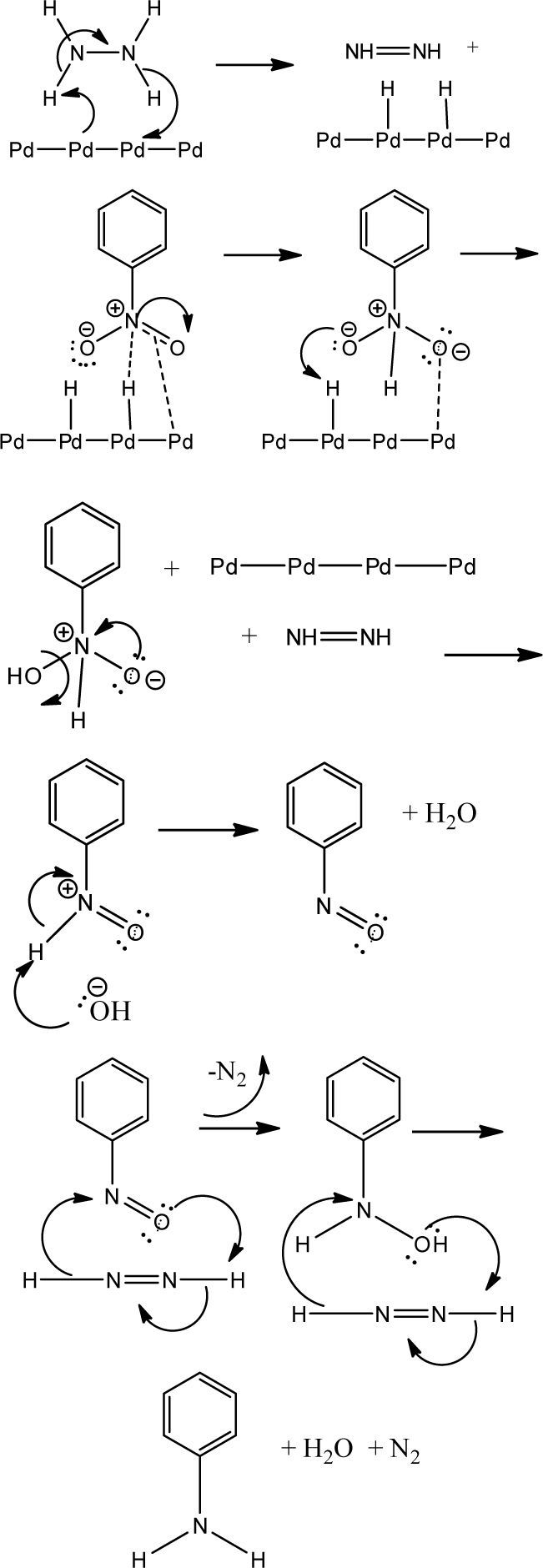
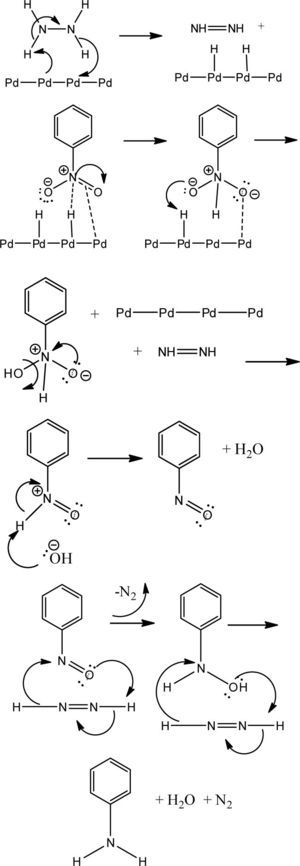
Además de lo anterior, es muy importante la quimiose-lección derivada de la sustitución presente en el sistema aromático. Es destacable observar cómo, para los sustratos con sustituyentes activadores, los rendimientos son mucho mayores que para aquellos que presentan grupos desactivadores. Esto muy probablemente esté relacionado con el mecanismo propuesto (House, 1972) (figura 2) para la reducción de grupos nitro en presencia del sistema Pd/H2N-NH2.
Como se puede observar, es necesaria una cierta densidad electrónica en el doble enlace del sistema resonante del grupo nitro para que se lleve a cabo la coordinación con el complejo de Pd activado y de esta manera se genere la transferencia de hidrógeno en el primer paso de la inserción reductiva. Es de esperar que si se tienen grupos electro-atractores en el sistema aromático, dicha densidad electrónica requerida se vea mermada y por lo tanto, la primera inserción de hidrógeno no se lleve a cabo con facilidad, lo que muestra la escasa conversión con la consecuente disminución en el rendimiento del producto reducido. Cabe destacar que para los compuestos dinitrados no se observa en ningún caso la doble reducción y la obtención de la feni-lendiamina, no obstante que se tengan grupos electrodona-dores en el sistema arílico. Este resultado está en contraposición con lo ya discutido; sin embargo, esto podría deberse a que una vez formado el grupo amino en la primer reducción, este grupo interactúe de alguna manera como lo hace la hidracina con el Pd y eso lleve a la inactivación del catalizador, con la consecuente pérdida del ciclo catalítico, lo que impide la inserción reductiva de los hidrógenos sobre el segundo grupo nitro, deteniéndose la reacción en la formación de un solo grupo amino.
Generalmente los experimentos realizados en los laboratorios de enseñanza son protocolos tomados de la de la literatura de procesos de investigación y posteriormente adaptados, dando como resultado una réplica de reactivos, material y equipo para efectuar tal experimento. No se consideran algunos aspectos relevantes para ilustrar y entrenar al alumno que desarrolla los experimentos con los conceptos de eficiencia, uso de reactivos que se transformen en productos y subproductos no tóxicos, y utilizando materiales y equipo de fácil acceso. En este trabajo se presenta el diseño y desarrollo de un experimento de importancia química como es la reducción, que el alumno podrá realizar utilizando equipo y material económico y de fácil acceso. Aunque los reactivos utilizados tienen cierta toxicidad (como la hi-dracina), los subproductos obtenidos en la transformación (H2, N2 y H2O) no son tóxicos; además, el experimento cumple varios principios de Química Verde: 1) Prevenir la generación de residuos. La hidracina prácticamente se transforma en hidrógeno (H2) y nitrógeno (N2); 2) Reducir los residuos. El diseño de este experimento minimiza la generación de residuos (etanol, agua y N2); 3) Uso de disolventes seguros y de baja toxicidad: etanol y agua; 4) Uso eficiente de la energía eficiente, ya que se reduce su uso al emplear microon-das, y 5) Uso de catalizadores (paladio) en cantidades muy pequeñas.
Metodología experimentala)Sistema con calentamiento convencionalEn un matraz bola de dos bocas de 50 mL se colocan 1 g del nitrocompuesto (1 Eq), 10 mL de etanol, 1 mL de H2O y 0.04 g de Pd/C al 5 %. Se adapta un sistema de reflujo. Lentamente se adicionan 5 Eq de H2N-NH2-H2O y se calienta la mezcla a reflujo por una hora. Transcurrido dicho tiempo se permite que la mezcla enfríe a temperatura ambiente y se filtra sobre celita para recuperar el Pd/C. El filtrado se concentra a un tercio de su volumen mediante vacío y se adiciona agua fría en pequeñas porciones hasta cristalizar el producto, el cual se filtra al vacío. La pureza de los productos crudos es muy buena. Sin embargo, se puede recristalizar de EtOH-H2O y se seca al vacío.
b)Sistema con calentamiento por microondasEn un matraz bola de dos bocas de 50 mL se colocan 1 g del nitrocompuesto (1 Eq), 10 mL de etanol, 1 mL de H2O, y 0.04 g de Pd/C al 5%. Se adapta el sistema de reflujo especial al horno de microondas doméstico modificado (figura 1). Lentamente se adicionan 5 Eq de H2N-NH2-H2O. La mezcla de reacción se calienta a la máxima potencia en intervalos de 15 segundos, hasta completar la reacción en dos minutos. Transcurrido dicho tiempo se permite que la mezcla enfríe a temperatura ambiente y se filtra sobre celita para recuperar el Pd/C. El filtrado se concentra a un tercio de su volumen mediante vacío y se adiciona agua fría en pequeñas porciones hasta cristalizar el producto, se filtra y seca al vacío.
ConclusionesEl análisis de resultados muestra que utilizando esta nueva metodología es posible lograr mejores resultados que los obtenidos con el método tradicional. Los rendimientos son superiores a los descritos con otros métodos, menores tiempos de reacción, subproductos no tóxicos y recuperación del catalizador de una manera sencilla utilizando material y equipo económico, sencillo y de fácil acceso. Se comprueba que el sistema Pd/H2N-NH2 es un método eficiente para la reducción de nitrocompuestos hacia las correspondientes aminas en condiciones suaves de reacción y con una alta quimioselección.
Esta investigación fue financiada por la Facultad de Química de la Universidad Nacional Autónoma de México (UNAM). La adquisición de espectros fue realizada por Rosa I. del Villar, Georgina Duarte, Margarita Guzmán y Maricela Gutiérrez.