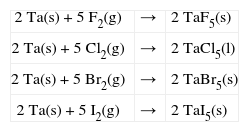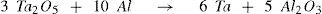Tantalum, a malleable metal, ductile, of high melting point, is mainly used to obtain special alloys, capacitors, and plates for skull fractures repairing, among other applications. Considering the importance of this element, in this article we describe its history, properties and applications.
Tántalo, un metal maleable, dúctil, de alto punto de fusión, es utilizado primordialmente en la obtención de aleaciones especiales, capacitores, placas para reparar fracturas de cráneo, entre otras cuestiones. Al considerar la importancia de este elemento describimos aquí su historia, propiedades y aplicaciones.
O tântalo (Ta) é um elemento metálico encontrado em baixíssima concentração na crosta terrestre, predominantemente no minério tantalita, (Fe, Mn)O·Ta2O4, ou, em menor concentração, no minério columbita (Fe, Mn)O·(Nb, Ta)2O4 (Friend, 1951). Sua história encontra-se vinculada à do nióbio, uma vez que esses elementos tendem a ser encontrados juntos na natureza, sendo, portanto, suas descobertas realizadas na mesma época, mas curiosamente por pesquisado-res de diferentes países (Sousa, 2012).
Anders Gustaf Ekeberg (1767-1813), químico e mineralogista sueco, graduou-se na Universidade de Uppsala em 1788 e, seis anos mais tarde, tornou-se professor desta insti-tuição. Devido a uma forte febre quando criança, Ekeberg apresentava algumas defciências físicas, sendo que em 1801, após a explosão de um balão de reação em suas mãos durante um experimento, perdeu a visão de um olho (Weeks, 1933). Assim que iniciou seus estudos em química, Eke-berg se interessou pelos minerais e seus constituintes. Em 1802, durante a análise de minerais oriundos de Kimito (província da Finlândia) e de Ytterby (vila próxima de Vax-holm, na Suécia), Ekeberg encontrou um óxido de um novo elemento que não se dissolvia em meio ácido (Weeks, 1933). Fazendo uma alusão à mitologia grega, Ekeberg nomeou-o de tântalo, que era um dos filhos de Zeus condenado pelos deuses a passar fome e sede, mas debaixo de uma árvore repleta de frutos e com água até os joelhos, porém a água e os frutos se afastavam dele e, portanto, sua condição de fome e sede era permanente, pois ele não conseguia reagir àquela situação. Assim, essa foi a origem do nome do elemento que se apresentava pouco reativo em meio ácido (Weeks, 1933; Greenwood, 2003). Em 1802, Ekeberg fez o comunicado de suas descobertas à revista francesa Annales de Chimie, sendo então aclamado como o descobridor do elemento químico de número atômico 73 da Tabela Periódica (Friend, 1951). No mesmo ano, o químico inglês Charles Hatchett (1765-1847) publicou na revista Proceedings of the Royal Society of London a descoberta de um elemento que denominou de columbio e ao minério de columbita, devido ao fato de ser oriundo da América (Griffith, 2003). Em 1809, William Hyde Wollaston (1766-1828), químico e físico in-glês, durante a análise dos óxidos presentes em minérios de columbita (cedidos cordialmente por Hatchett) e tantali-ta, concluiu que, embora os óxidos dos minerais apresen-tassem densidades diferentes, os elementos dos óxidos eram idênticos e publicou o artigo “On the identity of co-lumbium and tantalum” na revista Philosophical Transactions of the Royal Society of London (Weeks, 1933; Greenwood, 2003; Wollaston, 1809). Somente em 1846, Heinrich Rose (1795-1864), mineralogista e farmacêutico alemão, após seu estudo da columbita de Bodenmais na Bavária, publicou na revista Annalen der Physik under der Chemie von Poggendorff, que o minério continha o óxido de tântalo de Ekberg e óxido de um outro elemento químico que denominou de nióbio (na mitologia Grega seria a filha de Tântalo). Mais tarde, foi verificado que, na verdade, o nióbio era o columbio descoberto por Hattch. Assim, Rose verificou que a columbita apresentava uma mistura de óxidos de nióbio e tântalo, sendo o primeiro em maior concentração, e a tantalita apresentava essencialmente o óxido tântalo (Friend, 1951; Weeks, 1933).
Devido à extrema dificuldade, os óxidos ácidos de tânta-lo e nióbio somente foram isolados em 1866 pelo químico suíço Jean-Charles Galissard de Marignac (1817-1894). Atra-vés de seu artigo publicado na revista Annales de Chimie et de Physique, Marignac comprovou a existência do nióbio e do tântalo, através do tratamento da columbita com ácido fluorídrico, resultando na separação do sal pouco solúvel fluortantalato de potássio (K2TaF7) e do sal solúvel fluor-oxi-columbato de potássio (K3NbOF5·2H2O) (Weeks, 1933; Greenwood, 2003).
Em 1903, Werner von Bolton (1868-1912), químico ale-mão, desenvolveu o refino do metal através de fornos a arco elétrico sob vácuo e transformou o pó metálico em flamen-tos. Dois anos mais tarde, o tântalo metálico começou a ser utilizado comercialmente como filamento de lâmpadas elétricas devido ao seu elevado ponto de fusão (2980°C), subs-tituindo, portanto os frágeis filamentos de carbono. Seu uso durou cerca de seis anos, quando então o tungstênio, que apresenta ponto de fusão ainda mais elevado, passou a ser utilizado (Friend, 1951; Weeks, 1933).
No que se refere ao tântalo na natureza, é interessante comentar que as propriedades físico-químicas do tântalo são semelhantes as do nióbio e, devido a isso, eles tendem a serem encontrados juntos na natureza e separá-los é muito difícil. Um dos possíveis métodos de separação consiste em usar metil-isobutil-cetona em meio ácido (hidrometalurgia1) (Ayanda, 2011). Esse procedimento permite isolar o pentóxi-do de tântalo (Ta2O5) que prontamente pode ser reduzido pelo alumínio (aluminotermia), gerando tântalo e óxido de alumínio.
A disponibilidade de recursos mundiais de tântalo é de cerca de 193,3 mil toneladas, distribuídos nas Américas (Brasil, 40,1% e Canadá 2,6 %), na Austrália (35,7 %), África (8,3 %), Ásia (8,3 %) e Oriente Médio (7,3 %) (Rodrigues, 2009). Atual-mente, o Brasil e a Austrália são os maiores fornecedores mundiais de tântalo. Com relação ao Brasil, o país produz mais de 18 % do tântalo consumido e a maior parte do metal minerado (~ 95%) é exportada, principalmente para os Países Baixos, China, Estados Unidos, Estônia, Hong Kong e Ja-pão. Curiosamente, o país importa produtos industrializados, principalmente capacitores, que são provenientes da África do Sul, Áustria e Federação Russa (DNPM, 2008). No que se refere a outras regiões produtoras, é importante destacar que 60 % do total das reservas africanas se localizam no leste da República Democrática do Congo, na forma de coltan, ou seja, tantalita associada à columbita. Devido à raridade deste metal e sua elevada procura no mercado mundial, esse país vivencia conflitos civis devido ao interesse da população em explorar o coltan de maneira ilícita. Os países compradores do minério explorado ilegalmente, de certa forma financiam a guerra civil no Congo. Por isso, os minerais dos quais são extraídos o tântalo e o nióbio são chamados de “minerais de confito” (Harmon, 2011).
O Tântalo é um sólido metálico de cor prateada, macio, dúctil, de elevado ponto de fusão (um dos maiores do quadro periódico) e muito resistente à corrosão devido à for-mação de uma película superficial de óxido, chamada de camada de passivação. Quando combinado exibe vários estados de oxidação, sendo o +5 o mais comum. À temperatura ambiente não reage com o ar, a água, ou ácidos, exceto o fluorídrico ou sua mistura com o nítrico. Sob aquecimento reage com a maioria dos elementos não metálicos, gerando produtos que frequentemente são intersticiais e não este-quiométricos. Também reage com bases fundidas. Tântalo em seu estado de oxidação mais elevado (+5) tende a formar polioxoânions, como exemplo, [Ta6O19]8-. Uma outra característica interessante é a formação de clusters, com-postos que apresentam ligação metal-metal, e que tem atraído certo interesse teórico. Atualmente, muitos com-postos organometálicos contendo tântalo são conhecidos, um composto digno de nota é um que contém o ligante ci-clopentadienil [Ta(η5-C5H5)2(η1-C5H5)2], no qual dois dos anéis ciclopentadienila se ligam com hapticidade η5 e dois com η1. Por possuir apenas dois isótopos estáveis, sua mas-sa atômica foi determinada com grande precisão (Greenwood, 2003). Na tabela periódica localiza-se no 6° período, grupo 5, bloco d.
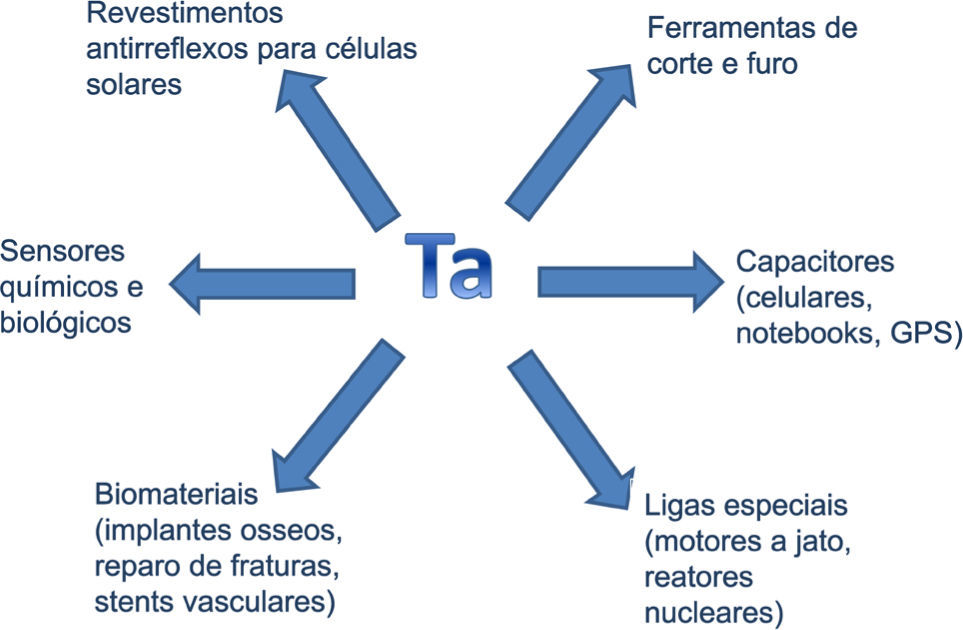
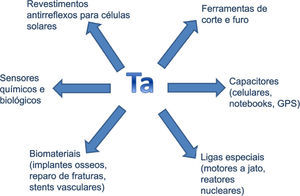
O tântalo apresenta uma variedade de aplicações, seja o metal puro, seu óxido ou ligas. Este fato se deve a proprie-dades como inércia química (baixa reatividade), ótima duc-tibilidade, alto ponto de fusão, elevada capacitância e excelente condução de calor e eletricidade.
Atualmente, uma das maiores aplicações do tântalo é na fabricação de componentes eletrônicos. O uso do metal em capacitores tem contribuído para a miniaturização de circuitos eletrônicos. Capacitores são constituídos basicamen-te de um filme dielétrico (óxido metálico). A capacitância dos capacitores está relacionada à sua área, à espessura do filme dielétrico e a constante dielétrica deste. Quanto maior a constante dielétrica do filme, maior é a capacitância do material e, portanto, maior é o armazenamento de energia. Capacitores de tântalo são formados pelo metal e pelo filme do óxido que é formado sobre o metal. Uma vez que a constante dielétrica do óxido de tântalo é elevada, é necessário uma área menor para atingir a mesma capacitância de outro óxido metálico, como por exemplo, o óxido de alumínio. Isto resulta em equipamentos menores e mais leves (Balaj, 2002; Turner, 2005). A maior demanda para o tântalo está na indústria de telefonia (aparelhos celulares) e de equipamentos eletrônicos (computadores, laptops, vídeo filmadoras, câmeras digitais, televisores e carregadores de bateria), mas também é muito empregado na indústria de armamentos, aeroespacial, naval e automotiva (ligas especiais, “airbags”, freios ABS e aparelhos de GPS) onde dispositivos eletrônicos são necessários. Também é encontrado em guias de onda ópticas, dispositivos de ondas e transistores (Chaneliere, 1998).
Alguns dados sobre o tântalo e suas propriedades físico-químicas.
| Símbolo | Ta |
| Número atômico | Z = 73 |
| Massa molar | M = 180,947882 g mol–1 |
| Ponto de fusão | Tf = 2980 °C |
| Ponto de ebulição | Te = 5534 °C |
| Densidade | 16,65 g/cm³ |
| Isótopos naturais | 180Ta (0,012 %), 181Ta (99,988 %) |
| Resistividade elétrica (20 °C) | 12,4 µΩm |
| Condutividade térmica | 57,5 W/(m °C) |
| Estrutura cristalina | Cúbica de corpo centrado |
| Eletronegatividade | 1,5 (Pauling) |
| Configuração eletrônica | [Xe]4f145d36s2 |
No que se refere às ligas metálicas, por ser muito duro e exibir elevado ponto de fusão (cerca de 3800 °C), o carbeto de tântalo (TaC) é utilizado em ferramentas de corte, furadei-ras e máquinas trefiladoras. Por sua vez, suas ligas especiais são utilizadas em motores a jato, reatores nucleares e equipamentos onde uma alta resistência mecânica é necessária.
Na área médica e odontológica, o tântalo é utilizado em implantes cirúrgicos. Isso se deve a sua biocompatibilidade, pois sua inércia química faz com que não seja corroído por fluidos corporais e ao mesmo tempo não cause irritações no tecido vivo, não sendo, portanto, rejeitado pelo organismo. Assim, o tântalo tem sido utilizado em placas para repa-ração de fraturas no crânio, em parafusos para fixar ossos quebrados, pinos, fios e aplicações dentárias. Também é utilizado em “stents” vasculares para evitar colapso de artérias (TIC, 2012; Black, 1994). O tântalo não possui qualquer função biológica conhecida, apesar do corpo humano apresentar quantidades mensuráveis (aproximadamente 0,2 mg) (Greenwood, 2003).
Por fim, filme de óxido de tântalo (Ta2O5) é utilizado como um material de revestimento antirreflexo para células solares de silício, devido a sua elevada estabilidade química, elevado índice de refração e um coeficiente de absorção muito baixa. O filme também é utilizado em sensores químicos e biológicos por ser sensível a grande variedade de componentes. No caso de sensores químicos, destaca-se o sensor de pH e no caso do sensor biológico destaca-se a de-tecção de proteínas que se baseia na variação da capacitân-cia dos filmes de óxidos (em que anticorpos ou receptores estão ligados) durante a ligação do antígeno. Halogenetos de tântalo têm sido utilizados na indústria petroquímica como catalisadores, contudo, foi evidenciado que cloreto de tântalo (TaCl5) pode ser utilizado como um catalisador na síntese de compostos organomagnésio (Sultanov, 2012).
NotasAluminotermia: Obtenção de altas temperaturas por re-ação do alumínio em pó com vários óxidos metálicos.
Biocompatibilidade: Que não produz efeitos adversos sobre os tecidos biológicos.
Capacitância: Capacidade de armazenamento de energia elétrica.
Capacitor: Dispositivo eletrônico que tem como função armazenar cargas elétricas e consequentemente energia eletrostática.
Filme fino: Película, lâmina delgada.
Hapticidade: (ηx) É o número de átomos de carbono ligados ao átomo metálico.
Hidrometalurgia: É o uso de processos químicos que ocorrem em solução aquosa para separar um mineral de seu minério ou um elemento específico de outros
Liga metálica: São materiais que possuem propriedades metálicas características e que são constituídos por no mínimo dois elementos.
Não estequiométrico: Composto sólido no qual os números dos átomos dos elementos presentes não podem ser expressos como uma razão de pequenos números inteiros (não obedecem a lei das proporções definidas). Por exemplo, o óxido de ferro tem proporções de ferro que variam de Fe(0,89)O a Fe(0,95)O.
Organometálico: Composto que contém uma ou mais ligações metal-carbono.