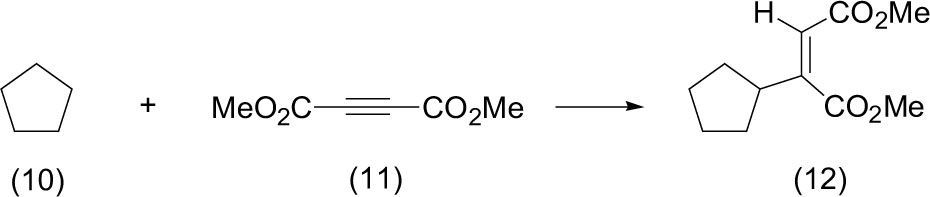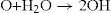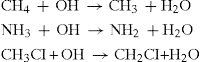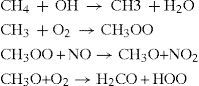The primary source of energy for nearly all chemical transformations on Earth is the Sun. These photoprocesses have been the main sources for the origin of life, and their evolution has been a basis for the succession of abiotic and biotic evolutions. This is so because sunlight is the primary source for synthesis of organic matter and one of the main factors of biotic evolution and, because also was the main source of energy for abiogenesis of substances. The light of the Sun can be used directly for changing chemical structures photochemically. Since light is regarded as a clean reagent, photochemistry can contribute efficiently to the growing field of Green Chemistry. Such reactions using sunlight are inexpensive and easily scaled up for compounds synthesis. Some phototransformations that have been studied are: Cycloadditions, Photo-reduction, Photo-oxidation, photolysis and others.
Por convención, hoy podemos clasificar como energías cinética y potencial a los dos tipos dominantes de energía. No obstante, hemos entrado a su clasificación también en virtud de la fuente de aprovisionamiento de la energía como: energía nuclear, energía hidráulica, energía solar, energía geotérmica, energía eólica, energía del mar y bioenergía, entre otras. Una de las más importantes por su origen y duración es la energía solar (para que se agote pasarán aproximadamente cinco mil millones de años en los que se consumirá hidrógeno en el Sol de manera estable).
La energía solar es una de las más importantes ya que de ella podemos obtener energía por radiación directa, sea en forma de calor, electricidad o directamente mediante foto-transformaciones, es decir, reacciones fotoquímicas.
Si bien es cierto que nuestros experimentos fotoquímicos dependen de la intensidad de la luz solar que llega a la Tierra y ésta varía con el tiempo del día y año, la ubicación, y las condiciones meteorológicas (Chatti, 2007), el total de energía a diario o anualmente se llama irradiación e indica la fuerza de la luz solar. La irradiación es generalmente expresada en unidades Wh/m2 por día o kWh/m2 por día. Para tener un dato que nos señale qué cantidad de energía proporciona la luz del Sol podemos hacer algunos cálculos simplificados. La participación de los rayos solares se puede expresar mediante la energía solar en los equivalentes de las horas de luz del Sol. La luz brillante del Sol corresponde a una potencia de 1000 W/m2 (1 kW/m2), de tal manera que al final de una hora de luz solar corresponde una cantidad de energía de 1 kWh/m2. Esto es aproximadamente la energía solar cuando el Sol brilla en un día despejado en el verano en una superficie de 1 m2 perpendicular al Sol. Para esta medición se puede utilizar un medidor de luz. Y así podemos tener un dato que nos indique la cantidad de energía solar utilizada en nuestra foto-transformación a través de la irradiación de la luz solar.
Esta energía radiante producida en el Sol, como resultado de reacciones nucleares de fusión, llega a la Tierra a través del espacio en cuantos de energía llamados fotones, que interactúan con la atmósfera y la superficie terrestres. La intensidad de la radiación solar en el borde exterior de la atmósfera, si se considera que la Tierra está a su distancia promedio del Sol, se llama constante solar, y su valor medio es 1370 W/m2 (aprox. 2 cal/min/cm2). Sin embargo, esta cantidad no es constante, ya que parece ser que varía un 0.2% en un periodo de 30 años. La intensidad de energía real disponible en la superficie terrestre es menor que la constante solar debido a la absorción y a la dispersión de la radiación que origina la interacción de los fotones con la atmósfera. La irradiación es la magnitud utilizada para describir la potencia incidente por unidad de superficie de todo tipo de radiación electromagnética y se mide en W/m2.
Algunas de las transformaciones fotoquímicas fundamentales que se llevan a cabo en la atmósfera implican la irradiación solar sobre moléculas sencillas. A continuación ilustramos algunas de ellas.
Reacciones fotoquímicas en medio abióticoRadicales hidroxilo e hidroperoxilo en la atmósfera El radical hidroxilo HO es la especie simple reactiva intermediaria más importante en los procesos químicos atmosféricos. Se forma por varios mecanismos. A elevadas altitudes se produce por la interacción de átomos de oxígeno y agua (Levy, 1971).
En presencia de materia orgánica el radical hidroxilo (Kamat, 2009) se produce en cantidades abundantes como intermediario en la formación de neblumo o smog fotoquímico. Hasta cierto punto en la atmósfera y en ensayos de laboratorio, el HO se obtiene de fotólisis del vapor de ácido nitroso.
Una de las reacciones fundamentales que se efectúan en la atmósfera ocurre a partir del radical hidroxilo. Esta especie, esencialmente oxidante, puede reaccionar con otros compuestos para abstraer hidrógeno y dar lugar a la formación de nuevas especies de radicales tales como:
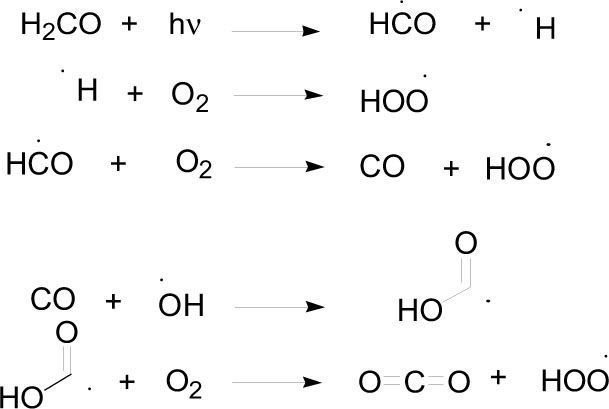
Otro de los procesos de abstracción de hidrógeno es el que se ejemplifica a continuación con la siguiente secuencia de reacciones en la que interaccionan el metano con el radical hidroxilo; vía radicales se acaba por oxidar el metano a formaldehido.
Una vez formado el formaldehido (H2CO) puede seguir la transformación hasta formar el monóxido de carbono, el cual es un intermediario estable que puede transformarse hasta formar dióxido de carbono.
La energía es un requisito esencial para la vida humana (Solomon, 1999). Sin embargo, las fuentes convencionales de energía llamados combustibles fósiles no son suficientes para satisfacer la demanda creciente de energía. La humanidad ha recibido de la naturaleza el regalo de la energía solar y de tiempos inmemorables el hombre ha tratado de explorar la utilización de esta fuente vasta y abundante de energía. El uso de la energía solar es un aspecto muy interesante de la ciencia. Por lo tanto la foto-catálisis solar ha llegado a ser un ámbito de la investigación muy importante, en donde la luz del Sol es la fuente de iluminación para realizar diferentes reacciones foto-catalíticas. La luz visible (4400 nm) es un componente mayor de la luz del Sol en comparación con la luz UV-visible, que es sólo aproximadamente 4% de la radiación solar total. Entonces la luz visible es el componente mayor de la radiación solar, y un sistema estable de foto-catálisis.
Reacciones fotoquímicas en medio bióticoLa fuente primaria de energía para casi toda vida es el Sol. Estos foto-procesos han sido un director para el origen de la vida, y su evolución ha sido una base para la sucesión de evoluciones no bióticas y bióticas porque la luz del Sol es la fuente primaria para la síntesis de materia orgánica y uno de los principales factores de la evolución biótica, y la luz solar fue la principal fuente de energía para el abiogénesis de sustancias. Una de las primeras foto-transformaciones es la fotosíntesis.
La fotosíntesis (Cavallaro, 2009) ocurre en organelos específicos llamados cloroplastos, que se encuentran en células fotosintéticas, es decir, en células expuestas al Sol. En plantas terrestres estas células están en las hojas y los tallos verdes (los tallos leñosos tienen células muertas que forman la corteza). Existen también algas fotosintéticas que no poseen cloroplastos, pues son organismos unicelulares procariontes (sin núcleo verdadero ni compartimientos celulares) y también realizan la fotosíntesis. Estas células, llamadas cianofitas o algas verde azules, son seguramente muy similares a los primeros organismos fotosintéticos que habitaron nuestro planeta y realizan la fotosíntesis en prolongaciones de su membrana plasmática y en su citoplasma.
Como sabemos el espectro lumínico que proviene del Sol se puede descomponer en diferentes colores a través de un prisma, cada color corresponde a una cierta longitud de onda de la luz, cada pigmento puede capturar un tipo distinto de longitud de onda β. Pero para hacer más eficiente la absorción de la luz las plantas utilizan sistemas “trampa” o foto-sistemas, con un pigmento principal como la clorofila a o b y diferentes pigmentos accesorios. A través de estos sistemas los autótrofos pueden aprovechar mejor la energía lumínica.
La fotosíntesis es un proceso que ocurre en dos fases. La primera es un proceso que depende de la luz (reacciones luminosas) y que requiere la energía directa de la luz que genera los transportadores que son utilizados en la segunda fase. La fase independiente de la luz (reacciones de oscuridad), se realiza cuando los productos de las reacciones de luz son utilizados para formar enlaces covalentes carbono-carbono (C–C), de los carbohidratos. Las reacciones oscuras pueden realizarse en la oscuridad, con la condición de que la fuente de energía (ATP) y el poder reductor (NADPH) formados en la luz se encuentren presentes. Investigaciones recientes sugieren que varias enzimas del ciclo de Calvin son activadas por la luz mediante la formación de grupos SH, de tal forma que el término reacción de oscuridad no es del todo correcto. Las reacciones de oscuridad se efectúan en el estroma, mientras que las de luz ocurren en los tilacoides.
Las síntesis (transformaciones no-naturales) fotoquímicas que utiliza luz del Sol naturalLa luz del Sol se puede utilizar directamente para cambiar estructuras químicas de las sustancias fotoquímicamente (Esser, 1994). Dado que la luz es considerada como un reactivo limpio, la fotoquímica puede contribuir eficazmente al creciente campo de la química verde. Las reacciones orgánicas fotoquímicas han utilizado la luz del Sol como fuente de fotones, que es barata y fácil de escalar para la síntesis.
Ciamician (1900) describió en París el trabajo fotoquímico que había llevado a cabo en los últimos diez años. La hipótesis era que la absorción de la luz fue lo que permitió a las plantas sintetizar productos químicos en las células bajo condiciones mucho más suaves que los químicos podrían efectuar en un matraz. Como ahora sabemos, no es exactamente así. Las plantas utilizan energía solar para acumular NADPH y ATP y éstos son utilizados en la síntesis real (térmica) de los productos químicos.
La exposición de un compuesto a la luz del Sol en estado sólido es una de las reacciones más antiguas que se llevaron a cabo en condiciones libres de disolvente. Actualmente se utiliza la foto-transformación en medios acuosos, orgánicos o sin disolventes.
Las transformaciones fotoquímicas han abierto una fascinante variedad de las posibilidades de sintetizar compuestos con alto control en la estéreo-selectividad y enantio-selectividad.
A continuación presentaremos algunas de las transformaciones fotoquímicas. Con las cuales se ilustra la versatilidad de reacciones, además de las condiciones utilizadas para efectuar las síntesis fotoquímicas.
Transformaciones fotoquímicas mediante la luz del Sol- a)
Reacciones con abstracción de hidrógeno
- b)
Cicloadiciones
- c)
Reacciones electrocíclicas en cascada
- d)
Expulsión de moléculas pequeñas
- e)
Foto-oxidaciones
- f)
Foto-reducciones
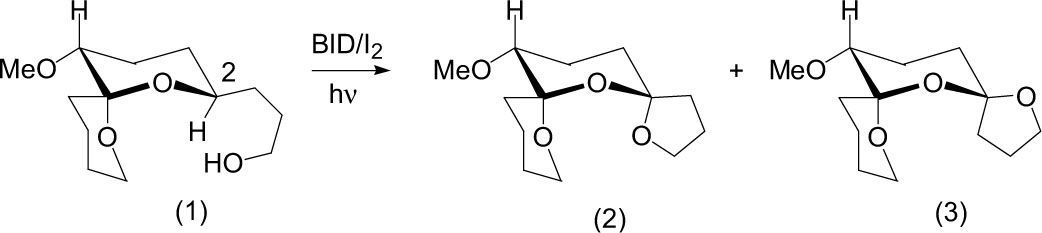
Dorta efectuó (1996) una construcción de espirocetales a partir del carbohidrato (1) funcionalizado con una cadena que contiene un alcohol a través de una abstracción de hidrógeno intramolecular de la posición 2 mediante diacetoxiyodobenceno (DIB) y yodo molecular (I2) como catalizador, ciclohexano como disolvente, a temperatura ambiente y como fuente de energía luz solar. La mezcla de reacción se irradió durante cuatro horas y produjo de esta manera la mezcla isomérica de diespirocetales (2) y (3) en un 56% de rendimiento con una proporción de (1.4:1) respectivamente.
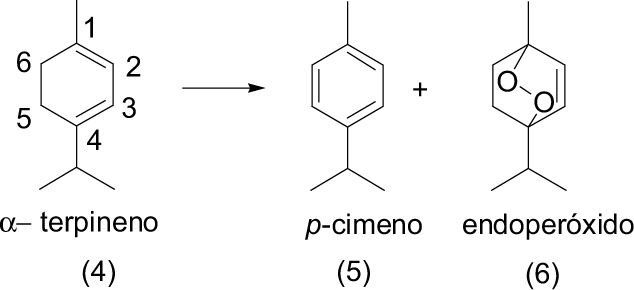
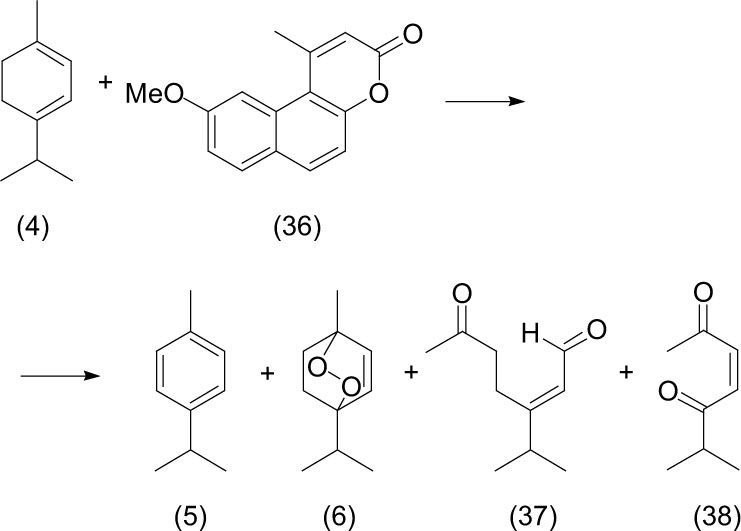
Así también Avsibasi (2003) llevó a cabo la foto-dehidrogenación de un terpeno de origen natural α-terpineno (4) con la formación de p-cimeno (5), producto obtenido de la abstracción de dos hidrógenos de las posiciones 5 y 6. Además de la formación del endoperóxido de α-terpineno (6) este producto formado de la adición 1,4 del oxígeno al doble enlace conjugado del α-terpineno con el uso como disolvente de tetracloruro de carbono (CCl4) la solución fue expuesta a la luz solar durante cuatro horas, en un sistema expuesto al aire.
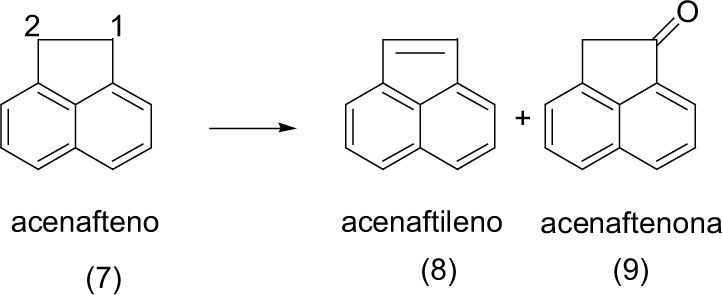
Otra de las materias primas utilizadas para mostrar la abstracción de hidrógeno fotoquímicamente con luz solar es la mostrada a continuación, en donde se utiliza un hidrocarburo aromático policíclico acenafteno (7), el cual se obtiene de la combustión incompleta de materia orgánica. En las mismas condiciones anteriormente descritas (7) se logró la foto-dehidrogenación de los carbonos 1 y 2, que dio lugar al acenaftileno (8). Además se obtuvo el producto de oxidación de la posición 1: la acenaftenona (9).
La funcionalización de cicloalcanos es un proceso de construcción de moléculas orgánicas fundamental y de enorme importancia práctica. Un estudio muy interesante (Doohan, 2000) muestra una abstracción de hidrógeno intermolecular para obtener cicloalcanos funcionalizados. El estudio muestra que cuando se ponen a reaccionar ciclopentano (10), acetilendicarboxilato de metilo (DMAD) (11), benzofenona como foto-mediador en atmósfera inerte de nitrógeno y como fuente de energía luz solar, se observa la transformación completa después de tres horas con el aislamiento del ciclopentano funcionalizado con un fragmento de fumarato de dimetilo (Z)-2-ciclopentil-2-butenodioato (12) como un aceite en un 45%.
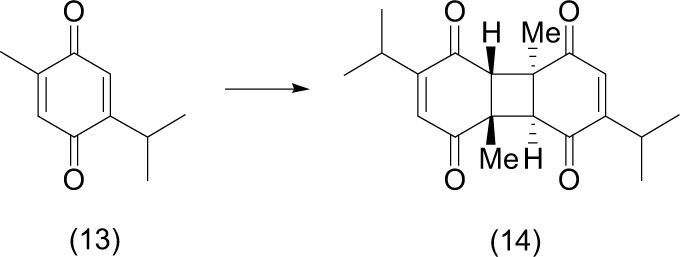
b) CicloadicionesLa primera reacción de fotocicloadición [2+2] (Kaupp, 2001) en estado sólido se observó cuando la timoquinona (13) —un compuesto de origen natural extraído del comino negro y usada en la medicina tradicional por muchos países del Medio Oriente que puede ayudar a combatir el cáncer de páncreas—, fue expuesta a la luz solar, con lo que se obtiene el aducto con el ciclo central de cuatro miembros (14).
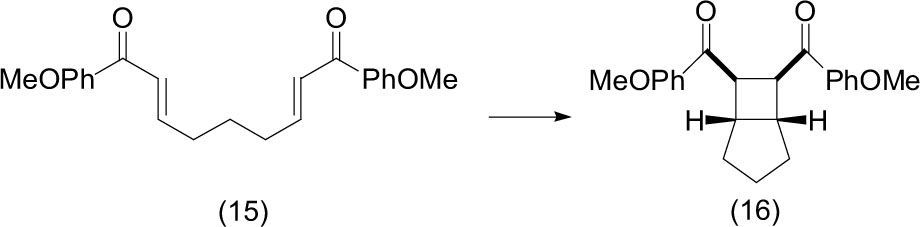
Ischay (2008) mostró una eficiencia extremadamente alta en la foto-catálisis de enonas (15) para efectuar la cicloadición [2+2] con luz solar como única fuente de radiación, y al utilizar como catalizador un compuesto de rutenio (Ru(bipy)3 Cl2), en presencia de etildiisopropilamina (i-Pr2Net), tetrafluoroborato de litio (LiBF4) en acetonitrilo. Estas condiciones dan lugar al ciclo-aducto (16) de una manera eficiente, rápida y con alto rendimiento. Una amplia variedad de arilenonas pueden participar en esta reacción y la diasteroselectividad en la formación de los productos con el anillo de ciclobutano es excelente.
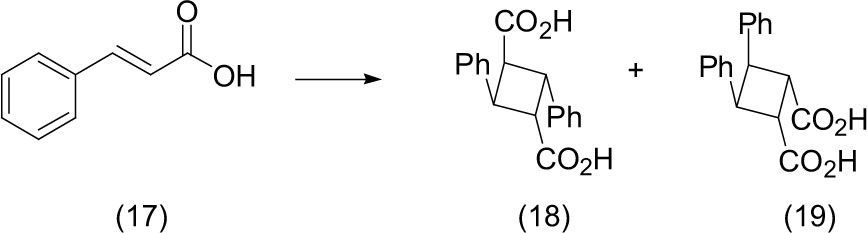
Los ácidos truxílico (18) y truxínico (19) son producidos en las plantas por la dimerización de los ácidos cis- o trans-cinámico. El ácido truxílico ha mostrado actividad antiinflamatoria, mientras que el ácido truxínico ha mostrado actividad anticancerígena.
Por irradiación directa de luz solar del ácido trans-cinámico normal (17) se produce la dimerización, con lo que se forman ácido truxílico (ácido 2,4-difenilciclobutano-1,3-dicarboxílico) y ácido truxínico (ácido 2,4-difenilciclobutano-1,3-dicarboxílico.
Cuando se trata ácido cinámico en solución o en fase sólida irradiada con luz solar durante dos semanas se puede lograr la cicloadición [2+2] de una manera eficiente y sencilla (Bernstein, 1943).
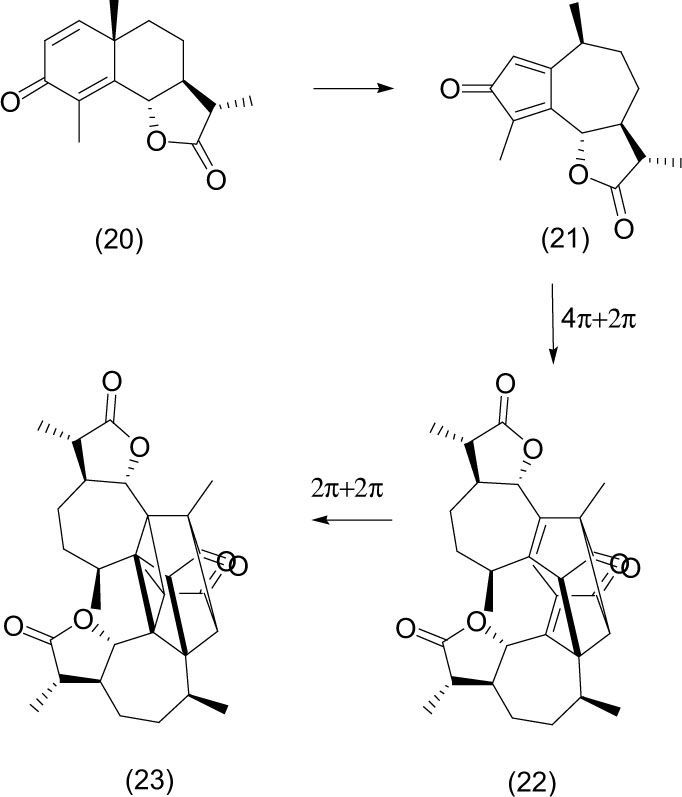
c) Reacciones electrocíclicas en cascadaLa α-santonina (20) es una droga que fue ampliamente utilizada como antihelmíntico.
La primera reacción fotoquímica fue descrita por Trommsdorf en 1834, quien observó que cuando los cristales de la α-santonina son expuestos a la luz del Sol se transforman de cristales incoloros a amarillos. El foto-rearreglo fue estudiado por Natarayan en 2007 (Natarayán, 2007), quien describió la transformación como una sucesión de tres etapas que tienen lugar en un solo cristal.
El primer paso es una reacción de transposición, en la que se forma una ciclopentadienona intermediaria (21); el segundo es una dimerización en una reacción Diels-Alder [4+2] en la que se forma el cicloaducto (22), y el tercero una cicloadición intramolecular [2 +2], mediante la cual se obtiene el policiclo (23).
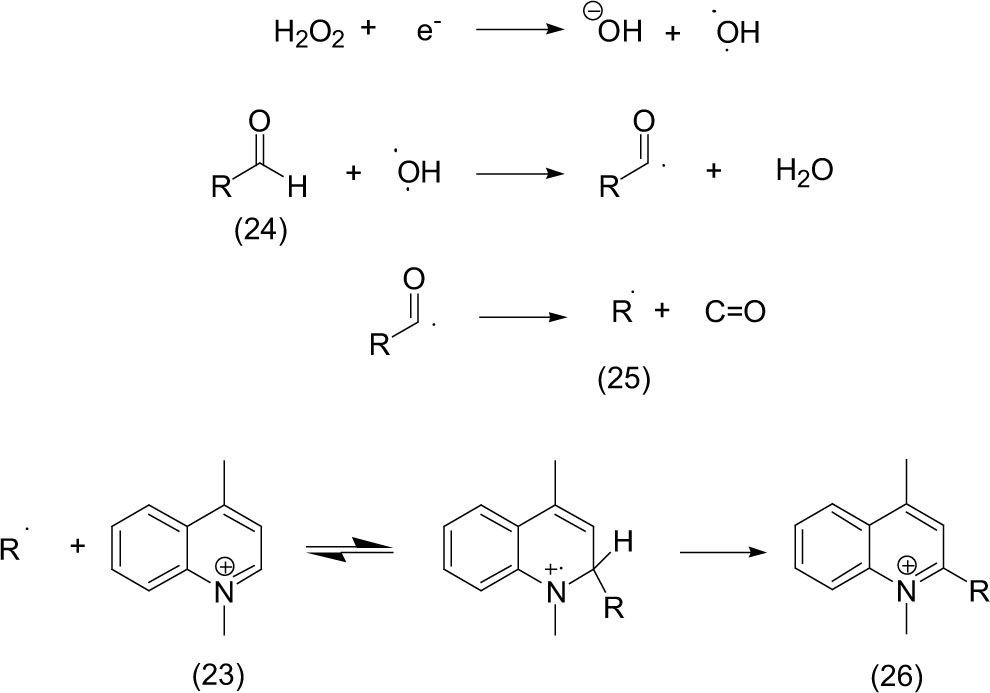
d) Expulsión de moléculas pequeñasUn método que ha sido utilizado para efectuar alquilaciones de quinolinas (23) en la posición 2 fue descrito por Caronna (2007). Demostró que la luz del Sol es capaz de efectuar una ruptura homolítica del alquilaldehido (24) y expulsar monóxido de carbono (CO) y generar el radical alquilo (25), el cual reacciona con la posición 2 de la quinoleína (23). El proceso fue desarrollado en un tubo sin degasificar con el uso de dióxido de titanio (TiO2) como catalizador en acetonitrilo como disolvente; esta mezcla se cerró con un tapón y fue expuesta a la radiación solar durante un periodo de cinco horas (10 am – 3 pm); la temperatura de la reacción fue de 30-35°C debido al calentamiento producido por la luz. Los productos formados son 2-alquil quinoleínas (26) en moderados a buenos rendimientos. Cuando se efectuó la reacción con degasificación no se observaron diferencias.
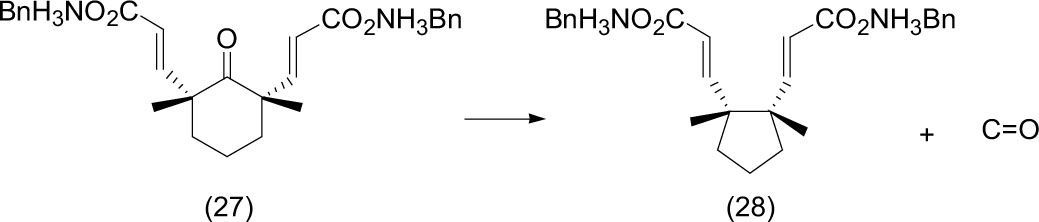
En Mortko (2005) se describen los pasos para desarrollar estrategias y preparar compuestos con carbonos cuaternario adyacentes por foto-decarbonilación estereoespecífica de dialquenoilciclohexanonas (27) en estado cristalino. La transformación se desarrolló mediante la exposición de los cristales a irradiación directa con luz solar hasta escala semipreparativa (1.5 g). Los rendimientos de la decarbonilación (expulsión de CO) fueron de alta selectividad, con un rendimiento superior a 97%. Como se observa, el resultado es la transformación de una ciclohexanona sustituida (27) hacia la obtención de un ciclopentano disustituido (28).
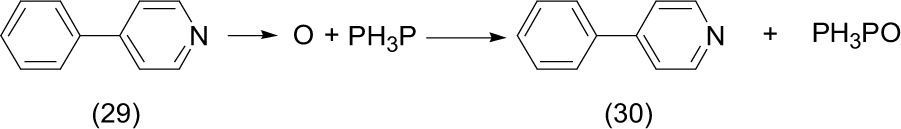
Taganoh (2008) desarrolla una metodología muy sencilla para efectuar una deoxigenación de N-óxidos de piridina (29). El procedimiento de la reacción es muy sencillo. Una mezcla en solución de N-óxido de piridina, con el empleo de un catalizador de renio (Re)-porfirina y trifenilfosfina (Ph3P) fueron mezclados a temperatura ambiente en aire —no fue requerida atmósfera inerte—, durante varias horas e irradiando directamente con luz solar. Se logró la obtención de los derivados de piridina desoxigenados (30) con excelente rendimiento, superior al 90%.
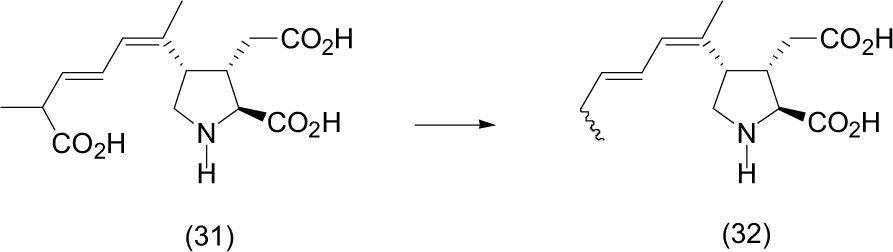
El ácido domoico (31) es un amino ácido tricarboxílico. Estructuralmente es una pirrolidina trisustituida, la cual contiene tres grupos carboxilos, es producida por algas marinas o plancton y es neurotóxica en mamíferos marinos y humanos. Bouillon (2006) y Steidinger (2004) demostraron que la exposición del ácido domóico (31) en el agua de mar a la luz solar se traduce en una rápida formación de isómeros geométricos. Además, el estudio de foto-degradación preliminar reveló que una serie de derivados también son producidos por la mono descarboxilación (expulsión de CO2) del ácido carboxílico de la cadena alquenílica, dando lugar al diácido (32).
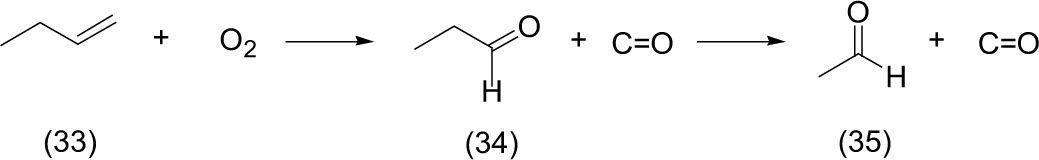
e) Foto-oxidacionesEn una bolsa de plástico, Ellis (1971) efectuó una foto-oxidación de 1-buteno (33) con alta concentración de oxígeno bajo irradiación de luz solar durante un periodo de 1-3 horas, dando lugar a la ruptura oxidativa regioespecífica del doble enla-ce en el alqueno; de esta manera se forman monóxido de carbono (CO) y el aldehído (propanal) (34), que a su vez sufre una segunda oxidación en el aldehído y, como consecuencia, se forman una segunda molécula de monóxido de carbono y acetaldehído (35). En la reacción se observa como producto mayoritario el propanal.
Karapire (2002) estudió la foto-oxidación de α-terpineno (4) al utilizar como agente sensibilizador benzocoumarina (36) en una disolución de acetonitrilo y mediante la irradiación con luz solar directa, con lo que se forman varios productos de oxidación como p-cimeno (5), peróxido de terpineno (6), y por la apertura del ciclo se obtuvieron un compuesto 1,6-dicarbonílico (37) formado por una cetona y un aldehído insaturado, y un compuesto 1,4-dicarbonilico (38) formado por dos cetonas.
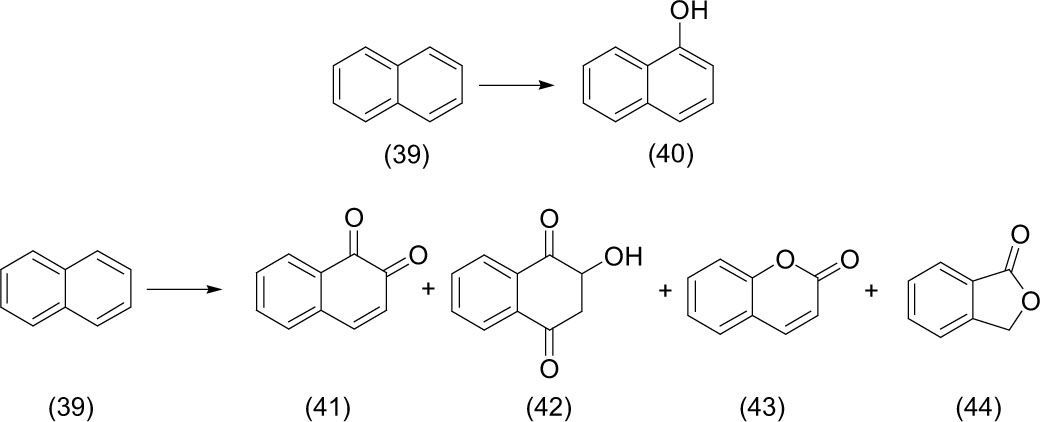
Sorprendentemente, hay pocos datos sobre la foto-oxidación de los hidrocarburos aromáticos policíclicos (HAP) en virtud de las condiciones de iluminación ambiental. En las reacciones de foto-oxidación acuosa de naftaleno (39) —el más simple y más soluble en agua HAP—, éste se vio expuesto a la luz solar durante 24 horas en total para producir una mezcla de productos de foto-oxidación. McConkey (2002) investigó el uso de luz natural como una fuente de luz. Seis de los principales productos de reacción fueron identificados, entre ellos 1-naftol (40), 1,2-naftoquinona (41), 2-hidroxi-2,4-naftoquinona (42), cumarina (43) e isobenzofuranona (44).
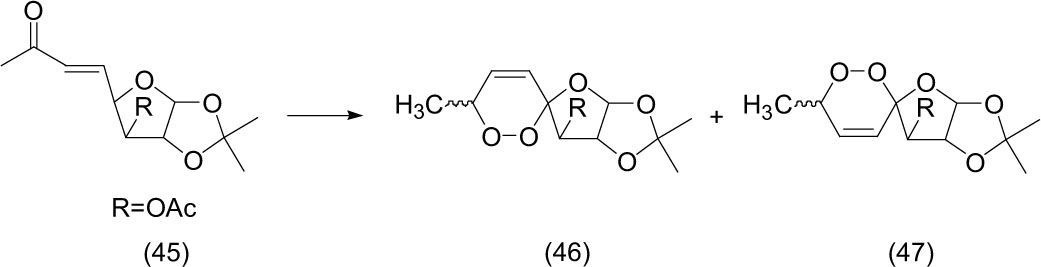
Cetin (2005) efectuó un estudio de foto-oxidación de carbohidratos en tetracloruro de carbono (CCl4). Así, la disolución recibió irradiación de luz solar directa durante cuatro horas, en un periodo de 20 a 40 días en presencia de aire y con agitación ocasional del matraz de reacción. La reacción del carbohidrato (45) —el cual contiene una enona— sufre una adición de oxígeno en el doble enlace, obteniendo como resultado dos nuevos espiro-endoperóxidos estereoisoméricos (46) y (47), los cuales son potencialmente activos biológicamente.
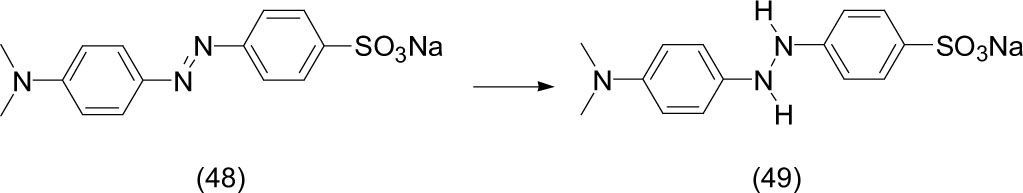
f) Foto-reduccionesSe ha preparado una nueva clase de foto-catalizadores (Chatti, 2007) mediante la utilización de dióxido de titanio (TiO2) sobre una matriz de zeolita. Para el estudio de foto-reducción se usó naranja de metilo (48) como materia prima, la cual fue mezclada con etanol y el foto-catalizador soportado, y se irradió con la exposición directa a la luz solar durante cuatro horas; así se obtuvo el producto de reducción (49) del doble enlace N=N. El experimento se efectuó en presencia de luz visible artificial para evaluar la actividad foto-catalítica del sistema.
La reducción foto-catalítica de CO2 (Ohta, 1998) se efectuó al utilizar una mezcla de bióxido de carbono y silicato de roca–Cu en agua; esta mezcla se irradió con luz solar durante 10 horas. Después de este tiempo se observó como producto de reducción ácido fórmico. En este estudio se observaron los efectos de las cantidades de cobre, el tiempo de iluminación con luz solar y temperatura. Las mejores condiciones son cuando se utiliza 30% de Cu-cuarzodiorita (0,3 g/g); el Cu en esta roca es el mejor catalizador.
El máximo rendimiento de ácido fórmico fue de 54 nmol/g en las mejores condiciones experimentales. El sistema de reducción de emisiones de dióxido de carbono podría llegar a ser un método práctico desarrollado para la industria fotoquímica en la producción de materias primas.
ConclusionesHasta este punto fueron descritos varios ejemplos de transformaciones químicas que emplean como fuente de energía luz solar directa, utilizando medios acuosos, orgánicos o sin disolventes para realizar las foto-transformaciones. En todos los casos observamos que es posible controlar las transformaciones, de ahí que podemos considerar como una alternativa no sólo el uso de la luz solar directa para llevar a cabo estas reacciones en los laboratorios de enseñanza, sino también en los laboratorios de investigación. Ésta puede ser una práctica común, de tal suerte que se aproveche una de las fuentes de energía que hemos dejado a un lado: como ha sido desde el principio de los tiempos, la luz solar seguirá como responsable de las transformaciones químicas.
En cuanto al aspecto estereoquímico, las transformaciones fotoquímicas han abierto una fascinante variedad de posibilidades para sintetizar compuestos con alto control en la estéreo-selectividad y la enantio-selectividad.
Un aspecto relevante es el material utilizado para las foto-transformaciones con luz solar, que puede ser material de vidrio de uso común como son matraces, y materiales de plástico tales como bolsas. Lo más importante es que sean transparentes y garanticen aislamiento del viento que pueda variar la concentración de la mezcla de la reacción o puedan perderse las materias primas y productos involucrados.
Es claro que estos ejemplos son una alternativa para realizar experimentos en los cuales se pueden sustituir las fuentes de energía convencionales con una fuente de origen natural, y si bien es cierto que se va agotar la luz solar, al menos tenemos algunos millones de años para utilizarla.
Referencias no citadasAvcibasi and Icli, 2003, Levy, 1975, and Toganoh et al., 2008.