In this study we investigated alternative conceptions about galvanic cells and interpretations of the process occurring in a voltaic cell. It was conducted with fifty-five 12th grade high school students and forty-three first-year university chemistry students. Comparative analysis of the results obtained by means of a test and an open question reveals that: a) Many high school and university students hold misconceptions about galvanic cells; b) There is no significant difference in misconceptions and interpretations between the two groups of students, and c) Few students can correctly explain how a voltaic cell works. Finally, the implications of these results are discussed.
En el presente trabajo se han investigado las concepciones alternativas sobre pilas galvánicas y las interpretaciones de los procesos que tienen lugar en una pila voltaica simple. Han participado en él 55 estudiantes del 2° de Bachillerato español (curso previo al ingreso en la universidad) y 43 estudiantes de primer año del Grado de Química. El análisis comparativo de los resultados de la administración de un test y de una pregunta abierta revela que: a) Tanto los estudiantes de 2° de Bachillerato como los de 1° de Grado sostienen concepciones erróneas sobre pilas galvánicas; b) No hay diferencias significativas en las concepciones e interpretaciones entre ambos grupos de estudiantes, y c) Pocos estudiantes son capaces de explicar cómo funciona una pila voltaica simple. Finalmente, se discuten las implicaciones que tienen estos resultados.
Los investigadores en la didáctica de la química han detectado dificultades y concepciones alternativas en el aprendizaje de la electroquímica. En concreto, en los estudios Garnett, Garnett y Treagust (1990a, 1990b) se pone de manifiesto poca comprensión y muchos errores conceptuales en electroquímica, que los autores atribuyen a las siguientes razones: desconocimiento de los prerrequisitos, interpretaciones erróneas del lenguaje, uso de múltiples definiciones y modelos, y aprendizaje de conceptos y algoritmos de resolución sin la comprensión adecuada.
En estudios posteriores, Garnett y Treagust (1992a, 1992b) llevaron a cabo entrevistas clínicas a estudiantes de enseñanza secundaria que revelaron ideas erróneas sobre: la identificación de cátodo y ánodo, y sus funciones; el flujo de corriente en las celdas electroquímicas, su origen y las partículas responsables, y la función del puente salino en las celdas galvánicas. Ogude and Bradley (1994) en un trabajo realizado con estudiantes de secundaria y universitarios pudieron comprobar que un gran número de ellos creen que los electrones circulan a través del puente salino y de las disoluciones electrolíticas, e incluso no son capaces de señalar el sentido del movimiento de iones y electrones de manera correcta. Posteriormente estos mismos autores (Ogude y Bradley, 1996) identificaron las dificultades de los estudiantes en las celdas electroquímicas, que hallaron sobre todo relacionadas con: componentes, fuerza electromotriz, procesos en los electrodos y terminología.
Sanger y Greenbowe (1997a, 1997b) replicaron unos años después las entrevistas sobre celdas galvánicas y electrolíticas efectuadas por Garnett y Treagust (1992a, 1992b) y las ampliaron para el caso de las celdas de concentración. Hallaron los mismos errores conceptuales y señalaron algunos más, concluyendo, entre otras cosas, que los estudiantes no saben explicar cómo se origina la corriente eléctrica; creen que ánodo y cátodo dependen de su localización física; piensan que el cátodo siempre está cargado positivamente y ánodo negativamente; sostienen que los electrones fluyen por las disoluciones acuosas, y afirman que el flujo de corriente iónico en los electrolitos y puente salino es debido únicamente a los aniones.
También Sanger y Greenbowe (1999) efectuaron un análisis de libros de texto que les llevó a concluir que dichos libros pueden ser origen de muchos de los errores conceptuales en electroquímica. En particular, descubrieron contenidos en los textos que no muestran las relaciones entre conceptos, y que pueden inducir a creer que los electrones pueden fluir por las disoluciones electrolíticas y el puente salino. En esta misma línea, Sanmartín, Solaz-Portolés y Sanjosé (2013) han analizado libros de texto de 2° de Bachillerato españoles para conocer cómo se presentan los conceptos más problemáticos relacionados con celdas galvánicas, y sacan a la luz que en la mayoría de los textos no aparecen explicaciones, razonamientos o ilustraciones adecuadas sobre:
- a)
El origen de la diferencia de potencial entre los terminales de la celda electroquímica.
- b)
Características del flujo de corriente eléctrica generada.
- c)
Movimiento de electrones y de iones en cada parte de la pila.
- d)
Papel del puente salino en la celda electroquímica.
En el presente estudio, de carácter exploratorio, nos vamos a centrar en las concepciones alternativas de los estudiantes sobre las celdas galvánicas y en la capacidad que tienen para explicar los fenómenos que ocurren en una pila voltaica simple. En concreto, nuestros objetivos son:
- •
Aproximarnos a las ideas de estudiantes de dos niveles académicos diferentes (2° Bachillerato español y 1° del Grado de Química) sobre pilas galvánicas.
- •
Conocer los conceptos, modelos y razonamientos que utilizan estos estudiantes para explicar los fenómenos que ocurren en una pila voltaica simple.
- •
Comparar las diferencias de conocimientos, entre los estudiantes de ambos niveles académicos, sobre el funcionamiento de pilas galvánicas en general y de la pila voltaica simple en particular
Las investigaciones mencionadas anteriormente, en las que se pone en evidencia la existencia de esquemas conceptuales alternativos en los estudiantes en relación a las celdas electroquímicas y las deficiencias encontradas en los libros de texto, además del previsible mayor conocimiento previo del tema (fruto de la instrucción recibida) por parte de los estudiantes que cursan el grado que Química, nos llevan a formular las siguientes hipótesis:
- 1.
Una mayoría de los estudiantes mantiene concepciones sobre celdas galvánicas que no se ajustan a las aceptadas por la comunidad científica.
- 2.
Se observarán diferencias significativas en los errores conceptuales sobre pilas galvánicas entre los estudiantes de grado de Química y los estudiantes de Bachillerato: los de Bachillerato cometerán significativamente más errores conceptuales.
- 3.
Las interpretaciones que darán para describir los fenómenos que ocurren en una pila voltaica simple serán mayoritariamente incorrectos, si bien aparecerán diferencias significativas entre los estudiantes de Bachillerato y del grado de Química (las interpretaciones correctas de estos últimos superarán a las de los primeros).
Como ya se ha indicado se trata de un estudio exploratorio. Pretendemos detectar, de manera aproximada y tentativa, ideas de los estudiantes de dos niveles académicos sobre pilas galvánicas, por lo que la muestra será reducida y no se diseñan (ni validan) instrumentos de diagnóstico específicos, sino que los que se emplean ya han sido utilizados en otras investigaciones. Por la misma razón, las pruebas estadísticas aplicadas no son de gran potencia. Obviamente, los resultados obtenidos no son generalizables pero nos servirán como guía para ulteriores estudios.
Sujetos participantesEn esta investigación participaron estudiantes de dos niveles académicos distintos. Por una parte, alumnos de 2° de Bachillerato (en España es el curso previo a la entrada a la universidad y la edad media se sitúa entre los 17 y 18 años) y, por otra, estudiantes de 1° de Grado en Química (edad media entre los 18 y 19 años). Tanto los primeros como los segundos ya habían estudiado la unidad didáctica en la que se incluyen las pilas galvánicas en el momento de iniciarse este estudio.
El número total de alumnos del grupo de bachillerato es de 55. Este grupo estuvo formado por alumnos de 2° de Bachillerato de tres centros de secundaria diferentes, aunque no hay razones para pensar que se tratara de estudiantes de muy distinto perfil. De hecho, los tres centros se encuentran en zonas de nivel socioeconómico medio. Por otro lado, el segundo grupo de alumnos de este estudio está constituido por 43 alumnos de un grupo de la asignatura Química (II) de 1° de grado en Química, de la Facultad de Química de la Universitat de Valéncia.
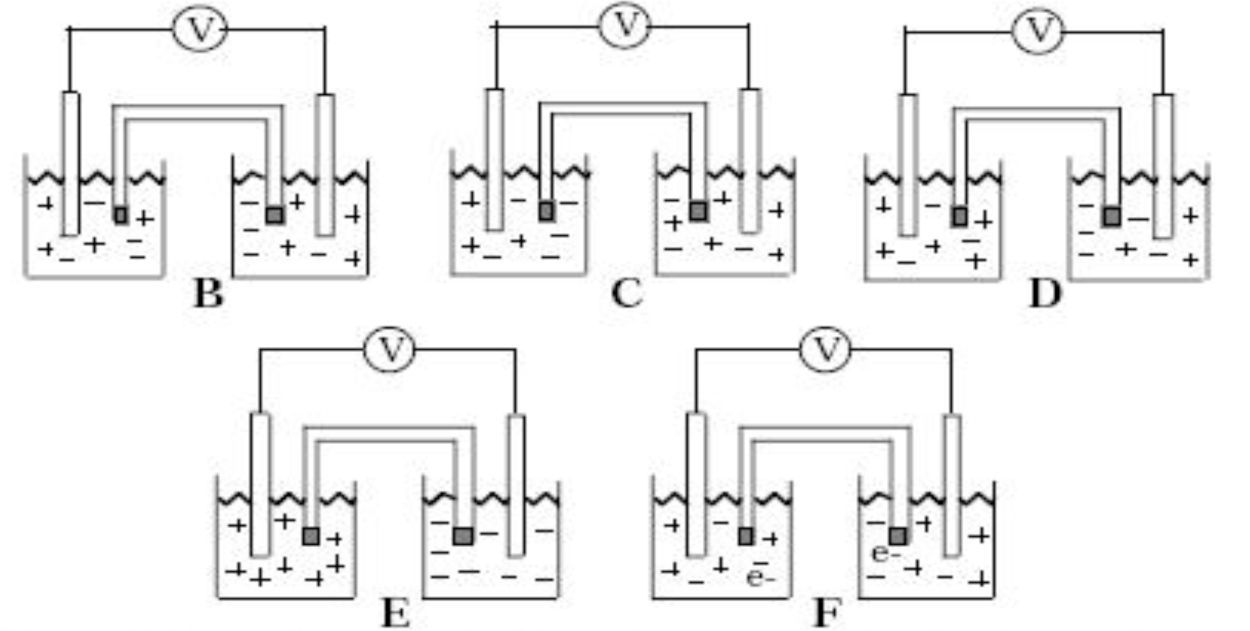
MaterialesTest de opción múltipleCon la finalidad de aproximarnos a las ideas de nuestros estudiantes sobre pilas galvánicas utilizamos un test de tres ítems, propuesto por Sanger y Greenbowe (1997b), que se recoge en el Anexo 1. Los tres ítems son de opción múltiple, con tres o cuatro distractores y solo una respuesta correcta. Con estos tres ítems se pretende conocer si el estudiante:
- •
Identifica correctamente cada electrodo en relación a sus potenciales estándar de reducción como ánodo o cátodo, y señala que los electrones solo fluyen por el circuito externo y no por el puente salino.
- •
Sabe que la conducción eléctrica en el interior de la celda (semiceldas y puente salino) se debe al movimiento de iones positivos y negativos del electrolito, y que este movimiento iónico es el encargado de cerrar el circuito.
- •
Ha aprendido que en una disolución electrolítica no existen electrones libres y que en todo momento se debe mantener la electroneutralidad en cada semicelda.
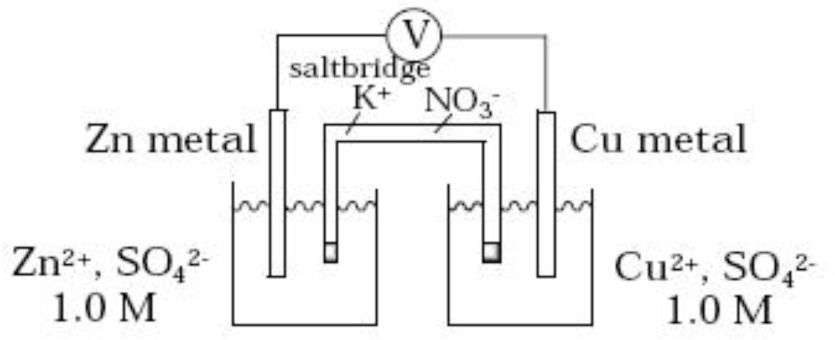
El objetivo de esta pregunta fue recoger las interpretaciones de los estudiantes sobre los fenómenos que ocurren en una pila voltaica simple de zinc-cobre. Para ello, se construyó ante los estudiantes una pila voltaica, como se explicará en el apartado Procedimiento.
La interpretación correcta de los procesos que ocurren en esta pila voltaica puede resumirse en los siguientes puntos:
- 1.
En virtud de la diferencia de potenciales existe una transferencia de electrones por parte del zinc que sufre una oxidación a Zn+2
- 2.
Los electrones circulan desde la placa de zinc hacia el hilo de cobre, y posteriormente entran en contacto con los iones hidrógeno, H+, de la disolución, que se reducen a hidrógeno gaseoso, H2.
- 3.
El hilo de cobre actúa de mero conductor de electrones: ni se oxida ni se reduce.
- 4.
También se desprende gas hidrógeno en el electrodo de zinc, por la reducción correspondiente de iones hidrógeno.
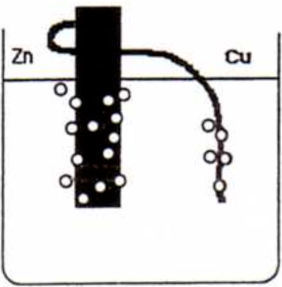
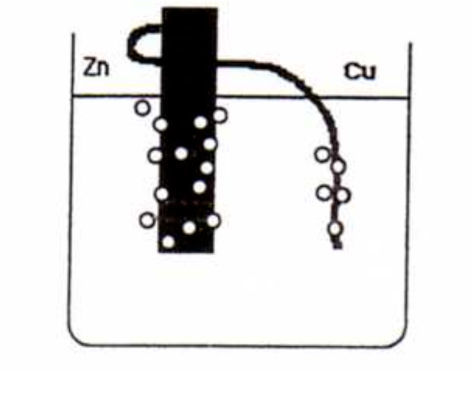
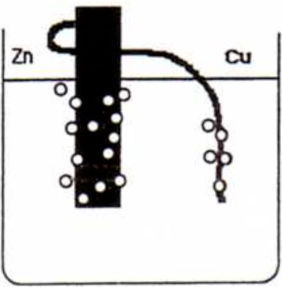
La administración de los materiales se llevó a cabo durante una sesión de clase. En primer lugar, y en alrededor de 5 minutos, se les construyó una pila de Volta simple mediante una placa de zinc, un hilo grueso de cobre y un vaso de precipitados con disolución acuosa acidificada con ácido clorhídrico. Se siguieron tres pasos:
- 1.
Sumergir parte del trozo zinc en la disolución ácida. Se observa la aparición de un burbujeo.
- 2.
Sumergir parte del hilo de cobre en la disolución ácida. No se observa fenómeno alguno.
- 3.
Unir el hilo de cobre al trozo de zinc (mediante un agujero realizado en la placa de zinc) y sumergir parcialmente ambos metales en la disolución ácida (ver figura 1). Aparición de burbujeo alrededor de ambos metales.
Seguidamente, se les suministró un cuadernillo (Anexo 1) que contenía los tres ítems del test de opción múltiple y la pregunta abierta. Dispusieron de 45 minutos para la tarea y hubo tiempo suficiente para todos los estudiantes.
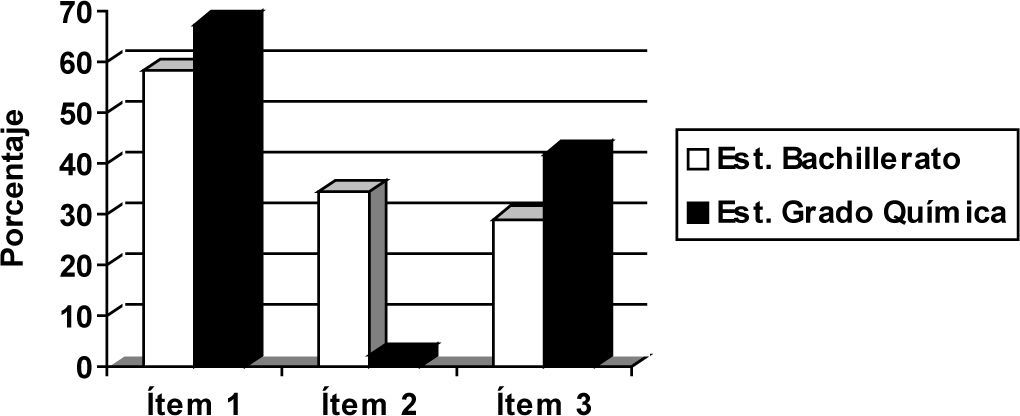
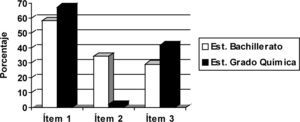
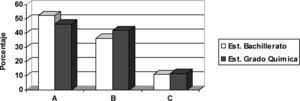
ResultadosTest de opción múltipleComo visión global de los resultados, en la figura 2 se encuentran representados los porcentajes de respuestas correctas en cada ítem y nivel académico. Posteriormente ofreceremos una descripción pormenorizada de los resultados en cada ítem.
Ítem 1En este primer ítem del cuestionario el alumno debía identificar correctamente cada electrodo, teniendo en cuenta los potenciales estándar de reducción que se le proporcionan, señalar el ánodo y cátodo, e indicar que los electrones sólo fluyen por el circuito externo. El porcentaje de estudiantes de Bachillerato que respondió correctamente este ítem es del 58,2%, y del 67,4% en el caso de los estudiantes universitarios.
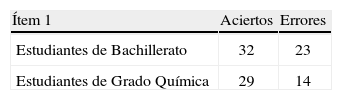
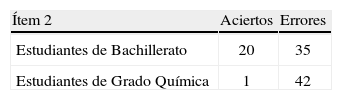
En la tabla 1 se recoge el número de estudiantes de cada nivel académico que acierta o yerra el ítem 1.
La aplicación de la prueba estadística “chi cuadrado” a la tabla de contingencia anterior produce el siguiente resultado: x2 = 0,62 (g. l. = 1), p>0,05; en consecuencia, no hay diferencias estadísticamente significativas entre los estudiantes de 2° de Bachillerato y 1° de grado de Químicas en este ítem.
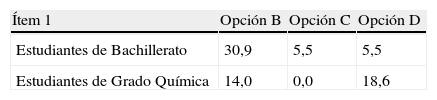
En relación a las respuestas incorrectas, la tabla 2 nos ofrece la distribución de porcentajes en cada una de las opciones incorrectas, y vemos que 18,6% de los alumnos universitarios han elegido la opción D, esto es, piensan que los electrones circulan a través del puente salino, frente a 5,5% de los estudiantes de bachillerato que también lo piensa. Estas respuestas ponen de manifiesto la idea alternativa de que los electrones que proceden de un electrodo circulan a través del puente salino hacia el otro. Los que marcaron la respuesta C (5,5% de los estudiantes de Bachillerato) no identifican correctamente el sentido de los electrones y, además, piensan que los electrones fluyen también por el puente salino. Por otro lado, casi uno de cada tres alumnos de Bachillerato (30,9%) no identificó correctamente el sentido de los electrones haciendo uso de los potenciales estándar de reducción que se les proporcionaban (opción B); en cambio, solo 14% de estudiantes universitarios incurrió en este error.
Ítem 2En este ítem se pide señalar qué partículas conducen la corriente eléctrica en la disolución electrolítica. Podemos destacar que los porcentajes de respuestas correctas son bastante inferiores respecto a los del primer ítem. Solo 2,3% de los estudiantes universitarios responde correctamente el ítem 2, esto es, piensa que la conducción a través del electrolito es debida al movimiento de iones. Esto mismo, sin embargo, lo piensa 34,5% de alumnos de bachillerato. En la tabla 3 se recoge el número de estudiantes de cada nivel académico que acierta o yerra el ítem 2.
La prueba estadística “chi cuadrado” aplicada a la tabla anterior nos revela diferencias estadísticamente significativas entre los estudiantes de 2° de Bachillerato y 1° de Químicas en el ítem, en un nivel de confianza superior al 99,9%: x2 = 14,65 (g. l. = 1), p<0,001. Es decir, los estudiantes de Bachillerato participantes en nuestro estudio han respondido significativamente mejor este ítem que los universitarios.
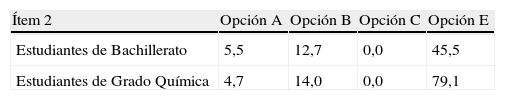
A continuación analizaremos los resultados que ponen de manifiesto ideas alternativas por parte de los alumnos en este ítem. En la tabla 4 se muestran los porcentajes de alumnos universitarios y de Bachillerato que no han respondido correctamente distribuidos por opciones.
El análisis de estos resultados evidencia que la mayoría de los estudiantes universitarios (79,1%) relaciona la conducción a través del electrolito con electrones moviéndose a través de la disolución de un electrodo a otro (respuesta E). También 45.5% de los estudiantes de Bachillerato cometen el mismo error conceptual. Por otra parte, son una minoría aquellos que evidencian que la conducción es debida a electrones moviéndose a través de la disolución unidos a iones (respuesta A, entre 5,5 y 4,7%) o electrones moviéndose de un ión a otro a través de la disolución (respuesta B, entre 12,7 y 14%). En las tres opciones se pone de manifiesto la concepción alternativa de que la conducción en el electrolito es debida al movimiento de los electrones en la disolución. Por último, ninguno de los estudiantes identifica la conducción eléctrica por moléculas de agua (opción C).
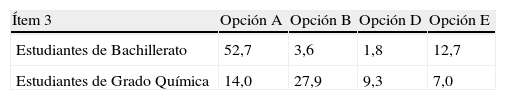
Ítem 3Los resultados del ítem 3 evidencian que 41,9% de los estudiantes universitarios y 29,1% de los de Bachillerato respondieron correctamente este ítem. Es decir, menos de la mitad, en el primer caso, y menos de un tercio, en el segundo, son capaces de identificar correctamente que las semiceldas han de ser eléctricamente neutras.
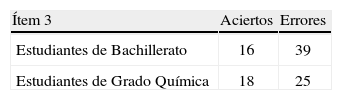
La tabla 5 ofrece el número de estudiantes de cada nivel académico que acierta o yerra el ítem 3.
La aplicación de la prueba “chi cuadrado” a la tabla de contingencia anterior proporciona el siguiente resultado: x2 = 1,22 (g. l. = 1), p>0,05; en consecuencia, no hay diferencias estadísticamente significativas entre los estudiantes de 2° de Bachillerato y 1° de Químicas en el ítem 3.
En la tabla 6 vemos los porcentajes de alumnos que demuestran tener ideas alternativas en el ítem 3 clasificados por opciones.
En este caso, la única opción que es consistente con la idea alternativa de que los electrones se encuentran de manera libre por la disolución es la E. Solo un pequeño porcentaje de alumnos marcaron la respuesta E (entre 12,7% y 7%). En cambio, la opción A sí muestra un alto porcentaje de alumnos, concretamente un poco más de la mitad de los alumnos de Bachillerato, que marcan esta opción como correcta (52,7%). Esto prueba que más de la mitad de los estudiantes de Bachillerato no ha comprendido que las semi-celdas en todo momento tienen que ser eléctricamente neutras. En cambio, casi uno de cada tres alumnos universitarios (27,9%) piensa que una semicelda queda cargada totalmente de manera positiva y la otra semicelda de manera negativa (opción B).
Pregunta abiertaLas respuestas dadas a la pregunta abierta por los estudiantes han sido agrupadas siguiendo un esquema similar de ca-tegorización al presentado en el trabajo de Lorenzo, García-Rodeja y Gallástegui (1992). Las categorías y subcategorías descritas a continuación fueron acordadas por los tres autores de este trabajo, tras un análisis de los protocolos de los estudiantes e intercambio de opiniones al respecto.
Categoría A: Interpretaciones en términos de transferencia de cargaSubcategoría A1: Interpretaciones correcta o casi correctas
Este grupo está formado por enunciados donde los alumnos especifican que el zinc cede electrones. Como criterio de clasificación en esta categoría el alumno debió especificar textualmente que el zinc se oxida y transfiere sus electrones al cobre. Se incluyen en este grupo aquellas interpretaciones que mencionan que el cobre, al captar electrones del zinc, produce un burbujeo ya que éste también reacciona debido al intercambio de electrones. Sin embargo, esta interpretación no es correcta, ya que en realidad el cobre no reacciona, solo permite el paso de los electrones para que finalmente éstos entren en contacto con la disolución.
Subcategoría A2: Interpretaciones con características aceptables aunque no correctas
En este grupo se incluyeron todas aquellas interpretaciones donde se hizo referencia a la existencia de una transferencia de electrones o transferencia de carga, pero sin especificar claramente que es el zinc quien proporciona los electrones al cobre. Aquí podemos encontrar dos tipos de enunciados dentro de esta misma categoría A2:
- •
Donde solo se hace referencia a interpretaciones macroscópicas, es decir, ambos metales entran en contacto y de ahí la transferencia de carga.
- •
Donde los alumnos sí mencionan la transferencia de carga relacionada directamente con una reacción de oxidación-reducción: indican que se produce una oxidación y una reducción donde el cobre se ve implicado y en el intercambio de transferencia de carga se apunta la reducción de Cu2+ a cobre sólido.
Subcategoría A3: Interpretaciones con características aceptables pero con errores conceptuales
En este tercer grupo hemos incluido interpretaciones que implican el intercambio de carga o de electrones pero contienen errores conceptuales, como por ejemplo:
- •
Transferencia de electrones al Zn+2 por parte del cobre.
- •
El electrodo de cobre cede sus electrones al zinc.
En la categoría B se han recogido las interpretaciones alternativas encontradas en los razonamientos de los alumnos. En esta categoría hemos hallado cuatro subcategorías, que se comentan seguidamente.
Subcategoría B1: Interpretaciones donde el Zn le proporciona algo al Cu
Estas interpretaciones reflejan la convicción por parte de los alumnos de que el zinc tiene “algo” que el Cu no tiene y, que cuando ambos se ponen en contacto, son capaces de reaccionar. Aquí se leen proposiciones tales como:
- •
Al ponerse en contacto ambos metales ocurre algo y se desprende hidrógeno.
- •
Al ponerse en contacto ambos metales se produce un cambio en la química del cobre.
- •
Al ponerse en contacto ambos metales, el hidrógeno se dirige hacia el cobre y de ahí que se observen burbujas a su alrededor.
Subcategoría B2: Interpretaciones erróneas
En esta categoría agrupamos interpretaciones con concepciones erróneas de diversa índole. Así, aparecen ideas tales como:
- •
Al reaccionar ambos metales con el ácido clorhídrico se desprende el catión H+, que es gaseoso.
- •
Se produce la oxidación del cobre y éste produce hidrógeno como el zinc.
- •
Los electrones del cobre se unen al hidrógeno gas que se ha desprendido por la oxidación del zinc y hacen que el cobre burbujee.
Subcategoría B3: Interpretaciones con ideas alternativas en relación con los electrones
En este tercer subgrupo se han subsumido las interpretaciones de los alumnos que ponen de manifiesto la idea alternativa acerca de la existencia y el transporte de electrones a través de la disolución electrolítica. Como, por ejemplo, que los electrones se transfieren al cobre por medio de la disolución, y eso hace que se produzca burbujeo en ambos metales.
Subcategoría B4: Ideas alternativas en términos de intercambio iónico
En esta subcategoría se recogen razonamientos de los estudiantes que presentan una explicación del fenómeno por medio de un intercambio de iones. Las ideas más repetidas que hemos encontrado hacen referencia a que:
- •
Al producirse un intercambio de iones entre los metales, el cobre burbujea hidrógeno.
- •
La reducción del cobre crea un polo que atrae los iones Cl- y posteriormente se desprende cloro.
- •
Se produce un intercambio de iones por la disolución.
A esta categoría pertenecen los enunciados puramente descriptivos en los que no hay ningún tipo de aportación conceptual más allá de la mera enumeración de hechos macroscópicos como, por ejemplo: “Se observa un burbujeo por parte del cobre”.
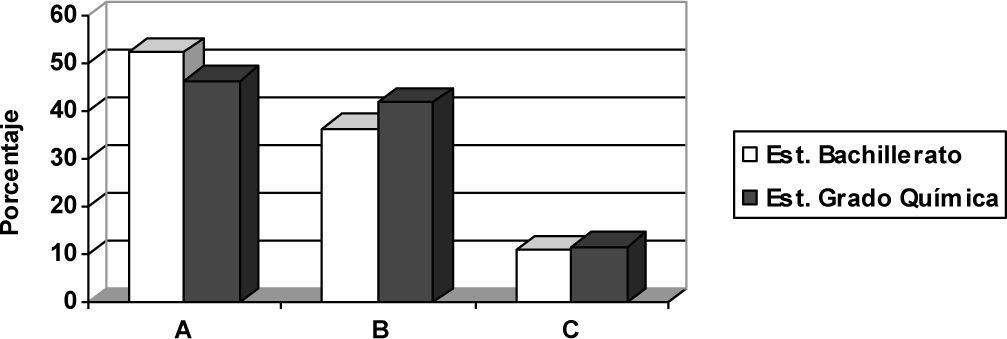
La figura 3 nos proporciona la distribución de los porcentajes de estudiantes de Bachillerato y del grado de Química en cada una de las tres categorías anteriores A, B y C.
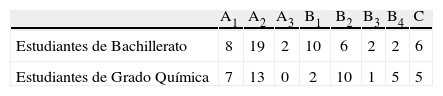
La tabla de contingencia 7 ofrece el número de estudiantes de 2° de Bachillerato y de 1° de Grado de Química, en cada subcategoría.
La aplicación de la prueba estadística “chi cuadrado” a la tabla de contingencia anterior produce el siguiente resultado x2 = 9,95 (g. l. = 14), p>0,05; en consecuencia, no hay diferencias estadísticamente significativas entre los estudiantes de 2° de Bachillerato y 1° de Químicas en esta pregunta abierta.
Como puede observarse en la tabla 7, solo 8 estudiantes de Bachillerato (14,5%) y 7 del grado de química (16,3%) interpretan de manera correcta o casi correcta los fenómenos que ocurren en una pila voltaica. La subcategoría donde se acumulan más estudiantes es la A2 (34,5% de Bachillerato y 30,2% de Químicas), esto es, en este grupo de estudiantes no se explica bien el funcionamiento de la pila, pero han elaborado un modelo que tiene rasgos aceptables, aunque no del todo correctos. En las subcategorías B aparecen, en general, pocos estudiantes, aunque en su conjunto representan el 36,4% (18,2% B1, 10,9% B2, 3,6% B3 y 3,6% B4) de los estudiantes de Bachillerato y el 41,9% (4,7% B1, 23,3% B2, 2,3%, B3 y 11,6% B4) de los del grado de Química. Como vemos destacan la subcategoría B1, en estudiantes de bachiller, y la B2 en los universitarios; es decir, los primeros intuyen que el zinc proporciona “alguna cosa” al cobre, y en los segundos predominan las explicaciones erróneas que hacen intervenir especies químicas de manera incorrecta. Se presentan pocos estudiantes (3,6% y 2,3% en cada respectivo nivel académico) que necesiten hacer intervenir a electrones circulando por la disolución electrolítica (subcategoría B3). Finalmente, se observa un pequeño número de estudiantes en la categoría C de ambos niveles académicos (que representa 10,9% de los estudiantes de Bachillerato y 11,6% de los estudiantes universitarios) que no puede ir más allá de la elemental descripción macroscópica del fenómeno.
ConclusionesEn primer lugar, y de acuerdo con la información recogida en la figura 2 y en las tablas 2, 4, 6 en relación con el test de opción múltiple sobre celdas galvánicas, parece confirmarse parcialmente nuestra primera hipótesis, que hacía referencia a que una mayoría de estudiantes mantendría concepciones alternativas sobre celdas galvánicas. Únicamente en el ítem 1 de dicho test (en el que se tiene que identificar correctamente cada electrodo en una pila galvánica teniendo en cuenta los potenciales estándar de reducción que se le proporcionan, señalar el ánodo y cátodo, e indicar que los electrones sólo fluyen por el circuito externo) no se observa una mayoría, quedándose reducida a aproximadamente a 40% de los estudiantes.
Los análisis estadísticos efectuados sobre los ítems 1 y 3 del test de opción múltiple apuntan hacia la no existencia de diferencias significativas entre las concepciones de ambos grupos de estudiantes sobre celdas galvánicas. Son de destacar, no obstante, las diferencias encontradas entre dichos grupos en el ítem 2 (que indaga sobre las partículas que conducen la corriente eléctrica en la disolución electrolítica): los estudiantes del grado de Química lo han contestado significativamente peor. No tenemos ninguna hipótesis plausible que pueda justificar este hecho y lo atribuimos a circunstancias particulares de este grupo de estudiantes. En consecuencia, la segunda hipótesis planteada queda refutada, y todo nos indica que el primer curso en la universidad no ha servido para superar las deficiencias de los esquemas conceptuales de los estudiantes sobre celdas galvánicas arrastradas desde el Bachillerato.
También parece verificarse parcialmente nuestra tercera hipótesis porque, según nos indica la tabla 7, son mayoritarias las interpretaciones incorrectas que se dan a los fenómenos que ocurren en una pila voltaica simple. Sin embargo, no aparecen diferencias significativas entre estudiantes preuniversitarios y universitarios, como inicialmente preveíamos en nuestra hipótesis. Nuevamente se constata la escasa influencia de la instrucción universitaria sobre la formación de sus estudiantes, incapaces de mejorar las explicaciones dadas por los estudiantes de Bachillerato.
Discusión e implicaciones didácticasDentro de las limitaciones que presenta nuestro estudio (en los instrumentos utilizados y por el escaso número de sujetos que han participado) que suponen que las conclusiones obtenidas solo sean estrictamente válidas para la muestra y los instrumentos empleados, todo apunta hacia la presencia de esquemas conceptuales erróneos en los estudiantes de bachillerato y universitarios sobre pilas galvánicas. Estos resultados son coherentes con otros trabajos que han analizado cuestiones similares a las que hemos abordado aquí (Garnett y Treagust, 1992a y 1992b; Ogude y Bradley, 1994; Sanger y Greenbowe, 1997a y 1997b).
Además, se han puesto de relieve las enormes dificultades de los estudiantes que han participado en nuestra investigación para interpretar los procesos relacionados con las pilas voltaicas. Los estudiantes no han sido capaces de utilizar correctamente los conceptos, modelos y teorías que han estudiado. Todo ello nos induce a pensar que, probablemente, las metodologías instruccionales y recursos didácticos que han utilizado no son todo lo eficientes que cabría esperar. En este sentido, la investigación en la didáctica de la química nos muestra que es necesario introducir en el aula una metodología socioconstructivista de enseñanza que, mediante actividades de aprendizaje que aborden situaciones problemáticas (Furió y Furió, 2009), permita a los estudiantes construir su conocimiento a partir sus ideas previas (Acar y Tarhan, 2006).
Destacaremos la estrategia de enseñanza para el cambio conceptual propuesta por Níaz y Chacón (2003) con el objetivo de mejorar la comprensión de los estudiantes de secundaria de la electroquímica. En dicha estrategia se pone el acento en la presentación de situaciones que generen un conflicto cognitivo en los estudiantes, es decir, que pongan en evidencia sus ideas (erróneas) y posibiliten su cambio hacia las aceptadas por la comunidad científica. Sanger y Greenbowe (2000) también proponen el uso de una estrategia de enseñanza basada en el cambio conceptual, pero basada en animaciones por computadora. Tampoco resultaría desdeñable la aplicación de una metodología ABP (Aprendizaje Basado en Problemas) que ha mostrado sus bondades en varios estudios (Solaz-Portoles, Sanjosé y Gómez, 2011).