Los inhibidores de los puntos de control inmunitario (IPCI) han conseguido elevados porcentajes de respuesta en diversas neoplasias. Los efectos secundarios se relacionan con la hiperestimulación del sistema inmune y los que afectan a la glándula tiroides se encuentran entre los más frecuentes.
ObjetivoDescribir la presentación clínica y evolución de la disfunción tiroidea (DT) en pacientes oncológicos en tratamiento con IPCI remitidos a las consultas de endocrinología.
Material y métodosEstudio descriptivo, retrospectivo y multicéntrico de pacientes con DT asociada a IPCI en seis centros hospitalarios españoles.
ResultadosSe incluyeron 120 pacientes (50,1% mujeres), edad 60 ± 12 años. La DT inicial fue el hipotiroidismo en el 49% de los pacientes y el hipertiroidismo en el 51%, con una media de 76 (41-140) y 43 (26-82) días, respectivamente entre el inicio de IPCI y la alteración hormonal. El diagnóstico de hipertiroidismo estaba significativamente asociado a una evaluación analítica más temprana. En un 80% se observó un viraje durante el seguimiento, en la mayoría de hipertiroidismo a hipotiroidismo. El 21,7% recibió doble terapia con IPCI. La forma de presentación más frecuente en monoterapia fue el hipotiroidismo (57%), y en doble terapia fue el hipertiroidismo (77%) (p = 0,002). Los pacientes en doble terapia presentaron alteraciones tiroideas significativamente más tempranas que los del grupo en monoterapia. Tras un seguimiento de 205 (112-360) días, el 50% de los pacientes continuaba en tratamiento con levotiroxina.
ConclusionesEl hipotiroidismo y el hipertiroidismo se presentan en una proporción similar en la DT asociada a IPCI, aunque es posible que el hipertiroidismo no sea detectado en un gran número de casos. La DT en la doble terapia es más precoz, hecho que debiera tenerse en cuenta en los protocolos de seguimiento de estos pacientes.
Immune checkpoint inhibitors (IPCI) have improved progression-free survival in several solid tumors. Side effects are related to overstimulation of the immune system. Thyroid dysfunction (TD) is the most common endocrine immune-related adverse event of IPCI.
ObjectiveTo describe the clinical presentation and the course of TD in cancer patients treated with IPCI referred to an endocrinology outpatient clinic.
Material and methodsThis was a descriptive, retrospective and multicenter study of patients with TD associated with IPCI in six Spanish hospitals.
Results120 patients (50.1% women), mean age 60 ± 12 years were included. The initial TD was hypothyroidism in 49% of patients and hyperthyroidism in 51%, with an average of 76 (41-140) and 43 (26-82) days respectively between the onset of IPCI and the analytical alteration. Significantly, the earlier the first analytical determination was, the greater the prevalence of hyperthyroidism. A turnover was observed in 80% of subjects during follow-up, mostly from hyperthyroidism to hypothyroidism. Twenty-one percent received double IPCI therapy. The most frequent form of presentation in monotherapy was hypothyroidism (57%), and in double therapy it was hyperthyroidism (77%) (p = 0.002). Patients under double therapy showed thyroid alterations earlier than those in the monotherapy group (p = 0.001). After a follow-up of 205 (112-360) days, half of the patients continued under levothyroxine treatment.
ConclusionsHypothyroidism and hyperthyroidism present in a similar proportion in cancer patients undergoing ICPI therapy. Our results suggest that transitory hyperthyroidism may not be detected in a relevant number of cases. In addition, TD in double therapy presents earlier. This should be taken into account in the follow-up protocols of these patients.
Los fármacos inhibidores de los puntos de control inmunitario (inmune checkpoints) (IPCI) han revolucionado el tratamiento de diferentes neoplasias malignas1. En el momento actual, la Food and Drug Administration (FDA) ha aprobado siete IPCI para el tratamiento de tumores sólidos avanzados, que se clasifican según su mecanismo de acción en inhibidores de CTLA-4 (cytotoxic T lymphocyte antigen-4): ipilimumab y tremelimumab; inhibidores de PD-1 (programmed death-1): nivolumab y pembrolizumab, e inhibidores de PD-L1 (programmed death-ligand 1): atezolizumab, avelumab y durvalumab. Además, hay nuevos fármacos en desarrollo de estos grupos, así como ensayos clínicos de nuevas dianas terapéuticas como los inhibidores de LAG-3 (lymphocyte-activation gene 3), los inhibidores de TIM-3 (T-cell immunoglobulin and mucin-domain containing-3) y los inhibidores de IDO (indoleamine-2,3-dioxygenase)2, por lo que es de esperar que el uso y el desarrollo de este grupo terapéutico se incremente en los próximos años.
Debido a su mecanismo de acción, los efectos adversos de estos fármacos se encuentran relacionados con el estado de activación inmune que desencadenan, por lo que se han denominado efectos adversos inmunomediados (immune-related adverse events, irAE)3. Los irAE pueden presentarse en cualquier órgano, aunque las manifestaciones más frecuentes se producen en la piel, el sistema digestivo y las glándulas endocrinas, y son generalmente de intensidad leve. Si bien son comunes en todos los tipos de tumores, muestran ciertas diferencias en relación con la familia a la cual pertenecen4. El espectro de alteraciones endocrinas incluye hipofisitis y disfunción tiroidea como las más frecuentes, aunque se han comunicado casos de adrenalitis, diabetes mellitus tipo 1 e hipoparatiroidismo5,6. La frecuencia y gravedad de las alteraciones endocrinas aún no están bien definidas debido a la variabilidad en la recolección de datos, sin embargo, cada vez es más frecuente el despistaje de alteraciones hormonales en los protocolos terapéuticos, lo que se traduce en una detección más precoz7. La incidencia publicada de alteraciones tiroideas es variable y depende del patrón de la alteración, así como del uso de IPCI en monoterapia o terapia dual8. Una revisión de Byun et al. encontró que la incidencia de hipotiroidismo y tiroiditis asociada a ipilimumab se estimaba en 5,6 y 3,2% respectivamente, similar a la reportada para anti-PD-1 con una incidencia de 5,9% de hipotiroidismo y 3,3% de hipertiroidismo. En relación con los anti-PD-L1 la incidencia de hipotiroidismo fue de 4,3%9. Otros grupos han reportado su experiencia a escala nacional con relación a los efectos adversos endocrinos inducidos por la inmunoterapia10,11. En España, la evidencia se basa en reporte de casos y pequeñas series12. En este sentido, planteamos este estudio descriptivo, retrospectivo y multicéntrico, con el objetivo de describir la presentación clínica y evolución de las alteraciones tiroideas encontradas en pacientes oncológicos en tratamiento con IPCI en seis centros hospitalarios españoles.
Material y métodosDiseño del estudioRealizamos una revisión retrospectiva de las historias médicas de pacientes oncológicos derivados al Servicio de Endocrinología. Los datos recogidos proceden de seis hospitales públicos nacionales de referencia en tratamiento oncológico en España: Hospital Universitario Vall d́Hebron (Catalunya), Complejo Hospitalario de Navarra (Navarra), Hospital Universitario de Burgos (Castilla y León), Hospital 12 de Octubre (Madrid), Hospital Ramón y Cajal (Madrid) y Hospital Virgen del Rocío (Andalucía).
PacientesSe incluyeron 120 pacientes oncológicos en tratamiento con IPCI derivados al Servicio de Endocrinología por alteraciones en la función tiroidea desde diciembre de 2011 hasta julio de 2018. En todo momento se ha preservado el anonimato de los pacientes mediante la codificación de los registros y el análisis acumulado de los datos, realizándose ambos procedimientos por equipos investigadores diferentes. Los pacientes que previamente al tratamiento inmunológico presentaban algún tipo de disfunción tiroidea también fueron incluidos, cuando la introducción del IPCI causaba una modificación de su situación hormonal. Se analizaron los tratamientos que incluían las familias de anti-CTLA4, anti PD-1 y anti PD-L1 aprobados por ficha técnica, además de tratamientos de nuevas familias terapéuticas (anti LAG-3) en régimen de ensayo clínico fase i–ii, tanto en monoterapia como en combinación, independientemente del tipo de neoplasia. Se analizaron variables relacionadas con el fármaco (tipo, fechas de inicio y discontinuación, duración del tratamiento, causa de la discontinuación), en relación con otros tratamientos recibidos que pudieran alterar la función tiroidea (terapia con glucocorticoides, tratamientos previos con quimioterapia o inhibidores tirosina-cinasa, [ITK]) y antecedentes de radiación cervical, uso previo de radioyodo o contrastes yodados en los últimos tres meses.
Se documentó el perfil tiroideo antes del inicio de inmunoterapia, considerándolo válido si la determinación hormonal se había efectuado dentro de los seis meses anteriores al inicio de los IPCI. Se recogieron datos sobre la frecuencia con que se realizaban las analíticas de control de función tiroidea. Se registraron al menos cuatro analíticas de seguimiento en cada caso. Para la evaluación de la función tiroidea se consideraron los rangos de referencia del laboratorio de cada hospital para tirotropina (TSH) y tiroxina libre (T4L). También se recogieron datos sobre presencia de autoanticuerpos tiroideos: anti-tiroglobulina (anti-Tg), anti-tiroperoxidasa (anti-TPO) y anti-receptor de TSH (TSI).
Evaluación de la función tiroideaSe definieron las variables de interés de función tiroidea según criterios de la European Thyroid Association(ETA)13,14: a) Hipotiroidismo subclínico: TSH elevada por encima del límite de referencia y T4L dentro de rango de referencia; b) Hipotiroidismo clínico: TSH elevada por encima del límite superior de referencia con T4L por debajo del límite inferior de referencia; c) Hipertiroidismo subclínico: TSH inferior al límite inferior de referencia con T4L y T3L normales; d) Hipertiroidismo clínico: TSH inferior al límite inferior de referencia y elevación de hormonas tiroideas libres por encima del límite superior de referencia.
Definición de tiempo de inicio de alteraciones tiroideasEn la mayoría de los centros la función tiroidea se evaluaba antes del inicio de cada ciclo de tratamiento con IPCI, y posteriormente cada dos a tres semanas. El tiempo de inicio de la disfunción tiroidea fue definido como el número de días entre la administración de la primera dosis de la inmunoterapia y la fecha de la primera documentación de alteración bioquímica. El tiempo de viraje fue definido como el tiempo en días desde el inicio de la primera alteración tiroidea constatada y el momento del diagnóstico del cambio de esa disfunción.
Análisis estadísticoPara el análisis estadístico se utilizó SPSS® (versión 24). Las variables continuas se expresaron en medias ± desviación estándar para las variables normales y en medianas ± rango intercuartílico (RIC) para las variables no normales. Las variables categóricas se expresaron con porcentajes. Para las diferencias entre grupos en variables continuas se utilizó la prueba t de Student o el test de U-Mann-Whitney mientras que para las categóricas se utilizó χ2. En el análisis de los posibles predictores de alteraciones tiroideas se utilizó el modelo de regresión logística multivariante, para evaluar la asociación entre seis posibles predictores (edad, sexo, tiempo en diagnóstico de alteración tiroidea [días], tipo de terapia, terapia previa recibida y corticoterapia previa) y la ocurrencia de alteración tiroidea como resultado, con hipotiroidismo o hipertiroidismo en la categoría referente. Se consideró como significación estadística una p < 0,05.
ResultadosPacientes estudiadosSe incluyeron 120 pacientes cuyas características clínicas principales se recogen en la tabla 1. El 18% habían recibido tratamiento previo con ITK y en nueve pacientes (7,5%) se registró el uso de otros fármacos con conocido efecto sobre la función tiroidea (amiodarona, betabloqueadores, etc.). Como es de esperarse, debido al contexto oncológico, un gran porcentaje de la cohorte (72,5%) había sido expuesta a contraste yodado en los últimos tres meses.
Características clínicas principales de los pacientes estudiados
| n | 120 |
|---|---|
| Edad (años), media (DE) | 60,6 (12,3) |
| Sexo, n (%) | |
| Mujeres | 61 (50,8) |
| Varones | 59 (49,2) |
| Neoplasia, n (%) | |
| Pulmón | 36 (30) |
| Melanoma | 21 (17,5) |
| Riñón-vías urinarias | 20 (16,7) |
| Mama | 12 (10) |
| Colo-rectal | 9 (7,5) |
| Otros | 22 (18,3) |
| Ensayo clínico, n (%) | |
| Sí | 71 (59,2) |
| No | 42 (35) |
| Desconocido | 7 (5,8) |
| Fármaco IPCI, n (%) | |
| Nivolumab | 63 (52,5) |
| Pembrolizumab | 31 (25,8) |
| Atezolizumab | 16 (13,3) |
| Ipilimumab | 14 (11,7) |
| Durvalumab | 6 (5) |
| Otros | 16 (13,3) |
| Tratamiento combinado, n (%) | |
| Sí | 26 (21,7) |
| No | 94 (78,3) |
| Quimioterapia previa, n (%) | |
| Sí | 53 (44,2) |
| No | 63 (52,5) |
| Desconocido | 4 (3,3) |
| ITK previos, n (%) | |
| Sí | 21 (17,5) |
| No | 99 (82,5) |
| Tratamiento con corticoides, n (%) | |
| Sí | 21 (17,5) |
| No | 99 (82,5) |
| Radioterapia cervical previa, n (%) | |
| Sí | 38 (31,7) |
| No | 81 (67,5) |
| Desconocido | 1 (0,8) |
| Contrastes yodados, n (%) | |
| Sí | 87 (72,5) |
| No | 33 (27,5) |
DE: desviación estándar; IPCI: inhibidores de los puntos de control inmunitario; ITK: inhibidores de la tirosina cinasa.
Previamente al inicio de la terapia inmunológica el 75% de los pacientes se encontraban eutiroideos y en seis casos (5%) se desconocía el estado inicial (tabla 2). En la mayoría no se estudió la autoinmunidad tiroidea ni antes ni después de iniciar el IPCI y solo se disponía de ecografía tiroidea previa en dos sujetos con bocio multinodular.
Cambios en la función tiroideaLa primera determinación analítica se obtuvo a los 31 días (20-60) después del inicio del tratamiento con IPCI. De manera global y para toda la cohorte, en la primera determinación analítica se observó una tendencia a la disminución de la TSH (-0,33 mU/L [-1,5-1,8]) junto con un discreto aumento de T4l (0,07 ng/dL [-0,1-0,5]) respecto a la determinación basal.
La primera alteración de la función tiroidea se detectó a los 55 días (27,5-105) tras el comienzo de la inmunoterapia. El tipo de disfunción tiroidea inicial y los valores hormonales acompañantes se resumen en la tabla 3. Las alteraciones tiroideas se presentaron de forma asintomática en casi la mitad de los casos (46,7%), siguiendo en frecuencia la astenia (10,8%) y, en una pequeña proporción de casos, la clínica de hipertiroidismo (3,3%). En un 39,2% no se registraron las manifestaciones clínicas.
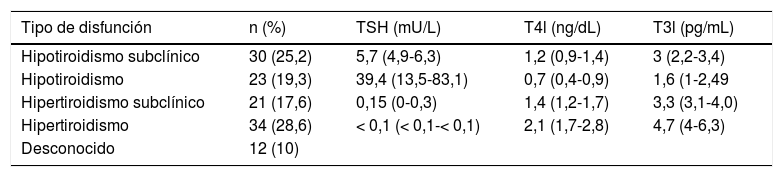
Disfunción tiroidea inicial tras el inicio de IPCI. Obsérvese que, sin tomar en cuenta los casos desconocidos, la proporción de pacientes que manifiestan inicialmente cualquier forma de hipotiroidismo (44,5%) es similar a los que lo hacen con cualquier forma de hipertiroidismo (46,2%). Valores de TSH, T4l y T3l expresados como media (rango)
| Tipo de disfunción | n (%) | TSH (mU/L) | T4l (ng/dL) | T3l (pg/mL) |
|---|---|---|---|---|
| Hipotiroidismo subclínico | 30 (25,2) | 5,7 (4,9-6,3) | 1,2 (0,9-1,4) | 3 (2,2-3,4) |
| Hipotiroidismo | 23 (19,3) | 39,4 (13,5-83,1) | 0,7 (0,4-0,9) | 1,6 (1-2,49 |
| Hipertiroidismo subclínico | 21 (17,6) | 0,15 (0-0,3) | 1,4 (1,2-1,7) | 3,3 (3,1-4,0) |
| Hipertiroidismo | 34 (28,6) | < 0,1 (< 0,1-< 0,1) | 2,1 (1,7-2,8) | 4,7 (4-6,3) |
| Desconocido | 12 (10) |
Los pacientes se subdividieron en dos grupos según la primera manifestación fuera el hipotiroidismo (n = 53) o el hipertiroidismo (n = 55). Se descartaron los 12 casos en que no constaba registro de analítica en las nueve semanas posteriores al inicio del tratamiento. Destaca que cuando la primera determinación analítica se efectuó dentro de los dos primeros meses de tratamiento, el 60% de los pacientes presentaban hipertiroidismo como primera manifestación, en cambio cuando la primera determinación analítica se demoró más allá de los 60 días, en el 70% de los casos se registró el hipotiroidismo como primera alteración (p = 0,012). Las diferencias en las características de ambas formas de presentación se muestran en la tabla 4, en la cual puede observarse que de las variables que mostraron diferencias significativas en el estudio univariante, únicamente la monoterapia/terapia dual se mantuvo significativa en el análisis de regresión multivariante (p = 0,02).
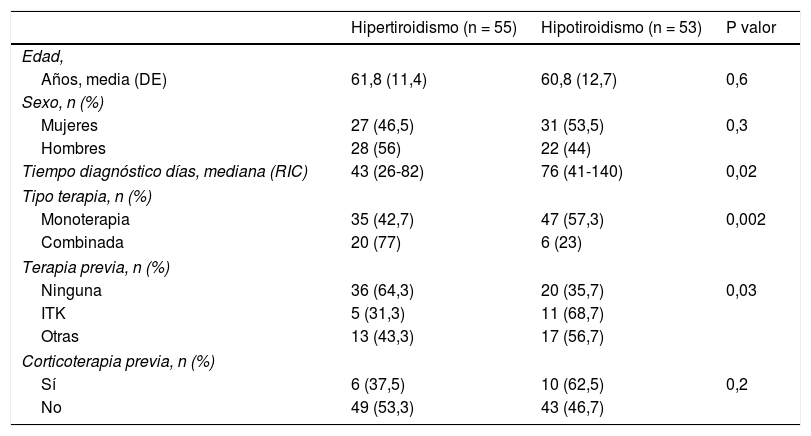
Diferencias en la forma de presentación de la disfunción tiroidea
| Hipertiroidismo (n = 55) | Hipotiroidismo (n = 53) | P valor | |
|---|---|---|---|
| Edad, | |||
| Años, media (DE) | 61,8 (11,4) | 60,8 (12,7) | 0,6 |
| Sexo, n (%) | |||
| Mujeres | 27 (46,5) | 31 (53,5) | 0,3 |
| Hombres | 28 (56) | 22 (44) | |
| Tiempo diagnóstico días, mediana (RIC) | 43 (26-82) | 76 (41-140) | 0,02 |
| Tipo terapia, n (%) | |||
| Monoterapia | 35 (42,7) | 47 (57,3) | 0,002 |
| Combinada | 20 (77) | 6 (23) | |
| Terapia previa, n (%) | |||
| Ninguna | 36 (64,3) | 20 (35,7) | 0,03 |
| ITK | 5 (31,3) | 11 (68,7) | |
| Otras | 13 (43,3) | 17 (56,7) | |
| Corticoterapia previa, n (%) | |||
| Sí | 6 (37,5) | 10 (62,5) | 0,2 |
| No | 49 (53,3) | 43 (46,7) | |
DE: desviación estándar; ITK: inhibidor de tirosina-cinasa; RIC: rango intercuartílico.
En 57 pacientes se instauró tratamiento farmacológico para la disfunción tiroidea. De los sujetos que desarrollaron hipotiroidismo clínico, 52 fueron tratados con levotiroxina. Antes de iniciar tratamiento sustitutivo con levotiroxina, el valor medio de TSH era 23,1 ug/dL (10,3-59,6). La dosis inicial media de levotiroxina fue de 75 mcg/día (50-100). De los pacientes que desarrollaron hipertiroidismo clínico se trataron cinco sujetos con antitiroideos de síntesis. En todos los casos el tratamiento con antitiroideos se inició con un valor de TSH indetectable. El inicio de este tratamiento se efectuó a los 91 (56-154) días tras la introducción del IPCI.
Viraje o cambio de situación funcional tiroideaEn 58 pacientes se verificó un cambio en la situación tiroidea durante el seguimiento (viraje), mientras que el resto progresaron de una situación subclínica a clínica, 38 con hipotiroidismo y nueve con hipertiroidismo, según muestra la tabla 5. El tiempo transcurrido entre el diagnóstico de la disfunción y el viraje o progresión fue de 42 (28-84) días.
Tipo de viraje según la disfunción tiroidea inicial. Destacar que el 20,8% de los pacientes hacen un viraje de una forma clínica o subclínica de alteración tiroidea a eutiroidismo
| Viraje | n (%) |
|---|---|
| Hipotiroidismo subclínico a hipotiroidismo clínico | 29 (30,2) |
| Hipertiroidismo subclínico a hipertiroidismo clínico | 9 (9,3) |
| Hipotiroidismo subclínico/clínico a eutiroidismo | 9 (9,3) |
| Hipertiroidismo subclínico/clínico a eutiroidismo | 11 (11,5) |
| Hipertiroidismo clínico a hipotiroidismo subclínico/clínico | 38 (39,6) |
Durante el seguimiento se solicitaron anticuerpos antitiroideos en el 25% de los casos. En este subgrupo, los anticuerpos anti-Tg resultaron positivos en 27,8%, los anti-TPO en 31,8% y los TSI en 14,3% de los casos.
Evolución de la disfunción tiroideaTras un seguimiento de 205 (112-360) días desde el inicio de la terapia inmunológica hasta el último control analítico, 60 (50%) pacientes se encontraban en tratamiento con levotiroxina (94 [56-112] mcg/día), 47 (39%) pacientes no recibían ninguna terapia relacionada con el tiroides y en el resto se desconocía. De los 60 pacientes que seguían con levotiroxina, 38 pertenecían al grupo de pacientes que debutó con hipotiroidismo clínico o evolucionó de la forma subclínica a la clínica, mientras que los 21 casos restantes habían virado de hipertiroidismo a hipotiroidismo clínico. Al final de este periodo de tiempo, únicamente 39 (33,3%) pacientes continuaron con IPCI y en el resto la terapia inmune se había suspendido, en 38 casos (32,5%) por progresión de la neoplasia, en 17 (14,6%) por efectos adversos (tres de ellos por la alteración tiroidea), nueve (7,7%) por fallecimiento y otros 14 (12%) debido a otras causas. Al final del seguimiento seis pacientes presentaron remisión completa de su neoplasia, 45 enfermedad estable, 45 progresaron y hubo un total de 13 defunciones. No se encontraron diferencias entre esta situación clínica final y el tipo de disfunción inicial ni con el tiempo transcurrido hasta la aparición de la disfunción.
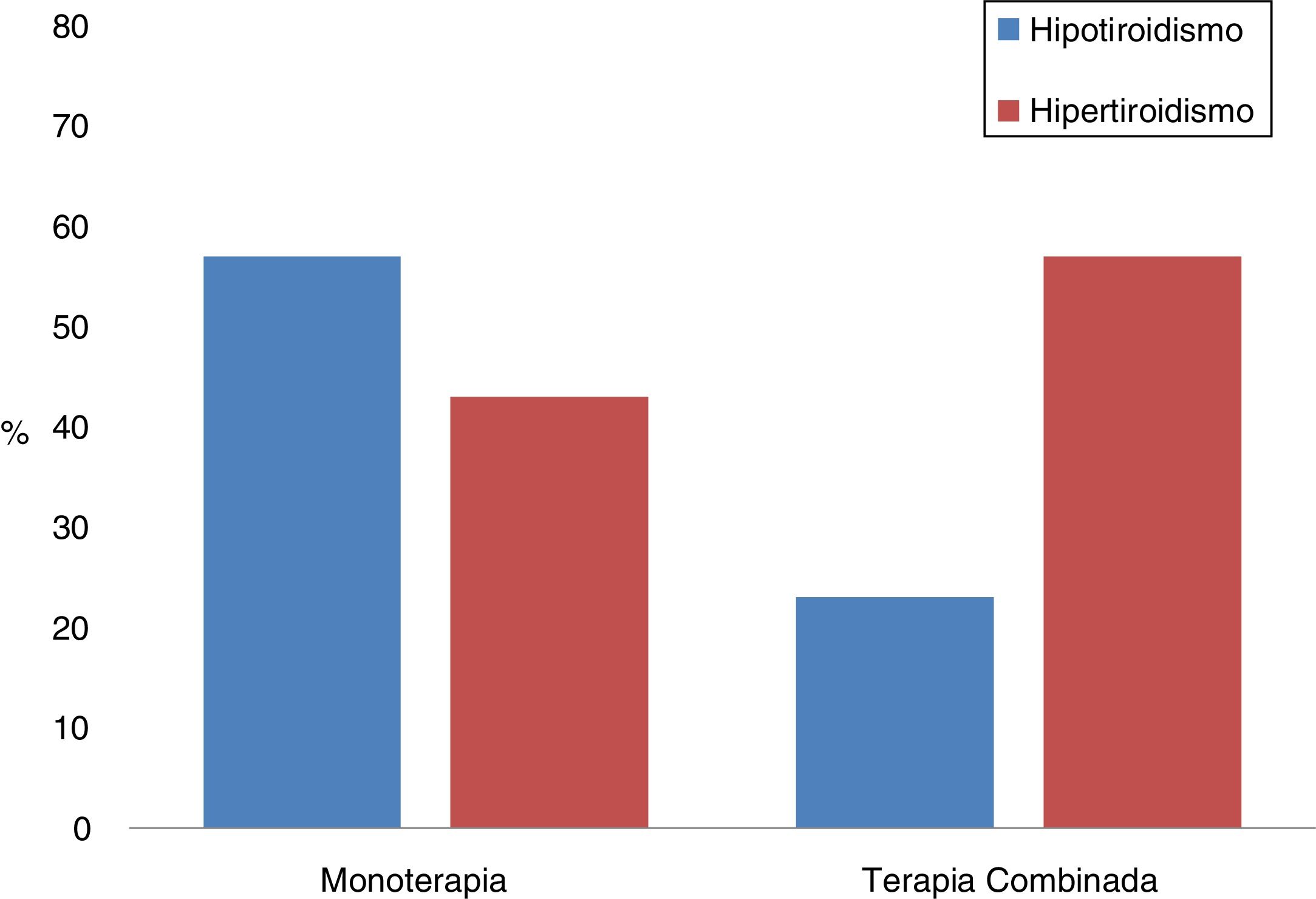
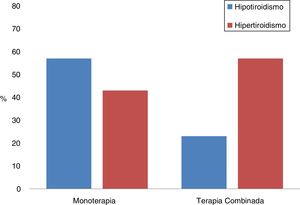
Tratamiento combinadoSe analizaron las diferencias entre los pacientes que habían sido tratados con monoterapia o en combinación de dos IPCI; un total de 26 (21,7%) recibieron terapia IPCI dual (tabla 6, fig. 1). Cabe destacar que la forma de presentación más frecuente en la monoterapia fue el hipotiroidismo (57%), mientras que en la terapia combinada lo fue el hipertiroidismo (77%). Además, en los tratamientos combinados, la primera alteración tiroidea se observó a los 30 días de iniciado el tratamiento, y este periodo fue de exactamente el doble en la monoterapia (p = 0,001). No obstante, también existían diferencias entre ambos grupos en relación al tiempo transcurrido entre el inicio de la terapia inmune y la primera determinación analítica, siendo de 25 (17-41) días en los que recibían dos fármacos y de 42 (21-67) en los que se trataron con monoterapia (p = 0,01).
Características de los pacientes según recibieron monoterapia o terapia combinada
| Monoterapia (n = 94) | Combinada (n = 26) | P valor | |
|---|---|---|---|
| Edad | |||
| Años, media (DE) | 60,5 (12,2) | 60,8 (12,8) | 0,9 |
| Sexo, n (%) | |||
| Mujeres | 48 (78,7) | 13 (21,3) | 0,9 |
| Hombres | 46 (78) | 13 (22) | |
| Tiempo primera analítica días, mediana (RIC) | 42 (21-67) | 25 (17-41) | 0,01 |
| Tiempo diagnóstico días, mediana (RIC) | 61 (40-118) | 30,5 (22-49) | 0,001 |
| Forma presentación, n (%) | |||
| Hipertiroidismo | 35 (63,6) | 20 (36,4) | 0,002 |
| Hipotiroidismo | 47 (88,7) | 6 (11,3) | |
DE: desviación estándar; RIC: rango intercuartílico.
La incidencia global de alteraciones tiroideas asociadas al tratamiento con IPCI llega hasta al 35%, según las series y el tipo de fármaco utilizado15. Cuando se compara con placebo, el riesgo relativo de desarrollar un hipotiroidismo es de 8,3 (IC 95% 4,7-14,6) y un hipertiroidismo de 5,5 (IC 95% 1,3-22,5)16. La prevalencia aumenta con la terapia combinada17. El mecanismo por el que se desarrolla la disfunción tiroidea con los IPCI es desconocido, sin embargo, el papel que juegan en la tolerancia inmunológica sugiere como teoría más aceptada un desbalance a favor de una respuesta inmune exagerada18.
El patrón de alteraciones tiroideas publicadas en la literatura incluye: hipotiroidismo subclínico o clínico, tiroiditis silente con tirotoxicosis transitoria, e hipertiroidismo subclínico o clínico3. Se han descrito otras manifestaciones clínicas tiroideas infrecuentes: enfermedad de Graves por tremelimumab19, tormenta tiroidea en un paciente con enfermedad de Hashimoto durante el tratamiento con nivolumab e ipilimumab20. De forma anecdótica se ha descrito el desarrollo de orbitopatía tiroidea, patología asociada a la enfermedad de Graves, en un paciente eutiroideo durante el curso de tratamiento con nivolumab21. En algunos casos la disfunción tiroidea se presenta concomitante con otros irAE endocrinos, como hipofisitis, diabetes mellitus tipo 1 con cetoacidosis e insuficiencia suprarrenal, lo que puede hacer que el diagnóstico y su manejo sean un desafío22,23. En nuestra serie la presentación clínica inicial ocurrió bien como hipertiroidismo (clínico/subclínico) o hipotiroidismo (clínico/subclínico), sin diferencias en cuanto a sexo o edad para la presentación de alteración tiroidea en monoterapia o terapia combinada y en concordancia con lo descrito por Al Mushref et al.24. Los pacientes que presentaron hipotiroidismo como primera alteración en la analítica lo hicieron con una mediana de 76 días después de iniciar la terapia IPCI, similar a lo que reportaron Tan et al. con una media de 12 (7-36) semanas en una revisión que incluía 457 casos de irAE endocrinos de los cuales 152 eran alteraciones tiroideas25. En los 55 pacientes en los cuales la primera alteración tiroidea observada fue el hipertiroidismo lo hicieron tras una mediana de 27 días (19-50 días) después de iniciar el IPCI, también en concordancia con lo observado en otros estudios26.
Desde el punto de vista clínico, el comportamiento en muchos casos es similar al de una tiroiditis subaguda con una fase inicial de hipertiroidismo seguido del desarrollo de hipotiroidismo. Mientras que en los pacientes de nuestra serie que inicialmente se presentaron con hipertiroidismo era frecuente que viraran a hipotiroidismo, ningún paciente con hipotiroidismo desarrolló tirotoxicosis. Noventa y seis pacientes (80%) de nuestra cohorte siguieron una evolución semejante a este patrón de tiroiditis. La verdadera incidencia de la tiroiditis está posiblemente infravalorada debido a que previamente no se hacía seguimiento protocolizado de la función tiroidea, se registraban el hipertiroidismo y el hipotiroidismo como entidades separadas y la fase de tirotoxicosis, a menudo asintomática, podía pasar desapercibida. La evidencia creciente y el despistaje metódico de alteraciones tiroideas, cada vez más habitual en el seguimiento, han incrementado la prevalencia de esta entidad. En este sentido, y tomando en cuenta estas limitaciones, la prevalencia reportada en la literatura oscila entre 6,5-54%26. La presente serie refuerza la idea de que la fase inicial de hipertiroidismo pasa desapercibida en un porcentaje elevado de pacientes, dado que cuanto más precozmente se realiza la primera determinación analítica tanto mayor es el porcentaje de casos diagnosticados de hipertiroidismo. Destacar que en nuestra cohorte, solo tres pacientes requirieron la discontinuación del tratamiento IPCI debido a la gravedad de la disfunción tiroidea. Este resultado concuerda con lo publicado por Garon-Czmil et al. en donde 110 pacientes presentaron tiroiditis asociada al tratamiento con IPCI, los autores concluyen que con una optimización del manejo de la misma en casi ningún caso fue necesario suspender la terapia con IPCI11. Estos resultados sugieren que aunque la disfunción tiroidea es un irAE frecuente, manejado apropiadamente permite mantener el tratamiento IPCI.
En nuestra serie, en los pacientes que recibieron IPCI en terapia combinada se observó que la alteración de la función tiroidea se presentó antes que en el grupo de monoterapia (30 días vs. 60 días, p = 0,001), dato similar a otras series reportadas27. El hipotiroidismo como primera manifestación de DT se presentó con mayor proporción en el grupo de monoterapia en comparación con el grupo de tratamiento combinado (88,9% vs. 11,3%). No obstante, es interesante resaltar que el tiempo que transcurría entre el inicio de la inmunoterapia y la analítica también era significativamente menor en el grupo combinado, lo que posiblemente refleja el mayor grado de control analítico a este grupo de pacientes.
Nuestro estudio recoge las alteraciones de la función tiroidea durante el tratamiento con inmunoterapia de una cohorte significativa de pacientes en varios centros españoles, sin embargo, tiene diferentes limitaciones dada la naturaleza retrospectiva del análisis y la falta de algunos datos sobre las evaluaciones endocrinas clínicas, bioquímicas y de imagen. Así, no ha sido posible poder establecer la relación entre desarrollo de enfermedad tiroidea y tipo de respuesta del tumor al tratamiento inmune, relación que, aunque apuntada para otros irAE7, no queda claro en relación a la tiroides. Por otro lado, varios estudios parecen indicar que los títulos de anticuerpos anti-TPO y anti-Tg pueden ser de utilidad como factor predictivo del hipotiroidismo, dado que la prevalencia de autoinmunidad tiroidea es mayor entre los que desarrollan alteraciones tiroideas que entre los que no las desarrollan28. En otros estudios, el desarrollo de autoinmunidad tiroidea no se relacionó con la aparición de disfunción tiroidea29. En el presente trabajo, sólo disponíamos de determinaciones de autoinmunidad tiroidea previas a la terapia con IPCI en una pequeña proporción de pacientes, por lo que no se pudo realizar un análisis comparativo. Finalmente, no podemos extraer conclusiones sobre la incidencia de disfunción tiroidea asociada a la terapia con estos fármacos, dado que únicamente se incluyeron aquellos casos remitidos a Endocrinología con la alteración ya verificada.
ConclusionesEn resumen, tanto el hipotiroidismo como el hipertiroidismo presentan una incidencia similar como forma de presentación de la disfunción tiroidea asociada a IPCI, aunque es posible que el hipertiroidismo no sea detectado en un gran número de casos. La disfunción tiroidea en la terapia combinada es más precoz, hecho que debería tenerse en cuenta en los protocolos de seguimiento de estos pacientes. Entender la presentación clínica y el manejo de estos irAE permite un mejor tratamiento para el paciente y facilita la continuidad del tratamiento oncológico, que ha demostrado aumento de la supervivencia. Esto tiene como implicaciones un posible aumento de la prevalencia de las tiroiditis, un aumento del número de pacientes con tratamiento tiroideo a largo plazo, y como consecuencia un aumento de seguimiento por los servicios de Endocrinología.
El presente trabajo forma parte del programa de investigación del «Área de Conocimiento en Tiroides» de la Sociedad Española de Endocrinología y Nutrición (SEEN).
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.