La teoría de la programación fetal sostiene que el bajo peso al nacimiento (BPN) predispone a mayor ingesta alimentaria e incrementa las probabilidades de sobrepeso y obesidad, y estas a su vez de alteraciones como síndrome metabólico (SM) y acantosis nigricans. Nuestro objetivo fue estudiar la existencia de asociación entre el SM, el BPN, el consumo de dieta hipercalórica y la acantosis nigricans, en escolares y adolescentes con sobrepeso y obesidad.
Material y métodosSe realizó un estudio de casos y control en 100 menores que acudían a la consulta de sobrepeso y obesidad del OPD Hospital Civil de Guadalajara, «Fray Antonio Alcalde»; se categorizaron con y sin SM con los criterios de la Federación Internacional de Diabetes para menores de 16 años. Se obtuvo por interrogatorio a los padres y menores, el BPN, el consumo de dietas hipercalóricas (promedio de 2 días/semana del recordatorio de 24h) y la acantosis nigricans (criterios de Simone). Las frecuencias y la regresión logística se calcularon con SPSS versión 22.
ResultadosLos resultados muestran que el 82% de los menores presentaron obesidad, el 18% sobrepeso y el 73% SM. El SM se asoció con BPN (OR: 4,83 [IC 95%: 1,9-12,47]), dieta hipercalórica (OR: 136,8 [IC 95%: 7,7-2434]) y acantosis nigricans (OR: 1872 [IC 95%: 112,9-31028]).
ConclusionesEn escolares y adolescentes con sobrepeso y obesidad se encontró que el BPN, la dieta hipercalórica y la acantosis nigricans representan mayor probabilidad de SM.
The theory of fetal programming suggests that low birth weight (LBW) predisposes to greater food intake and increases the chance of overweight and obesity, which are in turn associated to conditions such as metabolic syndrome (MS) and acanthosis nigricans. The study objective was to ascertain whether an association exists between MS, LBW, intake of high-calorie diets, and acanthosis nigricans in children and adolescents with overweight or obesity.
Material and methodsA case-control was conducted on 100 children who attended the overweight and obesity outpatient clinic of the OPD Hospital Civil de Guadalajara “Fray Antonio Alcalde”. Subjects were stratified in groups with and without MS based on the criteria of the International Diabetes Federation for children aged less than 16 years. Data on LBW, intake of high-calorie diets for 24-hour dietary recalls (average 2 days a week), and acanthosis nigricans (Simone criteria) were obtained by questioning the parents. Frequencies and logistic regression were calculated using SPSS version 22.
ResultsThe results show that 82% of children and adolescents were obese and 18% overweight, and 73% had MS. MS was associated to LBW (OR: 4.83 [95% CI: 1.9-12.47]), high-calorie diets (OR:136.8 [95% CI: 7.7-2434]), and acanthosis nigricans (OR: 1872 [95% CI: 112.9-31028]).
ConclusionsIn children and adolescents with overweight and obesity, LBW, high-calorie diets, and acanthosis nigricans are associated to a higher probability of MS.
El bajo peso al nacimiento (BPN) es un factor determinante en la salud del adulto, que, aunado con la ingesta de dietas hipercalóricas, favorecen la acumulación de tejido adiposo en la región abdominal y la presencia de obesidad. Lo anterior repercute en el desarrollo del síndrome metabólico (SM), diabetes mellitus e insulinorresistencia (IR)1.
Las implicaciones del BPN se sustentan en la teoría de la «programación fetal» que relaciona la desnutrición en periodos críticos del desarrollo, como en la vida intrauterina en menores con BPN, con los cambios permanentes en el metabolismo y la estructura corporal2.
Estos cambios potencialmente aumentan la susceptibilidad a la obesidad y a las enfermedades cardiovasculares y metabólicas en la edad adulta. Realidad que se agrava si el consumo calórico en la infancia supera la ingesta diaria recomendada (dieta hipercalórica)2.
Un signo de IR es la acantosis nigricans (AN), cuya fisiopatología es aún desconocida; clínicamente está caracterizada por placas de piel hiperpigmentadas, verrugosas con hiperqueratosis3.
La teoría más aceptada para el desarrollo de la AN sostiene la presencia de hiperinsulinismo por la IR, activando el insulin-like growth factor-1, que estimula a los queratocitos y fibroblastos dérmicos, generando así AN3.
En México la ingesta alimentaria elevada ha favorecido el exceso de peso, representando un problema en la salud pública nacional. La Encuesta Nacional de Salud para el 2012 mostró que el 19,8% de los varones entre 10 y 15 años presentaron sobrepeso y el 18,1% obesidad, y en el sexo femenino el 29,6% y el 14,8% respectivamente4. Lo anterior aunado a la presencia de BPN puede favorecer el desarrollo de SM.
Nuestro objetivo fue estudiar la existencia de asociación entre el SM, el BPN, el consumo de dieta hipercalórica y la AN, en escolares y adolescentes con sobrepeso y obesidad.
Material y métodosEste es un diseño de casos y control, que se realizó de julio de 2013 a junio de 2014; se seleccionaron a 100 menores entre 10 y 15 años de edad, 50 del género masculino y 50 femenino, que acudían al grupo de sobrepeso y obesidad de la consulta de Nutrición Pediátrica del OPD Antiguo Hospital Civil de Guadalajara, «Fray Antonio Alcalde».
El proyecto fue aprobado por el Comité de Bioética e Investigación de dicha institución, acorde con los lineamientos de la Asociación Médica Mundial y de la Declaración de Helsinki, financiado por el Consejo Estatal de Ciencia y Tecnología del Estado de Jalisco (COECYTJal) con el n.o 06-425-2009.
Previa explicación a los padres y tutores, así como a los menores, se invitó a participar de forma voluntaria y confidencial y se obtuvo el consentimiento informado por escrito de los padres o tutores. Los sujetos que cumplieron los criterios y acudieron a la Clínica de Obesidad fueron invitados y todos aceptaron participar.
La población se separó por su nivel educativo en 2 grupos: de 10 a 12 años que acuden a nivel educación básico (menores) y de 13 a 15 años del nivel secundaria (mayores), el primero constituido por 40 individuos y el segundo por 60.
InstrumentosSe utilizó una historia clínica, báscula digital marca SALTER, estadímetro marca DYNA TOP, cinta métrica flexible de fibra y el baumanómetro digital Omron.
ProcedimientosLas mediciones fueron llevadas a cabo en el consultorio médico del Hospital, los individuos fueron evaluados en presencia de sus padres o tutores.
Se registró una historia clínica por interrogatorio directo con las madres o tutores, que incluía datos generales de la población y el peso del niño al nacimiento, y de acuerdo a la OMS se determinó BPN con menos de 2.500g y edad gestacional entre 37 y 42 semanas5.
De acuerdo a la clasificación del Servicio de Sobrepeso y Obesidad del Hospital, se clasificaron los menores por edad de acuerdo a la escolaridad, de 10 a 12 años (estudiantes de nivel básico) y de 13 a 15 años (estudiantes de nivel secundaria).
La exploración física se realizó con ropa ligera, cómoda y sin zapatos. Se procedió a realizar las mediciones antropométricas por duplicado, siguiendo las recomendaciones del National Health and Nutrition Examination Study6 y la OMS7, se obtuvieron las medidas de peso, talla y circunferencia de cintura (CC)8.
De acuerdo a los criterios de la OMS, se consideró sobrepeso en los menores que presentaron IMC≥percentil 85 y de obesidad≥956,7.
Para la identificación del SM se utilizaron los criterios de la Federación Internacional de Diabetes para menores de 16 años, que considera la obesidad abdominal (OA) más 2 criterios para su diagnóstico que incluyen TA y las pruebas bioquímicas de triglicéridos, HDL y glucosa9.
La cuantificación de triglicéridos, HDL y glucosa, se realizó previo ayuno de 12h, se tomó sangre periférica de los menores para la cuantificación enzimática-espectrofotométrica en el laboratorio central del Hospital. Los valores de normalidad fueron para glucosa<100mg/dl, HDL>40/mg/dl, triglicéridos<150mg/dl, TA sistólica<130mmHg y TA diastólica<85mmHg9.
Previa estandarización con personal certificado en medidas antropométricas, la CC se tomó con el individuo de pie, con los brazos en abducción. Se localizó las crestas iliacas, derecha e izquierda y se rodeó ambos puntos con la cinta métrica metálica, en forma horizontal a la altura del ombligo. Se solicitó al sujeto que inhalará y exhalará para realizar el registro9.
La OA de los escolares y adolescentes se determinó al medir la CC≥percentil 90 de las tablas de Fernández et al.8; la TA se consideró con los criterios del Bogalusa Heart Study10.
Para el diagnóstico clínico de AN se utilizaron los criterios de Simone et al.11, que incluye las zonas del cuello, axilas, codos, rodillas, palma y plantas de los pies, y establece los siguientes grados de AN dependiendo de la presencia en cada sitio afectado: grado 1: Imperceptible para una persona sin entrenamiento; grado 2: Visible pero no llama la atención; grado 3: Muy visible y grado 4: Llama la atención.
El consumo calórico de la dieta se estimó a través del recordatorio de 24h, con la media de 2 días de la semana (entre semana y el domingo). El recordatorio de 24h incluyó los tiempos de comida, categorizando todos los alimentos consumido durante el día en desayuno, colación matutina, comida, colación vespertina y cena, además de golosinas. Se estimaron las porciones ingerida utilizando réplicas de alimentos, marca Nasco®. Se elaboró una base de datos de los alimentos y la cantidad de kilocalorías se estimaron con lo reportado para cada alimentos del manual de Sistema Mexicano de Alimentos Equivalentes12 y las etiquetas de los empaques de las golosinas no incluidas en el manual.
La dieta hipercalórica se consideró cuando el incremento calórico fue≥30% de la ingesta recomendada, acorde a los criterios de la Dietary Guidelines for Americans, American Academy of Pediatrics Nutrition Handbook y la American Heart Association13.
Análisis estadísticoLas variables categóricas se describen en frecuencias y las continuas en medias y DE. La comparación de frecuencias se realizó con la prueba X2, la comparación de indicadores se llevó a cabo con la prueba de U de Mann Whitney. Para determinar la asociación entre SM y el resto de las variables se utilizó regresión logística y la correlación de Spearman. Se consideró un nivel de significación p<0,05 y un intervalo de confianza del 95% (IC 95%). Los datos se analizaron en el programa SPSS versión 22.0.
ResultadosDe los 100 individuos que se examinaron 82 mostraban obesidad y 18 sobrepeso. La prevalencia de SM fue del 73%, con una distribución similar por género con 38 hombres y 35 mujeres (p>0,05).
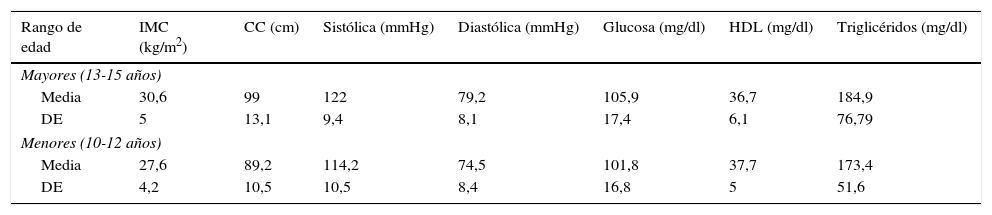
La media y DE de los indicadores de SM por rango de edad incluyendo IMC, TA, glucosa, HDL y triglicéridos se describen en la tabla 1.
Indicadores de síndrome metabólico en escolares y adolescentes con sobrepeso u obesidad por categoría de edad
| Rango de edad | IMC (kg/m2) | CC (cm) | Sistólica (mmHg) | Diastólica (mmHg) | Glucosa (mg/dl) | HDL (mg/dl) | Triglicéridos (mg/dl) |
|---|---|---|---|---|---|---|---|
| Mayores (13-15 años) | |||||||
| Media | 30,6 | 99 | 122 | 79,2 | 105,9 | 36,7 | 184,9 |
| DE | 5 | 13,1 | 9,4 | 8,1 | 17,4 | 6,1 | 76,79 |
| Menores (10-12 años) | |||||||
| Media | 27,6 | 89,2 | 114,2 | 74,5 | 101,8 | 37,7 | 173,4 |
| DE | 4,2 | 10,5 | 10,5 | 8,4 | 16,8 | 5 | 51,6 |
CC: circunferencia de cintura; DE: desviación estándar; IMC: índice de masa corporal.
n=60 mayores y 40 menores.
En ambos grupos de edad se obtuvo la media de HDL (normal<40mg/dl) y triglicéridos≥150mg/dl, considerado como hipertrigliceridemia por la Federación Internacional de Diabetes, en el grupo de mayores fue superior por 11mg/dl con respecto a menores.
La prevalencia de AN fue del 73%, la mayor frecuencia se encontró en la parte posterior del cuello (45%), seguido de codos (15%), rodillas (10%), palma de las manos y planta de los pies (3%). De acuerdo a la clasificación de Simone et al.12 el 1% presentaba grado 1, el 10% grado 2, el 23% grado 3 y el 39% grado 4.
No se encontraron diferencias por género y la frecuencia por edad fue similar en los mayores con el 73,3% y en los menores con el 72,5% (p<0,552).
Del total de sujetos el 72% presentaron SM y AN simultáneamente, de ellos el 87,5% tuvieron BPN (≤2,500kg) y 8 (11,1%) fueron macrosómicos.
El 87% del total de la muestra presentó consumo calórico elevado para su edad y género. Ninguno de los individuos estudiados practicaba ejercicio.
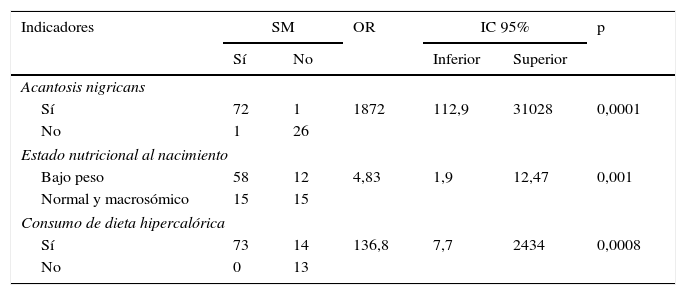
Se encontró asociación de SM con AN (p<0,0001), estado nutricional al nacimiento (p<0,001) y consumo de dieta hipercalórica (p<0,0008) todo lo cual se describen en la tabla 2.
Asociación de acantosis nigricans, estado nutricional al nacimiento y consumo de dieta hipercalórica con el síndrome metabólico en escolares y adolescentes con sobrepeso y obesidad
| Indicadores | SM | OR | IC 95% | p | ||
|---|---|---|---|---|---|---|
| Sí | No | Inferior | Superior | |||
| Acantosis nigricans | ||||||
| Sí | 72 | 1 | 1872 | 112,9 | 31028 | 0,0001 |
| No | 1 | 26 | ||||
| Estado nutricional al nacimiento | ||||||
| Bajo peso | 58 | 12 | 4,83 | 1,9 | 12,47 | 0,001 |
| Normal y macrosómico | 15 | 15 | ||||
| Consumo de dieta hipercalórica | ||||||
| Sí | 73 | 14 | 136,8 | 7,7 | 2434 | 0,0008 |
| No | 0 | 13 | ||||
IC 95%: intervalo de confianza del 95%; OR: odd ratio; SM: síndrome metabólico.
n=100.
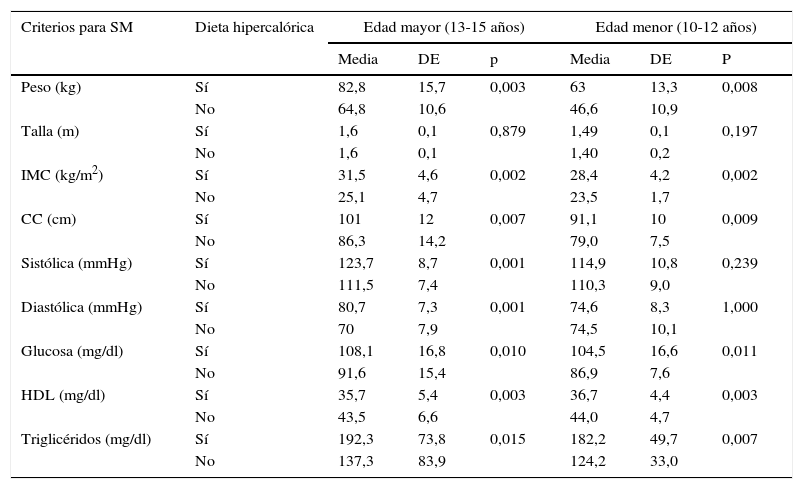
El grupo con mayor edad con SM y AN mostró una media y DE del consumo calórico de fin de semana de 2.707,8±291,3kcal (dieta hipercalórica); mientras en los que no presentaron SM y AN la ingesta fue de 2.206,3±336,1kcal (p<0,001) (dieta normal para hombres y mujeres de 13-15 años); en el grupo de menor edad el consumo promedio calórico de los que presentaron asociación en ambas variables estudiadas supera la ingesta diaria recomendada de 2.500,4±213,6kcal (dieta hipercalórica). Las variables de peso, IMC, CC, glucosa, HDL y triglicéridos para SM, por categoría de edad, se encontraron más alteradas con el consumo de la dieta hipercalórica (ver tabla 3).
Comparación de los criterios de síndrome metabólico con la dieta hipercalórica en escolares y adolescentes con sobrepeso u obesidad por grupo de edad
| Criterios para SM | Dieta hipercalórica | Edad mayor (13-15 años) | Edad menor (10-12 años) | ||||
|---|---|---|---|---|---|---|---|
| Media | DE | p | Media | DE | P | ||
| Peso (kg) | Sí | 82,8 | 15,7 | 0,003 | 63 | 13,3 | 0,008 |
| No | 64,8 | 10,6 | 46,6 | 10,9 | |||
| Talla (m) | Sí | 1,6 | 0,1 | 0,879 | 1,49 | 0,1 | 0,197 |
| No | 1,6 | 0,1 | 1,40 | 0,2 | |||
| IMC (kg/m2) | Sí | 31,5 | 4,6 | 0,002 | 28,4 | 4,2 | 0,002 |
| No | 25,1 | 4,7 | 23,5 | 1,7 | |||
| CC (cm) | Sí | 101 | 12 | 0,007 | 91,1 | 10 | 0,009 |
| No | 86,3 | 14,2 | 79,0 | 7,5 | |||
| Sistólica (mmHg) | Sí | 123,7 | 8,7 | 0,001 | 114,9 | 10,8 | 0,239 |
| No | 111,5 | 7,4 | 110,3 | 9,0 | |||
| Diastólica (mmHg) | Sí | 80,7 | 7,3 | 0,001 | 74,6 | 8,3 | 1,000 |
| No | 70 | 7,9 | 74,5 | 10,1 | |||
| Glucosa (mg/dl) | Sí | 108,1 | 16,8 | 0,010 | 104,5 | 16,6 | 0,011 |
| No | 91,6 | 15,4 | 86,9 | 7,6 | |||
| HDL (mg/dl) | Sí | 35,7 | 5,4 | 0,003 | 36,7 | 4,4 | 0,003 |
| No | 43,5 | 6,6 | 44,0 | 4,7 | |||
| Triglicéridos (mg/dl) | Sí | 192,3 | 73,8 | 0,015 | 182,2 | 49,7 | 0,007 |
| No | 137,3 | 83,9 | 124,2 | 33,0 | |||
CC: circunferencia de cintura; DE: desviación estándar; HDL: lipoproteínas de alta densidad; IMC: índice de masa corporal; SM: síndrome metabólico.
Mayores con dieta hipercalórica 52, sin 8; menores con dieta hipercalórica 34, sin 6.
n=60 mayores y 40 menores.
En México el porcentaje de BPN en niños menores de 5 años representa el 8,37% de los casos4, el alto porcentaje encontrado en la población estudiada es debido a que provienen de un hospital de concentración de tercer nivel, cuya población que atiende es de muy bajos recursos económicos y no cuenta con sistema de atención a la salud.
Los menores incluidos en este estudio fueron seleccionados de la atención de la clínica de obesidad por presentar mayor adiposidad, lo que explica la elevada frecuencia de SM con respecto a otros estudios de prevalencia en escolares y adolescentes de la población general14–17.
Los indicadores para SM que destacaron por presentar mayor frecuencia fueron la CC; los niveles de glucosa sérica elevados y la TA sistólica y diastólica alterados.
Los sujetos obesos estudiados presentaron una alta frecuencia de BPN, que fortalece la teoría de la «programación fetal» de Barker et al., para el desarrollo de alteraciones metabólicas2.
Los estudios previos indican que la nutrición intrauterina y el BPN pueden ser indicadores predictivos de diabetes, hipertensión y enfermedad cardiovascular en la vida adulta18,19, favorecidos con la convergencia de los factores ambientales4.
Se ha propuesto que la implicación que tiene el BPN en la adiposidad sea debida al desarrollo del centro del apetito hipotalámico, lo que lleva a la sobrealimentación y obesidad en la vida posnatal. Posiblemente los sujetos que presentan BPN, desde la vida intrauterina, limitan metabólicamente su consumo de energía, que los lleva a desarrollar el fenotipo ahorrador19.
Las inconsistencias entre el BPN y el riesgo de obesidad en la vida futura se han respondido con el estudio más reciente en niños y adolescentes de China, el cual indica que el BPN representa mayor probabilidad de obesidad y en los individuos con muy BPN mayor tendencia a la obesidad central20.
Para reforzar lo anterior, el estudio Pune Maternal Nutrition Study de India, en niños con BPN, hizo seguimiento en niños de los 4 a los 8 años de edad, confirmando que presentaban niveles altos de adiposidad, OA, IR y factores de riesgo cardiovascular21.
A pesar de la relación que se ha encontrado entre el BPN y la obesidad, así como otras alteraciones metabólicas como hiperinsulinemia22, la asociación exacta entre el peso al nacimiento y SM en la infancia/adolescencia sigue siendo poco clara.
Actualmente se está evaluando la participación de las condiciones ambientales y sociales de la vida, relacionadas con el desbalance nutricional en la edad adulta23.
Asimismo, la asociación encontrada entre la OA y las alteraciones de los componentes de SM en niños y adolescentes indica un riesgo similar al descrito por Weiss et al.17, el Bogalusa Heart Study10 y Freedman et al.24–26.
En el mismo sentido, Yuan et al., en China, encontraron asociación entre el BPN y la OA (OR: 2,3; IC 95%: 1,03-5,14), comparado con los recién nacidos de mayor peso, ajustados por edad gestacional, factores prenatales y diabéticos20.
Nosotros encontramos datos similares a los estudios de Barker19 y DOHaD18, con relación a las alteraciones metabólicas con el BPN, que a su vez se asocian con obesidad.
La evaluación de la OA es un fuerte indicador de adiposidad central para el diagnóstico de alteraciones metabólicas25. La CC estima mejor la OA, como se observó en este estudio.
La relación entre el exceso de adiposidad en el adulto, que predispone al riesgo alto de diabetes y trastornos metabólicos, se fundamenta en gran parte por los recién nacidos con BPN y OA que al parecer presentan mayor riesgo de diabetes condicionada desde la vida gestacional22.
Nuestros resultados coinciden con la asociación de riesgo del BPN con SM y OA, indicando la participación de posibles factores fisiopatológicos e inflamatorios relacionados con el SM en la gestación, la niñez y la adolescencia1,19 y que condicionan una alta probabilidad de desarrollar diabetes.
El consumo de la dieta hipercalórica, como parte del estilo de vida, se vincula estrechamente con la presencia de SM27, condición que muestra cierta tendencia que requiere de un tamaño de muestra mayor para fortalecer la idea.
Sobre la prevalencia de AN en escolares y adolescentes se ha examinado poco, y al parecer está fuertemente asociada con problemas metabólicos28.
Se ha considerado la AN como un signo clínico de riesgo para SM29, cuya importancia se fundamenta en la correlación que presenta con la IR30, como se muestra con la asociación SM y AN encontrada. Nuestros hallazgos contribuyen a considerar el signo clínico de AN de riesgo y como indicador de alteraciones metabólicas para SM.
La asociación entre SM y dieta hipercalórica en este estudio presenta como limitación un IC 95% amplio, por lo que se sugiere aumentar el tamaño de la muestra y estudios de cohortes para fortalecer esta hipótesis, así como evaluar el riesgo de SM y AN ajustados por edad gestacional, género, nivel socioeconómico y educación, entre otras condiciones sociales.
Finalmente, consideramos la determinación de factores de riesgo para SM esencial para tomar medidas preventivas, incluyendo cambios en el estilo de vida, en poblaciones de alto riego como los individuos con BPN.
ConclusionesEl BPN constituye un signo de alarma, de acuerdo a la programación fetal, se observa que facilita la distribución de adiposidad central, aunada al consumo frecuente de dietas hipercalóricas a edades tempranas, lo que favorece alteraciones endocrinometabólicas, entre ellas SM y AN.
El BPN, la AN y el consumo hipercalórico se asociaron con SM en individuos con sobrepeso y obesidad en edades tempranas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.