Uno de los principales objetivos de la prescripción de actividad física para personas con diabetes de tipo2 es reducir la hiperglucemia, ya que es un factor de riesgo para el desarrollo de las complicaciones crónicas. Puesto que un menor tiempo diario en conducta sedentaria (CS) implica un mayor consumo de glucosa por parte del tejido muscular esquelético, esto puede tener efectos positivos agudos sobre los parámetros de control glucémico. De acuerdo con lo anterior, el objetivo de este estudio fue analizar la información de distintos protocolos de quiebre en la CS y su asociación con parámetros de control glucémico en pacientes con diabetes tipo2.
Material y métodoSe realizó una búsqueda sistemática de los estudios controlados aleatorizados sobre este tema que se encuentran publicados en la literatura científica. Para ello se consideraron las siguientes bases de datos: PubMed, Cochrane, EBSCO, WoS, ScienceDirect y Medline.
ResultadosSe identificaron 24 estudios sobre el tema, los cuales se analizaron con la plataforma COVIDENCE. Para el estudio final se seleccionaron 7 artículos, que suman un total de 138 pacientes. Los resultados muestran que los quiebres en la CS, a través de actividad física ligera, son eficaces en disminuir la resistencia insulínica, el área bajo la curva de glucosa, las glucemias de ayuno y posprandial, y la variabilidad glucémica.
ConclusionesEl quiebre agudo en la CS, a través de ejercicio de intensidad liviana y duración breve, es capaz de mejorar los indicadores de control glucémico en personas con diabetes tipo2, incluyendo la variabilidad glucémica medida a corto plazo.
One of the main goals of prescribing physical activity for people with type2 diabetes is to reduce hyperglycaemia, as it is a risk factor for the development of chronic complications. As less time spent each day in sedentary behaviour would lead to higher glucose consumption by skeletal muscle tissue, this could have significant positive effects on blood glucose control parameters. For this reason, the aim of this study was to analyse the information from different protocols for breaking sedentary behaviour and the association with blood glucose control parameters in patients with type2 diabetes.
Material and methodsA systematic search was carried out for randomised controlled studies on this topic published in the scientific literature. The following databases were considered: PubMed, Cochrane, EBSCO, WoS, ScienceDirect and Medline.
Results24 studies were identified and analysed using the COVIDENCE platform. Seven articles were selected for the final analysis, comprising 138 patients. The results show that breaks in sedentary behaviour with light physical activity in people with type2 diabetes are effective in reducing insulin resistance, the area under the glucose curve, fasting and postprandial blood glucose, and blood glucose variability.
ConclusionsAcute interruption of sedentary behaviour, through light-intensity and short-duration exercise, can improve blood glucose indicators in patients with type2 diabetes, including short term blood glucose variability.
Las recomendaciones de la Organización Mundial de la Salud (OMS) del año 2020 establecen que los adultos deberían acumular al menos 150min, e idealmente 300min, de actividad física moderada semanal, ya que esta variable es determinante para lograr tanto prevención primaria como secundaria en la salud de las personas. La OMS define la actividad física como «cualquier movimiento corporal producido por los músculos esqueléticos, con el consiguiente consumo de energía». Estas recomendaciones propuestas por la OMS se orientan principalmente a evitar el desarrollo de enfermedades cardiovasculares, obesidad, diabetes mellitus de tipo2 (DM2) y algunos tipos de cáncer1. Sin embargo, a pesar de los beneficios conocidos de alcanzar las metas de actividad física propuestas por las entidades internacionales, su logro sigue siendo un gran desafío, particularmente para la prevención y el tratamiento de la DM22,3. Este desafío es especialmente complejo no solo en pacientes con DM2, sino también en personas con sobrepeso de mediana edad y en adultos mayores, todos los cuales tienen una alta probabilidad de ser inactivos y/o sedentarios, además de tener menor tolerancia al ejercicio que los individuos sanos4,5. De hecho, la prescripción de actividad física moderada-vigorosa (intensidad mayor a 3MET) en estos sujetos suele ser poco factible de lograr y, en muchos casos, inalcanzable6.
Por otra parte, estudios poblacionales han encontrado que más de la mitad de las personas presentan una conducta sedentaria (CS) elevada durante un día típico, entendiendo por CS toda actividad —en periodo de vigilia— que implique un gasto energético menor a 1,5MET, tales como: estar sedente mirando televisión o frente a un computador, estar reclinado, o estar recostado7. Específicamente, se ha evidenciado que las personas con DM2 pasan aproximadamente un 64% de su tiempo de vigilia en CS8. Este estilo de vida es una tendencia mundial especialmente preocupante, ya que las investigaciones sugieren que largos períodos en CS tienen efectos muy nocivos para la salud, incluso de manera independiente al logro alcanzado en las recomendaciones de actividad física9.
Desde el año 2016, la Asociación Americana de Diabetes (ADA) propone, como parte de la prescripción de estilo de vida saludable para personas con DM2, realizar quiebres de la conducta sedentaria (QCS). Los QCS se definen como una interrupción de la CS por un breve período de tiempo con actividad física de intensidad liviana (entre 1,5 y 3,0MET). Dentro de este tipo de actividad física se encuentran, por ejemplo, el caminar, el subir y bajar escaleras, o bien el realizar sentadillas. La ADA recomienda QCS de al menos 3min de actividad física liviana por cada 30min de CS para personas con diabetes mellitus10. La propuesta de la ADA se basa en los potentes efectos beneficiosos de los QCS sobre la aptitud cardiorrespiratoria, la captación de glucosa mediada por contracción muscular esquelética y la respuesta a la insulina11.
Actualmente, existe una tendencia creciente a enfocarse exclusivamente en ejercicio intencionado y estructurado de intensidad moderada a vigorosa. Sin embargo, esta prescripción tiene marcadas limitaciones en los casos de personas con morbilidades12. En este contexto, simplemente reemplazando más tiempo de CS con actividades livianas de pie, de breve duración, podrían ser estrategias más efectivas para el cambio de conducta, particularmente si son realizadas en el lugar de trabajo, puesto que es allí donde frecuentemente la persona acumula mucho de su tiempo en CS. De esta manera, el QCS realizado de dicha forma podría ser una herramienta de utilidad para acercar inicialmente a las personas a una vida más activa y, posteriormente, lograr las recomendaciones de actividad física adecuadas para su estado de salud.
Por otra parte, actualmente se sabe que la contribución a la patogénesis de las complicaciones diabéticas no solo está determinada por el grado de exposición a la hiperglucemia, el que tradicionalmente se evalúa a través de la HbA1c (hemoglobina glucosilada) a largo plazo, sino también por la variabilidad glucémica (VG), la que evalúa las fluctuaciones diarias de la glucosa en sangre a corto plazo (dentro del día o entre días consecutivos)13. Es así como la VG en DM2 ha demostrado estar asociada con un mayor riesgo de complicaciones, especialmente de tipo macrovascular14, al aumentar el estrés oxidativo, los marcadores proinflamatorios y los productos finales de glucación avanzada15-17. De acuerdo con ello, no solo es importante identificar los cambios en los indicadores glucémicos clásicos, como el área incremental bajo la curva (iAUC) de glucosa, la glucemia en ayuno y posprandial, o el fenómeno del alba (FA), sino también la VG con sus indicadores, tales como el tiempo en rango de glucosa, el tiempo en hiperglucemia, la desviación estándar (DE) de glucosa, el coeficiente de variación (CV) de glucosa, la amplitud media de excursión de glucosa (MAGE) y la superposición glucémica continua (CONGA)16,17.
Por todo lo anterior, es muy relevante conocer la evidencia sobre los beneficios de los QCS, evaluados a través de parámetros fisiológicos de control glucémico robustos, para contribuir a prevenir las complicaciones a largo plazo en las personas con DM2. En consecuencia, el objetivo de este estudio fue analizar los efectos a corto plazo de distintos protocolos de QCS sobre los parámetros fisiológicos de control glucémico en pacientes con DM2.
Material y métodoEstrategia de búsquedaEste artículo es una revisión sistemática. La búsqueda de artículos se realizó en las bases de datos bibliográficas Pubmed, ScienceDirect, Cochrane, WoS, Medline y EBSCO. Los límites de la búsqueda fueron: estudios publicados entre los años 2011 y 2021 (junio), realizados en humanos de 18años o más.
La estrategia de búsqueda incluyó los siguientes términos MeSH: (glycemic variability) AND (glucose control) AND (type2 diabetes) AND (sedentary behavior OR breaking sitting) AND (continuous glucose monitoring) AND (humans). Se consideraron para el estudio artículos de habla inglesa, española, portuguesa y alemana.
Selección de artículosRespecto a los diseños de artículos científicos incluidos, fueron: ensayos aleatorizados cruzados (crossover) (EAC). Los artículos de revisión bibliográfica, cartas al editor, estudios de casos y opinión de expertos no se consideraron. La población incluida fue: sujetos de 18 o más años con DM2 sometidos exámenes de VG a corto plazo con dispositivos de medición de glucemia continua. Inicialmente, dos investigadores revisaron los resúmenes de los artículos. Aquellos artículos cuyos resúmenes cumplían con los criterios de inclusión fueron examinados por completo para determinar su elegibilidad.
Extracción de datosLa extracción de datos fue realizada por un autor que no fue partícipe de la selección de estudios. La información extraída de los estudios elegidos incluyó información descriptiva, métodos de análisis, y resultados (tabla 1).
Efecto del quiebre de la conducta sedentaria en personas con diabetes mellitus
| Autor/año (referencia) | n (edad, años) | Sesión/condición | Diseño | Método de evaluación glucémica | Período lavado | Desenlace-Parámetros de control glucémico |
|---|---|---|---|---|---|---|
| Dempsey et al.21, 2016 | 24 (62+6) | 7 h total protocolo CS. Tres sesiones:1: SIT (control) sedente prolongado2: LW: sedente +3min sesiones de caminata liviana (3,2km/h) cada 30min de CS3: SRA: sedente +3min de ejercicio de fuerza simple cada 30min de CS | EAC | Muestras de sangre venosa cada 30 min | 6-14 días | Comparado con la sesión SIT, en ambas sesiones SRA o LW atenuó significativamente iAUC (7h): glucosa e insulina p<0,001QCS con sesiones LW o SRA atenúa significativamente la glucosa e insulina posprandial |
| Dempsey et al.20, 2017 | 24 (62+6) | 7 h total protocolo CS. Tres sesiones:1: SIT (control) sedente prolongado2: LW: sedente +3min sesiones de caminata liviana (3,2km/h) cada 30min de CS3: SRA: sedente +3min de ejercicio de fuerza simple cada 30min de CS | EAC | SMCG | 6-14 días | Comparado con la sesión SIT, ambos LW and SRA redujeron los niveles de glucosa significativamente 22h glucosa p<0,001Los promedios nocturno y matutino de glucosa disminuyeron significativamente en la sesión LW y SRA comparado con la sesión SIT (p<0,001)QCS 7h con sesión LW o SRA reduce significativamente 22h de hiperglucemia y iAUCDE de glucosa, CONGA-1 y MAGE disminuyeron significativamente con sesiones de LW y SRA comparado con sesión SIT. Sin embargo, CV% no tuvo diferencias significativas en los tres tipos de sesionesNo se identificaron episodios de hipoglucemia en ninguna de las sesiones |
| Duvivier et al.19, 2017 | 19 (63+9) | Tres sesiones1: Sitting: 14h2: Ejercicio: reemplazo de 1,1h/día de CS por ejercicio (intensidad 5,9MET)3: SIT Less: 17,502 pasos/día con reemplazo de 4,7h/día de la CS (caminar y estar de pie) | EAC | SMCG | 10 días | iAUC por 24h glucosa fue significativamente menor durante la sesión SIT Less que Sitting (p=0,002), disminuyó un 36%. Sin embargo, los valores de Sit Less y Ejercicio fueron similares (p=0,499)El tiempo en hiperglucemia en 24h se redujo de 211min/día en Sitting a 118min/día en Sit Less (p=0,002). En Ejercicio, el tiempo en hiperglucemia en 24h fue de 152min |
| Dempsey et al.18, 2018 | 24 (62+6) | 4 h CS cada sesión1: CS: 4h2: QCS cada 20min (3,2km/h) por 2min (en sobrepeso u obesos)3: QCS cada 30min (3,2km/h) por 3min (en diabéticos) | EAC | Muestras de sangre venosa cada 1 h | NR | Los resultados indican que, a mayor grado de resistencia insulínica, mayor beneficio metabólico provoca el QCS comparada con sesión controlEl impacto de la sesión CS sobre la glucosa tAUC, comparado con QCS fue mayor en 1,23mmol/h/l por cada 1mmol/l mayor de glucosa en ayunas (p<0,001) |
| Paing et al.24, 2019 | 12 (60+3) | 7 h CS cada sesión. QCS: 3min de ejercicio intensidad liviana-caminata1: QCS cada 60min2: QCS cada 30min3: QCS cada 15min | EAC de bloques incompletos | SMCG | 5 días | La glucemia de ayuno y la duración del FA fue menor para la sesión 3 comparada con la sesión 2 (p=0,041) y con la sesión 1 (p=0,004)El CV de la VG nocturna se redujo en la sesión 3 al compáralo con la sesión 2 (p<0,03) y con la sesión 1 (p<0,02) |
| Paing et al.22, 2019 | 12 (60+11) | 7 h CS cada sesión. QCS: 3min de ejercicio intensidad liviana-caminata1: QCS cada 60 min2: QCS cada 30 min3: QCS cada 15 min | EAC de bloques incompletos | SMCG | 5 días | La sesión 3 reduce la AUC de glucosa (21h) comparada con la sesión 1 (p<0,001) y con la sesión 2 (p=0,002)Post-desayuno: comparado con la sesión 1, el iAUC-glucosa disminuyó en la sesión 3 (p<0,04)Post-almuerzo: el iAUC-glucosa fue significativamente menor en sesión 3 (p<0,03) y en sesión 2 (p<0,05) con respecto a la sesión 1 |
| Homer et al.23, 2021 | 23 (62+8) | Tres sesiones.1: SIT: CS 7h ininterrumpida2: SRA3: CS +3min ejercicio de fuerza cada 30min3: SRA6: CS +6min ejercicio de fuerza cada 60min | EAC | Muestras de sangre venosa cada 30min | 6-14 días | Los niveles de glucosa e insulina en iAUCnet de 7h disminuyeron significativamente durante SRA6 en comparación con la sesión SIT (p<0,05)Los niveles de glucosa e insulina en iAUCnet de 7h no disminuyeron significativamente durante SRA3 en comparación con la sesión SITEn adultos diabéticos el QCS de 6min cada 60min redujo significativamente (p<0,05) la glucosa y la insulina posprandial |
AUC: área bajo la curva de glucosa; CONGA-1: superposición glucémica continua; CS: conducta sedentaria; CV: coeficiente de variación; CV%: porcentaje de coeficiente de variación; DE de glucosa: desviación estándar de glucosa; EAC: ensayo aleatorizado cruzado (crossover); iAUC: área bajo la curva de glucosa; iAUCnet: área bajo la curva neta de glucosa; LW: caminata de intensidad liviana; MAGE: amplitud media de excursión de glucosa; MET: unidad de medida del índice metabólico (corresponde a 3,5ml O2/kg ×min o 1kcal/kg/h); QCS: quiebre conducta sedentaria; SIT: sentarse; SIT Less: sentarse menos; Sitting: sentado; SMCG: sistemas de monitoreo continuo de glucosa; SRA: actividades resistidas simples.
El protocolo para llevar a cabo la presente revisión sistemática fue guiado por la declaración PRISMA (Preferred Reporting Items for Systematic Review and Meta-Analysis) y ejecutado a través de la plataforma COVIDENCE® (www.covidence.org).
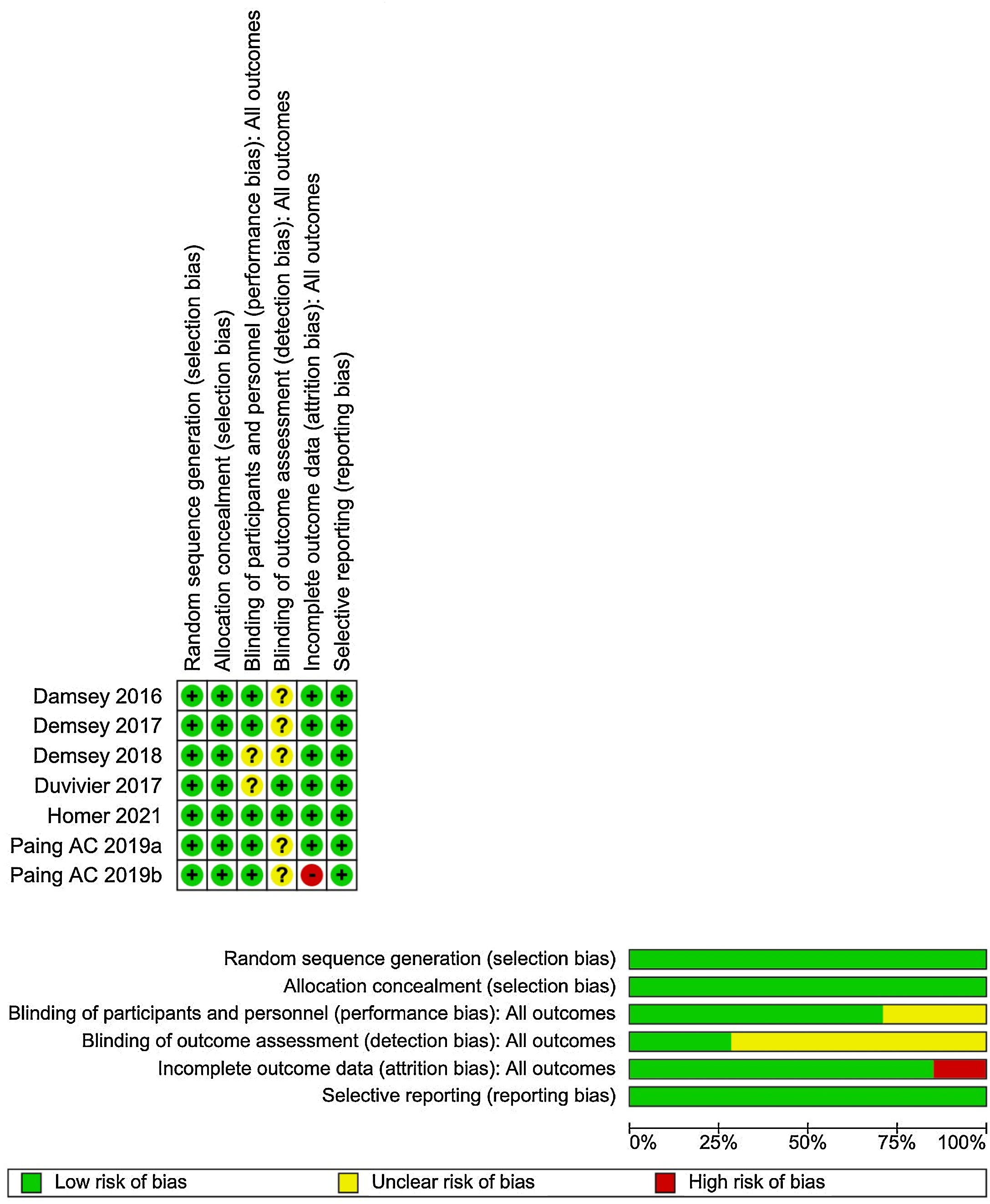
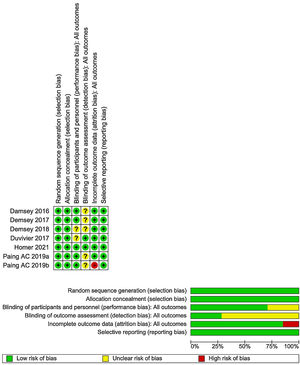
La evaluación del riesgo de sesgo de los estudios incluidos fue realizada por dos revisores de forma independiente para cada estudio, utilizando la herramienta RoB1 (fig. 1). Todos los conflictos entre los investigadores fueron resueltos por consenso.
Medidas de resultadoLos artículos analizados evaluaron el efecto de los QCS a través de los siguientes parámetros de control glucémico: resistencia a la insulina, iAUC de glucosa (área incremental bajo la curva de glucosa), fenómeno del alba (FA) y mediciones agudas de VG, como son: tiempo de hiperglucemia (posprandial o 24h) e hipoglucemia, CV y DE de glucosa, CONGA-1 y MAGE.
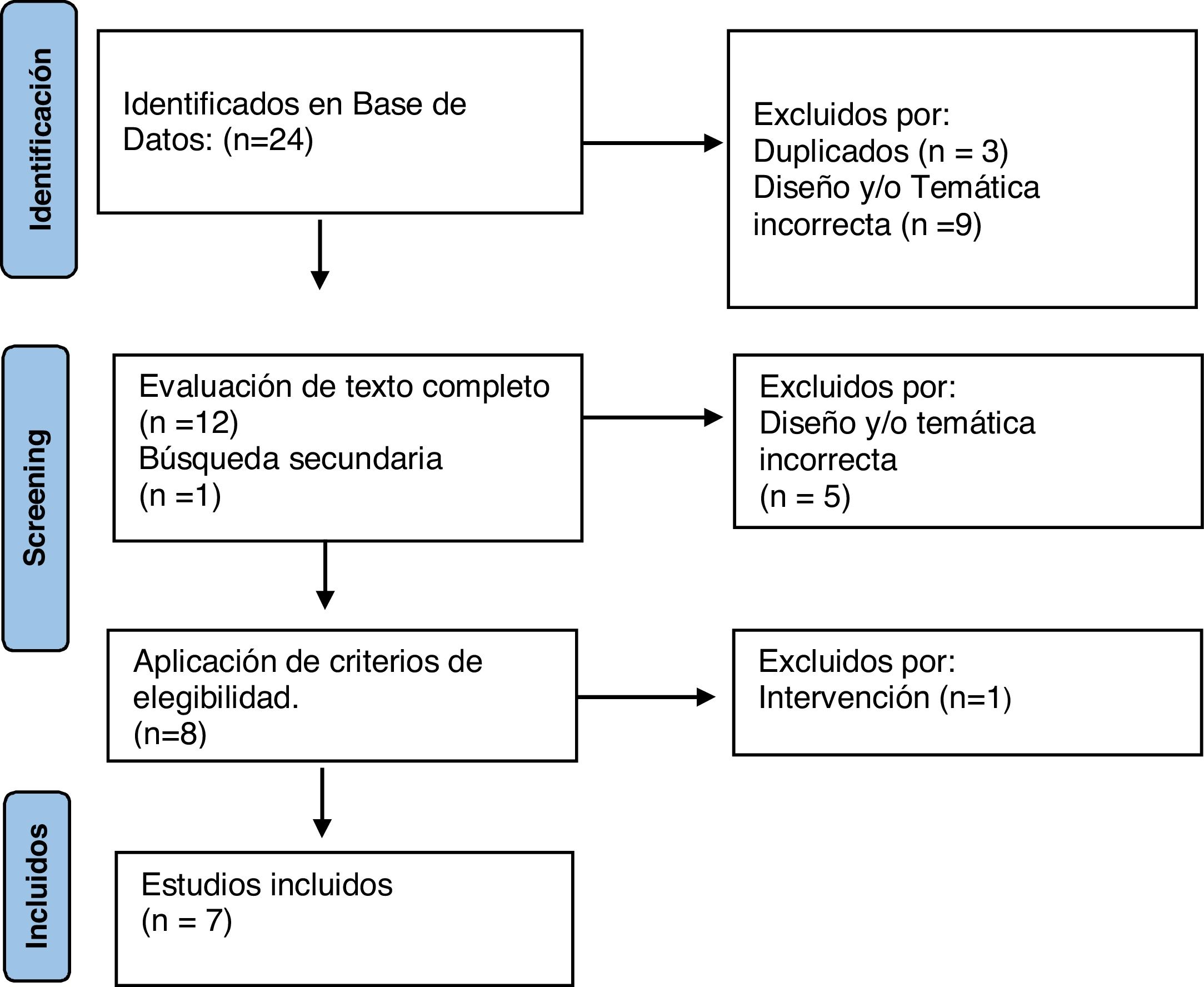
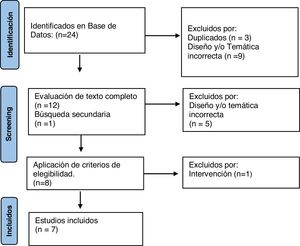
ResultadosDe los 24 artículos identificados en la búsqueda bibliográfica, se descartaron 12 y se sumó uno en búsqueda secundaria. A continuación, en la revisión del texto completo se descartaron 6 por su diseño, temática o intervención, quedando finalmente para el análisis 7 artículos, que incluyen un total de 138 pacientes (fig. 2).
Las principales características y hallazgos de los estudios se resumen en la tabla 1.
Resistencia insulínicaDempsey et al.18 demostraron que, a mayor grado de resistencia insulínica basal, mayor es el beneficio metabólico producido por el QCS comparado con una sesión de CS ininterrumpida. Por otra parte, el estudio de Duvivier et al.19 evidenció que la sesión «sentarse menos» (sit less), que corresponde al remplazo diario de 4,7h de CS por estar de pie y realizar caminatas livianas (acorde a la percepción del paciente), disminuyó significativamente (p=0,015) el HOMA2-IR al compararlo con la sesión de ejercicio (1,1h de CS reemplazada por pedaleo moderado a vigoroso) y con la sesión de CS (14h/día de CS; solo 4.415 pasos/día) (p=0,001). Por su parte, la sesión de ejercicio, a diferencia de la de «sentarse menos», no logró una disminución significativa del HOMA2-IR en comparación con la sesión CS (p=0,177).
iAUC de glucosaEl iAUC de glucosa se evaluó, entre 7 y 24h, en 6 de los 7 artículos. En 5 de las investigaciones18-22 las sesiones con QCS tuvieron como resultado una disminución significativa del iAUC de glucosa en comparación con la sesión control sedente ininterrumpida, independientemente del tipo de actividad física realizada. La única excepción fue el estudio de Homer et al.23, en donde los niveles de iAUC de glucosa no disminuyeron significativamente durante el protocolo de QCS (3min con ejercicio de fuerza) en comparación con el protocolo ininterrumpido sedente. También es interesante destacar el estudio de Dempsey et al.18, quienes concluyeron que el impacto de la sesión CS sobre el área total bajo la curva (tAUC) de glucosa, comparado con la sesión de QCS, fue mayor en 1,23mmol/h/l por cada 1mmol/l más de glucosa en ayunas (p<0,001).
GlucemiaGlucemia de ayunoEl estudio de Paing et al.24 demostró que la glucemia de ayuno fue significativamente (p=0,004) menor con sesiones de 3min de QCS por cada 15min de CS en el día anterior a la medición, en comparación con sesiones de 3min de QCS por cada 60min de CS en el día anterior a la medición. Similares resultados fueron obtenidos por Dempsey et al.20, con 3min de QCS por cada 30min de CS (p<0,001).
Tiempo en hiperglucemia- •
Posprandial. Tanto en los estudios de Dempsey et al.20,21 como en el de Homer et al.23, los QCS con sesiones de ejercicio aeróbico liviano (gasto energético menor a 3MET) o de fuerza (ejercicio con uso de la resistencia para lograr aumento en la masa y fuerza muscular), por 3min cada 30min, disminuyeron significativamente la glucosa posprandial. Adicionalmente, los resultados de Paing et al.22 demuestran una relación dosis-respuesta, con una mayor disminución de la glucemia posprandial (post desayuno) al aumentar la frecuencia de los QCS.
- •
22-24 horas. Las investigaciones de Dempsey et al.20 y de Duvivier et al.19 revelaron una disminución del tiempo en hiperglucemia en la sesión de QCS, en comparación con la sesión de CS. Es relevante destacar el protocolo de QCS sit less de Duvivier et al.19, con el cual se logró que el tiempo en hiperglucemia en 24h se redujese (p=0,002) casi a la mitad en comparación con la CS ininterrumpida.
Ninguno de los estudios que evaluaron la hipoglucemia reportó este efecto como consecuencia de los QCS19,20.
Coeficiente de variación, desviación estándar de glucosa, CONGA-1 y MAGEEn cuanto a los efectos observados frente a los QCS y los indicadores agudos de VG glucémica, es relevante destacar el estudio de Dempsey et al.18, en donde se analizó la DE de glucosa, CONGA-1 y MAGE, que disminuyeron significativamente con sesiones de 3min de QCS con ejercicio liviano aeróbico o bien con ejercicio de fuerza. En cuanto al indicador CV, se observan resultados contradictorios, puesto que en el estudio de Paing et al.24 se indica que el CV nocturno se redujo con sesiones de QCS de 3min cada 15min de CS en comparación a sesiones donde dichos QCS se realizaban cada 30min (p<0,03) o 60min (p<0,02) de CS; en tanto que en el trabajo de Dempsey et al.18 se informa que no hubo diferencias significativas en el CV porcentual entre los tres tipos de sesiones.
Fenómeno del albaEn el estudio de Paing et al.24 se informó que los QCS de 3min cada 30min de CS no disminuyen significativamente (p=0,370) la duración del FA, pero que los QCS de la misma duración con mayor frecuencia (cada 15min) sí lo hacen en comparación con los efectuados cada 60min (p=0,004) o cada 30min (p=0,041).
DiscusiónA pesar de que el número de estudios sobre el tema en cuestión es limitado, la información que entregan es comparable, consistente y sólida, ya que la población de personas evaluadas es homogénea, con rangos de edad similares, niveles de hemoglobina A1c entre 7,2 y 7,6% y, además, corresponde a sujetos sin tratamiento con insulina. Del mismo modo, de los 7 estudios analizados en esta revisión sistemática, 7 corresponden a RCT/ECC, los que permiten análisis robustos con tamaños muestrales pequeños. Y 5 de los 7 estudios analizados emplearon un sistema de monitorización continua de glucosa, el cual entrega información muy precisa sobre la VG aguda con los QCS.
La casi totalidad de las investigaciones consideradas en este trabajo utilizan múltiples (6 a 26; moda: 12) QCS breves (2 a 6min; moda: 3min) cada 15 a 60min (moda: 30min) de periodos sedentes. En estas se demuestra claramente que los QCS son una estrategia eficaz para mejorar los indicadores de control glucémico en personas con DM2. Incluso los tres estudios17,20,23 con menor tiempo acumulado de QCS (21 a 24min en total) revelan una mejora significativa en la mayoría de los indicadores de control glucémico que se evaluaron. Además, los estudios de Paing et al.22,24 muestran que en personas con DM2 podría existir una relación directa entre la frecuencia de QCS (caminata de intensidad ligera) y el control glucémico (diario y posprandial).
El único trabajo en donde el tiempo acumulado de QCS fue elevado es el de Duvivier et al.19, en el cual 4,7h diarias de posición sentada fueron reemplazadas por 2,5h de posición de pie más 2,2h de caminata ligera. Esta aproximación demostró ser aún más efectiva en la mejora significativa de parámetros de control glucémico en sujetos con DM2 que una sesión de ejercicio estructurado con igual gasto calórico total (1,1h de pedaleo moderado a intenso). Es así como los QCS de baja intensidad y prolongados disminuyen el iAUC de glucosa de 24h con respecto al control (solo CS) en forma similar al ejercicio estructurado de mediana-alta intensidad, pero son mucho más eficientes que este en la reducción de HOMA2-IR19.
Por otra parte, es relevante señalar que en ninguno de los estudios en los cuales se evaluó la posible ocurrencia de hipoglucemia como consecuencia de QCS en pacientes con DM2 fue posible observar dicho estado18,19, lo que resulta de gran importancia para la prescripción segura de este tipo de actividad para la patología en cuestión.
De acuerdo con lo anterior, la evidencia disponible en la actualidad muestra claramente que los QCS inciden positivamente en los distintos parámetros de control glucémico, lo que indica la eficacia de este tipo de actividad física para una mejor regulación de la glucemia. Esto avala la prescripción de los QCS como un pilar fundamental en el tratamiento de pacientes con DM2 y no solo como una indicación anexa o secundaria a las recomendaciones tradicionales de actividad física que son predominantes actualmente. Es por ello que el personal de salud debería enfatizar a los pacientes con DM2 que deben «sentarse menos y moverse más», promoviendo así un cambio conductual simple, pero de alto impacto en el control glucémico.
ConclusiónLos hallazgos de los estudios experimentales considerados en esta revisión sistemática proporcionan sólida evidencia de que los QCS consistentes en actividad física de intensidad ligera o cambio posicional, tales como caminar o ponerse de pie, son una estrategia valiosa en el control glucémico de la DM2. Aunque se requiere un mayor número de investigaciones para poder consensuar las recomendaciones específicas de QCS para una persona con DM2, esta estrategia podría ser el mejor punto de partida para aquellos pacientes que tienen una condición inactiva o bien son reacios a realizar ejercicio físico estructurado.
FinanciaciónSin fuentes de financiamiento que declarar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.