El objetivo es estudiar el índice triglicéridos/glucosa (TyG) como marcador de insulinorresistencia en niños y adolescentes obesos y su relación con otros parámetros clínicos, analíticos, composición corporal y hábitos de vida.
Pacientes y métodosFueron incluidos 60 pacientes obesos de 7 a 16 años. Se recogieron variables antropométricas, estadio puberal, tensión arterial y composición corporal por bioimpedanciometría. El índice TyG se definió como: ln (glucosa en ayunas [mg/dL]×triglicéridos [mg/dL])/2 y el índice HOMA (homeostatic model assessment): insulinemia (μU/mL)×glucemia (mmol/L)/22,5. Los hábitos de alimentación fueron recogidos a través de la encuesta de calidad de dieta mediterránea, mientras que los de actividad física lo fueron por el International Sedentary Assesment Tool (ISAT) así como acelerometría (Actigraph wGT3X+).
ResultadosLa media del índice TyG fue 4,45±0,18, mayor en puberales. Encontramos una correlación positiva con el índice HOMA (r=0,39; p=0,03) y el índice TG/c-HDL (r=0,53; p<0,001). El mejor valor como punto de corte del índice TyG para determinar insulinorresistencia fue de 4,21 en pacientes prepuberales (sensibilidad 84%, especificidad 100%; ABC: 0,84), y de 4,33 en puberales (sensibilidad 89%, especificidad 69%; ABC: 0,61). Se objetivó una correlación positiva con el tiempo de pantalla (r=0,39; p=0,01) así como una correlación negativa con el gasto calórico (kcal/día) en pacientes prepuberales (r=−0,81; p=0,005).
ConclusionesEl índice TyG podría utilizarse como marcador de insulinorresistencia en la población infantil. Se debe fomentar que la actividad deportiva sea de moderada a vigorosa intensidad, así como limitar el tiempo de pantalla dedicado al ocio, especialmente en población prepuberal.
To examine the triglyceride/glucose index (TyG) as an insulin resistance marker in obese children and adolescents and its relation to clinical and biochemical parameters, body composition and lifestyle.
Patients and methodSixty patients aged 7-16 years of age were enrolled. Anthropometric variables were recorded, together with pubertal stage, blood pressure and body composition assessed by bioimpedance. The TyG index was calculated as ln (fasting glucose (mg/dL)×triglycerides (mg/dL))/2 and the HOMA (homeostatic model assessment) index as fasting insulin (μU/mL)×fasting glucose (mmol/L)/22.5. Feeding habits were documented by adherence to the Mediterranean dietary pattern questionnaire, while physical activity was assessed using the International Sedentary Assessment Tool (ISAT), as well as accelerometry (Actigraph wGT3X+).
ResultsThe mean TyG index was 4.45±0.18, and proved higher in the pubertal group. We found a positive correlation with the HOMA index (r=0.39; P=.03) and TG/HDL-c index (r=0.53; P<.001). The best cut-off point of the TyG index for predicting insulin resistance was 4.21 in prepubertal children (sensitivity 84%, specificity 100%; AUC: 0.84) and 4.33 in pubertal children (sensitivity 89%, specificity 69%; AUC: 0.61). A positive correlation was found with screen time (r=0.39; P=.01), as well as a negative correlation with caloric expenditure (Kcal/day) in the prepubertal group (r=−0.81; P=.005).
ConclusionsThe TyG index could be a useful insulin resistance marker in the pediatric population. Moderate to vigorous physical activity should be encouraged, as well as restricting screen time for leisure purposes, mainly in the prepubertal group.
La prevalencia de obesidad infantil ha ido aumentando en las últimas décadas debido a los cambios en la alimentación y los hábitos de vida. En España se estima que un 23,2% de los niños presentan sobrepeso y un 18,1% obesidad1. Esta tendencia temporal se ha estabilizado e incluso disminuido en los últimos años, probablemente gracias a distintas políticas sociales así como a una detección y tratamiento más precoz por parte de los pediatras2. El desarrollo de las tecnologías de la información y la comunicación y su amplio uso en edades cada vez más tempranas contribuyen a que el sedentarismo y el tiempo de pantalla asociado al ocio constituyan hoy en día un punto clave en el manejo de la obesidad.
La población pediátrica ya presenta desde los primeros años de vida alteraciones metabólicas que predisponen a enfermedad cardiovascular en el futuro. La insulinorresistencia, característica central del síndrome metabólico, es una de ellas. A lo largo del tiempo se han empleado distintos marcadores clínicos y bioquímicos relacionados con la resistencia insulínica, muchos de los cuales requieren técnicas costosas y son poco reproducibles en la práctica diaria como el clamp hiperinsulinémico-euglucémico (considerado el gold standard), distintas citoquinas, etc. Sin embargo, es importante ampliar el conocimiento sobre marcadores que permitan a cualquier médico discriminar de manera sencilla y barata aquellos pacientes obesos con mayor riesgo metabólico con el objetivo de que reciban una atención especializada.
En los últimos años se han publicado varios estudios sobre el índice triglicéridos/colesterol-HDL (TG/c-HDL) en niños, con variabilidad en cuanto a la etnia y a la edad. En general, este marcador tiene una correlación positiva con el Homeostatic model assessment (HOMA) y la insulinemia basal por lo que podría ser un buen predictor de diabetes mellitus tipo 2 y síndrome metabólico3,4. En cuanto al índice triglicéridos/glucosa (TyG) los estudios realizados en adultos muestran correlaciones modestas con el HOMA aunque son buenas ante el clamp hiperinsulinémico-euglucémico5. Existen pocas publicaciones en referencia a este índice en población pediátrica, siendo difícil extrapolarlo a nuestro ámbito dada la heterogeneidad de estas: diferentes etnias, diferentes edades sin tener en cuenta la aparición o no de pubertad, etc.; y aunque parece un buen predictor de insulinorresistencia, faltan datos como para llegar a considerarlo como un buen marcador que nos discrimine los pacientes de mayor riesgo. Por ello, resulta necesario estudiar el índice TyG dentro de nuestra población y su asociación con otras variables, entre ellas las relacionadas con hábitos de vida.
Desde hace años se ha demostrado una relación entre el sedentarismo y/o la menor actividad física moderada-vigorosa y el aumento de adiposidad e insulinorresistencia. Para cuantificar estos hábitos, se utilizan de forma generalizada distintos cuestionarios que rellena la familia o el paciente sobre la actividad que realiza habitualmente. Sin embargo, estos test no son los más fiables y deberíamos contar de forma complementaria con un método objetivo como es la acelerometría.
Con todo ello, el objetivo de nuestro trabajo es estudiar el índice TyG como posible marcador de insulinorresistencia en una población de niños y adolescentes obesos y su relación con otros parámetros clínicos, analíticos, de composición corporal y hábitos de vida.
Pacientes y métodosParticiparon en el estudio 60 pacientes derivados a la consulta de Endocrinología Infantil en 2019 por obesidad con un rango de edad de 7-16 años. Fueron excluidos previamente aquellos con obesidad monogénica o sindrómica, patología crónica o tratamiento previo que pudiese interferir en los parámetros de estudio y obligatoriedad de permanecer en reposo por causa médica.
Se determinó el estadio puberal según estadios de Tanner (I-V). La medición de peso se realizó con aparato Secca (precisión de 100g) y la talla con estadiómetro Secca (precisión de 1mm). El índice de masa corporal (kg/m2) (IMC) se calculó por la fórmula peso/talla2. Se consideró obesidad un IMC por encima de 2 desviaciones estándar (DE) según las gráficas de referencia para edad y sexo de Hernández et al.6. El perímetro abdominal se midió con cinta métrica inextensible de 1mm de precisión con el paciente en bipedestación, al final de una espiración normal, con los brazos relajados a cada lado, en el punto medio entre la última costilla y la cresta iliaca. La valoración de la composición corporal se determinó mediante bioimpedanciometría con un aparato Tanita TBF300 (TANITA, Middlesex, Reino Unido) en ayunas, sin actividad física en las horas previas y en ropa interior. La tensión arterial sistólica y la diastólica se determinaron mediante aparato Dynamap XL haciendo la media de 3 tomas y se utilizaron como valores de referencia los publicados en Pediatrics 2004 por el grupo de trabajo NHBPEP (National High Blood Pressure Education Program)7.
Los hábitos de alimentación se valoraron a través del cuestionario KIDMED basado en el cumplimiento de los patrones de dieta mediterránea con respuestas de verdadero/falso y cuya puntuación oscila entre 0-12 (a mayor puntuación mejor calidad de la dieta). La actividad física y el comportamiento sedentario tanto en día laborable como en fin de semana se obtuvo de 2 formas: la primera, mediante cuestionarios como el International Sedentary Assesment Tool (ISAT) y la segunda, por un método objetivo como es la acelerometría triaxial realizada con el aparato Actigraph modelo wGT3X+ (49, E.Chase St, Pensacola FL 32502, EE. UU.) que llevaron consigo en la muñeca durante 6 días, siendo 2 de ellos festivos. Este acelerómetro proporciona medidas de actividad física incluyendo: aceleración prima, gasto energético, ratios de tasa metabólica en reposo (MET) e intensidad de la actividad física. Los METS miden el gasto metabólico de una actividad (<1,5METS: sedentaria; 1,5-3METS: ligera; 3-6METS: moderada; >6: vigorosa-muy vigorosa).
Las determinaciones analíticas se realizaron en su totalidad en el laboratorio de nuestro hospital, en ayunas de al menos 12h, entre las 08.00 y 09.00 de la mañana. La insulina se realizó mediante inmunoanálisis de electroquimioluminiscencia en un autoanalizador Cobas 601 (Roche) y la glucosa con un método de glucosa oxidasa en un autoanalizador modular 6000 (Roche) junto con el resto de parámetros de bioquímica general. La sobrecarga oral de glucosa se realizó con una dosis de 1,75g/kg peso (máximo 75g). El índice HOMA se definió como insulinemia (μU/mL)×glucemia (mmol/L)/22,5. El quantitative insulin sensitivity check index (índice QUICKI) como 1/(log insulina ayunas [μU/mL]+log glucosa en ayunas [mg/dL]). El índice TG/c-HDL se determinó con la relación triglicéridos (mg/dL)/c-HDL (mg/dL). El índice TyG se calculó a partir de la fórmula: ln [glucosa en ayunas (mg/dL)×triglicéridos (mg/dL)]/2. Las DE de la insulina, índice HOMA y QUICKI se calcularon a partir de los valores de referencia de nuestra población8. Se consideró como insulinorresistencia un índice HOMA≥2DE según sexo y estadio puberal.
Análisis estadísticoLas variables cualitativas de frecuencia se expresaron como porcentajes y las cuantitativas como media±DE. La comparación de estas se realizó con el test estadístico correspondiente (chi cuadrado, T de student, ANOVA) así como el estudio de correlaciones mediante la prueba Rho de Spearman. La sensibilidad y especificidad del punto de corte del índice TyG para el diagnóstico de insulinorresistencia se estableció mediante curvas ROC teniendo en cuenta el área bajo la curva (ABC) para determinar la exactitud del test. El análisis de los datos se realizó con el programa estadístico SPSS21.0. Se consideró un valor de p<0,05 como estadísticamente significativo.
Consentimiento y confidencialidadTras la aprobación por el Comité de Ética de nuestro hospital se solicitó consentimiento informado de los padres o tutores antes de iniciar el estudio, y en el caso de tratarse de un menor maduro también fue firmado por este. El estudio fue realizado con el compromiso de respetar la declaración de Helsinki actualizada sobre los principios éticos para las investigaciones médicas. Los datos personales se manejaron de forma anónima siempre de acuerdo a los principios de protección de datos recogidos en la nueva legislación del reglamento europeo de protección de datos del 25 de mayo de 2018.
ResultadosParticiparon en el estudio un total de 60 pacientes (el 51,7% mujeres y el 48,3% varones) con una edad media de 12,1 años (±2,14) en un rango desde los 7,4 a 15,7 años. El 26,7% de estos eran prepuberales (Tanner I). La media del IMC fue 28,58kg/m2 (±3,37) mientras que el z-score fue de+3,88DE (±1,27) (rango: 2,02-7,07DE), sin diferencias estadísticamente significativas en relación con el sexo. Valorando estos datos teniendo en cuenta la presencia o no de pubertad se encontró un mayor grado de obesidad en los pacientes prepuberales (+4,61DE±1,65) versus los puberales (+3,61DE±0,99) (p=0,006).
La media del perímetro abdominal fue 94,16cm (±10,56), siendo en el 100% de los casos superior al p95 para edad y género y sin diferencias entre sexos. En cuanto a la composición corporal, encontramos mayor masa magra en varones (46,9kg±11) que en mujeres (40,5kg±8,7) (p=0,01) y en los niños puberales (47,0kg±9,5) que en los prepuberales (33,8kg±4,4) (p<0,001).
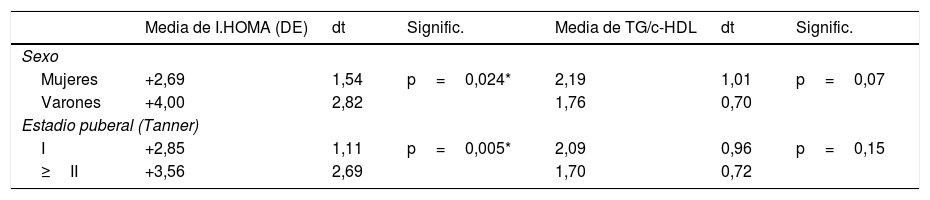
Respecto a los hallazgos analíticos, no se encontraron diferencias estadísticamente significativas en relación con el sexo. Los niños prepuberales presentaban niveles inferiores de insulina, índice HOMA e índice QUICKI en valores absolutos. El índice TG/c-HDL resultó de 1,99±0,91 sin diferencias significativas en relación con el sexo ni el estadio puberal. Los resultados quedan reflejados en la tabla 1. Se compararon asimismo distintos parámetros clínico-analíticos en función de si los pacientes presentaban o no insulinorresistencia (I.HOMA≥2DE) (tabla 2).
Desviaciones estándar del índice HOMA e índice TG/c-HDL según sexo y estadio puberal
| Media de I.HOMA (DE) | dt | Signific. | Media de TG/c-HDL | dt | Signific. | |
|---|---|---|---|---|---|---|
| Sexo | ||||||
| Mujeres | +2,69 | 1,54 | p=0,024* | 2,19 | 1,01 | p=0,07 |
| Varones | +4,00 | 2,82 | 1,76 | 0,70 | ||
| Estadio puberal (Tanner) | ||||||
| I | +2,85 | 1,11 | p=0,005* | 2,09 | 0,96 | p=0,15 |
| ≥II | +3,56 | 2,69 | 1,70 | 0,72 | ||
DE: desviaciones estándar; dt: desviación típica.
Parámetros antropométricos y analíticos en función de la presencia o no de insulinorresistencia (I.HOMA≥2DE)
| I.HOMA<2DE(media±dt)(N=18) | I.HOMA≥2DE (media±dt)(N=42) | Significación | |
|---|---|---|---|
| Edad (años) | 12,4±2,3 | 11,9±2,2 | p=0,38 |
| IMC-DE | 3,59±1,3 | 4,01±1,2 | p=0,28 |
| Perímetro abdominal (cm) | 90,61±9,2 | 96,8±10,4 | p=0,13 |
| Masa grasa (%) | 35,83±4,6 | 36,39±5,6 | p=0,73 |
| Masa grasa (kg) | 27,56±9,7 | 25,95±8 | p=0,54 |
| Masa muscular (kg) | 44,4±10,1 | 43,58±11,1 | p=0,79 |
| Glucosa basal (mg/dl) | 87±6 | 92,4±8 | p=0,01* |
| Insulina basal (mcu/ml) | 16,9±4,9 | 25,3±9,5 | p=0,02* |
| Índice HOMA | 3,43±1,1 | 5,73±2,3 | p<0,001* |
| Índice QUICKI | 0,53±0,4 | 0,48±04 | p=0,04* |
| Glucosa (mg/dl) tras SOG | 102,7±20,6 | 107±19,5 | p=0,72 |
| Colesterol total (mg/dl) | 151±28,9 | 147,9±24,4 | p=0,69 |
| Colesterol-LDL (mg/dl) | 91,3±28,5 | 82,7±20,5 | p=0,22 |
| Colesterol-HDL (mg/dl) | 49±8,8 | 46,5±7,9 | p=0,33 |
| Triglicéridos (mg/dl) | 78,8±23,1 | 93,1±31,3 | p=0,11 |
| Índice TG/HDL | 1,67±0,7 | 2±0,8 | p=0,12 |
| Índice TyG | 4,39±0,1 | 4,47±0,1 | p=0,04 |
Un 5% de los pacientes (3 casos) fue diagnosticado de síndrome metabólico según los criterios de la International Diabetes Federation (IDF) aunque un 33,3% del global presentaba al menos una de las alteraciones metabólicas/cardiovasculares: se objetivó una glucemia en ayunas≥100mg/dL en el 13,3%; triglicéridos≥150mg/dL en el 5,4%; HDL≤40mg/dL en el 13,3% y tensión arterial sistólica≥130mmHg en el 6,6% de los casos. Ningún paciente presentó una tensión arterial diastólica≥85mmHg ni alteración de la tolerancia a la glucosa o diabetes tras el test de sobrecarga oral.
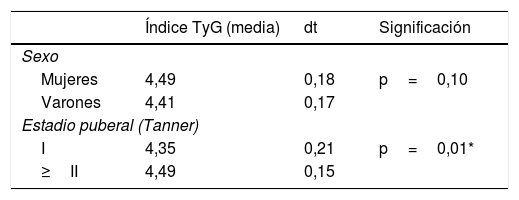
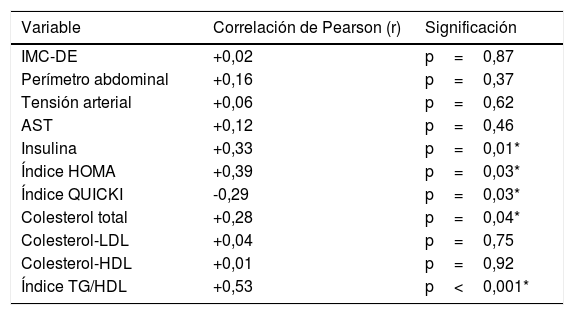
Índice TyG como marcador de insulinorresistenciaLa media del índice TyG fue de 4,45±0,18 (rango: 3,94-4,80) sin encontrar diferencias en relación con el sexo pero sí según la pubertad (tabla 3). Al comparar el índice TyG con otros parámetros analíticos se objetivó una correlación positiva con los niveles de insulina, índice HOMA, colesterol total y con el índice TG/c-HDL e inversa con el índice QUICKI de forma significativa (tabla 4).
Media del índice TyG según sexo y estadio puberal
| Índice TyG (media) | dt | Significación | |
|---|---|---|---|
| Sexo | |||
| Mujeres | 4,49 | 0,18 | p=0,10 |
| Varones | 4,41 | 0,17 | |
| Estadio puberal (Tanner) | |||
| I | 4,35 | 0,21 | p=0,01* |
| ≥II | 4,49 | 0,15 | |
dt: desviación típica.
Correlación entre el índice TyG y otros parámetros clínico-analíticos
| Variable | Correlación de Pearson (r) | Significación |
|---|---|---|
| IMC-DE | +0,02 | p=0,87 |
| Perímetro abdominal | +0,16 | p=0,37 |
| Tensión arterial | +0,06 | p=0,62 |
| AST | +0,12 | p=0,46 |
| Insulina | +0,33 | p=0,01* |
| Índice HOMA | +0,39 | p=0,03* |
| Índice QUICKI | -0,29 | p=0,03* |
| Colesterol total | +0,28 | p=0,04* |
| Colesterol-LDL | +0,04 | p=0,75 |
| Colesterol-HDL | +0,01 | p=0,92 |
| Índice TG/HDL | +0,53 | p<0,001* |
Al analizar las curvas ROC en pacientes prepuberales, se estimó que un índice TyG de 4,21 sería el mejor punto de corte para determinar insulinorresistencia (sensibilidad 84%, especificidad 100%; ABC: 0,84), mientras que en pacientes puberales sería de 4,33 (sensibilidad 89%, especificidad 69%; ABC: 0,61). Teniendo en cuenta estos resultados en nuestra población, un 74% de los niños prepuberales y un 82% de los puberales tendrían resistencia insulínica. Por otro lado, considerando la segunda fórmula utilizada en otras publicaciones ln (glucosa en ayunas [mg/dL]×triglicéridos [mg/dL]/2) obtendríamos un punto de corte de 7,86 para prepuberales (sensibilidad 92%, especificidad 100%; ABC: 0,96) y 8,19 en puberales (sensibilidad 72%, especificidad 54%; ABC: 0,70).
Índice TyG en relación con los hábitos de vida y actividad físicaSe objetivó de forma global una correlación positiva entre el índice TyG y el tiempo de pantalla (tablets, móvil, videojuegos, etc., excluyendo televisión) reportado en los cuestionarios recogidos en los días laborables (r=0,39; p=0,01), de forma que se halló diferencias significativas entre los que dedicaban≥1,5h/día (TyG 4,53±0,8) versus los que lo hacían˂1,5h/día (TyG 4,42±0,1) (p=0,03). Se observó también una correlación positiva entre el índice TyG y las horas dedicadas a los deberes/leer libros en casa los días laborables en pacientes prepuberales (r=0,67; p=0,02). No se halló relación con la puntuación del KIDMED ni según los días de actividad física escolar ni extraescolar.
En cuanto a los datos aportados por la acelerometría, encontramos buena correlación negativa del índice TyG con el gasto calórico (kcal/día) en pacientes prepuberales (r=−0,81; p=0,005). Dicho índice fue superior en aquellos niños con una media de actividad los días laborales˂3METS/día (TyG: 4,56±0,15) versus los que realizaban de media≥3METS/día (TyG: 4,21±0,16), aunque estas diferencias no fueron estadísticamente significativas (p=0,07). Por otro lado, en este mismo grupo de pacientes se halló una correlación positiva con el porcentaje de actividad sedentaria (r=0,61; p=0,04). Los hallazgos en pacientes puberales no fueron significativos a excepción de una correlación negativa entre el índice TyG y la actividad sedentaria (r=−0,52; p=0,006) así como con la actividad ligera durante los fines de semana (r=−0,43; p=0,01).
DiscusiónLos hallazgos de nuestro estudio muestran la utilidad del índice TyG como marcador de insulinorresistencia en niños y adolescentes obesos, objetivando además relación con otros factores de riesgo metabólico, incluyendo los hábitos de alimentación y actividad física.
El grupo de Simental-Mendía et al. fue el primero que propuso este índice TyG como parámetro útil para medir la insulinorresistencia tras los resultados que obtuvieron en pacientes adultos con normopeso y obesos al compararlo con el clamp hiperinsulinemia-euglucemia, considerada como prueba gold standard para dicho fin5,9. Son múltiples los estudios posteriores que analizan en población adulta esto mismo, pero comparando el índice TyG con otros parámetros de resistencia insulínica; el más ampliamente utilizado es el índice HOMA. Este mismo año 2020 se ha publicado una revisión sistemática en pacientes adultos, cuya conclusión es que existe de moderada a baja calidad de la evidencia para confirmar la utilidad de dicho índice como marcador bioquímico debido, principalmente, a la falta de una definición estandarizada y la gran heterogeneidad entre los diferentes trabajos10. El problema fundamental radica en la interpretación de la fórmula para obtener el índice TyG: mientras que en las publicaciones de los autores que propusieron el método utilizan la fórmula ln (glucosa en ayunas [mg/dL]×triglicéridos [mg/dL]/2), otros autores que analizaron este índice posteriormente lo obtienen a partir del ln (glucosa en ayunas [mg/dL]×triglicéridos [mg/dL]/2), resultando valores dispares. En nuestro trabajo hemos realizado el análisis manteniendo la fórmula del grupo original aunque también hemos obtenido los puntos de corte con la segunda fórmula propuesta para poder compararlo con otras publicaciones.
En los últimos años ha crecido el interés por estudiar el índice TyG en población pediátrica. Existen 2 estudios que lo comparan con el clamp hiperinsulinemia-euglucemia: el primero de ellos en pacientes mexicanos sanos y obesos, tanto prepuberales como puberales (con puntos de corte de TyG: 4,65 y 4,70 respectivamente), el segundo solo en niños obesos puberales de distintas etnias (TyG: 8,3). Ambos establecen una correlación moderada entre ambas pruebas11,12.
Al igual que en otros estudios, nosotros comparamos el índice TyG con otros parámetros de insulinorresistencia como son la insulinemia basal y el índice HOMA, siendo este último el más referenciado en la literatura. Obtuvimos una correlación positiva moderada, similar a lo publicado en trabajos previos, con coeficientes de correlación de entre 0,38-0,4613–16. No encontramos diferencias en el índice TyG en cuanto al sexo, pero sí en función de la aparición o no de pubertad; aquellos pacientes con desarrollo puberal presentaban un índice TyG mayor que los prepuberales. Esto coincide con el mayor grado de insulinorresistencia (mayor DE-HOMA) objetivado en los primeros. No hay estudios que tengan en cuenta este aspecto a excepción del grupo de Rodríguez-Morán et al. que dan diferentes puntos de corte para el índice TyG según la pubertad11, pero consideramos que es un factor importante dado que los niveles de triglicéridos no son los mismos en ambos grupos. Otro factor a tener en cuenta es la etnia: se han demostrado cifras inferiores del índice TyG en individuos de raza negra frente a los de raza blanca y asiática, posiblemente debido a que los primeros presentan de forma fisiológica niveles inferiores de triglicéridos respecto al resto de etnias12,17. Todo esto, independientemente del IMC con el que no se ha encontrado buena correlación. De hecho, hay que resaltar que a pesar del mayor grado de obesidad según el IMC-DE de nuestros pacientes prepuberales encontramos una mayor resistencia insulínica respecto a los valores de referencia en los puberales. Resulta difícil comparar los puntos de corte obtenidos con las curvas ROC entre estudios, debido entre otras cosas, al problema de la fórmula comentado anteriormente. En nuestro caso, parece ser un test más válido para pacientes prepuberales que puberales y nuestros valores de corte son inferiores a los presentados por Rodríguez-Morán et al., trabajo realizado en población mexicana, pero similares a los del grupo Italiano de Calcaterra et al.11,15.
La resistencia a la insulina es una de las primeras complicaciones metabólicas que se produce en la población infantil obesa. De hecho, en nuestro estudio, la mayoría de los pacientes la presentan, en un porcentaje bastante superior a otras alteraciones como la dislipidemia o la tensión arterial elevada. Puede ser debido a la relación entre la obesidad abdominal, presente en todos nuestros pacientes, y la disminución de la sensibilidad a la insulina. Esto es importante ya que con el índice TyG podríamos detectar esas primeras alteraciones en los niños y adolescentes obesos, incluso desde atención primaria, lo que quizás evitaría la progresión a un síndrome metabólico implementando una intervención especializada precoz. Hay varios estudios que han demostrado la utilidad del índice TyG como marcador de dicho síndrome, tanto en población adulta como infantil18–20. Del mismo modo, se ha valorado como posible marcador para las alteraciones del metabolismo de la glucosa en niños, siendo un buen test para el cribado de diabetes pero con resultados más dudosos para estados de prediabetes21,22. En nuestro caso, la escasa muestra de pacientes con estas patologías no nos permite el análisis. Es difícil explicar por qué encontramos solo un 5% de síndrome metabólico en nuestra muestra comparando con los resultados de otras poblaciones similares donde los porcentajes varían ampliamente pero puede que la clave esté no en la gravedad del IMC, sino en la adiposidad. Con relación a las cifras de tensión arterial no hemos encontrado correlación con este índice, siendo un aspecto poco estudiado en la actualidad en niños y adolescentes y con resultados variables23,24. Por otro lado, hemos demostrado que el índice TyG presenta correlación positiva con otro índice utilizado también como marcador de insulinorresistencia, síndrome metabólico y riesgo cardiovascular, como es el índice TG/c-HDL3,25.
Otro de los objetivos de nuestro trabajo fue valorar la posible relación que tienen los hábitos de alimentación, actividad física y sedentarismo con el índice TyG. De forma rutinaria, estas variables se recogen mediante encuestas pero dado que está demostrada la diferencia entre lo que los pacientes estiman y la realidad26, los métodos deberían ser lo más objetivos posibles y para ello, además de encuestas validadas, se ha recogido la actividad física mediante un acelerómetro triaxial que llevaron puesto tanto en días laborables como en fin de semana.
Con relación a la calidad de la dieta mediterránea, no se han encontrado diferencias al analizar el índice TyG según la puntuación obtenida. Un sistema más óptimo para corroborar si existe relación o no con la dieta sería pesar los alimentos de forma diaria, aunque consideramos que resultaría de difícil cumplimiento por parte de las familias. Respecto a la actividad física, aquellos niños y adolescentes con una tasa metabólica media diaria superior a 3METS, valor a partir del cual se considera actividad moderada, presentaban un menor grado de resistencia insulínica que aquellos con valores por debajo de 3METS, lo que apoya la importancia del ejercicio físico moderado-intenso de forma habitual en la población pediátrica con el objetivo, entre otras cosas, de prevenir las complicaciones metabólicas de la obesidad. Esta intensidad de la actividad física la consiguen normalmente a partir de ejercicios supervisados más que con los juegos en el parque, paseos, etc., por lo que es importante incidir no solo en el papel de los centros educativos, sino también en la responsabilidad de las familias para fomentar dichas actividades. Cuando comparamos el índice HOMA o el índice TyG con el número de días a la semana que realizan actividad física mediante cuestionarios no encontramos diferencias significativas. Por tanto, es importante incidir en la intensidad del ejercicio realizado, quizás aún más que en el número de días que dedican a actividades deportivas. Esto va en consonancia con la revisión sistemática de Ekelund et al. quienes concluyen que tiene mayor influencia en los factores de riesgo metabólico el tiempo de actividad física moderada-vigorosa que el tiempo de sedentarismo27.
Por otro lado, también hemos comprobado que en los niños prepuberales existe una correlación negativa entre el índice TyG y el gasto calórico (kcal/día) y positiva con el porcentaje de actividad sedentaria. Estos mismos hallazgos no han resultado en pacientes puberales, quizás porque, sobre todo los fines de semana, tienen una actividad más variable. De hecho, en este grupo hemos encontrado una correlación negativa moderada del índice TyG con la actividad sedentaria los fines de semana (a mayor sedentarismo, menor índice TyG), lo que resulta algo contradictorio. Una posible explicación para este hecho podría ser que esos pacientes que tienen mayores complicaciones metabólicas, al ser de mayor edad y conscientes de que están siendo monitorizados, pueden cambiar su actividad habitual durante la semana que llevan el acelerómetro. De cualquier forma, parece existir una mejor correlación entre los marcadores de insulinorresistencia y actividad física en pacientes prepuberales que en puberales. El único estudio que compara el índice TyG con los hábitos de vida es el del grupo de Vieira-Ribeiro et al., realizado en 402 niños brasileños de 4 a 7 años donde encuentran mayor índice TyG de forma significativa cuanto menor es la actividad física, medida por encuestas y mayor es la adiposidad28.
Respecto al sedentarismo calculado por acelerometría como factor de riesgo independiente en la resistencia insulínica, la literatura presenta resultados poco concluyentes tanto en población adulta como infantil y se precisan más estudios prospectivos para definir esta asociación29. En nuestro trabajo sí hemos encontrado una correlación positiva en pacientes prepuberales entre el índice TyG y el tiempo de actividad sedentaria y, más concretamente, con las horas de pantalla dedicadas al ocio (tablets, móvil…) por lo que es importante el control por parte de las familias del tiempo que dedican los menores a las nuevas tecnologías.
Entre las limitaciones de nuestro estudio cabe destacar, por un lado, el moderado número de pacientes analizados, y por otro, la dificultad de extrapolar los resultados a la población infantil de otros países, debido a la influencia que tiene la etnia en las variables metabólicas, ya que tanto el IMC como los parámetros de insulinorresistencia se han calculado sobre nuestra población de referencia. Además de esto, los hábitos de vida recogidos puede que sean más óptimos que los reales; los datos obtenidos a través de encuestas siguen siendo un método subjetivo, y los recogidos por acelerometría pueden estar sesgados por el efecto Hawthorne, al ser los pacientes conscientes de que están siendo monitorizados.
Como conclusión, el índice TyG podría utilizarse como marcador de insulinorresistencia en la población infantil, lo que permitiría a los pediatras seleccionar, entre todos los niños y adolescentes obesos, aquellos con mayor riesgo de complicaciones metabólicas e iniciar un seguimiento más intensivo y especializado. Se debe fomentar entre las familias hábitos de vida saludables e incidir especialmente en que la actividad deportiva sea de moderada a vigorosa intensidad así como limitar el tiempo de pantalla dedicado al ocio, especialmente en población prepuberal.
FinanciaciónEl presente trabajo ha sido financiado parcialmente a través de la beca otorgada en la X Convocatoria Proyectos de Investigación Santander – Fundación Universidad Alfonso X El Sabio. España. Proyecto 1010938.01.
Conflicto de interesesLas autoras declaran no tener conflicto de intereses.