El papel de las variantes genéticas del gen CB2R en la pérdida de peso después de una intervención dietética se ha investigado en pocos estudios, y hasta la fecha en ninguno tras cirugía bariátrica.
ObjetivosEl objetivo del presente estudio fue evaluar el efecto de la variante genética (rs3123554) del gen CB2R sobre los factores de riesgo cardiovascular y la pérdida de peso secundaria a una derivación biliopancreática.
DiseñoSe evaluó una muestra de 147 pacientes con obesidad mórbida. Los parámetros bioquímicos y antropométricos se estudiaron en la visita basal y en cada visita durante 3 años (1, 2 y 3 años).
ResultadosEl porcentaje de pérdida de peso en exceso, índice de masa corporal, peso, circunferencia de cintura, masa grasa, presión sanguínea, glucosa en ayunas, colesterol LDL, colesterol total, insulina, HOMA-IR y niveles de triglicéridos mejoraron en ambos genotipos tras la cirugía bariátrica. La disminución de los niveles de insulina en ayunas y HOMA-IR fue mayor en los portadores de alelos no A que en los portadores de alelos A.
ConclusionesNuestros datos sugieren que los pacientes con obesidad mórbida sometidos a una derivación biliopancreática y que son portadores del alelo A de la variante rs3123554 del gen CB2R presentan más peso. Este alelo no influye en la pérdida de peso tras la cirugía, pero sí en una menor disminución de los niveles de insulina y resistencia a la insulina.
The role of genetic variants of the CB2R gene in weight loss after a dietary intervention has been investigated in few studies, none of which has been conducted after bariatric surgery.
ObjectivesThe aim of this study was to assess the effect of the genetic variant (rs3123554) of the CB2R gene on cardiovascular risk factors and weight loss secondary to a biliopancreatic diversion.
DesignThe study simple consisted of 147 patients with morbid obesity. Biochemical and anthropometric parameters were measured at baseline and at each visit during 3 years (1, 2, and 3 years).
ResultsPercent excess weight loss, body mass index, weight, waist circumference, fat mass, blood pressure, fasting glucose, LDL cholesterol, total cholesterol, insulin, HOMA-IR, and triglyceride levels improved in both genotype groups. Decreases in fasting insulin levels and HOMA-IR were higher in non-A allele carriers as compared to A allele carriers.
ConclusionsOur data suggest that patients with morbid obesity who undergo bariatric surgery and carry the A allele of variant rs3123554 of the CB2R gene have greater weight. This allele has no influence on weight loss after surgery, but results in a lower decrease in insulin levels and insulin resistance.
En nuestro medio la prevalencia de la obesidad y sus comorbilidades está aumentando y representa un importante problema de salud pública1. Este aumento en la prevalencia de la obesidad y sus enfermedades relacionadas se debe a factores ambientales y genéticos2. Los factores ambientales se relacionan con la ingesta excesiva de calorías y la disminución de la actividad física. En relación con los factores genéticos, los polimorfismos de un solo nucleótido (SNP) se han asociado ampliamente con la obesidad. Algunos ejemplos en la literatura de SNP relacionados con la obesidad son los relacionados con receptores de cannabinoides, gen relacionado con la grasa en obesos, factor neutrófico derivado de cerebro, receptor subtipo 4 de la melanocortina3, etc.
En este escenario de influencia, tanto de factores ambientales como genéticos, el papel del sistema endocannabinoide y sus receptores está siendo evaluado como una vía importante en relación con la obesidad y la respuesta a las terapias utilizadas. Los receptores cannabinoides se agrupan en 2 familias, CB1R y CB2R. Estos receptores pertenecen a la familia de receptores acoplados a proteína G y se unen a ligandos exógenos derivados de Cannabis sativa y endocannabinoides endógenos. El CB1R se localiza principalmente a nivel central en el tejido cerebral, y su función en el comportamiento alimentario está bien establecida4. Sin embargo, el receptor CB2R se expresa fundamentalmente en tejidos periféricos, como por ejemplo las células del sistema inmunitario, y regulan la respuesta inflamatoria en diversos entornos5. Se han descrito con frecuencia en la literatura polimorfismos de un solo nucleótido en esta vía metabólica, de ese modo el SNP rs1049353 del gen CB1R que produce una sustitución de G por A en la posición de nucleótido 1359, se ha relacionado con alteraciones metabólicas en población caucásica6. Se ha descrito también un SNP del gen CB2R (rs3123554), de este modo Ketterer et al.7 han demostrado que los portadores del alelo menor (A) de este SNP mostraban un menor peso corporal acompañado de una menor disminución en la pérdida de este peso durante la intervención dietética. Además de la cohorte de Ketterer et al.7 existen otros 2 trabajos de intervención nutricional que evalúan el efecto de esta variante del gen CB2R en la pérdida de peso después de dietas hipocalóricas8–9. En el primer trabajo8, los pacientes obesos que no eran portadores del alelo A presentaron una mayor disminución de peso corporal, masa grasa, resistencia a la insulina y perfil lipídico que los portadores del alelo A, tras una intervención dietética que consistió en una restricción calórica leve durante 3 meses con un patrón mediterráneo. En un trabajo más reciente9 se evaluó el efecto de 2 dietas hipocalóricas diferentes (moderada restricción en hidratos de carbono vs. aporte normal en hidratos de carbono), los portadores del alelo A perdieron menos peso durante la intervención dietética con las 2 dietas hipocalóricas. Por otra parte, la mejoría de los parámetros inflamatorios y del metabolismo de la glucosa fue menor en los portadores del alelo A. Hasta la fecha en la literatura no existe un trabajo que haya evaluado el efecto de esta variante genética del gen CB2R sobre la pérdida de peso y las modificaciones metabólicas secundarias a una intervención con cirugía bariátrica en pacientes con obesidad mórbida.
El objetivo del presente estudio fue evaluar el efecto de la variante genética (rs3123554) del gen CB2R sobre los factores de riesgo cardiovascular y la pérdida de peso secundaria a una derivación biliopancreática (DBP).
Materiales y métodosSujetos y procedimiento quirúrgicoEn este trabajo se reclutaron un total de 147 pacientes obesos sin diabetes mellitus caucásicos (109 mujeres y 38 varones) con índice de masa corporal (IMC)>35kg/m2 con comorbilidades asociadas o IMC>40kg/m2. Los criterios de exclusión fueron: enfermedades hepáticas o renales graves, diabetes mellitus, tumores malignos, coagulopatía, enfermedades del tracto gastrointestinal y adicción a las drogas. Los criterios de inclusión fueron: IMC>40kg/m2 o IMC>35kg/m2 con comorbilidades asociadas excepto diabetes mellitus y un historial de pérdida de peso fallida con dietas hipocalóricas antes de la cirugía. Estos pacientes se sometieron a una DBP con un diseño de estudio observacional prospectivo no aleatorizado (tabla 1). La técnica quirúrgica consistió en un asa alimentaria de 175cm y un asa final común de 70cm, con una gastrectomía parcial con cierre del muñón duodenal. Se realizó un corte transversal del intestino delgado al nivel medio del ángulo de Treitz a la válvula ileocecal, seguido de una gastroenterostomía en Y de Roux en el asa intestinal distal y una enteroileostomía de extremo a lateral del asa intestinal proximal en el íleon 50-75cm antes de la válvula ileocecal.
Parámetros antropométricos y bioquímicos de los pacientes evaluados
| Basal | 1 año | 2 años | 3 años | |
|---|---|---|---|---|
| n=147 | n=145 | n=141 | n=139 | |
| Obeso mórbido | 101 | 62 | 43 | 10 |
| Superobeso | 28 | 11 | 3 | 0 |
| Género (masculino/femenino) | 38/109 | 37/108 | 37/104 | 36/103 |
| Edad (años) | 47,0+8,2 | - | - | - |
| IMC (kg/m2) | 47,3+5,2 | 37,0+4,1 | 34,4+3,0 | 33,4+3,8 |
De los 147 pacientes iniciales, 8 son no mórbidos con comorbilidades. Mórbido: IMC>40kg/m2 y <50kg/m2; superobeso>50kg/m2.
Todos los procedimientos realizados en este estudio se realizaron de conformidad con la Declaración de Helsinki y fueron aprobados por el comité ético local (HCUVA-Comité-3/2016). Se obtuvo el consentimiento informado por escrito de todos los pacientes.
Parámetros clínicos y bioquímicosEn este trabajo se registraron todas las variables antes de la cirugía y tras la cirugía en los siguientes tiempos: uno, 2 y 3 años Se registraron los siguientes parámetros: edad, peso, altura, IMC, circunferencia de la cintura (CC), masa grasa por impedancia, porcentaje de pérdida de exceso de peso (% PPEP), presión arterial sistólica y diastólica, niveles séricos de lípidos (colesterol total, LDL-colesterol, HDL-colesterol y triglicéridos), glucosa en ayunas, insulina, resistencia a la insulina mediante HOMA-IR y morbilidades asociadas (porcentaje de pacientes con hipertensión o hiperlipidemia). Se evaluó el genotipo rs3123554 del gen CB2R.
El peso corporal se determinó con una precisión de 25g con un peso calibrado (Omron, Los Ángeles, California, EE. UU.). El IMC se calculó como el peso corporal (en kg) dividido por la altura en metros al cuadrado. Se midió la CC con una cinta métrica flexible no elástica (tipo SECA, SECA, Birmingham, Reino Unido). Se calculó PPEP% (%PPEP=peso preoperatorio–peso actual×100/peso preoperatorio–peso ideal). El peso ideal se calculó con un IMC ideal de 22kg/m2. La bioimpedancia eléctrica se utilizó para determinar la masa grasa con una precisión de 50g (Akern, EFG, Milán, Italia)10. La presión arterial se determinó en 2 ocasiones después de un descanso de 10minutos con un esfigmomanómetro (Omrom, Los Ángeles, California, EE. UU.).
Se tomaron muestras de sangre después de un ayuno nocturno de 12horas. Después de la centrifugación el suero se almacenó a –80°C. Las concentraciones séricas de colesterol total, colesterol HDL y triglicéridos se determinaron mediante un ensayo colorimétrico enzimático (Roche Diagnostics, Mannheim, Alemania). El colesterol LDL se determinó usando la fórmula de Friedewald11. Los niveles de glucosa en plasma se midieron usando un método automático de glucosa oxidasa (Glucose analyzer 2, Beckman Instruments, Fullerton, California, EE. UU.). La insulina se midió mediante colorimétrico enzimático (Insulina, WAKO Pure-Chemical Industries Osaka, Osaka, Japón)12 y se calculó la resistencia a la insulina usando el modelo de homeostasis para la resistencia a la insulina (HOMA-IR)13.
La hipertensión y la hiperlipidemia se diagnosticaron de acuerdo con los estándares del Programa nacional de educación sobre el colesterol14. La hipertensión y la hiperlipidemia también se diagnosticaron en pacientes que tomaban hipotensores e hipolipidemiantes en el momento de la cirugía, respectivamente. Se consideró la remisión de la hipertensión o la hiperlipidemia cuando los valores basales de la presión arterial o el colesterol LDL eran normales según los estándares14 y la medicación se suspendió.
GenotipadoEl ADN genómico se extrajo de 5ml de sangre periférica al comienzo del estudio. El ADN se extrajo de la fracción leucocitaria utilizando un kit comercial (Biorad, Los Ángeles, California, EE. UU.). Su cantidad y calidad se midieron con un espectrómetro NanoDrop ND-1000 (Bio-Rad®, San Diego, California, EE. UU.). Los cebadores se diseñaron con Sequenom Assay Design v4 (SEQUENOM, Inc. San Diego, California, EE. UU.). El genotipado para el polimorfismo rs3123554 se realizó mediante análisis en tiempo real de la reacción en cadena de la polimerasa. Esta reacción en cadena de la polimerasa se llevó a cabo con 30ng de ADN genómico, 0,1-0,15μl cada uno de oligonucleótidos cebador para rs670 (cebador directo: 5’-ACGTTGGATGATTGTACCGAGGAGGGAACT-3’’e inverso 5’-ACGTTGGATGGAGACACGTATTCTAGTCCC-3’ en un 2,5μl volumen final [Termociclador Life Tecnologies, LA, CA]). El ADN se desnaturalizó a 85°C durante 5minutos, seguido de 45 ciclos a 65°C durante 15segundos, y el recocido a 58,1°C durante 45segundos. El equilibrio de Weinberg se calculó con una prueba estadística (Chi-cuadrado) y la variante del gen CB2R estaba en equilibrio de Hardy Weinberg (p=0,36). El programa estadístico usado ha sido SPSS 15.0 (Il, EE. UU.).
Análisis estadísticoLa estimación del tamaño de la muestra se realizó sobre la base de los efectos sobre la pérdida de peso utilizando la frecuencia del polimorfismo (30%) en sujetos con obesidad mórbida y extrema (n=130). Todos los análisis se realizaron bajo un modelo genético dominante con alelo A rs3123554 como alelo de riesgo (AA+AG frente a GG). La prueba de Kolmogorov-Smirnov se utilizó para determinar la distribución variable. Los resultados se expresaron como promedio±desviación estándar. Se analizaron otras variables con la prueba ANOVA (para la variable distribuida normalmente) o la prueba Kruskal-Wallis (para la variables no distribuidas normalmente). Se utilizó un ANOVA de medidas repetidas de 2 vías para evaluar los efectos de los genotipos. Se utilizó la corrección de múltiples pruebas (corrección de Bonferroni). Las variables cualitativas se analizaron con la prueba de Chi-cuadrado, con la corrección de Yates y la prueba de Fisher. Se utilizó una prueba de Chi cuadrado para evaluar el equilibrio de Hardy-Weinberg. Un valor de p<0,05 se consideró significativo.
ResultadosLas frecuencias genotípicas para el polimorfismo rs3123554 de los 147 pacientes (edad 47,0±8,2 años, 74,1% mujeres) mostraron la siguiente distribución: 34,0% (n=50) GG, 34,7% (n=51) GA y 31,3% (n=46) AA. La frecuencia alélica fue G (0,51) y A (0,49). La distribución de género fue similar en los diferentes genotipos (GG; 22,0% [n=11] varones y 78,0% [n=39] mujeres), (GA; 29,4% [n=15] varones y 70,6% [n=36] mujeres) y (AA; 28,3% [n=13] varones y 61,7% [n=23] mujeres). La edad promedio también fue similar en los diferentes grupos de genotipos (GG: 47,1+5,1 años vs. GA+AA 46,8+3,9 años: ns). La tabla 1 muestra las características de los pacientes incluidos en el estudio.
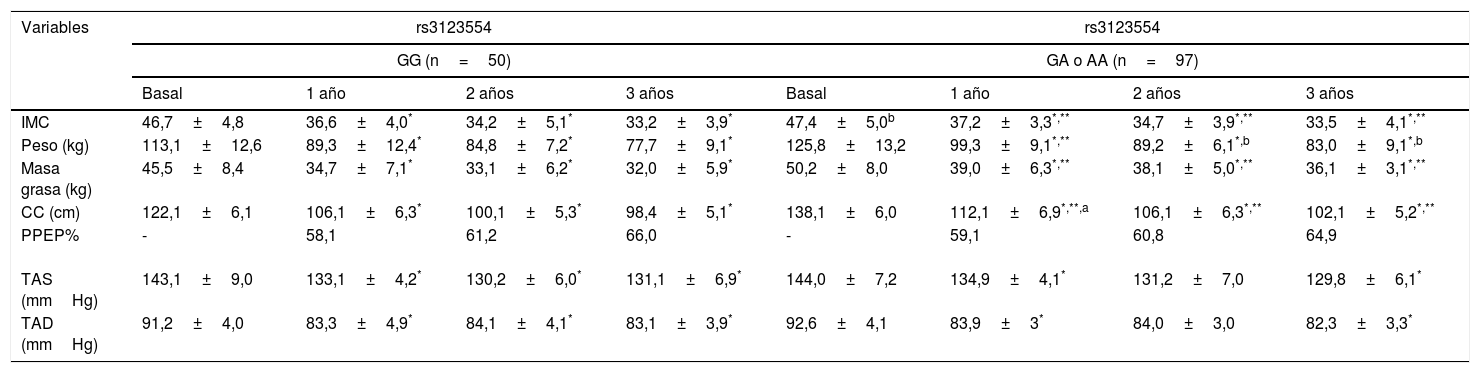
La tabla 2 muestra los parámetros de los sujetos antes y después de la DBP. Todos los parámetros mostraron una reducción estadísticamente significativa después de la cirugía tras uno, 2 y 3 años de seguimiento. Se observaron diferencias preoperatorias en el peso, el IMC, la masa grasa y la CC entre los genotipos, siendo más elevados en los pacientes portadores del alelo A. Las mejoras en estas variables fueron similares en ambos genotipos y todos los parámetros fueron significativamente diferentes de los valores basales a lo largo de los 3 años. En ambos genotipos el % PEPP mostró una mejoría significativa en todo momento durante el seguimiento.
Modificaciones en los parámetros antropométricos rs3123554 (media+desviación estándar)
| Variables | rs3123554 | rs3123554 | ||||||
|---|---|---|---|---|---|---|---|---|
| GG (n=50) | GA o AA (n=97) | |||||||
| Basal | 1 año | 2 años | 3 años | Basal | 1 año | 2 años | 3 años | |
| IMC | 46,7±4,8 | 36,6±4,0* | 34,2±5,1* | 33,2±3,9* | 47,4±5,0b | 37,2±3,3*,** | 34,7±3,9*,** | 33,5±4,1*,** |
| Peso (kg) | 113,1±12,6 | 89,3±12,4* | 84,8±7,2* | 77,7±9,1* | 125,8±13,2 | 99,3±9,1*,** | 89,2±6,1*,b | 83,0±9,1*,b |
| Masa grasa (kg) | 45,5±8,4 | 34,7±7,1* | 33,1±6,2* | 32,0±5,9* | 50,2±8,0 | 39,0±6,3*,** | 38,1±5,0*,** | 36,1±3,1*,** |
| CC (cm) | 122,1±6,1 | 106,1±6,3* | 100,1±5,3* | 98,4±5,1* | 138,1±6,0 | 112,1±6,9*,**,a | 106,1±6,3*,** | 102,1±5,2*,** |
| PPEP% | - | 58,1 | 61,2 | 66,0 | - | 59,1 | 60,8 | 64,9 |
| TAS (mmHg) | 143,1±9,0 | 133,1±4,2* | 130,2±6,0* | 131,1±6,9* | 144,0±7,2 | 134,9±4,1* | 131,2±7,0 | 129,8±6,1* |
| TAD (mmHg) | 91,2±4,0 | 83,3±4,9* | 84,1±4,1* | 83,1±3,9* | 92,6±4,1 | 83,9±3* | 84,0±3,0 | 82,3±3,3* |
CC: circunferencia de la cintura; IMC: índice de masa corporal; TAD: tensión arterial diastólica; TAS: tensión arterial sistólica; PPEP% porcentaje de pérdida de exceso de peso (PPEP%).
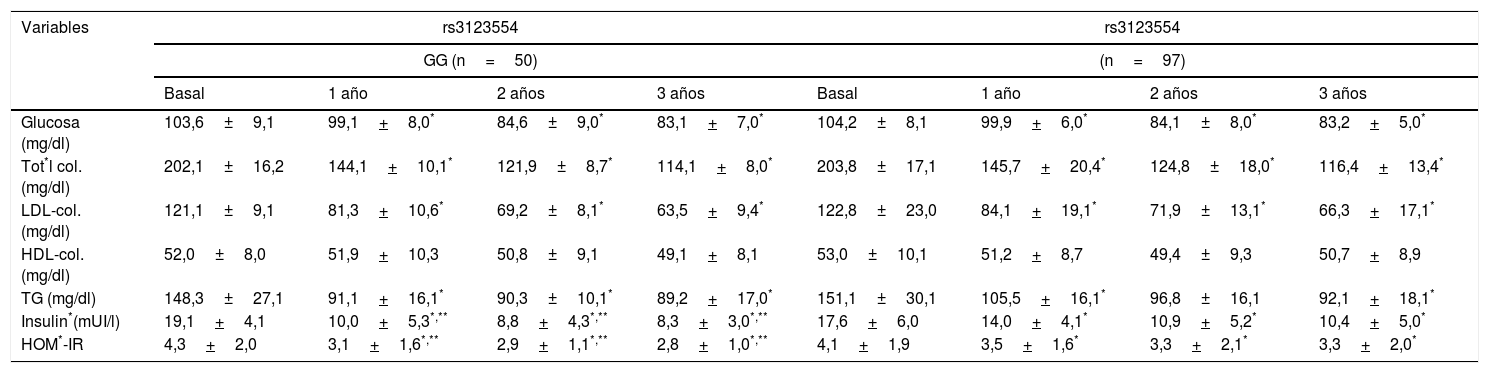
La tabla 3 muestra los cambios en los parámetros bioquímicos. No se detectaron diferencias preoperatorias significativas en los niveles séricos de glucosa, HOMA-IR, insulina, colesterol total, colesterol LDL, colesterol HDL y triglicéridos entre ambos genotipos. Los niveles de glucosa en ayunas, colesterol total, LDL-colesterol y triglicéridos disminuyeron en ambos grupos de genotipos durante el seguimiento. Sin embargo, la disminución de los niveles de insulina y HOMA-IR, aunque fue significativa en ambos genotipos, este cambio fue significativamente mayor en los no portadores del alelo A. La disminución de los niveles de insulina en ayunas después del primer año (delta: –9,1+1,4mUI/l vs. –3,6+1,3mUI/l; p=0,02), el segundo año (delta: –10,3+1,3mUI/l vs. –6,9+1,2mUI/l; p=0,01) y el tercer año (delta: –11,8+3,2mUI/l vs. –7,2+2,3mUI/l; p=0,02) fueron superiores en los no portadores del alelo A que en los portadores. Por otro lado, la mejoría de los niveles HOMA-IR en el primer año (delta: –1,2+0,4mUI/l vs. –0,6+0,8mUI/l; p=0,02), segundo año (delta: –1,4+0,4mUI/l vs. –0,8+0,2mUI/l; p=0,01) y en el tercer año (delta: –1,5+1,1mUI/l vs. –0,8+0,6mUI/l; p=0,01) también fueron mayores en los no portadores del alelo A que en los portadores de este alelo.
Parámetros bioquímicos (media+desviación estándar)
| Variables | rs3123554 | rs3123554 | ||||||
|---|---|---|---|---|---|---|---|---|
| GG (n=50) | (n=97) | |||||||
| Basal | 1 año | 2 años | 3 años | Basal | 1 año | 2 años | 3 años | |
| Glucosa (mg/dl) | 103,6±9,1 | 99,1+8,0* | 84,6±9,0* | 83,1+7,0* | 104,2±8,1 | 99,9+6,0* | 84,1±8,0* | 83,2+5,0* |
| Tot*l col. (mg/dl) | 202,1±16,2 | 144,1+10,1* | 121,9±8,7* | 114,1+8,0* | 203,8±17,1 | 145,7+20,4* | 124,8±18,0* | 116,4+13,4* |
| LDL-col. (mg/dl) | 121,1±9,1 | 81,3+10,6* | 69,2±8,1* | 63,5+9,4* | 122,8±23,0 | 84,1+19,1* | 71,9±13,1* | 66,3+17,1* |
| HDL-col. (mg/dl) | 52,0±8,0 | 51,9+10,3 | 50,8±9,1 | 49,1+8,1 | 53,0±10,1 | 51,2+8,7 | 49,4±9,3 | 50,7+8,9 |
| TG (mg/dl) | 148,3±27,1 | 91,1+16,1* | 90,3±10,1* | 89,2+17,0* | 151,1±30,1 | 105,5+16,1* | 96,8±16,1 | 92,1+18,1* |
| Insulin*(mUI/l) | 19,1+4,1 | 10,0+5,3*,** | 8,8+4,3*,** | 8,3+3,0*,** | 17,6+6,0 | 14,0+4,1* | 10,9+5,2* | 10,4+5,0* |
| HOM*-IR | 4,3+2,0 | 3,1+1,6*,** | 2,9+1,1*,** | 2,8+1,0*,** | 4,1+1,9 | 3,5+1,6* | 3,3+2,1* | 3,3+2,0* |
Col: colesterol; HOMA-IR: homeostasis model assessment; TG: triglicéridos.
Por último, en este grupo de pacientes con obesidad mórbida sin diabetes mellitus la remisión de los pacientes con diagnóstico de hipertensión arterial e hiperlipidemia antes del tratamiento fue similar en los 2 genotipos. En los pacientes con genotipo GG, un total de 25 (50%) presentaban dislipidemia y 47 con el genotipo (GA+AA) presentaban cifras elevadas de lípidos (48,5%); tras 3 años de la cirugía solo el 4% y el 3,1% presentaban cifras elevadas, respectivamente.
Con respecto a la hipertensión arterial los pacientes con genotipo GG, un total de 14 (28,0%), presentaban hipertensión arterial, y 26 con el genotipo (GA+AA) presentaban cifras elevadas de tensión arterial (26,8%); tras 3 años de la cirugía solo el 2,0% y el 3,1% presentaban cifras de tensión arterial elevadas, respectivamente.
DiscusiónEn este trabajo hemos comprobado una asociación del alelo A del SNP rs3123554 dentro del gen CNR2 con un mayor IMC y otros parámetros de adiposidad en pacientes con obesidad mórbida candidatos a cirugía bariátrica. Además, los obesos no portadores del alelo A mostraron una mejor respuesta de los niveles séricos de insulina y resistencia a la insulina (HOMA-IR) que los portadores de este alelo A después de la DBP en todos los tiempos de seguimiento.
Teniendo en cuenta que la obesidad es un problema de salud importante y un factor de riesgo cardiovascular de primer orden, un objetivo principal de las intervenciones en este grupo de pacientes es una pérdida de peso corporal mantenida en el tiempo. Con el objetivo de desarrollar en nuestra práctica diaria una medicina más personalizada, las interacciones genético-ambientales presentan un gran interés, y en este sentido se han identificado SNP asociados con el riesgo de obesidad y/o modificación de los factores de riesgo cardiovascular asociados tras una intervención dietética15 o cirugía bariátrica16. Estos antecedentes nos llevaron a investigar los efectos de este SNP dentro del gen CNR2 sobre la pérdida de peso y los cambios metabólicos tras 3 años de una DBP, no existiendo en la literatura ningún trabajo que evalúe la interacción de este polimorfismo con los efectos de cualquier técnica de cirugía bariátrica. Sorprendentemente, encontramos que el alelo menor de rs3123554 (A) se asoció con un mayor peso corporal y tuvo una mejoría menor en algunos parámetros metabólicos. En los últimos años el sistema endocannabinoide se ha relacionado con vías inflamatorias17, a su vez las evidencias que relacionan el papel de la inflamación en la patogénesis del riesgo cardiovascular en sujetos obesos18–19 es cada vez mayor. Como se menciona anteriormente, el CB2R se conoce desde hace tiempo como la isoforma del receptor cannabinoide periférico. En la actualidad existen evidencias de la expresión de CB2R en diferentes áreas del cerebro20. La presencia a nivel central de este receptor puede explicar los hallazgos de nuestro estudio, que relaciona este polimorfismo con determinados parámetros de obesidad, como la masa grasa, el IMC y la CC en los portadores del alelo A. Se conoce que la activación de CB2R en humanos influye en el comportamiento alimentario21 y, en segundo lugar, CB2R podría regular los niveles de endocannabinoides que podrían influir en los comportamientos de antojo y recompensa alimentaria a través del circuito neuronal relevante22. Estas situaciones podrían influir en la diferencia de peso encontrada.
Por otro lado, la diferente respuesta metabólica entre los 2 genotipos merece una atención especial. Sorprendentemente, encontramos que el alelo A de la variante rs31235554 condujo a una menor disminución de parámetros relacionados con el metabolismo de los hidratos de carbono (niveles de insulina y HOMA-IR). Para explicar esta asociación podemos utilizar 2 hipótesis. En primer lugar, una hipótesis central: Ketterer et al.7 han encontrado que los portadores del alelo A mostraron una menor sensibilidad a la insulina cerebral, y es necesario tener en cuenta que la sensibilidad a la insulina cerebral facilita la pérdida de peso corporal durante la restricción calórica19. Por otra parte, en estos trabajos previos7, se ha mostrado un efecto reducido relacionado con esta variante genética en la banda Theta del cerebro. Teniendo en cuenta que la sensibilidad a la insulina del cerebro determina la efectividad de la intervención dietética en términos de pérdida de peso23, podríamos postular que la disminución de la sensibilidad a nivel cerebral de la insulina en los portadores de alelos A puede estar relacionada con el peso más elevado y una mejoría menor de los niveles de insulina y resistencia a la insulina tras la cirugía.
Una segunda hipótesis para explicar estos hallazgos podría llamarse teoría periférica, ya que el CB2R se ha aislado en algunos órganos diana relacionados con el control del metabolismo glucémico como el hígado, el tejido adiposo y el músculo esquelético24. En sujetos obesos todos estos tejidos están implicados en la resistencia a la insulina y el metabolismo de los lípidos. Además, el efecto periférico de CB2R sobre el metabolismo en diferentes vías ya ha sido demostrado. Dos ejemplos de estos efectos periféricos son el papel del polimorfismo CB2R rs35761398 en la edad más temprana de la menarquia en sujetos portadores del alelo Q6325 y el papel de los SNPs rs3003336, rs2501431, rs2502992, rs2501432 del gen CB2R en la etiología de la osteoporosis, y sugieren que CB2R puede desempeñar un papel importante en la densidad ósea y la osteoporosis en mujeres posmenopáusicas26. Finalmente, podríamos aunar ambas hipótesis simultáneamente para explicar nuestros resultados, pudiendo deberse la diferencia del peso corporal en los datos basales a los mecanismos metabólicos periféricos, mientras que tras la intervención quirúrgica, la actividad cerebral alterada implícita en el sistema de recompensa y la diferente sensibilidad central a la insulina podría explicar los datos bioquímicos.
También es interesante que antes de la cirugía el peso y las variables clínicas asociadas fueron mayores en los portadores del alelo A, traduciéndose que a lo largo del seguimiento la mejoría en la sensibilidad a la insulina haya sido menor en estos a pesar de que la pérdida de peso es similar. Posiblemente la práctica asistencial nos obligaría a utilizar técnicas quirúrgicas con un mayor efecto en la pérdida de peso o en la resistencia en la insulina en los portadores del alelo A, y sin duda seguir más de cerca su metabolismo glucídico.
Las limitaciones de nuestro estudio son, por ejemplo, la ausencia de análisis de algunos factores incontrolados que podrían influir en nuestros resultados (estado epigenético, hormonal, otros factores ambientales desconocidos...). En segundo lugar, la falta de una cohorte de control sin una intervención quirúrgica podría ser un sesgo. En tercer lugar, las interacciones con otros genes no se han estudiado en nuestro estudio, por ejemplo, rs3123554 se encuentra a solo 1,5kb del gen FUCA1 y se relaciona con enfermedades metabólicas27.
En conclusión, nuestros datos sugieren que los pacientes con obesidad candidatos a cirugía bariátrica portadores del alelo A de la variante rs3123554 del gen CB2R presentan más peso, y ante una similar disminución del peso tras la cirugía bariátrica la mejoría en los niveles de insulina y resistencia a la insulina es menor. Estos resultados tienen que ser evaluados en futuros estudios para analizar el efecto de estas diferencias analíticas sobre variables clínicas más relevantes en la comorbilidad del paciente con obesidad mórbida.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.