El yodo es un componente esencial de las hormonas tiroideas y su déficit es la causa principal de retraso mental prevenible en el mundo. España ha sido considera yododeficiente hasta 2003. A pesar de que desde 2004, la yoduria está en rango óptimo, la OMS reconoce que no se cumplen los requisitos necesarios para garantizar que la población no pueda sufrir un trastorno por déficit de yodo. El objetivo de este artículo es realizar una revisión de la situación nacional de este micronutriente. Los datos obtenidos en diversos estudios destacan el bajo consumo domiciliario de sal yodada. A pesar de los avances conseguidos en las últimas décadas, los niños españoles no están exentos de sufrir un trastorno por déficit de yodo. Es necesario, por tanto, implementar políticas que permitan controlar la nutrición yódica así como impulsar el consumo de sal yodada de manera universal.
Iodine is an essential component of thyroid hormones, and iodine deficit is the leading cause of preventable mental retardation worldwide. Spain was considered iodine-deficient until 2003. Although iodine urinary levels have been in the optimal range in Spain since 2004, the WHO recognizes that our country does not meet the necessary requirements to ensure that the whole population is not at risk of an iodine deficiency disorder. The aim of this article is to review the current iodine status in Spain. Data from several studies emphasize the low consumption of iodized salt at home. Despite the progress made in recent decades, Spanish children are not exempt from suffering an iodine deficiency disorder. Policies that allow for controlling iodine nutrition and promote universal consumption of iodized salt should therefore be implemented.
El yodo es el componente esencial de las hormonas tiroideas, necesarias para la vida de todos los mamíferos. Según la Organización Mundial de la Salud (OMS), el déficit de yodo supone en la actualidad la principal causa de retraso mental prevenible en el mundo. Diferentes modelos animales han demostrado cambios histológicos en la corteza cerebral en mamíferos con deprivación grave de yodo: cuerpos neuronales pequeños y compactos, disminución de las prolongaciones dendríticas, déficit de mielinización y un retraso en la proliferación celular y la migración1. Cuando la cantidad de yodo es insuficiente, aparecen una serie de alteraciones funcionales y de desarrollo que se conocen como trastornos por déficit de yodo (TDY) (tabla 1)2. La gravedad de los mismos depende del momento de la vida en que ocurra, tanto más grave cuanto menor sea la edad. El mayor riesgo es el daño cerebral irreversible, que se puede producir intraútero si la ingesta de yodo por parte de la madre es insuficiente. Estos trastornos suponen un amplio espectro clínico desde el cretinismo, con retraso mental grave, hasta la disfunción cognitiva leve, hipoacusia o retraso somático o puberal. Estos últimos son mucho más prevalentes a nivel mundial.
Trastornos por déficit de yodo, según la etapa de la vida
| Periodo | Consecuencia |
|---|---|
| Feto | |
| Mayor número de abortos | |
| Nacidos muertos | |
| Anomalías congénitas | |
| Mayor mortalidad perinatal | |
| Cretinismo neurológico: -Deficiencia mental - Sordomudez - Diplejia, tetraplejia espástica - Estrabismo | |
| Cretinismo mixedematoso: - Enanismo - Deficiencia mental | |
| Retraso mental de los habitantes aparentemente normales | |
| Mayor susceptibilidad en accidentes nuclearesa | |
| Recién nacidos | |
| Defectos psicomotores | |
| Bocio neonatal | |
| Hipotiroidismo neonatal | |
| Retraso en el desarrollo somático | |
| Mayor susceptibilidad en accidentes nuclearesa | |
| Niños y adolescentes | |
| Bocio | |
| Hipotiroidismo juvenil | |
| Deterioro de las facultades mentales | |
| Retraso en el desarrollo somático | |
| Mayor susceptibilidad en accidentes nuclearesa | |
| Adultos | |
| Bocio y sus complicaciones | |
| Hipotiroidismo | |
| Deterioro de las facultades mentales | |
| Propensión al hipertiroidismo al instaurarse medidas profilácticas | |
| Mayor susceptibilidad en accidentes nuclearesa |
Al ser la glándula deficiente, presenta mayor avidez por los isótopos radiactivos de yodo. Toda la patología tiroidea, incluido el cáncer de tiroides, está aumentada en las zonas de deficiencias de yodo y en todas las edades.
Fuente: WHO2.
El yodo (en forma de yoduro) está distribuido ampliamente en el planeta pero, en muchas regiones y debido a las glaciaciones, inundaciones y erosiones, ha sido eliminado del terreno y actualmente se encuentra, en su mayoría, en los mares y océanos. Todos los alimentos de origen marino (algas, pescados y mariscos) tienen una elevada cantidad de yodo de manera natural, con la excepción de la sal marina. La sal marina o sal de mesa es la que procede del mar y se obtiene en las salinas; sin embargo, aunque de manera natural lleva yodo, la cantidad es insuficiente, a menos que se fortifique artificialmente. El uso de yodo para fortificar los piensos para las vacas y las gallinas ponedoras o como antiséptico de las ubres y los contenedores origina que, en muchos países, productos animales como la leche y sus derivados o los huevos puedan contener una elevada cantidad de yodo3,4. Otras fuentes no alimentarias de yodo son la povidona yodada, la amiodarona, algunos antitusígenos que contienen yoduro potásico como mucolítico, algunos suplementos vitamínicos y los contrastes radiológicos5.
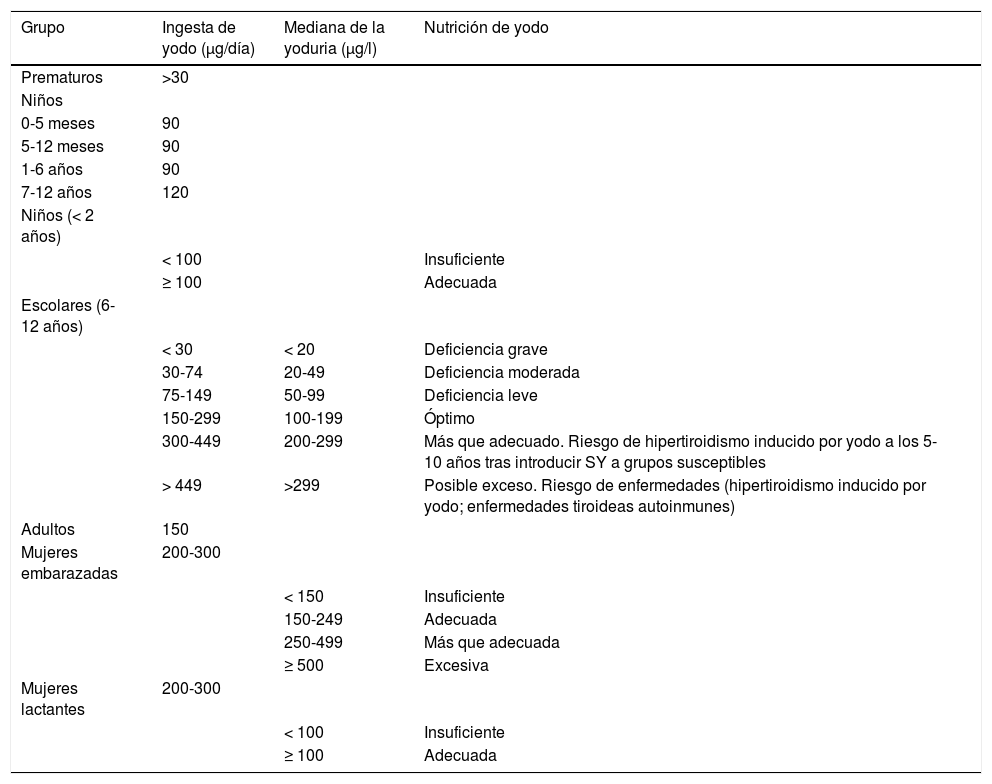
Requerimientos diarios de yodo según las edadesSegún las recomendaciones de la OMS, la dosis diaria de yodo necesaria varía según las distintas etapas de la vida (tabla 2)6–8. Es importante destacar que las necesidades de los recién nacidos prematuros, los neonatos y los niños pequeños son más altas en relación con sus pesos corporales. La cantidad de yodo necesaria para toda una vida es de tan solo 4g, pero es imprescindible ingerirlo diariamente porque no se puede almacenar en el organismo.
Ingesta mínima recomendada de yodo, medianas de las yodurias y su relevancia clínica en función del tipo de población
| Grupo | Ingesta de yodo (μg/día) | Mediana de la yoduria (μg/l) | Nutrición de yodo |
|---|---|---|---|
| Prematuros | >30 | ||
| Niños | |||
| 0-5 meses | 90 | ||
| 5-12 meses | 90 | ||
| 1-6 años | 90 | ||
| 7-12 años | 120 | ||
| Niños (< 2 años) | |||
| < 100 | Insuficiente | ||
| ≥ 100 | Adecuada | ||
| Escolares (6-12 años) | |||
| < 30 | < 20 | Deficiencia grave | |
| 30-74 | 20-49 | Deficiencia moderada | |
| 75-149 | 50-99 | Deficiencia leve | |
| 150-299 | 100-199 | Óptimo | |
| 300-449 | 200-299 | Más que adecuado. Riesgo de hipertiroidismo inducido por yodo a los 5-10 años tras introducir SY a grupos susceptibles | |
| > 449 | >299 | Posible exceso. Riesgo de enfermedades (hipertiroidismo inducido por yodo; enfermedades tiroideas autoinmunes) | |
| Adultos | 150 | ||
| Mujeres embarazadas | 200-300 | ||
| < 150 | Insuficiente | ||
| 150-249 | Adecuada | ||
| 250-499 | Más que adecuada | ||
| ≥ 500 | Excesiva | ||
| Mujeres lactantes | 200-300 | ||
| < 100 | Insuficiente | ||
| ≥ 100 | Adecuada |
Fuente: elaboración propia a partir de datos de la American Thyroid Association (http://thyroid.org/iodine-deficiency) y de referencias previas (Panel6, FAO7 y Rossi et al.8).
Existen tres criterios utilizados para conocer la situación nutricional de yodo en una región o en un determinado colectivo. El método directo es evaluar la concentración de yodo en orina y los métodos indirectos son el porcentaje de escolares con bocio y el porcentaje de TSH >5 mU/l detectado en las pruebas metabólicas realizadas a los recién nacidos. Debido a que más del 90% de yodo ingerido se elimina por la orina, la concentración urinaria de yodo (CUI) o yoduria es un buen biomarcador de la ingesta reciente de yodo y el mejor indicador para detectar los TDY. La determinación de la CUI en una micción aislada en cada individuo de la muestra y su mediana es el parámetro recomendado, tanto por la OMS como por el Consejo Internacional para el Control de los TDY, para conocer la situación nutricional de yodo en un grupo poblacional. Una mediana poblacional < 100μg/l sugiere un elevado riesgo de desarrollar diferentes trastornos tiroideos para esa población9,10. El análisis de la CUI se puede realizar mediante distintos sistemas: 1) estudio colorimétrico del ácido clórico de Zak modificado por Benotti, 2) la técnica colorimétrica de Dunn, 3) el método semicuantitativo descrito por Gnat, 4) el método de Sandell-Kolthoff y 5) la cromatografía líquida de alta resolución11–13.
Los mejores indicadores de que una población es yododeficiente son: una mediana de la yoduria en la población escolar <100μg/l, una tasa de bocio escolar > 5% y un porcentaje de TSH > 5 mU/l en sangre total en neonatos superior al 3%. Hay que resaltar que la yoduria en micción aislada sirve como indicador del estado de yodo poblacional, pero no es útil como marcador individual. La determinación de la CUI en orina de 24 h es el mejor indicador a nivel individual, pero menos recomendado para los estudios poblacionales por su elevado coste10. Algunos autores proponen ajustar la yoduria según la relación yoduria/creatinina, no siendo necesario para estudios poblacionales14,15, aunque, recientemente, se ha publicado un artículo que muestra cómo el grado de hidratación puede influir en la CUI16.
De manera universal y propuesto por la OMS, para conocer la situación nutricional de una comunidad, se estudian las yodurias de los niños en edad escolar (6–12 años). Igualmente, la tabla 2 muestra los valores de la yoduria en relación con la ingesta de yodo en escolares. Los valores considerados óptimos en esta población se sitúan entre 100–199μg/l, que corresponden a una ingesta de yodo/día de 150-299μg. Esta misma tabla expresa los valores de la yoduria en otros rangos de edad diferentes a la edad escolar.
El bocio aparece cuando la yoduria poblacional es < 100μg/l y, cuando se detecta en edad escolar es un indicador de yododeficiencia crónica dentro de esa población17. La valoración del volumen tiroideo puede ser realizada de dos maneras: por palpación directa del cuello (técnica clásica) o mediante ecografía cervical realizada por radiólogos expertos. Esta técnica es más precisa, especialmente en poblaciones con una ratio de bocio visible/palpable bajo, según las últimas recomendaciones internacionales17–19.
En zonas endémicas, la TSH elevada en sangre de los recién nacidos es un indicador eficaz de la situación nutricional de yodo en la población. La elevación de la TSH neonatal es el indicador aislado que mejor predice el daño cerebral y el deterioro del desarrollo intelectual a largo plazo. Para que una población sea considerada como yodosuficiente según la OMS, debe cumplir los siguientes criterios: yoduria mediana en la población escolar ≥ 100μg/l, tasa de bocio escolar < 5% y porcentaje de TSH > 5 mU/l en sangre total en neonatos < 3%20.
Epidemiología de la situación nutricional de yodo en el mundoEl déficit de yodo y su patología asociada fue detectado hace ya 150 años pero no ha sido un objetivo prioritario hasta bien entrado el siglo XX. En los años sesenta, la OMS describió la situación europea del cretinismo, pero no fue hasta 1980 cuando la European Thyroid Association reevaluó la situación nutricional del yodo21. Las estimaciones de déficit de yodo para finales del siglo XX eran tan elevadas que, en 1986, la OMS declaró ante la 43 Asamblea Mundial que «la deficiencia de yodo es, a nivel mundial y después de la inanición extrema, la causa nutricional más frecuente de retraso mental prevenible». Se señaló que la concepción del bocio debía dejarse a un lado y la relación que debía tenerse en cuenta era la que existe entre el yodo y el cerebro. Han sido varias las reuniones a nivel mundial abordando este tema y España ha participado en todas ellas22.
La profilaxis del bocio mediante la yodación de la sal comenzó en Suiza y en los Estados Unidos en los años veinte del pasado siglo. En 1990 solo Suiza, algunos países escandinavos, Estados Unidos, Canadá y Australia eran yodosuficientes. En la actualidad se estima que todavía 2000 millones de personas presentan CUI < 100μg/l, de los cuales, 246 millones son niños y, de ellos, 78 millones están en el Sudeste Asiático y 58 millones en África. El 12% de la población global tiene bocio, 26 millones personas presentan algún grado de afectación neurológica secundaria al déficit de este nutriente y cerca de 6 millones padecen cretinismo con retraso mental severo23.
En 2012, 111 países presentaban yodurias normales, incluida España, 30 estaban en situación de yododeficiencia (21 de tipo leve, 9 moderada y ninguno grave) y 10 países tenían unos rangos excesivos de yodo23. Es importante destacar que, incluso en los países que actualmente se consideran yodosuficientes, determinados grupos como los vegetarianos o los veganos, los niños menores de 2 años sin lactancia materna y que usan fórmulas no suplementadas con yodo, así como determinadas regiones con poca cobertura de sal yodada (SY), podrían ser todavía deficientes en yodo23.
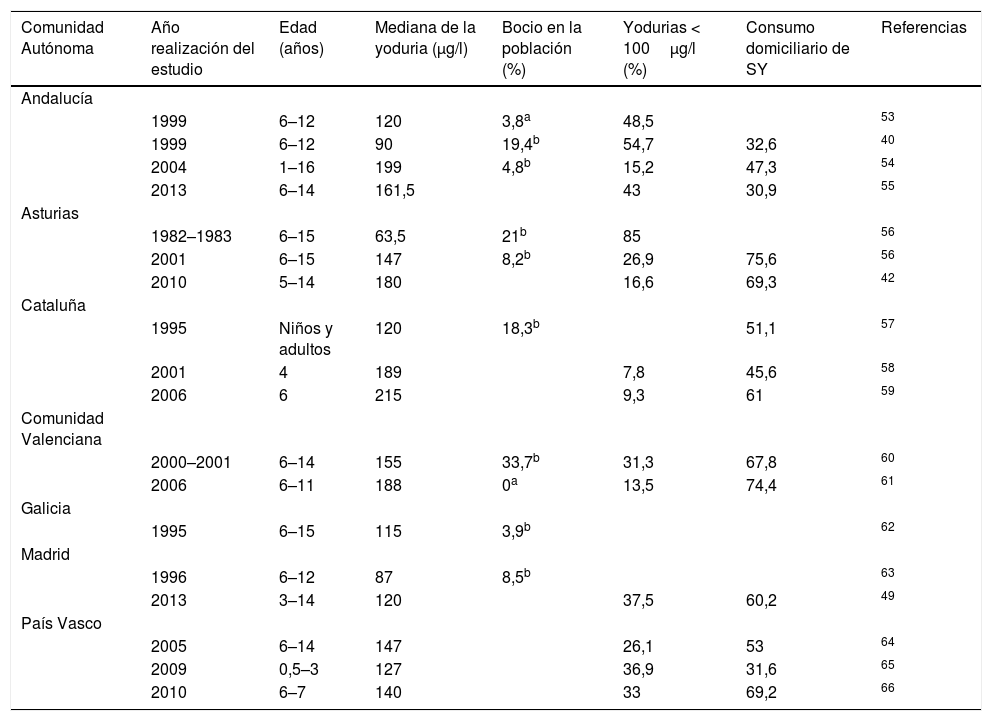
Epidemiología de la situación nutricional de yodo en EspañaLa primera noticia escrita acerca del problema del bocio en España data de 1833, pero fue en 1922, gracias al Dr. Marañón y a su viaje a Las Hurdes, cuando comenzó la concienciación institucional del problema. Hasta la publicación del estudio Tirokid en 201624, los últimos estudios relativos a todo el país en población pediátrica se publicaron en 1993, cuando los investigadores Morreale y Escobar recogieron toda la información obtenida de manera local desde 1981, mostrando una endemia nacional de bocio grado I–II25. Posteriormente, se han ido realizando múltiples estudios en distintas regiones españolas que se han recogido en la tabla 3. Hay que hacer notar que solo se han incluido estudios que proporcionen los datos de la mediana de la yoduria y no su media aritmética, ya que el valor de la yoduria no tiene una distribución normal.
Nivel de yodo en niños en diferentes regiones españolas
| Comunidad Autónoma | Año realización del estudio | Edad (años) | Mediana de la yoduria (μg/l) | Bocio en la población (%) | Yodurias < 100μg/l (%) | Consumo domiciliario de SY | Referencias |
|---|---|---|---|---|---|---|---|
| Andalucía | |||||||
| 1999 | 6–12 | 120 | 3,8a | 48,5 | 53 | ||
| 1999 | 6–12 | 90 | 19,4b | 54,7 | 32,6 | 40 | |
| 2004 | 1–16 | 199 | 4,8b | 15,2 | 47,3 | 54 | |
| 2013 | 6–14 | 161,5 | 43 | 30,9 | 55 | ||
| Asturias | |||||||
| 1982–1983 | 6–15 | 63,5 | 21b | 85 | 56 | ||
| 2001 | 6–15 | 147 | 8,2b | 26,9 | 75,6 | 56 | |
| 2010 | 5–14 | 180 | 16,6 | 69,3 | 42 | ||
| Cataluña | |||||||
| 1995 | Niños y adultos | 120 | 18,3b | 51,1 | 57 | ||
| 2001 | 4 | 189 | 7,8 | 45,6 | 58 | ||
| 2006 | 6 | 215 | 9,3 | 61 | 59 | ||
| Comunidad Valenciana | |||||||
| 2000–2001 | 6–14 | 155 | 33,7b | 31,3 | 67,8 | 60 | |
| 2006 | 6–11 | 188 | 0a | 13,5 | 74,4 | 61 | |
| Galicia | |||||||
| 1995 | 6–15 | 115 | 3,9b | 62 | |||
| Madrid | |||||||
| 1996 | 6–12 | 87 | 8,5b | 63 | |||
| 2013 | 3–14 | 120 | 37,5 | 60,2 | 49 | ||
| País Vasco | |||||||
| 2005 | 6–14 | 147 | 26,1 | 53 | 64 | ||
| 2009 | 0,5–3 | 127 | 36,9 | 31,6 | 65 | ||
| 2010 | 6–7 | 140 | 33 | 69,2 | 66 |
Son varios los estudios basados en encuestas nutricionales que muestran el insuficiente consumo de yodo. En 2010, se detectó en Valladolid que el consumo de SY era inferior al recomendado26. Datos de la Comunidad Valenciana recogidos en escolares y publicados en 2015 (Estudio ANIVA), mostró que los cuestionarios de alimentación resaltaban un consumo deficiente de yodo27. Por su parte, la Encuesta Nacional de Alimentación en la población Infantil y Adolescente (ENALIA) publicada en 2017, mostró que el consumo de alimentos ricos en yodo era claramente insuficiente a partir de los 14 años28.
Es importante destacar que dos comunidades autónomas han sido las pioneras en detectar la importancia de los TDY y en poner en marcha programas reglados para combatirlos: Cataluña que a partir de 1986 implementó un programa de salud pública informando acerca de las virtudes de la SY e incentivando a empresas salineras y expendedoras de sal y Asturias que, a partir de 1992, logró que se utilizara SY de manera obligatoria en todos los comedores escolares.
Los datos nacionales más actuales vienen recogidas en los siguientes estudios: 1) el proyecto Tirobus (2010), realizado en personas de todas las edades, que mostró que la mediana de la yoduria en España era de 143,2μg/l29, 2) el estudio Di@betes (2012) realizado solo en adultos, mostró una mediana de las yodurias de 117,2μg/l, con valores más elevados entre los individuos que consumían SY y leche de manera habitual30, y 3) el Proyecto Tirokid, publicado en 2016, que ha sido el único estudio pediátrico nacional realizado desde 1993. Se evaluaron casi 2000 niños entre 6 y 7 años en las 17 Comunidades Autónomas. La mediana de la yoduria fue 173μg/l —por lo tanto en rango óptimo— siendo más elevada en niños que en niñas, y en aquellos que consumían de manera regular SY y tomaban, al menos, 2 vasos de leche diarios24.
Hasta 2003 España fue considerada como un país yododeficiente31, pero, desde 2004, la OMS la incluye dentro del grupo de países con un nivel óptimo de yodo, según la mediana de la yoduria. Sin embargo, como se verá más adelante, desafortunadamente esto no significa que la población entera esté exenta de riesgo de sufrir TDY2. En la tabla 4 se recogen los datos más recientes de nuestro país publicados por la OMS, donde se destacaba la muy baja penetrancia de la SY en los domicilios y que casi un 40% de la población presentaba yodurias insuficientes23,32. Es importante aclarar en este punto que la CUI presenta una gran variabilidad a lo largo del día y puede verse influida por el grado de hidratación. Por lo tanto, encontrar una yoduria aislada < 100μg/l en un individuo, no significa que esa persona sea realmente yododeficiente ya que es posible que, al repetir la determinación en otro momento del día o al día siguiente, esta sea distinta33. Es por ello que estas yodurias aisladas solo se utilizan como valor global de la muestra, usando la mediana poblacional que, en el caso de España, es normal. Sin embargo, el número de muestras por debajo de 100μg/l, indica un riesgo potencial tanto para la población de manera global como para grupos específicos (mujeres embarazadas y lactantes). Los datos publicados por la OMS en 2012, han sido mejorados en el estudio Tirokid publicado en 2016, mostrando un consumo de SY a nivel nacional del 69% y un 17% de los niños con yodurias < 100μg/l24. Explicado esto, es importante decir que existen otros criterios para garantizar una ausencia de riesgo de sufrir un TDY a largo plazo (tabla 5) y que nuestro país no cumple en su totalidad tales criterios.
Situación de España con respecto al estado nutricional de yodo según los datos publicados por la OMS (2007 y 2012)
| Característica | Datos |
|---|---|
| Población total (2010; en miles) | 46007 |
| Domicilios que consumen SY (%) | 16 |
| Mediana de yodurias (μg/l) | 117 |
| Población con yoduria < 100μg/l (%) | 38,4 |
| Tipo de estudios realizados | Provinciales |
| Bocio por palpación (%) | 10 |
| Comités nacionales TDY | Sí |
| Programas nacionales contra TDY | No |
| Regulación de la SY | Sí |
| Programas de salud pública y control de consumo de SY y yodurias | No |
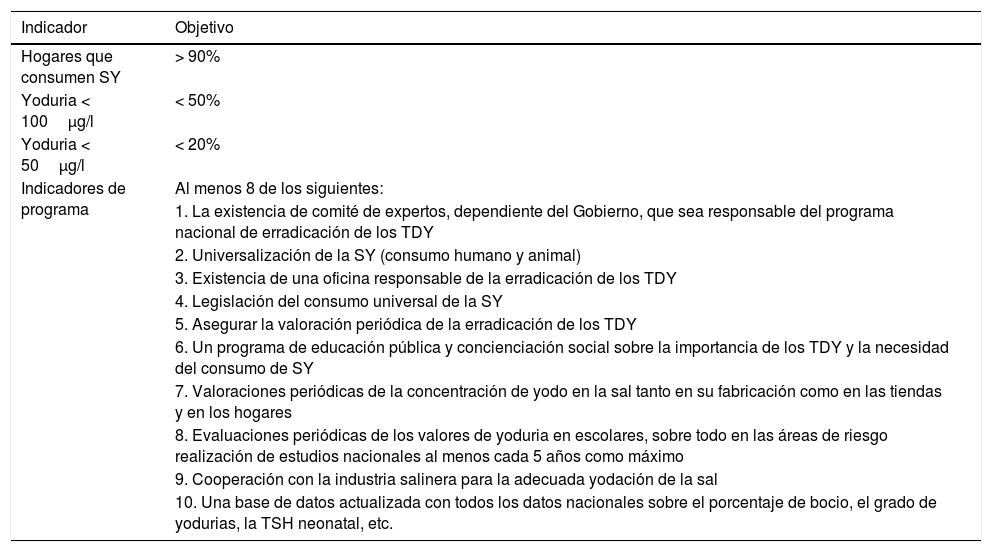
Objetivos para la erradicación virtual de los TDY
| Indicador | Objetivo |
|---|---|
| Hogares que consumen SY | > 90% |
| Yoduria < 100μg/l | < 50% |
| Yoduria < 50μg/l | < 20% |
| Indicadores de programa | Al menos 8 de los siguientes: |
| 1. La existencia de comité de expertos, dependiente del Gobierno, que sea responsable del programa nacional de erradicación de los TDY | |
| 2. Universalización de la SY (consumo humano y animal) | |
| 3. Existencia de una oficina responsable de la erradicación de los TDY | |
| 4. Legislación del consumo universal de la SY | |
| 5. Asegurar la valoración periódica de la erradicación de los TDY | |
| 6. Un programa de educación pública y concienciación social sobre la importancia de los TDY y la necesidad del consumo de SY | |
| 7. Valoraciones periódicas de la concentración de yodo en la sal tanto en su fabricación como en las tiendas y en los hogares | |
| 8. Evaluaciones periódicas de los valores de yoduria en escolares, sobre todo en las áreas de riesgo realización de estudios nacionales al menos cada 5 años como máximo | |
| 9. Cooperación con la industria salinera para la adecuada yodación de la sal | |
| 10. Una base de datos actualizada con todos los datos nacionales sobre el porcentaje de bocio, el grado de yodurias, la TSH neonatal, etc. |
Fuente: Díaz Cadórniga et al.44.
El yodo se encuentra en cantidades relativamente bajas en los alimentos cotidianos, por lo que la población necesita una fuente adicional. El método recomendado por la OMS para la eliminación del déficit de yodo y la prevención de los TDY es el uso de SY de manera universal (enriquecimiento con yodo de toda la sal utilizada para el consumo humano, tanto de mesa como la utilizada para la fabricación de alimentos y para el consumo animal). El contenido de la sal para consumo humano debe tener como mínimo 15ppm de yodo y usarse en, al menos, el 90% de los hogares34. Aunque en España dicho contenido es de 60ppm (de las más altas del mundo), varios estudios han comprobado que, frecuentemente, la concentración de yodo real es inferior a la referida en el envase o, directamente, la supuesta «sal yodada» contenía menos de 15ppm de yodo al ser analizada35. El origen de esto podría residir en procesos industriales de yodación inadecuados, envases y embalajes deficientes o condiciones ambientales de almacenamiento que favorezcan la degradación del yodo.
La cobertura de SY en los domicilios a nivel mundial es variable pero, según fuentes de la OMS, ha pasado de menos de un 20 a un 70% en dos décadas. En algunos países es obligatorio por ley el uso de la SY; ejemplos de esto son Dinamarca y China donde es obligatorio que toda la sal de venta en supermercados así como la que se utiliza en la fabricación de alimentos sea yodada. En Suiza, Dinamarca, Alemania y Holanda es obligatorio el uso de SY para el procesamiento de los alimentos preparados36. En España, la SY de mesa está disponible desde 1983 pero la fortificación de la sal y de otros alimentos no está regulada, por lo que no es obligatorio especificar el tipo de sal utilizada en las etiquetas de los alimentos manufacturados37. Aunque los datos aportados por la OMS en 2007 apuntaban que, en España, la ratio de penetración de la SY en los domicilios era del 16%51, los últimos datos disponibles reflejan un consumo de SY mayor, del 43,9% en adultos30, y del 68,9% en niños24.
Según la Sociedad Española de Endocrinología y Nutrición, la única contraindicación para el consumo de SY es la realización de un rastreo corporal total con 131I, cuando se vaya a recibir una dosis diagnóstica o terapéutica de yodo radiactivo o si la persona tiene una enfermedad de Graves-Basedow activa o un bocio multinodular tóxico. Los niños con hipotiroidismo que toman tratamiento con tiroxina, deben seguir manteniendo un consumo de SY suficiente para alcanzar el aporte recomendado total diario. Si el niño está tiroidectomizado, en tratamiento sustitutivo con levotiroxina, aunque no necesite este micronutriente, la SY no le perjudica38.
Son numerosos los estudios que reflejan los beneficios económicos de los programas de yodación. El coste estimado de los programas de yodación de sal en el mundo varía entre 0,0025–0,10 US $ por persona y año, incluyendo no solo el precio del yodato o yoduro potásico sino la construcción de los edificios ad hoc, los equipamientos, los trabajadores, el mantenimiento, la administración y la electricidad. Esto supone una tercera parte del coste de los tratamientos y cuidados a largo plazo de los pacientes con TDY23,39. Se recomienda de igual manera un consumo frecuente de alimentos con elevadas cantidades de yodo, procedentes del mar: pescados y mariscos. El yodo se utiliza de manera habitual para fortificar los piensos de las vacas y gallinas ponedoras, como antiséptico para el ganado o para los contenedores, dando lugar a que productos animales como la leche y sus derivados o los huevos puedan contener una elevada cantidad de yodo40. Sin embargo, este es un asunto sin regular. Un estudio publicado en 2011 encontró gran variabilidad en la cantidad de yodo incluso dentro de cada marca de leche (cada marca se abastece de diferentes granjas con diferentes políticas de uso del yodo). La media de la concentración de yodo en diferentes lotes de leche fue de 259 ± 58μg/l (valor mínimo 79μg/l y, máximo, 409μg/l). Hay que destacar que las etiquetas informativas de las distintas marcas no contenían ninguna información ni de su contenido en yodo ni de los procesos a los que había sido sometida41.
Un estudio reciente ha mostrado que el consumo de leche en niños asturianos se relaciona de forma significativa con la yoduria; esta aumentaba proporcionalmente a la cantidad diaria de vasos de leche y se pudo determinar que, por cada vaso de leche consumido diariamente, la yoduria media aumentaba 24g/l42.
La mediana del contenido en yodo encontrada en marcas vascas de leche pasteurizada de vaca fue de 190 (159–235) μg/l, sin diferencias entre leches enteras, semidesnatadas y desnatadas43. Sin embargo, dicha mediana en las leches orgánicas UHT fue de 55 (50,5–61,5) μg/l, debido a su distinto procesamiento41,43. La carne, los cereales, las verduras, las frutas y el aceite contienen poca cantidad de yodo (2–3μg yodo/100g de alimento) de manera natural.
Criterios de erradicación de los TDYNo es lo mismo decir que un país tiene una situación nutricional óptima de yodo (mediana de la yoduria de la población ≥ 100μg/l) que afirmar que esa misma población esté exenta de riesgo de desarrollar un TDY. Se considera que una población tiene una situación nutricional de yodo suficiente, desde el punto de vista cuantitativo, si cumple los siguientes criterios: una mediana de la yoduria en la población escolar ≥100μg/l, una tasa de bocio escolar menor del 5% y un porcentaje de TSH > 5 mU/l en sangre total en neonatos inferior al 3%, aunque esto no significa que se haya erradicado el déficit de yodo de manera definitiva y, por lo tanto, el riesgo de padecer los TDY2. Por ello, la OMS considera que es necesario que se cumplan una serie de objetivos que se muestran en la tabla 544.
Consideraciones finalesDe acuerdo con Santiago et al., el problema actual en el mundo ya no es el cretinismo sino las alteraciones leves en el desarrollo intelectual, que suponen un peor rendimiento escolar con el consiguiente menor desarrollo social y económico de las poblaciones40,45. Es muy importante conocer que, aunque el grado de yododeficiencia sea leve, eso no significa que las consecuencias sean leves en cuanto al deterioro intelectual o auditivo. Aunque España es considerada como un país con un nivel nutricional de yodo en el rango adecuado desde 2004, no se puede concluir que nuestra población esté libre de sufrir un TDY. Si observamos los criterios necesarios según la OMS para la erradicación de los TDY (tabla 5), se deduce que España no los cumple. En nuestro país, la cobertura de SY es inferior al 90% y solo se cumplen 3 de los 10 indicadores del programa: la existencia de un comité de expertos no dependiente del Gobierno y formado por profesionales sensibilizados con el tema, una regulación acerca del uso de SY y cierta cooperación con la industria salinera44. Sin embargo, ni existe un programa nacional de Salud Pública a tal efecto, ni programas de educación pública, ni se monitoriza de manera regular la cantidad de yodo en la sal ni la yoduria de la población, ni se realizan estudios centinelas32,46,47. Según datos de la Sociedad Española de Endocrinología y Nutrición, desde que en 1993 se demostró que toda España presentaba un bajo nivel de yoduria y que era endémica para el bocio, las acciones para impulsar el consumo de SY en su mayor parte han sido acometidas por profesionales comprometidos, siendo esporádicos los programas procedentes de gobiernos regionales o del gobierno central. Además, es importante destacar que todos los expertos aseguran que esta mejoría de la nutrición de yodo con respecto a décadas anteriores solo se debe en parte al mayor consumo de SY. La elevada cantidad de yodo en la leche de vaca y sus derivados ha sido la verdadera «profilaxis silenciosa» en muchos países y, probablemente, España entre ellos48. Tanto en el estudio Tirokid como en otro realizado en 2013 en niños madrileños de entre 3 y 14 años, se encontró que la CUI se relaciona, de manera muy consistente, tanto con el consumo de SY como con tomar, al menos, 2 vasos de leche al día24,49. Se comprobó que los niños que no tomaban SY ni bebían, al menos, dos vasos de leche diarios presentaban una mediana de yoduria de 90 (rango intercuartílico [RIC] 48,00–141,00) μg/l y cuatro veces más riesgo de yododeficiencia comparado con el grupo de niños que sí tomaban SY y bebían diariamente no menos de 2 vasos de leche49.
Existen propuestas por parte de algunos grupos para que la leche sea la alternativa a la yodación de la sal en países con bajo consumo de sal, pero la objeción es que, actualmente, no existe una regulación legal del nivel de yodo que debe llevar la leche. Existen países, como es el caso de Australia, donde la cantidad de yodo en la leche ha disminuido drásticamente en la última década por el uso de otros antisépticos no yodados para su procesamiento, de manera que la mediana de la yoduria de la población general ha pasado de situarse en los 200μg/l a cifras inferiores a 100μg/l en diez años50. Otros países como Reino Unido, están observando en los últimos años una disminución de las yodurias debido a un menor consumo de leche por parte de la población48. Esto demuestra que la leche es una profilaxis «vulnerable y oscilante» y, por lo tanto, debe ser la SY la verdadera responsable de la yodación en la población española. Con respecto a la sal, siempre ha existido un temor generalizado al riesgo cardiovascular asociado a un consumo moderado-alto de la misma. Según la estrategia NAOS (nutrición, actividad física y prevención de la obesidad) del Ministerio de Sanidad, Servicios Sociales e Igualdad, el 75% del total de sal que se consume en España proviene de los alimentos procesados, que no suelen estar elaborados con SY. Conociendo esto, la estrategia lógica es utilizar SY en la preparación industrial de alimentos y disminuir la cantidad total de sal que se utiliza. Aquellos pacientes en los que la sal estuviera contraindicada, como pueden ser los niños con síndrome nefrótico, deberían administrarse suplementos orales de yodo.
Un último punto que conviene destacar es que cada vez existen más estudios que demuestran que las cifras de las yodurias en niños en edad escolar (grupo clásicamente evaluado en estudios poblacionales) no son representativas de todos los grupos de edad, especialmente de las mujeres gestantes y lactantes, grupos especialmente vulnerables de sufrir un TDY. Estudios comparativos en Tailandia y China reflejaron que, al estudiar un grupo de escolares y sus madres embarazadas, los primeros presentaban un nivel óptimo de yodo mientras que sus madres eran, en su mayoría, yododeficientes51,52. Por lo tanto, las cifras de yodurias en rango de normalidad encontradas recientemente en adultos y niños españoles podrían no ser correlativas con los valores de las mujeres gestantes españolas, con el riesgo fetal que eso conlleva. En nuestro estudio realizado en niños entre 3 y 14 años, comprobamos que el grupo de 11 a 14 años (edad puberal) presentaba una mediana de yoduria de 100μg/l (RIC 58,00–145,00), límite de la yododeficiencia, siendo muy inferior a la de los niños más jóvenes, entre 3–6 años, con una yoduria de 148,50 (RIC 95,00–230,75) μg/l; P < 0,001. Aunque no encontramos diferencias entre el consumo de SY y alimentos ricos en yodo en ambos grupos de edad y por lo tanto desconocemos la causa exacta de este hallazgo, el hecho de que niñas en edad puberal presenten yodurias en el límite de la deficiencia, exponiéndose a un serio riesgo de daño cerebral fetal en caso de un posible embarazo, resulta altamente preocupante49.
Autoría/colaboradoresTodos los autores participaron en el diseño y realización del trabajo. La Dra. García-Ascaso se ha encargado de la redacción del mismo y las Dras. Ros y Ares Segura de la revisión de su contenido intelectual.
Todas las autoras revisaron y aprobaron la versión final para su publicación, así como su envío para publicación. Todas las autoras declaran que no existen fuentes de financiación y que el artículo no ha sido enviado a ninguna otra revista. Asimismo, declaran que se cede a Endocrinología, Diabetes y Nutrición la propiedad intelectual del trabajo, así como el derecho a permitir la reproducción de datos o ilustraciones en otras publicaciones.
Conflicto de interesesLas autoras declaran no tener ningún conflicto de intereses.