Los pacientes con obesidad, con frecuencia, tienen dificultad para adherirse a una dieta baja en calorías durante largos períodos de tiempo. Una de las causas del fracaso dietético es la sensación continua de hambre. La grelina es un péptido orexígeno, secretado por células enterocromafines del fundus gástrico.
El objetivo de este estudio fue analizar las variaciones de los valores plasmáticos de grelina tras PENS del dermatoma T6 asociado a dieta hipocalórica, así como la modificación del apetito y la pérdida de peso, comparándolo con un grupo control en el que solo se pautó una dieta hipocalórica.
Material y métodosRealizamos un estudio prospectivo no aleatorizado, incluyendo 20 pacientes sometidos a PENS del dermatoma T6, asociado a dieta hipocalórica, como tratamiento previo a ser sometidos a una técnica de cirugía bariátrica y con el fin de reducir peso (grupo 1), y 20 pacientes a los que se les pautó exclusivamente dieta hipocalórica previa a la intervención quirúrgica (grupo 2). En el grupo 1 se analizaron los niveles de grelina plasmática en 5 momentos diferentes del procedimiento: antes de realizar la primera sesión de PENS (muestra 1a), al finalizar la primera sesión de PENS (muestra 1b), antes de realizar la última sesión de PENS (muestra 2a), al finalizar la última sesión de PENS (muestra 2b) y un mes después de haber finalizado el tratamiento (muestra 3). En el grupo 2 se obtuvieron solo 2 muestras, antes de comenzar la dieta (muestra 1) y tras 12 semanas de dieta (muestra 2).
ResultadosTras 12 semanas de tratamiento se observó una pérdida de IMC del 8,42±2,6% en el grupo 1 y del 1,32±0,98% en el grupo 2 (p=0,007). En el grupo 1 se apreció un descenso significativo de los valores de grelina entre las muestras 1a y 2a, y entre las muestras 1a y 3. En el grupo 2 se observó un aumento no significativo de los niveles de grelina entre las muestras 1 y 2.
ConclusiónEl PENS del dermatoma T6 se asoció con una disminución en los valores de grelina plasmática. Esta terapia, asociada a una dieta hipocalórica, consigue una pérdida de IMC superior al 8% en 12 semanas de tratamiento.
Obese patients often find it difficult to adhere to long-term low-calorie diets. One of the reasons for dietary failure is the permanent feeling of hunger. Ghrelin is an orexigenic hormone, secreted by enterochromaffin cells in the gastric fundus.
The aim of this study was to analyze changes in plasma ghrelin levels after PENS of dermatome T6 associated to a low-calorie diet, as well as changes in appetite and weight loss, as compared to a control group on a low-calorie alone.
Material and methodsA prospective, non-randomized study was conducted including 20 patients who underwent PENS of dermatome T6 associated to a low-calorie diet before undergoing bariatric surgery to lose weight (Group 1), and 20 patients who were only prescribed a low-calorie diet before surgery (Group 2). In Group 1, plasma ghrelin levels were measured at 5 timepoints: before the first PENS session (Sample 1a); after the first PENS session (Sample 1b); before the last PENS session (Sample 2a); after the last PENS session (Sample 2b); and one month after treatment completion (Sample 3). In Group 2, only two samples were collected: before the start of the diet (Sample 1) and after 12 weeks of diet (Sample 2).
ResultsAfter 12 weeks of treatment, BMI decreases of 8.42%±2.6% and 1.32%±0.98% were seen in Group 1 and Group 2 respectively (p=0.007). A significant decrease was seen in ghrelin levels between samples 1a and 2a, and between samples 1a and 3. In Group 2, a non-significant increase was seen in ghrelin levels.
ConclusionPENS of dermatome T6 was associated to decreased plasma ghrelin levels. This therapy, associated to a low-calorie diet, achieves a BMI reduction greater than 8% after 12 weeks of treatment.
Alrededor de un tercio de la población en los países desarrollados es obesa en algún grado, y más de la mitad tiene al menos sobrepeso. La obesidad en sí es un factor de riesgo para la salud que influye en el desarrollo y la progresión de diversas enfermedades, tales como dislipidemia, la cardiopatía isquémica, la hipertensión, la diabetes mellitus tipo 2 y el síndrome de apnea-hipoapnea del sueño, empeorando así la calidad de vida de los pacientes, limitando sus actividades y causando problemas psicosociales. Existe una relación directa entre el índice de masa corporal (IMC), la morbilidad y los riesgos de mortalidad en los pacientes con obesidad, que se deriva de las enfermedades asociadas, haciendo de la obesidad una enfermedad en sí1–3.
El tratamiento dietético asociado con el ejercicio es el primer escalón terapéutico para la obesidad. Sin embargo, para que sea eficaz, la motivación del paciente es esencial. Los pacientes con obesidad, con frecuencia, tienen dificultad para adherirse a una dieta baja en calorías durante largos períodos de tiempo. Una de las causas del fracaso dietético es la sensación continua de hambre4.
La grelina es un péptido producido fundamentalmente por las células enterocromafines del fundus gástrico, cuya liberación está regulada por la hormona de crecimiento5. Estudios recientes han confirmado que la grelina tiene efecto orexígeno; estimula el apetito activando neuronas del núcleo arcuato del hipotálamo, donde se encuentra el centro regulador del apetito. A su vez, la grelina también produce un balance energético positivo, reduciendo el gasto metabólico basal y, por tanto, favoreciendo el depósito de lípidos6.
La electroestimulación percutánea (PENS) fue desarrollada originalmente para el tratamiento de la incontinencia urinaria y fecal, estimulando el nervio tibial posterior. Su mecanismo de acción consiste en la creación de un reflejo somatosomático (nervio tibial posterior, la vía aferente) que conduce el impulso eléctrico a la raíz S3, cuya vía eferente es el nervio pudendo, que es responsable de la inervación del esfínter anal7–9.
Sobre la base de la creación de un reflejo somatoautonómico la estimulación de las terminaciones nerviosas sensoriales situadas en el dermatoma T6 puede causar un reflejo, para las cuales las vías eferentes terminan en las ramas del nervio vago que estimulan la pared gástrica de manera similar al marcapasos gástrico. Un estudio previo de nuestro grupo10 concluyó que la PENS del dermatoma T6 estaba asociada con una reducción del apetito, y que junto con una dieta apropiada conseguía mayores pérdidas de peso que los pacientes que solo realizaban dieta.
El objetivo de este estudio fue analizar las variaciones de los valores plasmáticos de grelina tras PENS del dermatoma T6, asociado a dieta hipocalórica, así como la modificación del apetito y la pérdida de peso, comparándolo con un grupo control, al que se pautó dieta hipocalórica exclusivamente.
Material y métodosSe llevó a cabo un estudio prospectivo no aleatorizado, incluyendo 40 pacientes. Se seleccionaron pacientes candidatos a cirugía bariátrica y en lista de espera para la misma. Dado que la mayoría de pacientes sometidos a cirugía bariátrica son mujeres, se decidió incluir solamente mujeres para obtener una cierta homogeneidad en la muestra. Las 20 primeras pacientes consecutivas fueron sometidas a PENS del dermatoma T6, asociado a dieta hipocalórica (1.200Kcal/día) (grupo 1) y a las 20 pacientes siguientes se les pautó exclusivamente la dieta hipocalórica (grupo 2). No hubo apareamiento entre grupos. Ambas medidas se pautaban como tratamiento previo a ser sometidos a una técnica de cirugía bariátrica y con el fin de reducir peso y, así, el riesgo quirúrgico. Los criterios de inclusión fueron pacientes con IMC>40kg/m2 o IMC>35kg/m2 con comorbilidades asociadas con la obesidad. Los criterios de exclusión fueron enfermedades endocrinológicas causantes de la obesidad y/o enfermedades psiquiátricas graves.
Evaluación de candidatosLos pacientes candidatos a ser incluidos en el estudio siguieron los mismos criterios de selección que los pacientes que van a ser sometidos a cirugía bariátrica, dado que estos sujetos estaban programados para someterse a cirugía tras el tratamiento. Los posibles candidatos fueron evaluados por un equipo multidisciplinar integrado por cirujanos, endocrinólogos, psiquiatras, psicólogos, anestesiólogos, endoscopistas, radiólogos y enfermeras especializadas. Se explicó a los pacientes que iban a someterse a un procedimiento bariátrico después de terminar el tratamiento y que la reducción de peso es esencial para minimizar el riesgo quirúrgico.
Metodología de electroestimulación percutáneaLa PENS del dermatoma T6 fue realizada por los cirujanos del Hospital General Universitario de Elche. Se utilizó el dispositivo Urgente PC 200 Neuromodulation System® (Uroplasty, Minnetonka, MN, EE. UU.), el cual fue desarrollado originalmente para el tratamiento de la incontinencia fecal y urinaria. Los participantes se sometieron a una sesión de 30minutos cada semana durante 12 semanas consecutivas. Cada paciente fue colocado en posición supina sin anestesia y se le aplicó la PENS mediante un electrodo y una aguja que se inserta en el cuadrante superior izquierdo abdominal, a lo largo de la línea medioclavicular, 2cm por debajo del reborde costal en un ángulo de 90° hacia la pared abdominal a una profundidad de aproximadamente 0,5-1cm. El éxito de la colocación fue confirmado por la sensación de movimiento o sensación eléctrica al menos 5cm más allá del punto de inserción de la aguja. La PENS se llevó a cabo a una frecuencia de 20Hz en el mayor voltaje (0-20mA) tolerado por el paciente sin causar dolor.
DietaLa dieta hipocalórica pautada tenía un valor calórico de 1.200Kcal/día. La dieta era equilibrada y seguía los patrones de dieta mediterránea, con abundante ingesta de frutas y verduras y baja de carnes, siendo el aceite de oliva la principal fuente de lípidos (tabla 1). Esta dieta es el protocolo habitual que se pauta a los pacientes candidatos a cirugía bariátrica, 3 meses antes de la intervención. Una vez iniciada la dieta esta debía cumplirse hasta el día previo a la cirugía en ambos grupos. El control de la adherencia a la dieta y los posibles problemas con su cumplimiento fueron evaluados por la nutricionista del centro mediante visitas mensuales a su consulta.
Dieta de 1200kcal que seguirán todos los pacientes incluidos en el estudio
| Desayuno |
| Leche desnatada (200ml) o 2 yogures naturales |
| Pan integral (20g) o 3 galletas |
| Media mañana |
| Fruta (100g): manzana, pera, naranja, melocotón o kiwi |
| Comida y cena |
| Primer plato a elegir: |
| Verduras (200g): espinacas, acelgas, berenjenas, berros, escarola, lechuga, coliflor, champiñones, puerros, espárragos, col, pepinos, pimientos, tomates, alternando cocidas o en ensalada o 150g de judías verdes, remolacha, zanahorias, alcachofas o coles de Bruselas |
| Sopa de verdura |
| Sopa de pasta, sémola, arroz o almidón de tapioca (15g en seco) |
| Segundo plato a elegir: |
| Pescado (120g) |
| Pollo, pavo, conejo, ternera (100g) |
| Un huevo |
| Postre a elegir: |
| Fruta (100g): manzana, pera, naranja, melocotón o kiwi |
| o (200g): melón, sandía o fresas |
| Pan (30g) |
| Merienda: |
| Leche desnatada sola: 200ml, con café o té |
| Aceite de oliva: 30ml en todo el día (2 cucharadas soperas) |
| Valores medios de hidratos de carbono 51%; proteínas 23%; grasas 26% |
En el grupo 1 se extrajeron muestras sanguíneas en 5 momentos diferentes del procedimiento:
- -
Inmediatamente antes de realizar la primera sesión de PENS (muestra 1a).
- -
Al finalizar la primera sesión de PENS «efecto pico» (muestra 1b).
- -
Inmediatamente antes de realizar la última sesión de PENS «efecto valle» (muestra 2a).
- -
Al finalizar la última sesión de PENS (muestra 2b).
- -
Un mes después de haber finalizado las 12 sesiones de PENS «efecto residual» (muestra 3).
En el grupo 2 se extrajeron solo 2 muestras sanguíneas:
- -
Antes de comenzar la dieta (muestra 1).
- -
Tras 12 semanas de tratamiento dietético (muestra 2).
Dado que el tratamiento dietético no se suspendió en ningún momento previo a la cirugía, no tenía sentido extraer una 3.ª muestra a las 16 semanas.
Las muestras fueron extraídas por la misma enfermera en todos los casos, con amplia experiencia en la toma de muestras sanguíneas en pacientes obesos mórbidos, bajo condiciones de asepsia y antisepsia. Las muestras se extrajeron en tubos de EDTA con inhibidor de proteasas, se centrifugaron a 2.500rpm durante 20minutos y de ahí se extrajo la fracción de plasma, que se congeló a –80°C hasta su análisis posterior, según los protocolos instaurados por el servicio de análisis clínicos del centro.
VariablesSe creó un protocolo específico para la recogida de datos de este estudio. Se registraron:
- -
Variables sociodemográficas: edad, sexo y comorbilidades.
- -
Variables antropométricas: peso, IMC, porcentaje de IMC perdido. Estas variables se registraron antes y después de finalizar la terapia.
- -
La percepción del dolor después de PENS fue evaluada al finalizar la primera sesión de PENS mediante Escala visual analógica (EVA) (0: ausencia de dolor-10: dolor insoportable).
- -
Se registraron complicaciones secundarias a PENS: dolor, infección…
- -
El apetito fue evaluado con una EVA que osciló entre 0 (ausencia de la percepción) a 10 (percepción máxima). El apetito se investigó antes de comenzar el tratamiento y después de terminar las 12 sesiones.
- -
Se determinaron los valores de grelina plasmática en 5 muestras sanguíneas en el grupo 1 y en 2 muestras en el grupo 2, extraídas en diferentes momentos del proceso.
El análisis estadístico se realizó con el programa estadístico SPSS 19.0 para Windows. Las variables cuantitativas que seguían una distribución normal fueron definidas por la media y la desviación estándar. Para las variables no gaussianas se utilizaron mediana y rango. Las variables cualitativas se definen por el número y porcentaje de casos.
Se realizó una comparación de las variables intragrupos mediante la prueba ANOVA para muestras repetidas con análisis post-hoc y ajuste para comparaciones múltiples. Para la comparación entre grupos se utilizaron la prueba «t» de Student para datos independientes y el test de Mann-Whitney.
Se llevó a cabo una comparación de las variables cualitativas mediante la prueba de Chi-cuadrado; en los casos con menos de 5 observaciones en la célula se utilizó el método de probabilidad exacta de Fisher. Se consideraron significativos los valores de p<0,05.
El estudio fue aprobado por el Comité Ético de Investigación Clínica Local (código CEIC-HGUE 2013/7) y todos los pacientes firmaron un documento de consentimiento informado, aceptando su participación en el estudio.
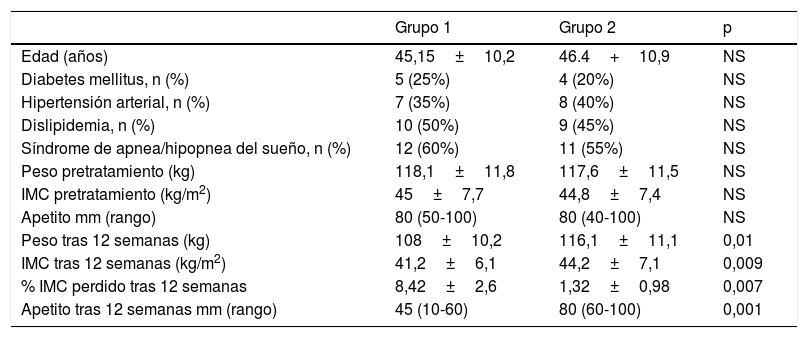
ResultadosSe incluyeron 20 mujeres en cada grupo. No hubo pérdidas en el seguimiento y se analizaron las 40 pacientes. Las variables antropométricas y el apetito en cada grupo, antes y después del tratamiento, se muestran en la tabla 2.
Comparación entre grupos de valores antropométricos y apetito, antes y después del tratamiento
| Grupo 1 | Grupo 2 | p | |
|---|---|---|---|
| Edad (años) | 45,15±10,2 | 46.4+10,9 | NS |
| Diabetes mellitus, n (%) | 5 (25%) | 4 (20%) | NS |
| Hipertensión arterial, n (%) | 7 (35%) | 8 (40%) | NS |
| Dislipidemia, n (%) | 10 (50%) | 9 (45%) | NS |
| Síndrome de apnea/hipopnea del sueño, n (%) | 12 (60%) | 11 (55%) | NS |
| Peso pretratamiento (kg) | 118,1±11,8 | 117,6±11,5 | NS |
| IMC pretratamiento (kg/m2) | 45±7,7 | 44,8±7,4 | NS |
| Apetito mm (rango) | 80 (50-100) | 80 (40-100) | NS |
| Peso tras 12 semanas (kg) | 108±10,2 | 116,1±11,1 | 0,01 |
| IMC tras 12 semanas (kg/m2) | 41,2±6,1 | 44,2±7,1 | 0,009 |
| % IMC perdido tras 12 semanas | 8,42±2,6 | 1,32±0,98 | 0,007 |
| Apetito tras 12 semanas mm (rango) | 45 (10-60) | 80 (60-100) | 0,001 |
| Grupo 1 | Grupo 2 | P | |
|---|---|---|---|
| Diabetes mellitus N (%) | 5 (25%) | 4 (20%) | NS |
| Hipertensión arterial N (%) | 7 (35%) | 8 (40%) | NS |
| Dislipemia N (%) | 10 (50%) | 9 (45%) | NS |
| Síndrome de apnea/hipopnea del sueño N (%) | 12 (60%) | 11 (55%) | NS |
NS: no significativo.
La mediana de percepción del dolor después de PENS de dermatoma T6 fue 1 (rango 0-2). No hubo complicaciones en ninguno de los pacientes.
Tras finalizar el tratamiento solo se observaron cambios de peso significativos en el grupo 1 (p=0,029), no así en el grupo 2. Igualmente, solo se apreció un descenso significativo del apetito en el grupo 1 (p<0,001).
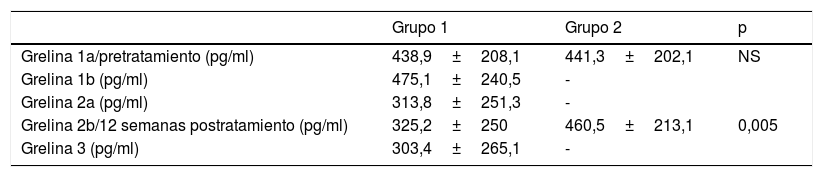
Los valores de grelina en las diferentes determinaciones en ambos grupos se muestran en la tabla 3. En el grupo 1 se observó un ascenso no significativo entre las muestras 1a y 1b. Se apreció una disminución media de los valores de grelina de 125,1pg/ml entre las muestras 1a y 2a (IC 95%: 67,448-182,885; p<0,001); del mismo modo que si comparamos la muestra 1a con 3, es decir, un mes tras haber finalizado el tratamiento, se observó una disminución media de 135,5pg/ml (IC 95%: 48,370-214,163; p=0,004). Tampoco se observaron diferencias significativas entre las muestras 2a y 2b.
Valores de grelina en las diferentes muestras de ambos grupos
| Grupo 1 | Grupo 2 | p | |
|---|---|---|---|
| Grelina 1a/pretratamiento (pg/ml) | 438,9±208,1 | 441,3±202,1 | NS |
| Grelina 1b (pg/ml) | 475,1±240,5 | - | |
| Grelina 2a (pg/ml) | 313,8±251,3 | - | |
| Grelina 2b/12 semanas postratamiento (pg/ml) | 325,2±250 | 460,5±213,1 | 0,005 |
| Grelina 3 (pg/ml) | 303,4±265,1 | - |
NS: no significativo.
En el grupo 2 solo se observó un aumento no significativo de los valores de grelina entre las muestras 1 y 2.
En ninguno de los 2 grupos se alcanzó una correlación estadísticamente significativa entre los valores de grelina y la cuantificación del apetito, ni entre el descenso en los niveles de grelina y la pérdida de peso.
DiscusiónEn el presente estudio el PENS del dermatoma T6 asociado a una dieta hipocalórica consigue un descenso de los valores de grelina, que se mantienen disminuidos hasta al menos un mes tras haber finalizado el tratamiento. Así mismo, el PENS del dermatoma T6 consigue una pérdida de peso significativa, lo que no se alcanza con el tratamiento dietético exclusivamente. No se observan correlaciones estadísticamente significativas entre la grelina y el apetito, ni entre los cambios tras el tratamiento y la pérdida de peso, si bien el tamaño muestral es pequeño.
El efecto del PENS ha sido ampliamente demostrado por la neuroestimulación del nervio tibial posterior en el tratamiento de la incontinencia urinaria y fecal, creando un reflejo somato-somático7–9. Nuestro grupo ya fue el primero en demostrar la aplicación de la PENS del dermatoma T6 para reducir el apetito y conseguir una pérdida de peso10.
Pereira y Foster11 observaron una pérdida de peso superior al 20% asociada a una disminución del apetito en 2 pacientes con obesidad mórbida en los que los estimuladores de la médula espinal se establecieron a nivel T6 y T7 para controlar el dolor lumbar intratable y la radiculitis lumbosacra secundaria a una hernia discal lumbar. Estos pacientes no aumentaban su actividad física ni seguían ningún tipo de dieta; sin embargo, experimentaron reducciones significativas del apetito. Los autores fueron los primeros en plantear la hipótesis de que la estimulación de la médula espinal podría afectar el estómago. Otros autores han reportado que la estimulación gástrica eléctrica transcutánea puede alterar la motilidad gástrica, retrasar el vaciado gástrico y dar lugar a la saciedad posprandial12–14. Ellos creían que la estimulación eléctrica se transmitía al estómago a través de la pared abdominal al colocar el electrodo en el cuadrante superior izquierdo del abdomen. Sin embargo, pensamos que es más probable que el efecto se produzca por la creación de un reflejo somatoautonómico, en lugar de por la transmisión transcutánea de los estímulos eléctricos, similar a la estimulación eléctrica transcutánea del nervio tibial posterior en el tratamiento de la incontinencia15.
Por otra parte, es difícil creer que el impulso eléctrico pueda tener algún efecto cuando se atraviesa una pared abdominal del espesor que está presente en pacientes con obesidad mórbida, especialmente teniendo en cuenta la presencia de tejido adiposo, que no es un buen conductor eléctrico. Los mismos autores también han postulado que el efecto de la estimulación gástrica, que está asociada con el retraso del vaciado gástrico, también podría disminuir la secreción de grelina en el fundus gástrico e inhibir el apetito a través del sistema nervioso central12–14. Chen16 informó de que la estimulación eléctrica gástrica con un marcapasos gástrico puede afectar el sistema nervioso central mediante la segregación de las hormonas en el estómago y la regulación de la saciedad y/o apetito, con la implicación particular de la grelina en este mecanismo. Basándonos en estos postulados, llevamos a cabo nuestro estudio para corroborar la implicación de dicha hormona en el mecanismo de estimulación-saciedad-pérdida de peso tras PENS T6.
En nuestra muestra se observó que el apetito era menor después de someterse al tratamiento con PENS, que lógicamente estaba asociado a una pérdida de peso. No analizamos el efecto aislado del PENS sin dieta, pero esta terapia en sí no justifica una pérdida de peso relevante. Como se muestra en el estudio previo llevado a cabo por nuestro grupo10, su principal efecto es la reducción del apetito; todos los pacientes presentaron menores sensaciones de hambre o incluso la ausencia de la misma después de PENS de dermatoma T6.
En el presente estudio observamos que el apetito disminuía después de someterse a PENS del dermatoma T6, y se conseguía una pérdida de IMC del 8,42%, datos similares a los de nuestro estudio inicial. De igual forma se determinó un descenso significativo en la cuantificación del apetito, que descendió de 80 a 45mm según la EVA, confirmando también los datos previos. Y como en el caso anterior, la técnica no se percibió como tratamiento doloroso y no hubo complicaciones asociadas. En estos pacientes no pudimos observar la evolución de la pérdida de peso a medio-largo plazo, más allá de un mes, dado que aprovechando el beneficio de la pérdida de peso conseguida fueron intervenidos seguidamente de un procedimiento bariátrico. Sin embargo, un estudio de seguimiento a un año de PENS T6 en pacientes obesos leve-moderados o con sobrepeso demostró que el peso perdido no se recuperaba 12 meses tras haber finalizado la terapia17.
En lo referente a los niveles de grelina plasmáticos se objetivó una disminución significativa en todos los pacientes sometidos a PENS del dermatoma T6, desde los valores basales hasta los obtenidos al finalizar el tratamiento (muestra 2a), así como manteniendo valores disminuidos un mes tras haber finalizado dicha estimulación (muestra 3). A pesar de que el pequeño tamaño muestral del estudio no permite correlacionar los niveles de grelina con la cuantificación del apetito, el descenso de esta sensación asociado al descenso en los valores tras la estimulación sugiere que este pudiera ser un mecanismo de actuación de esta terapia. Un estudio recientemente publicado ha demostrado que la PENS del dermatoma T6 aislada consigue una reducción de los niveles de grelina y una ligera pérdida de peso. Sin embargo, cuando la PENS T6 se asocia con una dieta hipocalórica es cuando se produce el descenso de peso significativo18.
Las principales limitaciones del presente estudio son el pequeño tamaño muestral, la ausencia de grupo control sometido a dieta sin PENS T6 o a PENS T6 sin dieta, y la falta de seguimiento a medio-largo plazo. Por todo ello, deben llevarse a cabo más estudios y con mayor número de pacientes para confirmar estos resultados.
ConclusiónEl PENS del dermatoma T6 se asoció con una disminución en los valores de grelina plasmática y una disminución en el apetito. Esta terapia asociada a una dieta apropiada consigue una pérdida de IMC superior al 8% en 12 semanas de tratamiento.
FinanciaciónPara la realización de este estudio se recibió financiación de la Fundación Navarro Tripodi (beca de investigación 2018-12).
Conflicto de interesesNinguno.