La presencia de diabetes (tipos 1 y 2) incrementa el riesgo de enfermedad cardiovascular aterosclerótica. A pesar de un control metabólico adecuado y un tratamiento de los factores de riesgo vascular hasta alcanzar los objetivos recomendados por las guías clínicas, el riesgo cardiovascular residual de algunos pacientes con diabetes puede ser muy elevado. Es necesario por ello estratificar de la forma más precisa posible el riesgo vascular del paciente individual.
Estrategias consolidadas para mejorar el pronóstico de los pacientes son la reducción agresiva del colesterol LDL, el control de la presión arterial, la consecución del mejor control posible de la HbA1c, sin inducir hipoglucemias, la utilización de fármacos hipoglucemiantes con beneficio cardiovascular y el empleo de antiagregantes en los pacientes de mayor riesgo inicial.
Estrategias emergentes para pacientes con riesgo muy alto o extremo serían la utilización de fármacos destinados a reducir las lipoproteínas ricas en triglicéridos y la inflamación.
Presence of diabetes (types 1 and 2) increases the risk of atherosclerotic cardiovascular disease. Despite adequate metabolic control and treatment of vascular risk factors until the goals recommended by the clinical practice guidelines are achieved, residual cardiovascular risk may be very high in some patients with diabetes.
Stratifying the vascular risk for each patient as precisely as possible is therefore necessary.
Consolidated strategies to improve patient prognosis include aggressive reduction of LDL cholesterol, blood pressure control, achievement of the best HbA1c control possible without inducing hypoglycemia, use of hypoglycemic drugs shown to have cardiovascular benefits, and use of platelet aggregation inhibitors in patients with greater initial risk.
Emerging strategies for patients with very high or extreme risk would include use of drugs intended to decrease triglyceride-rich lipoproteins and inflammation.
La presencia de diabetes mellitus (DM), tanto tipo 1 como tipo 2, incrementa el riesgo de aparición de enfermedad cardiovascular (ECV) aterosclerótica1,2. El riesgo se triplica a nivel arterial periférico y aproximadamente se dobla a nivel coronario o cerebrovascular3.
La intensidad del tratamiento de los factores de riesgo (FR) vascular debe adecuarse al riesgo inicial (R) del paciente, definido como la probabilidad de aparición de ECV aterosclerótica en un determinado periodo de tiempo (generalmente 10 años). En epidemiología, para la medición del ritmo de aparición de ECV, se utiliza la tasa de incidencia (TI) expresada como número de eventos por cada 1.000 pacientes-año. Ambas magnitudes (R y TI) pueden relacionarse de modo aproximado (R ≈ TI×duración del seguimiento) o de modo exacto (R=1 – e–TI×duración). Por ello un R promedio del 20% en los próximos 10 años sería aproximadamente el de una población con una TI de 20/1.000 pacientes-año.
Es importante unificar la nomenclatura para estratificar el riesgo de ECV aterosclerótica de los pacientes. Será necesario establecer tanto el tipo de evento vascular a considerar como los puntos de corte que definirán las distintas categorías de riesgo. Las guías europeas de prevención cardiovascular (CV)4 utilizan la mortalidad CV, mientras que las guías americanas AHA/ACC5 se basan en los eventos «duros» (evento vascular mayor [infarto de miocardio o ictus fatal o no fatal] [MACE), definidos como la suma de infarto de miocardio (IAM) e ictus fatales y no fatales. El R de MACE es aproximadamente el triple que el de mortalidad CV, aunque en ancianos sería el doble, ya que a medida que avanza la edad la ECV aterosclerótica es con mayor frecuencia fatal4. En la tabla 1 se estratifican las categorías de riesgo según las recomendaciones de ambas sociedades.
Clasificación del riesgo de enfermedad cardiovascular aterosclerótica según el tipo de evento vascular considerado
| R (% en 10 años) | MACE (guías AHA/ACC) | MCV (guías ESC/EAS) |
|---|---|---|
| Bajo | <7,5 (entre 5 y 7,5 puede considerarse en el límite entre bajo y moderado) | <1 |
| Moderado | 7,5-19 | 1-4 |
| Alto | 20-29 | 5-9 |
| Muy alto | ≥ 30 | ≥ 10 |
MACE: evento vascular mayor (infarto de miocardio o ictus fatal o no fatal); MCV: mortalidad cardiovascular; R: riesgo o probabilidad de aparición del evento considerado expresado en porcentaje en un plazo temporal de 10 años.
Elaboración propia.
Para comparar la magnitud de la diferencia del riesgo de ECV entre pacientes con DM (R1) y sin DM (R0) se utilizan medidas de asociación (riesgo relativo [RR]) y de impacto (diferencia absoluta de riesgo). El RR mide la fuerza de la asociación (RR=R1/R0), mientras que la diferencia de riesgos (DR) expresa el riesgo vascular de los sujetos con DM que es debido a la propia presencia de la DM (DR=R1 – R0). Un RR alto puede asociarse a una DR baja y viceversa, por lo que ambas medidas pueden considerarse complementarias.
En esta revisión se define riesgo CV residual (RCVR)6 como el R de ECV aterosclerótica que persiste en los pacientes con DM tras aplicar en ellos el estándar de cuidado recomendado por las guías de práctica clínica7. Debido a la extensión limitada, no se aborda el problema de la insuficiencia cardiaca, y la única ECV evaluada será aquella de origen aterosclerótico.
Riesgo de enfermedad cardiovascular aterosclerótica en el paciente con diabetesLa diabetes mellitus como potencial equivalente de riesgo coronarioExisten enfermedades que por sí mismas podrían ser definitorias de un riesgo vascular alto, entre las que se incluye la DM4. No obstante, la conveniencia de adjudicar a la DM un riesgo equiparable al de la ECV establecida ha sido ampliamente criticada. Estudios observacionales en población finlandesa8-10 sugerían la posibilidad de que la DM pudiese considerarse un equivalente de riesgo coronario, con similar mortalidad CV en DM tipo 1 y tipo 2. Estos hallazgos no se han replicado de forma universal, y un metaanálisis que comparó específicamente el riesgo de IAM en pacientes con DM tipo 2 sin IAM previo con el de pacientes con IAM previo sin DM11 obtuvo un riesgo más bajo (odds ratio [estimación del riesgo relativo en modelos de regresión logística] [OR]=0,56; IC del 95%: 0,53-0,60) en los pacientes con DM.
El RR observado en los estudios puede depender de la edad de los pacientes, del tiempo de evolución de la DM y del nivel socioeconómico de la población. Para delimitar mejor el RR «promedio» conferido por la DM podemos fijarnos en los resultados de los grandes metaanálisis, el del Emerging Risk Factors Collaboration (ERFC)12,13 y el Prospective Studies Collaboration and Asia Pacific Cohort Studies Collaboration (PSC)14. Ambos reflejan que el riesgo de ECV es aproximadamente del doble en personas con DM, así como que las tasas de mortalidad CV de los pacientes con DM quedarían encuadradas en la categoría del riesgo muy alto. Es interesante destacar que en ambos metaanálisis el aumento de RR fue más marcado en mujeres y en las personas de menor edad. El metaanálisis del PSC además estableció que la DM aumentaba el riesgo de mortalidad CV también en pacientes con ECV establecida (hazard ratio [estimación del riesgo relativo en modelos de Cox] [HR]=1,85; IC del 95%: 1,69-2,03).
Riesgo de enfermedad cardiovascular en el paciente con diabetes mellitus en el momento actualLa mejora en la atención sanitaria ha condicionado una tendencia temporal decreciente en las TI de ECV15. Datos recopilados en Estados Unidos16 entre 1990 y 2010, han demostrado en pacientes con DM reducciones en las TI de IAM del 67,8% (14,1 vs. 4,5/1.000) y de ictus del 52,7% (11,2 vs. 5,3/1.000). Dado que los descensos en las tasas han sido mayores en pacientes con DM que en población general, la tendencia es hacia una disminución del RR conferido por la presencia de DM comparando los años 1990 y 2010 (3,8 vs. 1,8 para IAM y 3,1 vs. 1,5 para ictus). Adicionalmente, se ha demostrado una reducción a lo largo de los años en la TI de hospitalizaciones por ECV17 en Suecia, tanto en DM tipo 1 como en DM tipo 2. Sin embargo, en países con menor renta per cápita la DM todavía más que triplica el riesgo de ECV18.
Para definir mejor el R actual en ambos tipos de DM19,20, pueden consultarse los datos del registro de diabetes nacional sueco (NDR), el cual tiene incluidos a prácticamente todos los pacientes con DM de Suecia. Los pacientes con DM tipo 2 presentaban tan solo un ligero aumento de mortalidad CV (HR=1,14; IC del 95%: 1,13-1,15). Como era de esperar, las TI aumentaban con la edad (desde 2,2 en menores de 55 años hasta 47,2/1.000 en mayores de 75 años). Muy importante es resaltar que las HR se atenuaban con la edad (desde el triple en menores de 55 años hasta prácticamente la igualdad en mayores de 75 años), por lo que los pacientes más jóvenes son los que podrían necesitar mayor intensificación de los esfuerzos terapéuticos.
En los pacientes con DM tipo 1 del mismo registro sueco (edad media de 35,8 años, tiempo de evolución de la enfermedad de 20,4 años y HbA1c media de 8,2%), el aumento del riesgo de mortalidad CV (HR=4,60; IC del 95%: 3,47-6,10) era muy marcado, sobre todo en mujeres y en los pacientes de menor edad. Es de destacar que, aunque las HR eran superiores cuanto peor era el control metabólico y cuanto más avanzada era la afectación renal, incluso los sujetos con HbA1c<7% y con normoalbuminuria tenían un riesgo multiplicado aproximadamente por 3.
Un mensaje importante a resaltar es que el menor RR producido por la DM en la actualidad, respecto a décadas anteriores, debe interpretarse como una consecuencia favorable de la aplicación de las recomendaciones terapéuticas contemporáneas.
Riesgo en diabetes mellitus tipo 2 versus tipo 1En los estudios referenciados10,19,20 se ha comprobado que hay relación directa entre HbA1c y ECV, pero la pendiente es más pronunciada en DM tipo 1. Esto puede deberse a que en la DM tipo 1 el FR predominante es la hiperglucemia21, mientras que en la DM tipo 2 tienen además protagonismo otros FR vascular asociados a resistencia insulínica22. De hecho, a igualdad de edad, tiempo de evolución y control glucémico, la DM tipo 2 se asocia con mayor riesgo de mortalidad CV23 y de aparición de complicaciones crónicas24 que la DM tipo 1. La morfología de las lesiones coronarias también puede diferir, con mayor proporción de placas no calcificadas tendentes a la rotura en la DM tipo 2 que en la DM tipo 1 (a igualdad de calcio coronario)25.
El metaanálisis del PSC14 demostró una asociación positiva entre riesgo de ECV y niveles de colesterol, presión arterial (PA) e índice de masa corporal (IMC). Aunque el RR conferido por estos FR era bastante similar independientemente de la presencia de DM, la DR era mayor en los pacientes con DM debido a su mayor R inicial. Tanto en DM tipo 2 como en DM tipo 1 se ha comprobado que, cuanto mejor es el control de los FR vascular (HbA1c, PA, tabaquismo, excreción de albúmina urinaria y colesterol unido a lipoproteínas de baja densidad [cLDL]), menor es el riesgo de ECV26,27.
El mejor control de los FR ha redundado en un descenso de la TI de ECV en los pacientes con DM28. No obstante, debido al R elevado, el RVCR en el paciente con DM puede ser todavía importante.
Estratificación del riesgo de enfermedad cardiovascular aterosclerótica en el paciente con diabetesCriterios para estratificar el riesgo vascularLos grandes metaanálisis y estudios poblacionales sirven para establecer el R promedio de la presencia de DM, pero no el R de cada paciente particular, que puede ser muy variable. Se hace preciso estratificar el R inicial de los pacientes para perfilar mejor la intensidad de las intervenciones terapéuticas4,7. Hay que considerar varios aspectos importantes.
- 1.
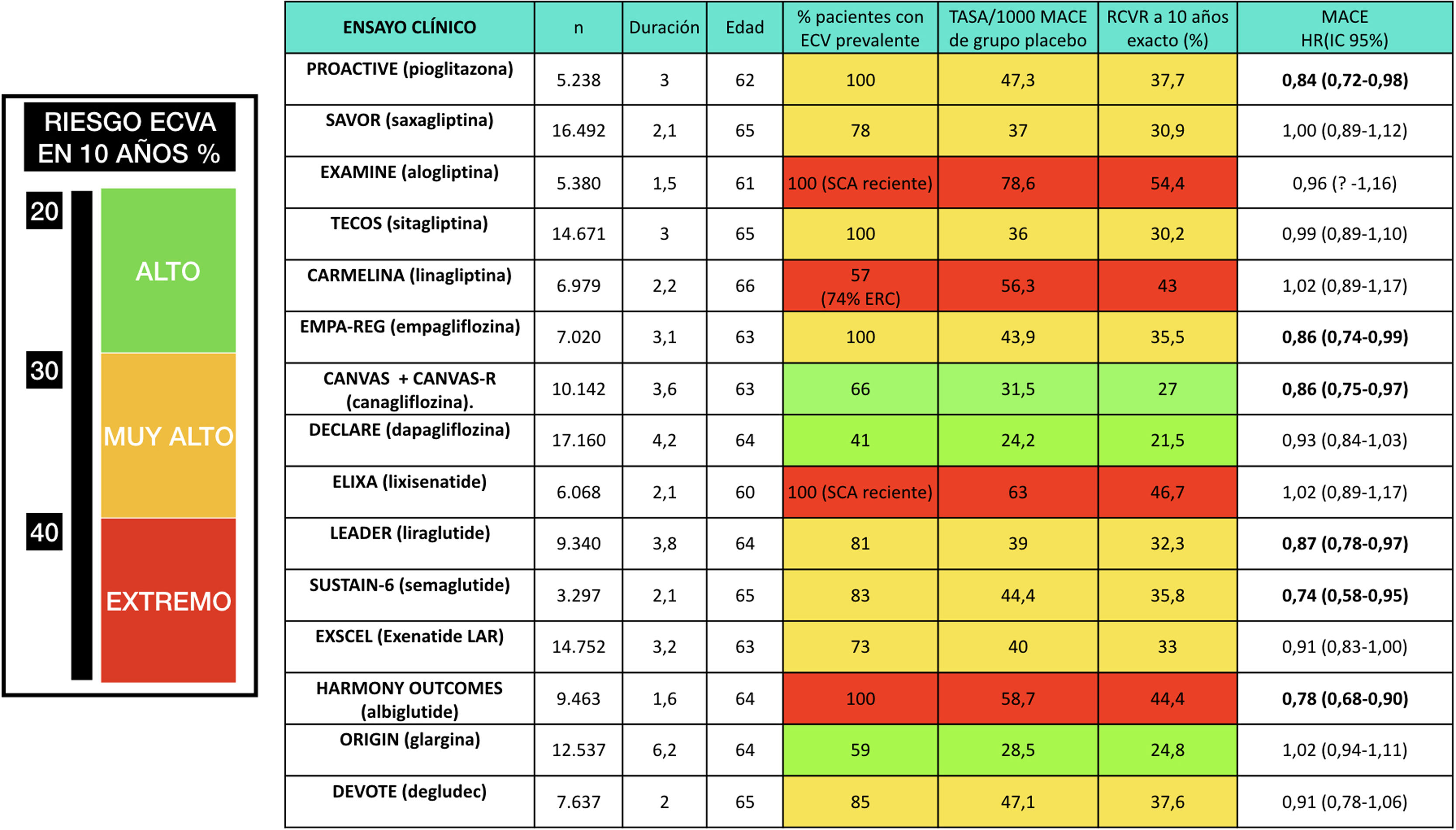
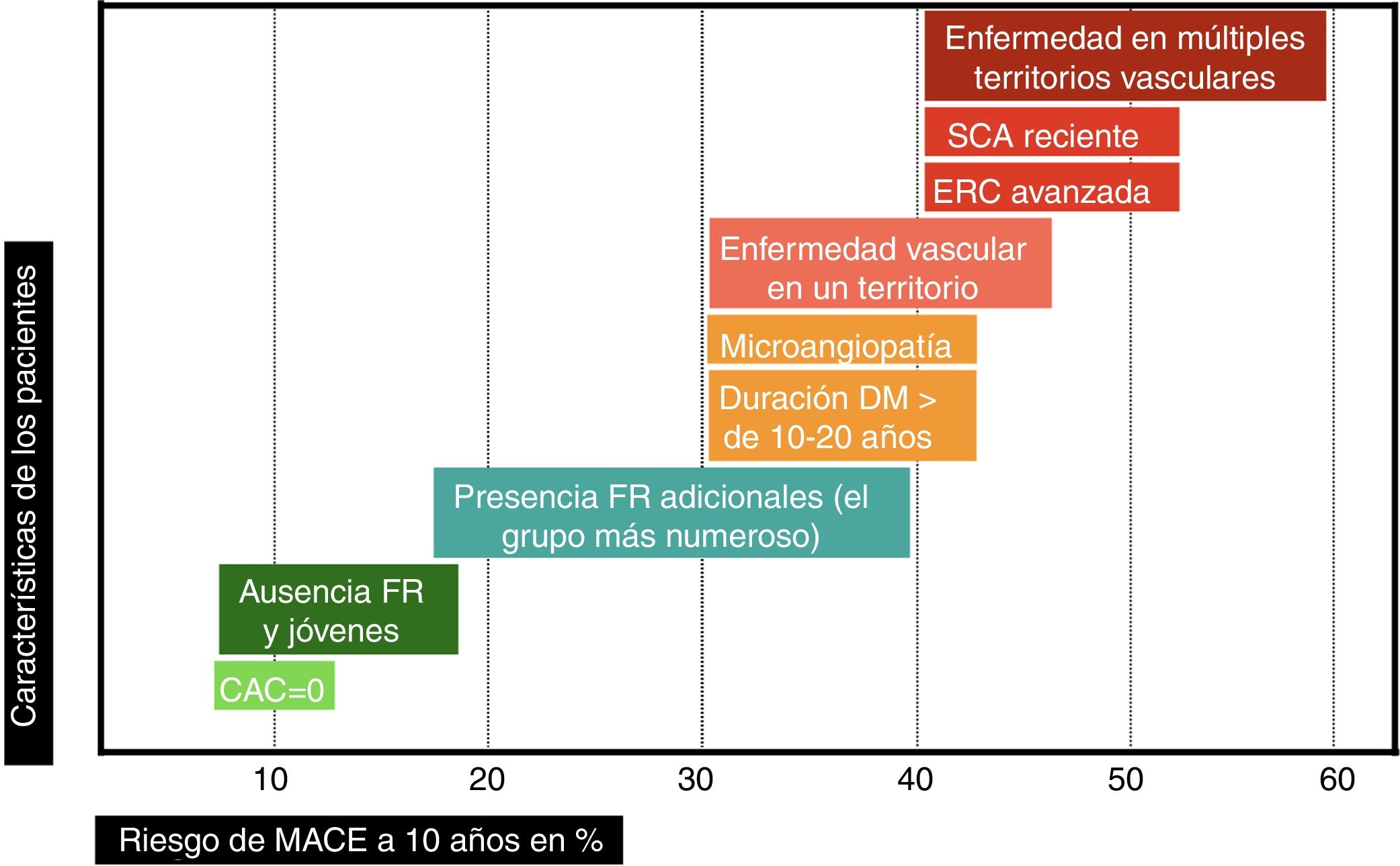
Puede haber pacientes con un R que supere muy ampliamente el umbral del muy alto riesgo. En el antiguo estudio de Haffner et al.8, los pacientes con DM e IAM previo tenían una TI de MACE de 112/1.000 (R exacto en 10 años del 67%) y de mortalidad CV de 73/1.000 (R exacto en 10 años del 52%). A pesar de aplicar el estándar de cuidado recomendado por las guías en el momento actual, los grupos placebo de los ensayos de seguridad CV de fármacos hipoglucemiantes, publicados recientemente, demuestran un RCVR muy elevado; las TI de MACE han oscilado entre 24,2 y 78,6/1.000, dependiendo de los criterios de inclusión de los pacientes (fig. 1). Este hecho justifica la definición de una categoría de riesgo extremo, con umbral no consensuado, pero que podría aplicarse a un R de MACE en 10 años ≥ 40% o de mortalidad CV ≥ 15%. Sí que hay recomendaciones29 acerca de los grupos que podrían considerarse de riesgo extremo: pacientes con ECV o con enfermedad renal crónica avanzada, los cuales han demostrado el R más elevado en los ensayos clínicos30. Afinando al máximo posible la estratificación, en la cúspide de esta categoría de riesgo extremo estarían aquellos pacientes con DM que han padecido un síndrome coronario agudo (SCA) reciente y presentan afectación de múltiples territorios vasculares (fenotipo vascular maligno), los cuales en el ensayo IMPROVE-IT31 experimentaron una TI de MACE de 72/1.000 a pesar de alcanzar cifras de cLDL<70mg/dl.
Figura 1.Ensayos de seguridad cardiovascular de fármacos hipoglucemiantes con el porcentaje de pacientes con enfermedad cardiovascular (ECV) prevalente. Se resaltan en negritas los resultados estadísticamente significativos. El riesgo cardiovascular residual (RCVR) en 10 años de eventos vasculares mayores (MACE) se extrapola a partir de la tasa de incidencia (TI) con la fórmula R=1 – e−TI×duración.
Elaboración propia.
(0.54MB). - 2.
En el paciente con DM hay otras condiciones que hacen que, directamente, pueda considerársele de muy alto riesgo vascular (y en algún caso incluso de riesgo extremo): enfermedad microvascular o larga duración de la DM (> 10 años en DM tipo 2 o>20 años en DM tipo 1)5. La gravedad de la lesión microvascular32-34 y el número de territorios microvasculares afectados se asocia con aumento progresivo del riesgo de MACE y mortalidad CV. Se ha comprobado que añadir en los modelos predictivos información acerca de la extensión de la alteración microvascular mejora la clasificación de R del paciente35.
- 3.
En los sujetos que no cumplan los criterios anteriores, una estrategia es considerarlos al menos de alto riesgo vascular. Para perfilar mejor si el R es realmente moderado, alto o muy alto, será útil emplear fórmulas de estratificación de riesgo7 que ponderen el resto de FR. Las ecuaciones específicas para DM no son perfectas. Recientemente, se ha comprobado que la ecuación de riesgo RECODe36 (https://sanjaybasu.shinyapps.io/recode/), basada en el estudio ACCORD, y validada externamente con datos del estudio Look AHEAD, mejora la discriminación del riesgo de MACE y mortalidad CV respecto a las ecuaciones derivadas del UKPDS y las recomendadas por la AHA/ACC5, sobre todo por identificar mejor a los pacientes de menor riesgo. La nueva ecuación QRISK3 (https://qrisk.org/three/) incluye entre sus parámetros37 la presencia de DM tipo 1.
- 4.
Si se quiere identificar con precisión al pequeño grupo de sujetos de riesgo bajo o moderado, habría que utilizar pruebas más complejas. En general, la medición del calcio arterial coronario (CAC) se considera más válida que la determinación de la proteína C reactiva (PCR) para reclasificar el riesgo de las personas en prevención primaria38. En un metaanálisis de 8 estudios39 con 5 años de seguimiento en pacientes con DM, una puntuación de<10 de CAC (28,5% de los pacientes) redujo la probabilidad estimada de MACE del 19 al 2,5%. Las guías AHA/ACC5 contemplan la posibilidad de evitar el tratamiento con estatinas en sujetos con CAC de 0 dado su buen valor predictivo negativo, aunque reconocen que podría ser menos fiable en el contexto de DM. Hay que tener además en cuenta que el riesgo se eleva con la duración de la DM, por lo que sería necesario repetir de modo periódico la determinación de CAC. En la cohorte de pacientes con DM tipo 1 de Pittsburgh40, hubo aumento de riesgo de ECV a medida que aumentaba el volumen de CAC, el cual mejoró la predicción de riesgo; además, los pacientes que incrementaban su volumen de CAC entre 2 exploraciones separadas por 4-8 años triplicaban su riesgo de ECV.
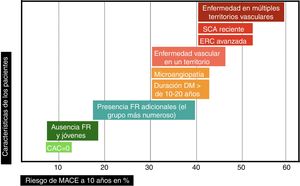
Puede pues deducirse de lo anteriormente expuesto que la clasificación del riesgo vascular en 2 categorías (prevención primaria y secundaria) es excesivamente simple. El riesgo vascular podría representarse como una línea continua (fig. 2), y hay variables que, en función de su número e intensidad, emplazarán al paciente en un punto concreto de dicha línea. Cuanto mayor sea el R inicial, y a pesar de la reducción de RR alcanzado con las intervenciones de prevención CV, mayor será el RCVR y por ello la necesidad de implementar estrategias preventivas más agresivas, las cuales se analizarán a continuación.
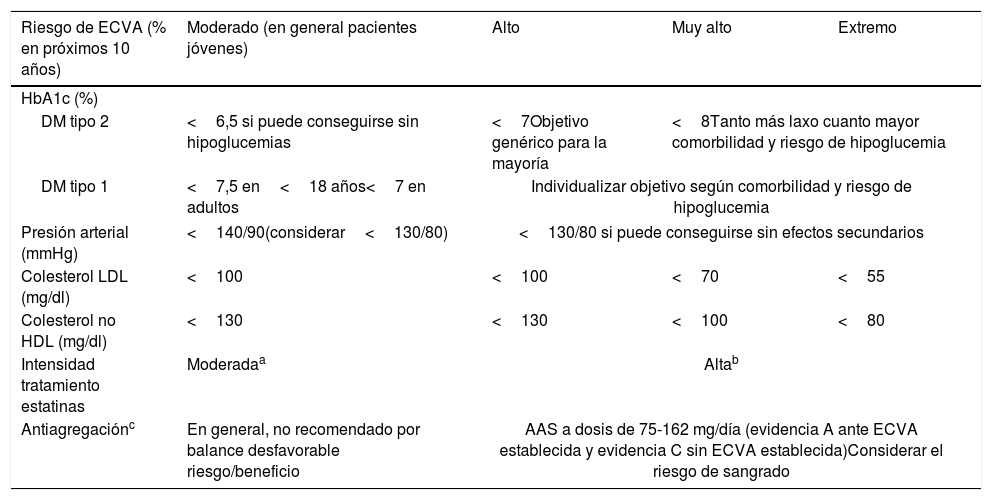
Estrategias terapéuticas para reducir el riesgo cardiovascular residual del paciente con diabetesEstrategias consolidadasUn resumen de las estrategias recomendadas en prevención CV puede verse en la tabla 2.
Objetivos de control de los factores de riesgo vascular adaptados al riesgo de ECVA
| Riesgo de ECVA (% en próximos 10 años) | Moderado (en general pacientes jóvenes) | Alto | Muy alto | Extremo |
|---|---|---|---|---|
| HbA1c (%) | ||||
| DM tipo 2 | <6,5 si puede conseguirse sin hipoglucemias | <7Objetivo genérico para la mayoría | <8Tanto más laxo cuanto mayor comorbilidad y riesgo de hipoglucemia | |
| DM tipo 1 | <7,5 en<18 años<7 en adultos | Individualizar objetivo según comorbilidad y riesgo de hipoglucemia | ||
| Presión arterial (mmHg) | <140/90(considerar<130/80) | <130/80 si puede conseguirse sin efectos secundarios | ||
| Colesterol LDL (mg/dl) | <100 | <100 | <70 | <55 |
| Colesterol no HDL (mg/dl) | <130 | <130 | <100 | <80 |
| Intensidad tratamiento estatinas | Moderadaa | Altab | ||
| Antiagregaciónc | En general, no recomendado por balance desfavorable riesgo/beneficio | AAS a dosis de 75-162 mg/día (evidencia A ante ECVA establecida y evidencia C sin ECVA establecida)Considerar el riesgo de sangrado | ||
AAS: ácido acetilsalicílico; cLDL: colesterol unido a lipoproteínas de baja densidad; DM; diabetes mellitus; ECVA: enfermedad cardiovascular aterosclerótica; HDL: lipoproteínas de alta densidad; iPCSK9: inhibidores de PCSK9; LDL: lipoproteínas de baja densidad.
El metaanálisis del ERFC13 estimó que, a la edad de 50 años, la DM acortaba la expectativa de vida en 6 años, motivado en un 58% de los casos por un exceso de muertes CV. Más llamativa es la situación en la DM tipo 1, la cual aparece frecuentemente a edades tempranas de la vida; datos del NDR sueco avalan que, cuanto más precoz es su aparición, mayor es el número de años perdidos atribuibles a la DM (hasta 16 años en pacientes diagnosticados antes de los 10 años de edad)41.
Hay consenso en las guías4,5,7,29,42 en la necesidad de un manejo multifactorial y agresivo de los FR vascular en el paciente con DM tipo 2 adaptado al R de ECV. Además, ha crecido el reconocimiento de la necesidad de realizar también un tratamiento precoz de los FR vascular en el paciente con DM tipo 1 para retrasar el umbral de aparición de ECV43.
Los objetivos a alcanzar de cLDL son cada vez más estrictos29. Datos recogidos de estudios de aleatorización mendeliana, de estudios epidemiológicos y de ensayos clínicos, han permitido extrapolar que una reducción de cLDL de 40mg/dl produce una disminución de RR de ECV de un 10% durante el primer año de tratamiento, de un 20-25% después de 5 años de tratamiento y de más de un 50% tras 40 años de tratamiento44. Cuanto mayor sea el R inicial, a igualdad de reducción de RR, mayor será la DR alcanzada, y por ello menor el número de pacientes que es necesario tratar (NNT) para obtener un beneficio (NNT=1/DR).
Los objetivos de control de PA han sido controvertidos en la última década. Un metaanálisis reciente45 ha sugerido que el beneficio del descenso agresivo de la PA es mayor en pacientes sin DM que con DM. No obstante, en pacientes con DM, un descenso adicional de PA sistólica de 10mmHg, incluso por debajo de 130mmHg, produjo una disminución significativa del RR de MACE (HR=0,81; IC del 95%: 0,70-0,94) y de ictus (HR=0,74; IC del 95%: 0,59-0,92), aunque no de enfermedad coronaria o mortalidad CV. Las nuevas guías americanas46 y europeas47 apuestan por una estrategia adaptada al R de ECV, con objetivo de PA<130/80mmHg en DM. La ADA7 sugiere un nivel de PA<130/80mmHg para pacientes con un R>15% si se tolera sin efectos secundarios. Un aspecto importante es la insistencia en la necesidad de utilizar la monitorización ambulatoria, o bien la automedición domiciliaria, de PA para el diagnóstico de hipertensión y para la titulación del tratamiento.
Tratamiento antiagregantePacientes con diabetes mellitus y efermedad cardiovascular ateroscleróticaHay indicación formal de tratamiento antiagregante con 75-162mg/día de ácido acetilsalicílico (AAS) en pacientes con DM y ECV establecida7. El tratamiento dual (AAS+inhibidor de P2Y12) es necesario el primer año tras un SCA y puede ser razonable más allá de este periodo en sujetos con un RCVR muy alto y sin características que incrementen el riesgo de sangrado48. En el ensayo49 Pegasus-TIMI 54 (sujetos con IAM entre 1 y 3 años antes y en más de un 50% de los casos con enfermedad multivaso), los pacientes con DM aleatorizados a ticagrelor+AAS experimentaron un menor riesgo de MACE (HR=0,84; IC del 95%: 0,72-0,99; DR –5/1.000 pacientes-año) balanceado con un mayor riesgo de sangrado (HR=2,56; IC del 95%: 1,52-4,33; DR+5/1.000 pacientes-año).
Pacientes con diabetes mellitus sin efermedad cardiovascular ateroscleróticaEn pacientes con DM pero sin ECV establecida, el metaanálisis de Zhang et al.50 determinó que el tratamiento con AAS podía disminuir el riesgo de IAM preferentemente en varones (HR=0,71; IC del 95%: 0,50-1,00) y el de ictus en mujeres (HR=0,67; IC del 95%: 0,48-0,92). En el recientemente publicado ASCEND51 (pacientes con DM tipo 2 de 7 años de evolución, sin ECV, y tratados en un 75% de los casos con estatinas), la administración de AAS vs. placebo durante 7,4 años redujo el riesgo de MACE (HR=0,88; IC del 95%: 0,79-0,97; DR –1,5/1.000 pacientes-año), pero también a expensas de un aumento del riesgo de sangrado (HR=1,29; IC del 95%: 1,09-1,52; DR+1,2/1.000 pacientes-año).
Puede concluirse diciendo que, en pacientes sin ECV establecida, con un RCVR (estimado tras el tratamiento óptimo del resto de FR vascular) superior al 10% en 10 años, el número de eventos vasculares evitados por el tratamiento antiagregante será superior al de sucesos hemorrágicos inducidos. Podrían así ser tributarios a tratamiento con AAS los pacientes con DM sin ECV si se clasifican como de muy alto riesgo vascular; si pertenecen a la categoría de alto riesgo será necesaria una selección cuidadosa, evaluando la posibilidad de sangrado, para optimizar el balance riesgo/beneficio.
Importancia de la reducción del peso corporalEn pacientes con DM tipo 2 debe intentarse una reducción del peso corporal de>5% mediante dieta hipocalórica y ejercicio físico52. Aunque el estudio Look AHEAD fue interrumpido por falta de eficacia en reducción de ECV, los pacientes del grupo de intervención tuvieron menor necesidad de utilización de estatinas, hipotensores e insulina. En un análisis secundario53, los sujetos que consiguieron perder ≥ 10% del peso corporal sí que lograron una disminución significativa del riesgo de ECV (HR=0,79; IC del 95%: 0,64-0,98). Aunque un descenso de peso del 5% ya es saludable, una reducción>10% puede ser más beneficiosa.
Siempre hay que pensar en la posibilidad de la cirugía metabólica en pacientes con DM tipo 2 asociada a IMC 35-40 kg/m2 (e incluso en el futuro podría llegar a considerarse entre 30 y 35 si hubiese disponibilidad de recursos sanitarios), ante un control de FR inadecuado a pesar de tratamiento médico optimizado52. En un estudio observacional reciente, con 4,7 años de seguimiento, hubo reducción del riesgo de ECV (HR=0,60; IC del 95%: 0,42-0,86) en pacientes con DM tipo 2 e IMC>35 kg/m2 que fueron tratados quirúrgicamente (76% con bypass gástrico)54.
En pacientes con DM tipo 1 es importante minimizar el impacto del tratamiento intensivo sobre el peso corporal. Los participantes en el grupo intensivo del DCCT que exhibieron mayor incremento de peso durante el ensayo (entrando en el rango de obesidad), experimentaron a partir de los 14 años de seguimiento más eventos vasculares que los que mantuvieron un peso prácticamente estable, igualando sus tasas a las del grupo convencional55. Es decir, los beneficios del buen control glucémico pueden perderse si este se asocia a aumento progresivo de peso.
Importancia de la selección del tratamiento hipoglucemianteLa selección del tratamiento hipoglucemiante debe intentar evitar el incremento de peso y la posibilidad de hipoglucemias52. Aunque no hay prueba definitiva para tener la certeza de si la hipoglucemia es realmente un factor causal de mortalidad CV, o simplemente un marcador de pacientes frágiles con mayor riesgo de fallecer, un metaanálisis con evaluación de la posibilidad de sesgos llegó a la conclusión de que la hipoglucemia grave duplicaba el riesgo de ECV (HR=2,05; IC del 95%: 1,74-2,42; fracción atribuible poblacional 1,56%) y de que la asociación observada difícilmente podía justificarse plenamente por la confusión producida por las comorbilidades asociadas56. Además, un metaanálisis de estudios con monitorización continua de glucemia de pacientes con DM tipo 1 y tipo 2 ha comprobado que la hipoglucemia, sobre todo nocturna, conduce a prolongación del intervalo QT y a una reducción de la variabilidad de la frecuencia cardiaca, ambos marcadores de muerte súbita57.
Los últimos años han asistido a la publicación de numerosos ensayos de seguridad CV, que han modificado la práctica clínica al demostrar beneficios adicionales de algunos fármacos más allá de su efecto sobre el control glucémico (fig. 1). Los grupos terapéuticos que de modo más consistente han demostrado beneficio CV son los agonistas del receptor de GLP1 (ARGLP1) y los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2), y por ello son de elección en pacientes con ECV establecida52. Como puede observarse en la figura 1, no todos los integrantes de estos grupos terapéuticos han obtenido resultados significativos, siendo la fuerza de la evidencia mayor para liraglutida y empagliflozina52.
Un metaanálisis58 de ARGLP1 (incluidos liraglutida, semaglutida, exenatida y lixisenatida pero no albiglutida) ha comprobado que, en promedio, la reducción del riesgo de MACE (HR=0,90; IC del 95%: 0,82-0,99) y de mortalidad CV (HR=0,87; IC del 95%: 0,79-0,96) es significativa. La mayoría de los pacientes tenían ECV establecida. El efecto significativo de unos miembros de la clase (liraglutida, semaglutida, albiglutida) pero no de otros (exenatida, lixisenatida) podría atribuirse a su diferente potencia, duración de acción, estructura molecular y formulación (relacionada esta última con la adherencia).
Un metaanálisis59 de iSGLT2 (incluidos empagliflozina, canagliflozina y dapagliflozina) también comprobó una reducción del riesgo de MACE (HR=0,89; IC del 95%: 0,83-0,96) y de mortalidad CV (HR=0,84; IC del 95%: 0,75-0,94) estadísticamente significativo, además de un efecto marcadamente favorable sobre el riesgo de insuficiencia cardiaca y progresión de la enfermedad renal. Un hallazgo interesante es que en análisis estratificado, el efecto beneficioso sobre MACE y mortalidad CV se producía solo en pacientes con ECV establecida. También relevante es el hecho de que en pacientes con ECV inicial, el descenso del riesgo de mortalidad CV era más intenso y solo significativo con empagliflozina, en cuyo ensayo estaban los pacientes con mayor R inicial (TI de mortalidad CV del grupo placebo en ensayo EMPA-REG: 20,2/1.000; TI placebo en CANVAS: 16,8/1.000; TI placebo en DECLARE: 11,6/1.000). Con los iSGLT2, la heterogeneidad de resultados puede atribuirse posiblemente más a las características iniciales de los pacientes que a diferencias entre las moléculas: a mayor R inicial mayor beneficio sobre la reducción de ECV.
Finalmente debemos reseñar que, aunque no destacado en las guías recientes, la pioglitazona también ha demostrado efectos saludables sobre la progresión de la ECV. Una selección cuidadosa de pacientes (indicación preferente ante resistencia a la insulina elevada o esteatosis hepática no alcohólica), que maximice los beneficios de pioglitazona y minimice sus efectos secundarios (osteoporosis, insuficiencia cardiaca), podría ayudar a ampliar su uso en el futuro60.
Estrategias emergentes para reducir el riesgo cardiovascular residual en escenarios de riesgo muy alto o extremoProbablemente, en el futuro asistiremos a nuevas posibilidades terapéuticas para erosionar de modo progresivo el RCVR de la DM.
Detección de los pacientes en los que el tratamiento intensivo de la glucemia puede optimizar el balance riesgo-beneficioEn este sentido, en ACCORD61 se han identificado 2 variantes genéticas que incrementan el riesgo de mortalidad CV ante un tratamiento intensivo. De hecho, tratar intensivamente a 1.000 sujetos de alto riesgo genético puede producir 38 muertes vasculares y prevenir 8 IAM, mientras que el mismo tratamiento en sujetos de bajo riesgo genético prevendría 14 muertes vasculares y 30 IAM.
Consecución de un colesterol LDL cuanto más bajo mejorLos inhibidores de PCSK9 (iPCSK9) logran descensos de cLDL del 50-70% y han demostrado en prevención secundaria reducciones de eventos vasculares de aproximadamente un 15%, con eficacia similar en pacientes con y sin DM62. Su eficacia clínica por unidad de cambio de cLDL es similar a la de las estatinas44. Además, no parece haber un umbral de cLDL por debajo del cual ya no haya beneficio: en FOURIER, los sujetos que alcanzaron un cLDL<10mg/dl fueron los que tuvieron la menor TI de MACE sin aumento de efectos adversos63. Cuanto mayor sea el RCVR más coste-efectiva5 será la utilización de iPCSK9. La ADA recomienda añadir ezetimiba o iPCSK9 al tratamiento con estatinas en pacientes con DM y ECV establecida ante un cLDL>70mg/dl7.
Actuación sobre la dislipidemia aterogénicaPuede definirse como una alteración que aglutina hipertrigliceridemia, descenso de colesterol unido a lipoproteínas de alta densidad (cHDL), predominio de partículas de LDL densas y aumento de colesterol asociado a lipoproteínas ricas en triglicéridos (cLRT). Este fenotipo lipídico contribuye al RCVR en pacientes en los que se ha logrado el objetivo de cLDL64, ya que las partículas de LRT y sus remanentes pueden ser incluso más aterogénicas que las de LDL. Las intervenciones terapéuticas, revisadas por Sandesara et al.65, serían:
- –
Utilización de fibratos. No se recomienda de modo general, pero podría indicarse en pacientes con triglicéridos ≥ 204mg/dl y cHDL ≤ 34mg/dl7. La respuesta definitiva a su potencial utilidad puede venir del ensayo PROMINENT, que evaluará la eficacia de pemafibrato asociado a estatinas en pacientes con DM y dislipidemia mixta.
- –
Utilización de ácidos grasos omega-3. Aunque los resultados han sido hasta la actualidad controvertidos, recientemente se ha publicado el ensayo REDUCE-IT, en el que una formulación de ácido eicosapentanoico (icosapent ethyl), a la dosis de 4 g al día, administrada a pacientes con ECV o DM, y con triglicéridos entre 150 y 500mg/dl, obtuvo una reducción significativa del riesgo de MACE en los pacientes con DM (HR=0,77; IC del 95%: 0,68-0,87). Los efectos beneficiosos pueden deberse a la alta dosis utilizada y a un efecto antitrombótico66.
- –
Terapias destinadas a mejorar el metabolismo de las LRT: fármacos anti-Apo-C III (volanesorsen) y antiangiopoyetina-3 (evinacumab).
- –
Fármacos antiapolipoproteína A, que han conseguido reducciones de hasta un 92% de Lp(a).
Aunque los marcadores inflamatorios (PCR, interleucina [IL]-6) tienen escasa utilidad predictiva en pacientes sin ECV38, hay datos en pacientes con DM que indican que pueden predecir eventos en aquellos con ECV establecida67. En este aspecto es muy importante un hallazgo en el ensayo Fourier, mostrando que el riesgo de ECV se incrementaba cuando aumentaban los valores de PCR, aunque los sujetos alcanzasen un cLDL<20mg/dl68.
La utilidad de actuar sobre la inflamación se ha confirmado en estudios específicos de intervención. En el ensayo CANTOS, la administración de canakinumab (anticuerpo monoclonal frente a IL-1ß) a pacientes con IAM previo (40% de ellos con DM) y PCR>2mg/l redujo en un 15% el riesgo de MACE, similar en pacientes con y sin DM. Lo más interesante es que el beneficio clínico estuvo relacionado con los niveles de PCR alcanzados: solo ante la consecución de una PCR<2mg/l se redujo significativamente el riesgo de MACE (HR=0,75; IC del 95%: 0,66-0,85) y de mortalidad CV (HR=0,69; IC del 95%: 0,56-0,85)69. La inflamación crónica favorece la progresión de la aterosclerosis y aumenta la vulnerabilidad de la placa a la rotura, por lo que es plausible que tratamientos destinados a corregirla aporten beneficio CV, como indican Kottoor y Arora70.
Conclusiones: puntos clave en la evaluación y manejo del riesgo cardiovascular residualDe la revisión de la epidemiología de la ECV aterosclerótica en la DM se desprende que:
- 1.
Tanto la DM tipo 1 como la tipo 2 incrementan el riesgo de aparición de ECV.
- 2.
Existe una relación clara entre el mejor control de los FR vascular que se ha producido en las últimas décadas y la reducción del RR conferido por la presencia de DM.
- 3.
A pesar de la consecución de los objetivos de control recomendados por las guías de práctica clínica, el RCVR de los pacientes con DM puede permanecer muy elevado.
Como recomendaciones para reducir el RCVR podemos destacar:
- 1.
Implementar una estratificación cuidadosa del riesgo vascular del paciente individual, teniendo en cuenta que cuanto mayor sea su R mayor será su eventual RCVR remanente. Especialmente importante será detectar pacientes de riesgo muy alto o incluso extremo (sobre todo aquellos con ECV establecida o enfermedad microvascular).
- 2.
Luchar contra la inercia clínica, que podría retrasar la consecución de los objetivos recomendados por las guías.
- 3.
Utilizar las estrategias terapéuticas disponibles que han demostrado eficacia en los ensayos clínicos, adaptadas a las características de los pacientes. Entre ellas destacan el empleo de fármacos hipoglucemiantes con beneficio CV específico (ARGLP1 e iSGLT2) y la reducción intensiva del cLDL (con el empleo de iPCSK9 si fuese necesario).
- 4.
Continuar la investigación en campos prometedores para disminuir el RCVR. Estrategias emergentes para pacientes con riesgo muy alto o extremo serían la utilización de fármacos destinados a reducir las lipoproteínas ricas en triglicéridos y la inflamación.