Los anticuerpos antiperoxidasa tiroidea (ATPO) en la gestación pueden influir en el desarrollo de hipotiroidismo subclínico gestacional (HSG). Ambas entidades parecen asociarse a complicaciones maternas y fetales. Los objetivos de este estudio son analizar si existe relación entre los valores de TSH y ATPO durante el embarazo, los posibles efectos sobre complicaciones gestacionales y perinatales, y valorar si los ATPO detectables, pero no positivos, influyen en el desarrollo de HSG.
MetodologíaEstudio prospectivo realizado en el área sanitaria del Complejo Asistencial Universitario de León (CAULE), donde se realiza cribado universal para disfunción tiroidea gestacional entre la semana 7-13 de gestación. Se recogieron datos de TSH, ATPO, obstétricos y neonatales de los partos de 2016. Se considera ATPO positivo si≥35UI/ml. En estudio previo se estableció valor TSH>3,72 mU/L como corte para HSG.
ResultadosSe analizaron registros correspondientes a 1.980 partos en CAULE, 21 abortos y 18 partos fuera del centro. Se realizó cribado a 1.670 gestantes (84,34%): 142(8,50%) tuvieron ATPO positivos. La detección de ATPO positivo se asoció con el diagnóstico de HSG (p<0,01) y con media de TSH significativamente mayor (3,51 vs. 2,46mU/L; p=0,03). No encontramos diferencias significativas en las complicaciones gestacionales o neonatales. En el grupo con ATPO indetectable (<10Ul/ml) la media de TSH fue ligeramente inferior que en el grupo con valores de ATPO 10-35UI/ml, pero sin diferencias significativas (p=0,89).
ConclusiónLa presencia de ATPO positivo se asocia con valores de TSH más elevados y con mayor riesgo de HSG, pero no incrementa la tasa de complicaciones materno-fetales.
During pregnancy, thyroid peroxidase (TPO) antibodies may increase the risk of developing subclinical hypothyroidism (SCH). Both conditions appear to be associated to maternal-fetal complications. The objectives of this study were to analyze if a relationship exists between TSH and TPO levels during pregnancy and the potential effects on gestational and perinatal complications, and to assess whether detectable, but not positive, TPO levels have an impact on development of gestational SCH.
MethodsA prospective study was conducted at the Leon Health Area (CAULE), where universal screening for gestational thyroid dysfunction is performed between weeks 7-13 of pregnancy. Data on TSH and TPO levels and gestational and perinatal complications were collected for all 2016 deliveries. Positive TPO antibodies were defined as values≥35IU/mL. In a previous study, a TSH level>3.72mU/L was established as the cut-off value for gestational SCH.
ResultsRecords corresponding to 1,980 deliveries at CAULE, 21 abortions, and 18 deliveries outside the hospital were analyzed. Of the 1,670 pregnant women screened (84.34%), 142 (8.50%) had positive TPO antibodies and their presence was associated to diagnosis of SCH (P<0.01) and to significantly higher mean TSH levels (3.51mU/L vs. 2.46mU/L, P=0.03). There were no significant differences in gestational or neonatal complications. In the group with undetectable TPO antibodies (<10lU/mL), the mean TSH levels was slightly lower than in the group with TPO values ranging from 10-35 IU/mL, but the difference was not significant (P=0.89).
ConclusionPresence of positive TPO antibodies is associated to higher TSH levels and higher risk of gestational SCH, but does not increase the rate of maternal-fetal complications.
La presencia de anticuerpos antiperoxidasa tiroideos (ATPO) durante la gestación se ha postulado como un factor de riesgo de aborto y de parto prematuro1. En general, la presencia de autoinmunidad, incluso con función tiroidea normal es relativamente frecuente en las mujeres en edad fértil. La prevalencia de anticuerpos tiroideos en una muestra no seleccionada de mujeres oscila entre el 6-20%, cifra que aumenta al 17-33% si estudiamos a una población que ha tenido abortos, pérdidas fetales o partos prematuros2.
La causa más frecuente de aparición de hipotiroidismo en nuestro medio es la presencia de autoinmunidad. El hipotiroidismo clínico –definido como TSH elevada y T4l baja o TSH>10mU/L independientemente del valor de T4l– no tratado durante la gestación se asocia a complicaciones obstétricas, efectos negativos en el desarrollo neurocognitivo fetal, aumento del riesgo de parto prematuro y de aborto, y se ha relacionado también con bajo peso al nacer e hipertensión arterial gestacional3.
Si bien no se conoce con exactitud el mecanismo por el cual los ATPO alteran la función tiroidea durante la gestación se piensa que podría originarse por la existencia de una deficiencia leve en la disponibilidad de hormonas tiroideas cuando hay presencia de ATPO elevados y, por otra parte, que podría deberse a que la glándula tiroidea tenga menos capacidad de adaptación al aumento de la demanda de síntesis de hormonas tiroideas durante la gestación3.
Las recomendaciones generales iniciales establecían que el límite superior de TSH en las gestantes debía estar en 2,5mU/L en el primer trimestre y después en 3mU/L en el segundo y tercer trimestre4. Sin embargo, en los últimos años, diversos estudios han ido demostrando que el límite de referencia no debería ser tan estricto. Un estudio realizado en China y que incluyó a casi 5.000 pacientes demostró que el nivel de TSH más bajo ocurre entre las semanas 7-12 de gestación, pero que solo se redujo de 5,31 (valor normal fuera de gestación) a 4,34mU/L en esas semanas5. Otros estudios evidencian reducción de la T4l cuando la TSH se encuentra por encima de 4,8mU/L6. Por ello, la recomendación de las últimas guías de la Asociación Americana de Tiroides4 es utilizar el corte propio en la población de referencia (que sería aquella sin antecedentes de enfermedad tiroidea, con autoinmunidad negativa y con consumo de yodo adecuado) e incluso determina que, si no es posible tener niveles de referencia propios, se utilicen los arrojados por aquellos estudios de poblaciones de similares características. Estas últimas guías concluyen, basándose en los estudios más recientes, que de forma general el límite superior de la normalidad para la TSH asciende a 4mU/L en el primer trimestre, pero recomendando también que, en mujeres embarazadas con TSH>2,5mU/L, se evalúe la presencia de ATPO (y, en caso de ATPO positivos y TSH>2,5mUI/L –pero sin sobrepasar el corte de referencia propio–, debería considerarse tratar con levotiroxina)4.
La prevalencia de hipotiroidismo clínico durante la gestación varía entre 0,25-0,91% en estudios que abarcan más de 106 participantes, mientras que el diagnóstico de hipotiroidismo subclínico gestacional (HSG) aparece en un 3-10% de los embarazos, dependiendo del punto de corte3. No obstante, en estudios de población similares al área sanitaria de León, que es yodo-deficiente, la prevalencia de HSG (TSH>2,5mU/L) asciende hasta más del 30% de gestantes7. Hay que tener presente que asumir tal cantidad de pacientes es un reto importante tanto desde el punto de vista asistencial como de gestión clínica.
El cribado universal de disfunción tiroidea a la población gestante sigue siendo un tema de debate. En nuestro país, la Sociedad Española de Endocrinología y Nutrición (SEEN), en un documento conjunto con la Sociedad Española de Ginecología y Obstetricia (SEGO) recomiendan evaluar precozmente (antes de la décima semana de gestación) la función tiroidea en las embarazadas8. En el área sanitaria de León, el programa de cribado universal para la disfunción tiroidea gestacional fue implantado en mayo de 2013 por la sección de Endocrinología y Nutrición en colaboración con Obstetricia y las matronas de atención primaria. Respecto a este tema la Asociación Americana de Tiroides no se posiciona: expone que no hay suficiente evidencia para recomendar a favor o en contra del cribado universal, con la única excepción de mujeres en proceso de reproducción asistida o con el antecedente de ATPO positivos. No obstante, sí que recomienda estudiar a las gestantes con factores de riesgo para disfunción tiroidea4, es decir, aquellas con antecedentes personales de hipotiroidismo/hipertiroidismo o con síntomas/signos de disfunción tiroidea gestacional, con autoinmunidad positiva o presencia de bocio, con historia de radicación cervical o cirugía tiroidea, con edad>30 años, con historia personal de pérdida fetal, con abortos o prematuridad, con embarazos previos múltiples, con historia familiar de disfunción tiroidea, con obesidad mórbida (IMC≥40), con uso de amiodarona, litio o uso de contrastes yodados o que residan en un área yodo-deficiente.
Los objetivos de nuestro estudio fueron describir la situación de la disfunción tiroidea gestacional en el área sanitaria de León y valorar la influencia de los ATPO en la función tiroidea durante la gestación y su posible asociación con complicaciones materno-fetales.
Como objetivo secundario se quiso valorar si los ATPO detectables (10-35UI/ml), pero no considerados positivos, pueden influir en el desarrollo de HSG.
MetodologíaSe trata de un estudio prospectivo realizado en aquellas gestantes que dieron a luz en el Complejo Asistencial Universitario de León (CAULE) en el año 2016 registradas en la base de datos de partos del servicio de Ginecología y Obstetricia del CAULE y seguidas en la consulta de Endocrinología y Nutrición durante esa gestación.
Considerando la necesidad de disponer valores poblacionales propios, nuestro grupo había realizado en 2014 un estudio transversal para determinar el valor de TSH durante el periodo gestacional en el CAULE. El criterio de inclusión fue mujer sana, exenta de enfermedad previa y gestante entre la semana 8.a y 11.a. Los criterios de exclusión fueron: enfermedad tiroidea pregestacional, anomalía de la morfología tiroidea visible o palpable, sin ATPO detectables, hipotiroxinemia (VN T4l 0,9-1,7ng/dl), antecedentes de enfermedad tiroidea familiar, diabetes pregestacional o gestacional, cualquier enfermedad crónica previa a la gestación, reproducción asistida y toma de cualquier tratamiento farmacológico con posibilidad de afectar la función tiroidea. No se tuvo en cuenta el estado nutricional de yodo en las gestantes estudiadas. Para establecer los puntos de corte utilizados como referencia, se procedió a la normalización de la distribución de los valores de TSH mediante su transformación logarítmica para posteriormente establecer los intervalos de confianza para los percentiles 2,5 y 97,5.
Para este objetivo, desde diciembre 2013 a septiembre del año 2014, se incluyeron 1.023 gestantes en las 8-11.a semanas de gestación. Se excluyeron 289 gestantes por los criterios de exclusión arriba mencionados. El grupo final de población gestante sana sobre el que se calcularon los valores de referencia fue de 734. En estas gestantes se obtuvo un valor medio de TSH: 1,72(0,83)mU/L, con una mediana: 1,69mU/L. El valor de TSH fue de 0,33 mU/L para el percentil 2,5 y de TSH: 3,72mU/L para el percentil 97,5 que se tomaron como referencia para el primer trimestre de gestación (datos no publicados).
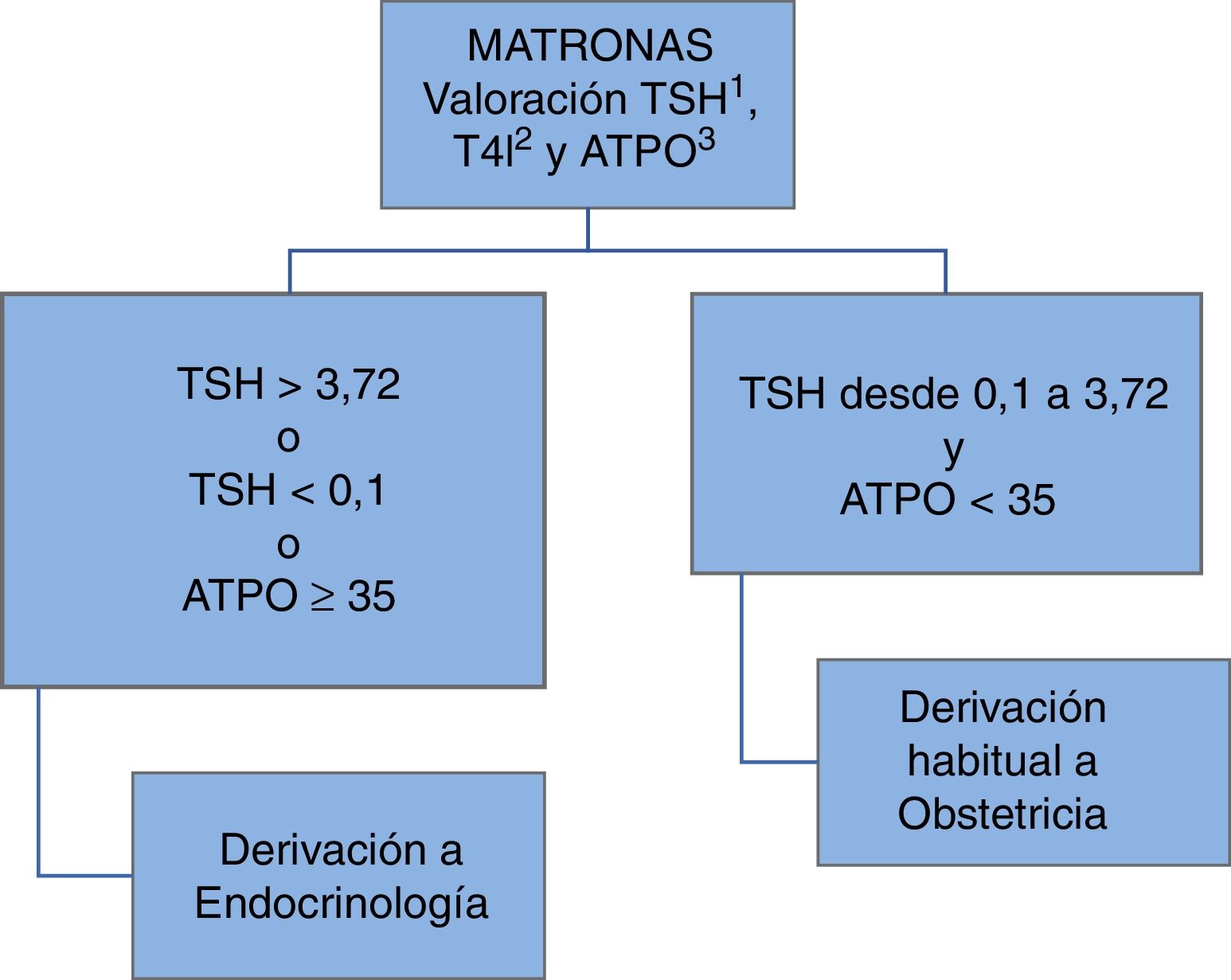
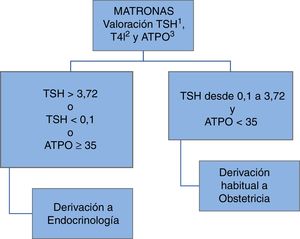
Desde mayo del 2013, en el área sanitaria de León se implantó un programa de cribado universal de la función tiroidea a todas las gestantes en colaboración con las matronas de atención primaria y el servicio de Ginecología y Obstetricia como se recoge en la figura 1.
Se excluyeron del presente estudio aquellas mujeres con tratamiento con tiroxina previamente a la gestación. Así, se recogieron los datos del cribado poblacional llevado a cabo entre la semana 7-13 de gestación obteniendo datos de: TSH, T4l y ATPO (inmunoanálisis de inmunoquimioluminiscencia (ECLIA), COBAS®. Roche Diagnostics).
A partir de la base de datos de Endocrinología se obtuvieron también la edad, peso, talla, tabaquismo materno, antecedentes familiares o personales de enfermedad tiroidea y de diabetes mellitus, consumo de suplementos vitamínicos durante el embarazo y su contenido en yodo, consumo de sal yodada y antecedentes obstétricos.
Respecto a los datos del parto registrados por Obstetricia, se anotó la edad gestacional, tipo de parto, peso del recién nacido y test de Apgar en el minuto 1 y el 5.
Los ATPO que se detectan en nuestro laboratorio con el test Cobas 6000 de Roche Diagnostics se consideran positivos si son iguales o superiores a 35UI/ml. No obstante, nuestro laboratorio detecta valores entre 10 y <35UI/ml, considerados como negativos.
Para la comparación de los pesos de los recién nacidos se usaron las medias de los neonatos nacidos a término (≥37 semanas de edad gestacional) y los percentiles según el estudio español de crecimiento de 20109.
Los datos se recogieron en Excel versión 2003 y el análisis estadístico se realizó con el programa SPSS (IBM Corp. Released 2010. IBM SPSS Statistics for Windows, Version 19.0. Armonk, NY: IBM Corp.) Las variables categóricas se expresan en valores absolutos y porcentajes, mientras que las cuantitativas se presentan como media y desviación estándar (DE).
Se utilizaron tablas de contingencia para valorar la asociación entre datos cualitativos y la prueba chi cuadrado de Pearson para evaluar el grado de asociación. Por otro lado, se compararon las medias con la prueba t Student.
Este estudio se llevó a cabo de acuerdo con las directrices establecidas en la Declaración de Helsinki y todos los procedimientos realizados en pacientes humanos fueron aprobados por el Comité de Ética y de Investigación Clínica del Hospital.
ResultadosEn el año 2016 se registraron 1.980 partos, 21 abortos en pacientes con seguimiento por Endocrinología y 18 pacientes con parto fuera del CAULE. Se eliminaron del análisis estadístico 88 pacientes con tratamiento previo con tiroxina. Por lo tanto, se incluyeron 1.931 pacientes «naive».
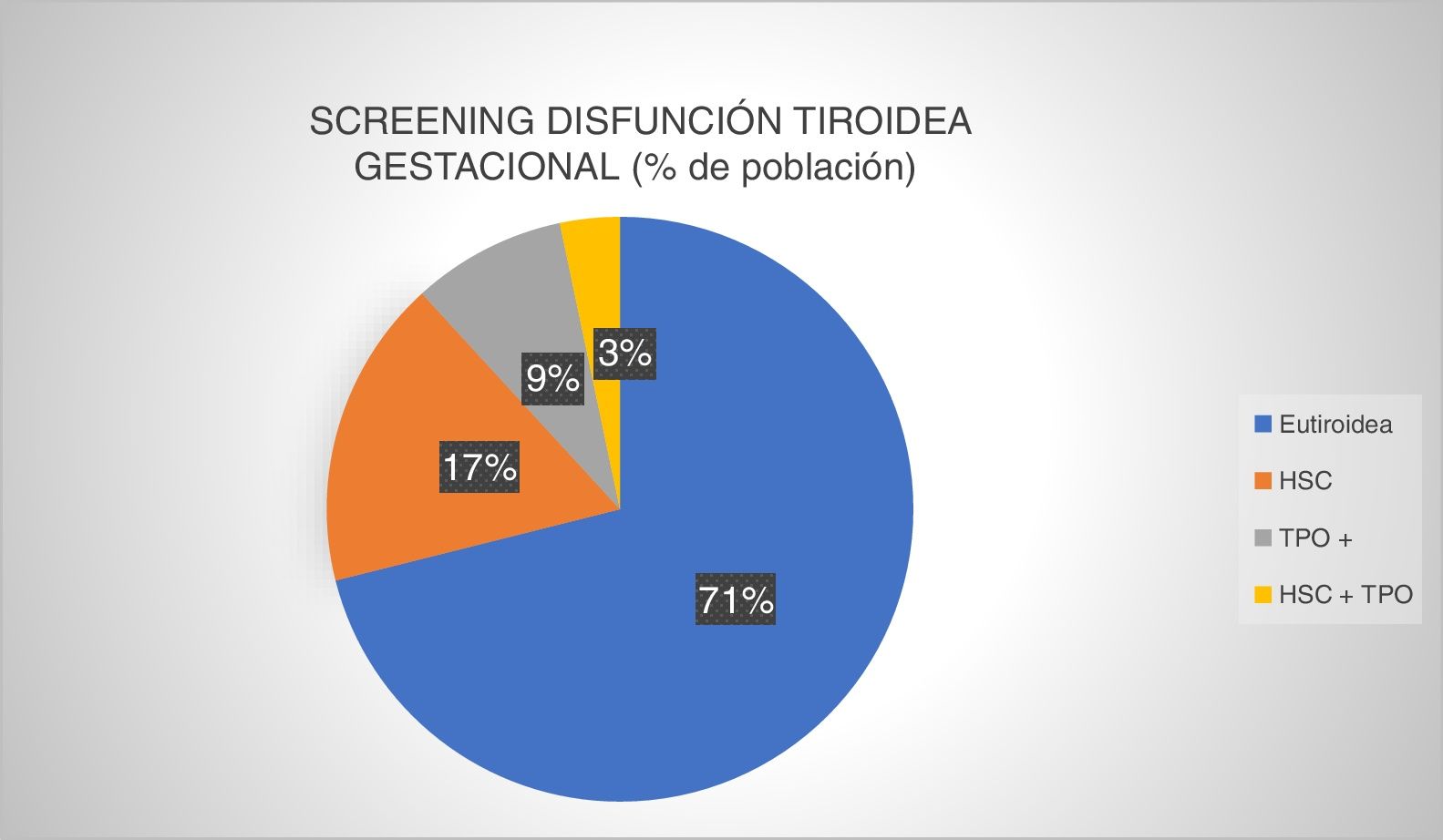
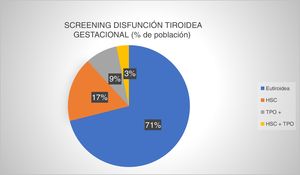
Fueron cribadas 1.670 pacientes, lo que supone que en un 82,71% del total de gestantes se realizó análisis al menos de la TSH en el primer trimestre de gestación. Los resultados del cribado fueron los descritos en la figura 2.
Prevalencia de disfunción tiroidea gestacional en el screening primer trimestre (Complejo Asistencial Universitario de León, 2016). Eutiroidea: función tiroidea normal y autoinmunidad negativa; HSC: hipotiroidismo subclínico; HSC+TPO: hipotiroidismo subclínico junto con autoinmunidad positiva; TPO+: anticuerpos antiperoxidasa tiroidea positivo.
El 100% de las pacientes tomaban suplementos orales de yodo, a dosis entre 150-300mcg/día.
TSH y anticuerpos antiperoxidasa tiroideosDe las 1.670 pacientes cribadas, 1.551 tienen datos de ATPO (92,87%). Encontramos que desarrollan HSG el 38,73% con ATPO positivos; mientras que solo ocurre en un 16,25% si no hay autoinmunidad (p<0,01).
La media de TSH en el grupo con ATPO positivos fue de 3,51mU/L (2,14) frente a 2,46mU/L (2,72) en el grupo de ATPO negativos(p=0,03).
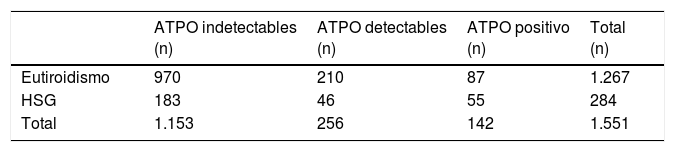
En 1.153(69,04%) pacientes el valor de ATPO fue indetectable (<10) y en 256 (15,33%) el valor de ATPO osciló entre 10-35UI/ml. En este último grupo, el 17,97%(n=46) tuvieron TSH>3,72mU/L. En las gestantes con autoinmunidad indetectable se diagnosticó HSG en un 15,87% (p=0,40) (tabla 1).
Tabla de contingencia niveles de anticuerpos antiperoxidasa tiroidea e hipotiroidismo subclínico gestacional
| ATPO indetectables (n) | ATPO detectables (n) | ATPO positivo (n) | Total (n) | |
|---|---|---|---|---|
| Eutiroidismo | 970 | 210 | 87 | 1.267 |
| HSG | 183 | 46 | 55 | 284 |
| Total | 1.153 | 256 | 142 | 1.551 |
ATPO: anticuerpos antiperoxidasa tiroidea; HSG: hipotiroidismo subclínico gestacional.
TPO indetectables: <10UI/ml. TPO detectables 10-35UI/ml. TPO positivos≥35UI/ml.
En el caso de ATPO indetectables la media de TSH fue de 2,44mU/L (2,89) frente a 2,53mU/L (1,69) en el grupo de valores detectables (ATPO 10-35UI/ml), pero sin diferencias significativas (p=0,89).
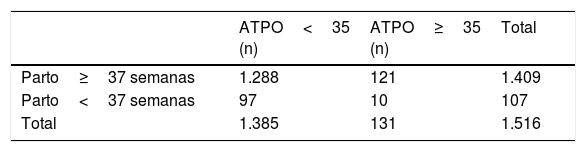
Complicaciones materno-fetales con autoinmunidadEn el año 2016, se registraron en el CAULE 107 partos prematuros (<37 semanas), lo que supone un 5,40% de prematuridad.
No encontramos diferencias de prematuridad según la positividad o no de ATPO (7,63 vs. 7%; p=0,79) (tabla 2).
Respecto al tipo de parto, 420 fueron instrumentalizados (21,21%) y la prevalencia de cesárea en el año 2016 fue del 16,70% (n=390). En las gestantes con ATPO positivo se realizó cesárea en un 19,08% de los casos, prácticamente igual que en el caso de negatividad para los anticuerpos (19,49%) (p=0,99).
El peso medio de los recién nacidos a término cuyas madres tenían ATPO positivos fue de 3.305,53 (463,69)g (p41; −0,24 DE), ligeramente superior al de los neonatos de madres con autoinmunidad negativa: 3.264,92 (457,74)g (p37; −0,34 DE) sin encontrar diferencias significativas (p=0,35). Respecto a los neonatos a término con peso considerado pequeño para la edad gestacional (<2.500g), encontramos una mayor prevalencia en aquellos nacidos de madres con autoinmunidad positiva, pero sin diferencias estadísticamente relevantes: el 3,02% en caso de ATPO negativos frente al 4,10% entre las pacientes con ATPO positivos (p=0,51).
DiscusiónEn la mayoría de los estudios previos se demuestra que los valores de TSH en gestantes con ATPO positivos, aun sin disfunción tiroidea previa conocida, son más elevados que en gestantes sin autoinmunidad. En el estudio de Negro et al.10 la diferencia de TSH fue de 1,25mU/L con ATPO positivo frente a 0,82mU/L con ATPO negativos (p<0,01). En nuestros resultados la diferencia es incluso relevante estadísticamente y la media de TSH es superior en ambos grupos, posiblemente en relación con el déficit de yodo de nuestra población11. En el estudio del Bierzo, área de la provincia de León, observaron que la yoduria media de las gestantes en el primer trimestre fue de 71,40μg/l, cuando la concentración de yodo en orina recomendado por la organización mundial de la salud es entre 149 y 249μg/l.
En el embarazo, la prevalencia de anticuerpos antitiroideos asciende al 10-20%, dependiendo del punto de corte usado con cada laboratorio12. En nuestro estudio la prevalencia de ATPO positivo es del 8,50% de las gestantes cribadas en el primer trimestre, ligeramente inferior a otros estudios, aunque hay que tener en cuenta que hemos eliminado a las pacientes que recibían tratamiento previo con tiroxina (un 4,44% de los partos en 2016).
La relación entre ATPO y complicaciones obstétricas es confusa y genera gran controversia. Como se ha mencionado anteriormente, la autoinmunidad tiroidea parece que eleva la TSH y aumenta el riesgo de desarrollar HSG. El incremento de TSH aislado sí que ha demostrado que aumenta el riesgo de efectos negativos maternos y neonatales como el parto prematuro, por lo que puede ser un factor de confusión a la hora de evaluar las complicaciones13. En Texas, se estudió la función tiroidea en una cohorte de 17.298 mujeres embarazadas. Se encontró un 2,3% de HSG (definido como una TSH≥97,5 percentil y T4l normal) con una tasa de parto prematuro incrementada frente al grupo control (4 vs. 2,50%; p<0,05)14.
En nuestros resultados no hemos encontrado asociación entre prematuridad y autoinmunidad positiva. Sin embargo, es un tema de gran controversia y actualmente podemos encontrar estudios apoyando las 2 hipótesis: Glinoer et al.15 hallaron el doble de partos prematuros en las gestantes con autoinmunidad (16 vs. 8%; p<0,05). Otro estudio de Ghafoor et al. en 1.500 mujeres pakistaníes también logró demostrar esta asociación(26,8 vs. 8%; p<0,01)16. En la misma vertiente Negro et al. encontraron una fuerte asociación entre prematuridad y ATPO positivo (22,4 vs. 8,2%) en embarazadas de Italia17.
Por el contrario, encontramos un estudio australiano de Tierney et al.18 donde no hallan diferencias respecto al parto prematuro en mujeres con anticuerpos tiroideos positivos frente a las que no. Tampoco encontraron asociación Stagnaro-Green et al. en Nueva Jersey19 sobre esta cuestión entre mujeres con y sin ATPO.
Otro aspecto que se debería tener en cuenta a la hora de evaluar las complicaciones es cómo afecta tratar con tiroxina. En nuestro caso, un alto porcentaje de las gestantes con autoinmunidad recibieron tratamiento sustitutivo al ser diagnosticadas también de HSG. De hecho ya hay estudios que han demostrado reducir la tasa de prematuridad en gestantes ATPO positivo al administrar tiroxina20. Por el contrario, parece que la administración de tiroxina en pacientes con ATPO negativo y TSH<10 no supone beneficio en este sentido21.
Sobre otras complicaciones obstétricas hay menos datos: en uno de los estudios de Negro et al.10 estudian la tasa de cesáreas y encuentran datos similares en las gestantes tengan o no ATPO (20,90% en ATPO negativos vs. 22,40% en ATPO positivo; p=0,56). Tampoco hubo diferencias con el peso del recién nacido en función de la autoinmunidad: (peso<2.500g: 4,80 vs. 6,50%; p=0,23), con resultados similares a nuestro estudio.
Por último, se estudió si existían diferencias de función tiroidea en aquellas pacientes con ATPO detectables, pero por debajo del nivel de la normalidad según nuestro corte de referencia de laboratorio. Nuestra muestra presentaba un leve aumento de TSH con valores de ATPO entre 10 y 35UI/ml pero sin diferencias estadísticamente significativas. Existen pocos estudios acerca de este problema. En un reciente estudio llevado a cabo por Korevaar et al.22 valoraron a una población de gestantes (n=11.212) para intentar mejorar la especificidad del punto de corte de ATPO. Para ello realizaron un metaanálisis de 3 grandes estudios poblacionales previos en Holanda. Como ya se ha mencionado previamente, la recomendación general es usar los valores de corte propios para TSH y T4l en la disfunción tiroidea gestacional, mientras que para hablar de los ATPO usamos los cortes del laboratorio fabricante del kit. Estos valores han sido probados en población general y no específicamente en embarazo. De ahí que muchas veces sea difícil establecer comparación entre diferentes ensayos, ya que se ha visto una variabilidad para considerar ATPO positivo entre 15-143UI/ml. Korevaar et al. encontraron asociación positiva entre los niveles de TSH y asociación negativa con los valores de T4l (p<0,01). Establecieron un punto de corte a partir del cual los valores de TSH se incrementaban de forma significativa (p92) y decrecían los de T4l (p94). Observaron gran diferencia respecto a este corte y el del laboratorio de referencia: Generacion R23: 25,7 frente a 60UI/ml del laboratorio; ABCD study24 30,7 frente a 80UI/ml de la referencia. En el ensayo HAPPY25, sin embargo, el valor del percentil y del laboratorio fueron similares: 35 vs. 34UI/ml.
Además, corroboraron que existe asociación positiva entre el parto prematuro y ATPO positivos según el valor de referencia. Por lo tanto, actualmente, son necesarios estudios para determinar el corte de ATPO durante la gestación que pueda afectar de forma severa a la función tiroidea y que implique la necesidad de tratamiento con tiroxina22.
En conclusión, el presente estudio proporciona pruebas adicionales de una asociación entre la positividad de los anticuerpos tiroideos y la elevación de TSH, y, en consecuencia, una mayor asociación a desarrollar hipotiroidismo subclínico en la gestación. Las fortalezas del presente estudio incluyen el número total de mujeres estudiadas y el amplio porcentaje de mujeres incluidas en el screening universal usando corte propio del área. Las debilidades del estudio son la uniformidad de la población, que consistía en mujeres del área de León, un área con deficiencia de yodo. En este caso no se estudió específicamente el estado nutricional de yodo y, de manera general, se suplementa a las embarazadas, por lo que podrían no ser deficitarias en este elemento. No se ha encontrado asociación con complicaciones materno-fetales en las gestantes con autoinmunidad positiva, si bien hoy en día sigue siendo un tema de controversia y existen teorías en ambas direcciones. Todo ello apoya la necesidad de realizar pruebas prospectivas donde se incluya otro factor importante: la terapia con levotiroxina en mujeres eutiroideas con autoinmunidad positivas a la peroxidasa tiroidea.
Contribuciones de los autoresPaula Fernández Martínez y Rocío Aguado García concibieron y diseñaron el estudio.
Paula Fernández Martínez, analizó los datos y escribió el documento. Todos los autores contribuyeron a la adquisición de datos, a la redacción del manuscrito y aprueban la versión definitiva del mismo.
FinanciaciónEsta investigación no recibió ninguna subvención pública ni de sectores comerciales.
Conflicto de interesesTodos los autores declaran no tener conflictos de intereses.