La diabetes es una de las mayores causas de morbimortalidad en el mundo occidental y se asocia de forma independiente con la enfermedad renal crónica (ERC) y la enfermedad cardiovascular (ECV)1. La diabetes y la ECV tienen un impacto individual sobre la ERC1. Banerjee y Panas demostraron que pacientes con ECV y diabetes tenían el doble de probabilidad de desarrollar ERC en comparación con aquellos que no presentaban ECV1.
Hoy en día, una alta proporción de los pacientes ingresados en un hospital sufren distintos grados de insuficiencia cardiaca (IC) e insuficiencia renal. La disfunción de uno de estos órganos conduce a la disfunción del otro, en una compleja interacción que clínicamente se ha denominado síndrome cardiorrenal (SCR)2. El SCR se puede definir como un deterioro patológico a nivel renal y cardíaco como consecuencia de una disfunción aguda o crónica de uno de los órganos (riñón o corazón) que induce la disfunción del otro1,2.
Varios estudios muestran la existencia de una regulación bidireccional entre el corazón y el riñón, de manera que cambios en la función de uno de los órganos conducen a la disfunción de ambos produciéndose alteraciones en los niveles de óxido nítrico y las especies reactivas de oxígeno (ROS), favoreciendo la inflamación sistémica y la activación del sistema nervioso simpático y el sistema renina-angiotensina (SRA)2,3. Además, se ha observado que pacientes con factores de riesgo cardiovascular (fumadores, hipertensión, dislipidemia, edad y diabetes) presentan también mayor riesgo de enfermedad renal2.
La nefropatía diabética (ND) es la causa principal de insuficiencia renal crónica terminal en los países desarrollados y una de las principales causas de mortalidad cardiovascular. En estadios precoces de la ND se detecta un incremento de la presión arterial (PA) junto con un aumento de la excreción urinaria de albúmina conocido como microalbuminuria. En estadios más avanzados de la enfermedad, el paciente desarrolla hipertensión y proteinuria4. Así pues, los niveles de proteinuria son un marcador de progresión de la ERC5. Cabe destacar que los niveles de microalbuminuria no son solo marcadores de riesgo de enfermedad renal, sino que también se asocian con un incremento del riesgo de eventos cardiovasculares y mortalidad6.
Los pacientes con diabetes tipo 1 y con microalbuminuria o proteinuria presentan entre 2 y 10 veces mayor progresión de complicaciones cardiovasculares en comparación con aquellos pacientes con excreción de albúmina normal7. En diabetes tipo 2 (DM2), los niveles de microalbuminuria son un factor de riesgo para el desarrollo de la aterosclerosis, enfermedades coronarias y otras enfermedades vasculares8. Así, es claramente conocido que los pacientes afectos de DM2 presentan tasas de evento cardiovascular superiores a las de pacientes sin diabetes con previo evento cardiovascular9.
El SRA es importante en la regulación de la PA y juega un papel importante a nivel renal y cardíaco. Su bloqueo se ha relacionado con una mejora de la proteinuria y una reducción en la progresión de la ERC10. La formación de angiotensina-II (Ang-II) por acción de la enzima convertidora de angiotensina (ECA) favorece la contracción de las células de la musculatura vascular lisa de las arteriolas, la reabsorción de sodio a nivel de túbulo renal, la estimulación de la secreción de aldosterona y el aumento de la respuesta simpática. A largo plazo, estimula la fibrosis, la proliferación y diferenciación celular, la inflamación, la apoptosis, la generación de ROS y, en última instancia, la inhibición de la liberación de renina al torrente sanguíneo11.
En el paciente con diabetes, la hiperglucemia e hipertensión mal controladas favorecen la activación del SRA facilitando la acumulación de Ang-II a través de la interacción con su receptor I de Ang-II. El exceso de Ang-II incrementa los niveles de TFG-β que estimulan el estrés oxidativo, favorece la aparición de lesiones endoteliales, incrementa la PA, produce vasocontricción y aumenta el riesgo cardiovascular. A nivel renal, la acumulación de Ang-II afecta negativamente a la estructura podocitaria, favorece la apoptosis y la transición epitelio-mesenquimal provocando lesión y reducción en el número de podocitos, lo que conduce a la aparición de proteinuria y glomerulosclerosis con la subsiguiente pérdida de función renal11.
En el año 2000, se descubrió la enzima convertidora de angiotensina 2 (ECA2), una enzima homóloga de la ECA. Mientras la función principal de la ECA es formar Ang-II de Ang-I, el ECA2 evita la acumulación de Ang-II degradándola a Ang-(1-7). A su vez, también degrada la Ang-I a angiotensina 1-9, aunque su afinidad por la Ang-I es menor que la observada sobre la Ang-II12. Así, la Ang-(1-7) contrarresta, a nivel renal y cardíaco, los efectos negativos de la acumulación de Ang-II. Presenta propiedades vasodilatadoras, inhibe señales proliferativas de las células epiteliales tubulares y evita la lesión renal11,13.
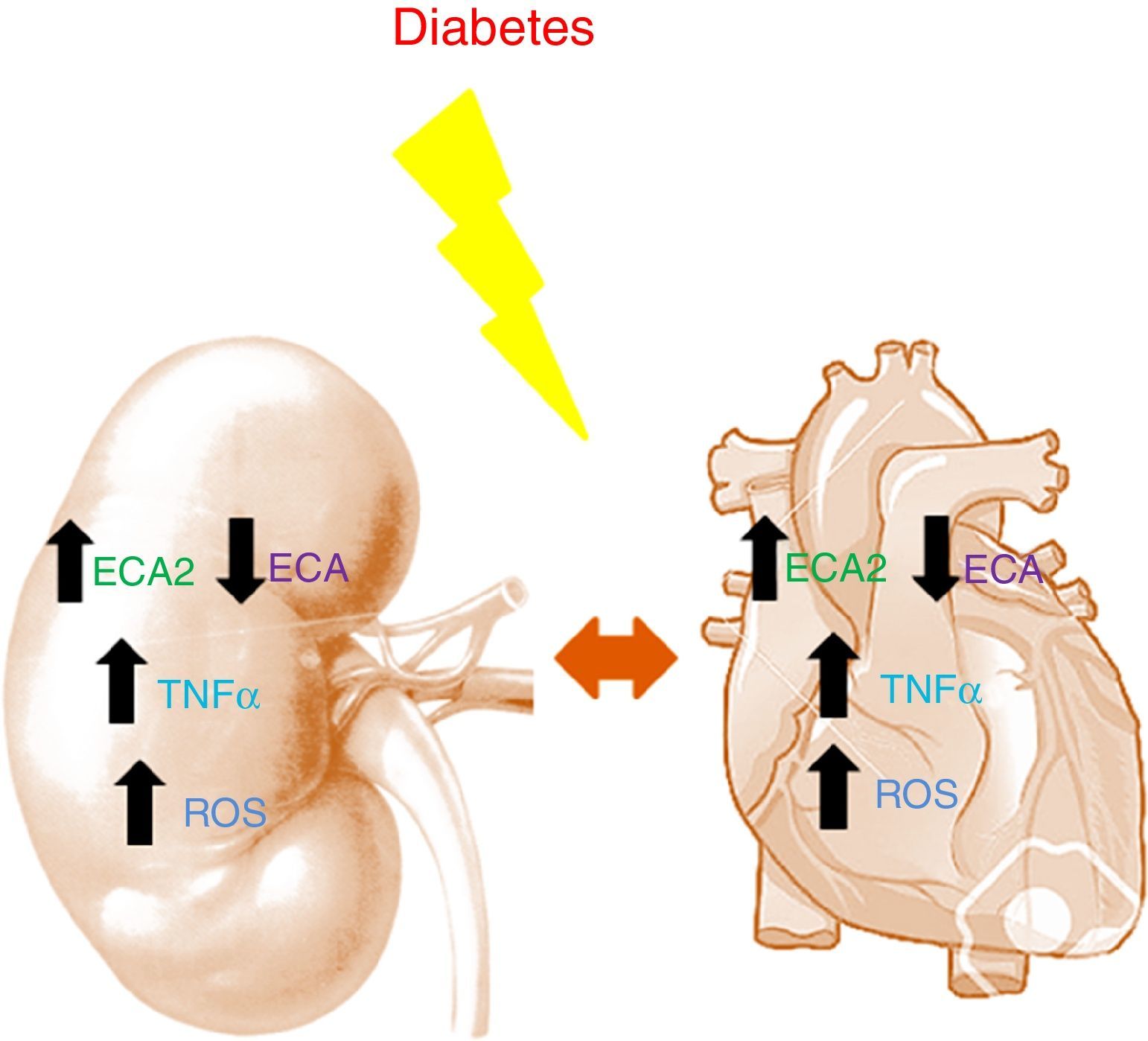
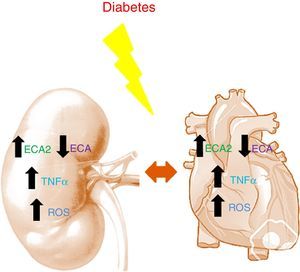
Trabajos en modelos murinos demuestran como en diabetes, tanto a nivel renal como a nivel cardíaco, hay un incremento de la ECA2 y una disminución de la ECA14,15. La disminución de la ECA junto con el aumento de la ECA2 parece ser un mecanismo reno y cardioprotector durante las primeras etapas de la diabetes, ayudando a frenar la acumulación de Ang-II para favorecer la formación de Ang-(1-7). La deficiencia de ECA2 en modelos murinos con diabetes tipo 1 muestra como a nivel histológico existe hipertrofia glomerular y expansión de la matriz mesangial con un empeoramiento de la lesión renal debido a la acumulación de Ang-II16. A nivel cardíaco, la deficiencia de ECA2 produce una dilatación en el ventrículo izquierdo y una disfunción sistólica que se revierte con una deleción génica de ECA17. En pacientes con infarto agudo de miocardio, la actividad circulante de la ECA2 se relaciona con el tamaño del infarto, la fracción de eyección ventricular y la muerte12. A su vez, en ERC la actividad circulante de la ECA2 está aumentada en pacientes afectos de diabetes18. Es interesante mencionar que en dichos pacientes el aumento de la actividad de la ECA2 se asocia a un mayor riesgo de presentar aterosclerosis silente a los 2 años de seguimiento19 (fig. 1).
Los tratamientos con inhibidores de ECA (IECA) o antagonistas del receptor de Ang-II (ARA2) son la piedra angular del manejo de los pacientes con disfunción sistólica del ventrículo izquierdo y además también previenen el empeoramiento renal progresivo en la ND y en otras formas de insuficiencia renal crónica. Las evidencias disponibles indican que los IECA, gracias a sus efectos antihipertensivos y antiproteinúricos, retrasan el deterioro de la función renal en el paciente con diabetes tipo 1. Son útiles también para frenar la progresión de la ND incipiente a nefropatía establecida en pacientes con DM2. En pacientes con DM2 con nefropatía incipiente o establecida se ha visto que el tratamiento con ARA2 reduce la proteinuria y la progresión de la enfermedad o la necesidad de diálisis por ERC terminal20. El bloqueo del SRA con IECA o ARA2 permite no solo reducir la PA sino también disminuir la proteinuria. Además, el bloqueo del SRA disminuye la mortalidad cardiovascular en enfermos de alto riesgo, entre los cuales se encuentran los pacientes con ERC20.
Estudios recientes han demostrado un papel protector a nivel cardiorrenal de la empagliflozina, inhibidor del cotransportador de sodio-glucosa tipo 2 (SGLT2), fármaco con acción hipoglucemiante conocida. Así, Wanner et al., en pacientes con DM2 con elevado riesgo cardiovascular, han demostrado que el tratamiento con empagliflozina se asocia a una menor progresión de la lesión renal21. En una situación de diabetes, además de alteraciones en el SRA, también se ven alteradas otras vías de señalización implicadas en las disfunciones cardíaca y renal. Alteraciones metabólicas como consecuencia de la hiperglucemia o la resistencia a insulina contribuyen al incremento del estrés oxidativo a niveles cardíaco y renal22. Las ROS son un producto básico del metabolismo celular. En un estado no diabético, el propio organismo es capaz de mantener los niveles de ROS equilibrados evitando así su acumulación. En diabetes, estos exceden la capacidad antioxidante de las células dañando así los distintos tejidos del organismo. La acumulación de ROS ejerce efectos tóxicos sobre genes y factores de transcripción encargados de controlar la fosforilación oxidativa mitocondrial contribuyendo así a la disfunción de las mitocondrias y favoreciendo la formación de radicales libres23.
Como se ha comentado con anterioridad, el paciente con diabetes presenta una alteración del eje SRA. Esto se traduce en un incremento de los niveles de Ang-II que favorecen la actividad de la enzima NADPH oxidasa citosólica alterando la mitocondria, incrementando el metabolismo de los ácidos grasos y contribuyendo al desarrollo de cardiomiopatías23.
Estudios en humanos demostraron el importante rol que juegan las citoquinas en la diabetes a nivel cardíaco y renal. El efecto de las citoquinas en la ERC se asocia con alteraciones hemodinámicas, alteraciones en la estructura renal y cambios en la matriz mesangial, estimulación de apoptosis y necrosis e incrementos en la producción de ROS24. A nivel cardíaco, las citoquinas proinflamatorias se ven incrementadas en diabetes favoreciendo la cardiomiopatía25. Los niveles de TNF-α se ven incrementados tanto a nivel cardíaco como renal en el paciente con diabetes. Esta citoquina causa citotoxicidad a nivel de la célula renal e induce daño renal, apoptosis y necrosis. Favorece la pérdida de TFG dado que altera el equilibrio entre factores que promueven la vasoconstricción y vasodilatación. Induce la activación de la enzima NADPH oxidasa promoviendo el incremento en los niveles de ROS produciendo alteraciones a nivel glomerular24. A nivel cardíaco, TNF-α juega un papel relevante en la patogénesis de la obesidad y la resistencia a la insulina alterando las vías de señalización de la insulina y la función miocárdica. Su bloqueo farmacológico mejora la función cardíaca en la IC reduciendo la inflamación intramiocárdica y la fibrosis cardíaca25. Recientemente, diferentes vías de la inflamación se postulan como dianas terapéuticas en el tratamiento reno-cardiovascular en el paciente afecto de DM2. Así, la pentoxifilina, los inhibidores del CCR2 y los antagonistas de la interleucina 1 podrían ser estrategias terapéuticas futuras26.
A mencionar, que otras vías de actuación relacionadas con la fibrosis también podrían ser de utilidad en el tratamiento en dichos pacientes, incluyendo en un futuro no tan lejano el tratamiento con células madre mesenquimales27.