Determinar el riesgo de hipotiroidismo en gestantes con enfermedad tiroidea autoinmune y tirotropina (TSH) < 2,5 mUI/l al inicio del embarazo.
MétodosEstudio prospectivo longitudinal en gestantes de primer trimestre sin antecedentes de patología tiroidea y con TSH en primer trimestre < 2,5 mUI/l. Se determinaron TSH, tiroxina libre (T4l) y anticuerpos antiperoxidasa (TPO) y antitiroglobulina en los 3 trimestres. Se comparó la evolución de la función tiroidea y la aparición de hipotiroidismo gestacional (TSH > 4 mUI/l), entre las gestantes con autoinmunidad positiva y autoinmunidad negativa.
ResultadosSe incluyeron 300 gestantes con TSH basal 1,3 ± 0,6 mUI/l (semana gestacional 9). El 17,7% (n = 53) tenían autoinmunidad positiva en el primer trimestre. Los títulos de anticuerpos TPO y antitiroglobulina disminuyeron entre el primer y el tercer trimestre un 76,8% y un 80,7% respectivamente. La evolución de la función tiroidea fue similar en el grupo con autoinmunidad positiva y el grupo con autoinmunidad negativa, y la aparición de hipotiroidismo fue del 1,9% (1/53) y del 2% (5/247) respectivamente. Las gestantes en las que la TSH aumentó por encima de 4 mUI/l (n = 6) tenían cifras superiores de TSH basal en comparación con las que mantuvieron TSH≤4 mUI/l a lo largo del embarazo (1,8 vs. 1,3 mUI/l; p = 0,047).
ConclusiónEn nuestra población, las mujeres con TSH < 2,5 mUI/l al inicio del embarazo tienen un riesgo mínimo de desarrollar hipotiroidismo durante la gestación, independientemente de la autoinmunidad tiroidea.
To determine the risk of hypothyroidism in pregnant women with autoimmune thyroid disease and thyrotropin (TSH) < 2,5 mIU/l at the beginning of pregnancy.
MethodsProspective longitudinal study of pregnant women with no personal history of thyroid disease, and with TSH < 2.5 mIU/l in the first trimester. TSH, free thyroxine (FT4), anti peroxidase (TPO) and anti thyroglobulin antibodies were measured in the 3 trimesters of pregnancy. We compared thyroid function throughout pregnancy, and the development of gestational hypothyroidism (TSH >4 mIU/l) among pregnant women with positive thyroid autoimmunity and those with negative autoimmunity.
ResultsWe included 300 pregnant women with mean baseline TSH 1.3 ± 0.6 mIU/l (9th gestational week). Positive thyroid autoinmunity was detected in 17.7% of women (n = 53) at the first trimester. Between the first and the third trimesters, TPO and anti thyroglobulin antibodies titers decreased 76.8% and 80.7% respectively. Thyroid function during pregnancy was similar among the group with positive autoimmunity and the group with negative autoimmunity, and the development of hypothyroidism was 1.9% (1/53) and 2% (5/247) respectively. Pregnant women in whom TSH increased above 4 mIU/l (n = 6), had higher baseline TSH levels compared to those who maintained TSH ≤4 mIU/l during pregnancy (1.8 vs. 1.3 mIU/l; p=.047).
ConclusionIn our population, women with TSH levels <2.5 mIU/l at the beginning of pregnancy have a minimal risk of developing gestational hypothyroidism regardless of thyroid autoimmunity.
La prevalencia de autoinmunidad tiroidea en mujeres gestantes se sitúa entre el 3 y el 18% en los distintos estudios1, y se asocia a un mayor riesgo de complicaciones materno-fetales, fundamentalmente aborto y parto pretérmino2–4. Además, las mujeres con autoinmunidad tiroidea positiva suelen tener cifras de tirotropina (TSH) más elevadas al inicio del embarazo, comparadas con las que tienen autoinmunidad negativa5,6. La presencia de anticuerpos antiperoxidasa (TPO) y antitiroglobulina (anti-Tg) en gestantes se ha relacionado con distintos factores, tales como los antecedentes familiares de enfermedad tiroidea autoinmune, la edad, la paridad y el déficit o exceso de yodo7–9.
Los títulos de los anticuerpos antitiroideos son más elevados en el primer trimestre, y disminuyen considerablemente a lo largo del embarazo, llegando a negativizarse en algunos casos10. A pesar de esto, se considera que las mujeres con autoinmunidad tiroidea positiva tienen más riesgo de desarrollar hipotiroidismo durante la gestación, por lo que se aconseja monitorizar la función tiroidea fundamentalmente durante la primera mitad del embarazo11,12.
El objetivo de este trabajo es determinar el porcentaje de gestantes con autoinmunidad tiroidea positiva y TSH < 2,5 mUI/l en el primer trimestre que desarrolla hipotiroidismo a lo largo del embarazo, y compararlas con un grupo control de gestantes con autoinmunidad negativa.
Material y métodosPoblaciónSe evaluaron de forma prospectiva 400 gestantes de primer trimestre sin antecedentes de patología tiroidea y sin tratamiento farmacológico con influencia en la función tiroidea (amiodarona, litio, levotiroxina, antitiroideos). Las participantes fueron reclutadas de dos centros de atención a la mujer en la primera visita prenatal, y se evaluaron de forma presencial en el Servicio de Endocrinología del Complejo Hospitalario de Navarra (Pamplona), entre mayo de 2014 y mayo de 2016. En dicha visita se realizó anamnesis y exploración física, ecografía tiroidea y recogida de muestra simple de orina para determinación de yoduria. Se realizaron determinaciones de TSH, tiroxina libre (T4l) y anticuerpos TPO y anti-Tg coincidiendo con los controles analíticos rutinarios de la gestación (semanas gestacionales 9, 15, 25 y 36).
Para el presente trabajo, excluimos a las mujeres con embarazo múltiple (n=14), con nódulos tiroideos > 1cm (n=24) y/o a las que presentaron en el primer trimestre TSH≥2,5 mUI/l (n=62), por lo que la población final incluida fue de 300 gestantes. Se consideró aparición de hipotiroidismo, una elevación de la cifra de TSH por encima de 4 mUI/l en cualquier momento del embarazo.
Se registraron los abortos y partos pretérmino (aquellos ocurridos antes de la semana 37 de gestación) que tuvieron lugar durante el estudio.
El estudio fue aprobado por el Comité Ético de Investigación Clínica de Navarra, y todas las gestantes incluidas firmaron el documento de consentimiento informado.
Determinaciones analíticas y estudio ecográficoLas muestras sanguíneas para la determinación de TSH, T4l, anticuerpos TPO y anti-Tg se analizaron en el laboratorio central del Complejo Hospitalario de Navarra (Pamplona) mediante quimioluminiscencia (método Abbott). Todas las muestras se obtuvieron por la mañana. Para los anticuerpos TPO y anti-Tg, se consideraron positivos los valores por encima del límite superior de la normalidad. Se recogió además el título (valor numérico) de ambos anticuerpos.
La determinación de la yoduria en una muestra simple de orina se realizó en el Laboratorio Normativo de Salud Pública del Gobierno Vasco en Derio, Vizcaya, mediante cromatografía líquida de alta resolución en fase reversa, utilizando par iónico con detección electroquímica y electrodo de plata (Waters Chromatography, Milford, MA). La información detallada sobre el procedimiento y la validación del método y su precisión intra- e interserial ha sido previamente publicada13. Las muestras de orina se almacenaron en el biobanco, congeladas a -20°C, debidamente identificadas, hasta ser enviadas para su análisis.
La ecografía tiroidea se realizó en decúbito supino, con el ecógrafo portátil MicroMaxx® (Sonosite, Bothell, WA) con sonda lineal de 5-12MHz. El volumen tiroideo (ml) se calculó mediante la suma del volumen de ambos lóbulos tiroideos (volumen de cada lóbulo: eje longitudinal [cm] x eje trasversal [cm] x eje anteroposterior [cm] x 0,479).
Análisis estadísticoLas variables cualitativas se describieron mediante frecuencias y porcentajes para cada una de sus categorías, y las cuantitativas mediante medidas centrales (media, mediana) con medidas de dispersión (desviación estándar y rango intercuartil).
La normalidad de las variables se evaluó mediante test de Kolmorov-Smirnov. Las cifras de TSH y T4l según positividad en la prueba de autoinmunidad tiroidea se compararon mediante el test paramétrico t de Student o el test no paramétrico de Mann-Whitney, según normalidad. La asociación entre variables categóricas fue evaluada mediante el test χ2. Para el análisis estadístico se empleó el programa SPSS versión 20. Valores de p < 0,05 se consideraron estadísticamente significativos.
ResultadosCaracterísticas basales de la poblaciónSe incluyeron 300 gestantes en el primer trimestre de embarazo, el 95% caucásicas, que fueron evaluadas en la 10.ª semana gestacional (rango 6-18). La mediana de yoduria fue 242 mcg/l (148,5-413 mcg/l), consistente con población yodosuficiente según los criterios de la Organización Mundial de la Salud. El 98,3% de las mujeres recibían suplementos farmacológicos con yoduro potásico en el momento de ser evaluadas (dosis media de yodo 202,6 ± 30,1 mcg diarios).
El 17,7% (n = 53) de las gestantes tenía autoinmunidad positiva en el primer trimestre. De estas, el 15,1% (n = 8) tenían TPO positivos, el 47,2% (n = 25) anti-Tg positivos y 37,7% (n = 20) positividad para ambos anticuerpos.
No hubo diferencias basales entre las mujeres con autoinmunidad tiroidea positiva y aquellas con autoinmunidad negativa (tabla 1).
Características basales de la población estudiada en el primer trimestre
| Población total (n = 300) | Autoinmunidad positiva (n = 53) | Autoinmunidad negativa (n = 247) | p* | |
|---|---|---|---|---|
| Edad (años) | 33,4 ± 4,1 | 33,4 ± 4,1 | 33,4 ± 4,1 | 0,989 |
| IMC | 23,7 ± 4,4 | 23,5 ± 4,5 | 23,7 ± 4,4 | 0,739 |
| A familiares (%) | 19 | 24,5 | 17,8 | 0,258 |
| Nuliparidad (%) | 47,7 | 37,7 | 49,8 | 0,111 |
| N.° hijos previos | 0,6 ± 0,7 | 0,8 ± 0,7 | 0,6 ± 0,7 | 0,083 |
| Vol tiroideo (ml) | 8,0 ± 2,6 | 8,4 ± 2,3 | 7,9 ± 2,7 | 0,300 |
| Yoduria (mcg/l) | 242 (148,5-413,0) | 294 (169,8-430,8) | 234 (140,5-409,0) | 0,114 |
| TSH (mUI/l) | 1,3 ± 0,6 | 1,4 ± 0,7 | 1,2 ± 0,6 | 0,091 |
| T4l (ng/dl) | 1,04 ± 0,99 | 1,04 ± 0,11 | 1,05 ± 0,10 | 0,780 |
Los valores se expresan como media ± desviación estándar a excepción de la yoduria, que se expresa como mediana (P25-P75). La TSH (mUI/l) y T4l (ng/dl) corresponden a la semana gestacional 9, y el volumen tiroideo y la yoduria a la semana gestacional 10.
A familiares: antecedentes familiares; Vol tiroideo: volumen tiroideo.
Se analizaron por separado las gestantes con anticuerpos TPO positivos (n = 28) y las que presentaron positividad exclusiva para anti-Tg (n = 25), y ambos grupos se compararon con la población control con autoinmunidad negativa (n = 247). Las mujeres con TPO positivos tenían mayor frecuencia de antecedentes familiares de patología tiroidea que la población control (35,7% vs. 17,8%; p = 0,024), sin encontrarse diferencias en la edad, la paridad ni en la cifra de TSH basal (TSH 1,4 ± 0,7 vs. 1,2 ± 0,6 mUI/l; p = 0,328). Entre las gestantes con positividad exclusiva para anti-Tg y el grupo control no se encontraron diferencias significativas en ninguna de las variables anteriores. La TSH basal fue 1,4 ± 0,7 mUI/l y 1,2 ± 0,6 mUI/l respectivamente (p = 0,123).
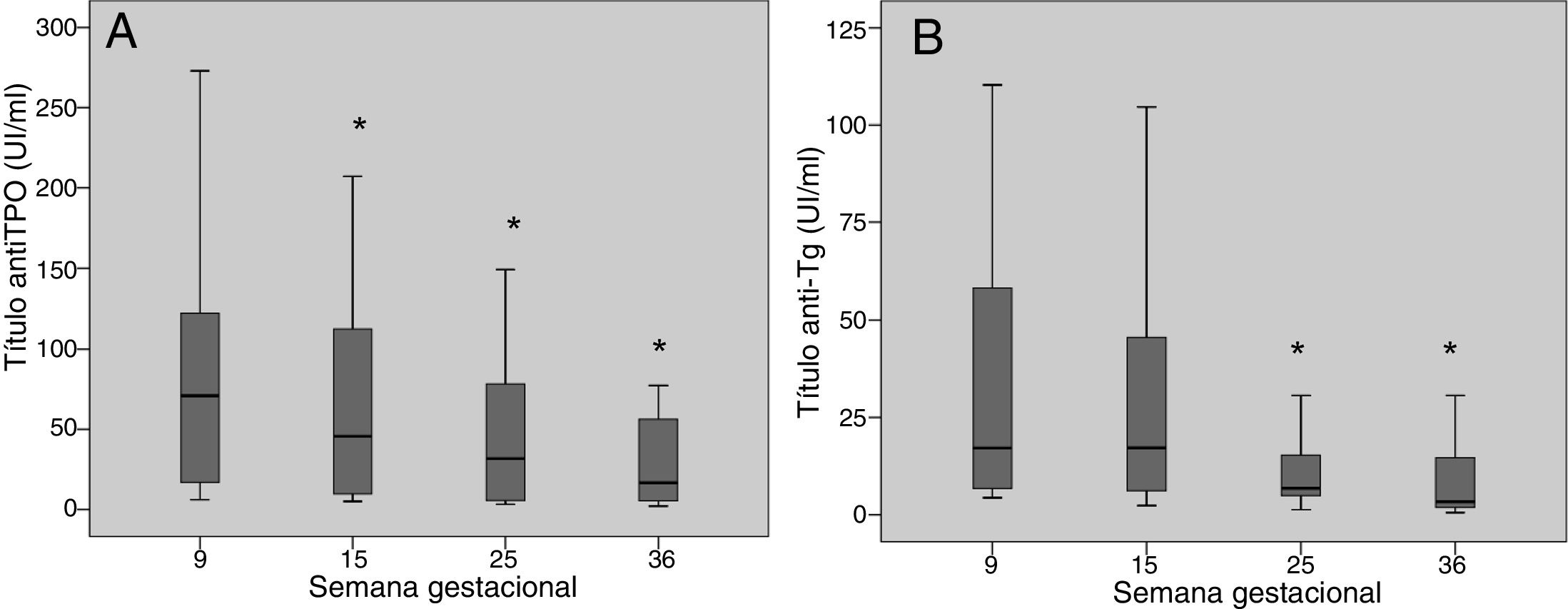
Evolución de los anticuerpos antitiroideosLas determinaciones analíticas se realizaron en las siguientes semanas gestacionales (mediana [P25-P75]): semana 9 [8-9] (n = 300), semana 15 [14-15] (n = 266), semana 25 [25-26] (n = 98) y semana 36 [36-37] (n = 248).
Los títulos de anticuerpos TPO y anti-Tg disminuyeron a lo largo del embarazo de forma significativa (fig. 1). Entre la primera y la última determinación analítica (semanas gestacionales 9 y 36 respectivamente) los anticuerpos TPO disminuyeron un 76,8%, negativizándose en 6 mujeres (21,4%), y los anti-Tg disminuyeron un 80,7% y se negativizaron en 18 mujeres (40%).
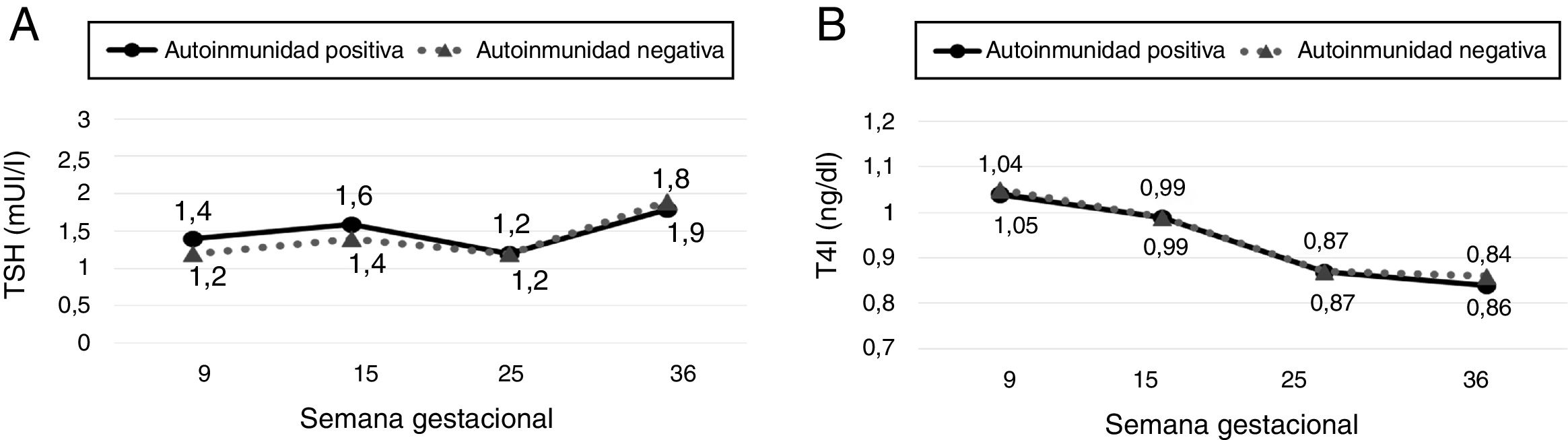
Evolución de la función tiroidea y aparición de hipotiroidismoLas cifras de TSH y T4l a lo largo del embarazo fueron similares en las mujeres con enfermedad tiroidea autoinmune comparadas con las gestantes con autoinmunidad negativa (fig. 2). No hubo diferencias significativas en las concentraciones de TSH y T4l entre ambos grupos en ninguna de las semanas gestacionales en que se realizaron las determinaciones analíticas.
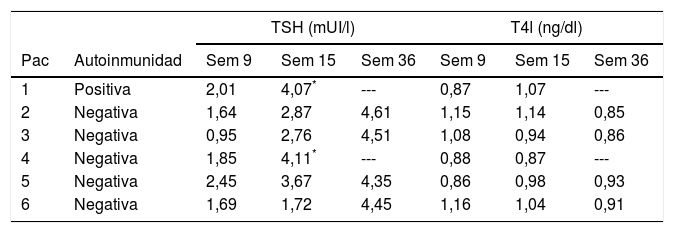
Durante el seguimiento, la TSH aumentó por encima de 4 mUI/l en una de las 53 gestantes del grupo con autoinmunidad positiva (1,9%), y en 5 de las 247 de las mujeres con autoinmunidad negativa (2%). El hipotiroidismo fue detectado en la semana 15 en 2 gestantes, y en la semana 36 en las otras 4. En ningún caso la TSH aumentó por encima de 5 mUI/l (tabla 2). Las gestantes que desarrollaron hipotiroidismo (n = 6) tenían cifras de TSH superiores al inicio del embarazo en comparación con las mujeres que mantuvieron TSH ≤4 mUI/l a lo largo del embarazo (TSH 1,8 vs. 1,3 mUI/l, p = 0,047), sin encontrarse otras diferencias significativas.
Evolución de la función tiroidea en las mujeres que desarrollaron hipotiroidismo durante el seguimiento
| TSH (mUI/l) | T4l (ng/dl) | ||||||
|---|---|---|---|---|---|---|---|
| Pac | Autoinmunidad | Sem 9 | Sem 15 | Sem 36 | Sem 9 | Sem 15 | Sem 36 |
| 1 | Positiva | 2,01 | 4,07* | --- | 0,87 | 1,07 | --- |
| 2 | Negativa | 1,64 | 2,87 | 4,61 | 1,15 | 1,14 | 0,85 |
| 3 | Negativa | 0,95 | 2,76 | 4,51 | 1,08 | 0,94 | 0,86 |
| 4 | Negativa | 1,85 | 4,11* | --- | 0,88 | 0,87 | --- |
| 5 | Negativa | 2,45 | 3,67 | 4,35 | 0,86 | 0,98 | 0,93 |
| 6 | Negativa | 1,69 | 1,72 | 4,45 | 1,16 | 1,04 | 0,91 |
Valores de TSH (mUI/l) y T4l (ng/dl) en las semanas gestacionales 9, 15 y 36 en las mujeres que desarrollaron hipotiroidismo a lo largo del seguimiento.
Pac: paciente; Sem: semana gestacional.
Durante el seguimiento se produjeron 12 abortos: uno en el grupo de gestantes con autoinmunidad positiva y 11 en el grupo control (1,9% vs. 4,5%; p = 0,387). La frecuencia de parto pretérmino fue 7,5% y 5,2% respectivamente (p = 0,547). Tampoco se encontraron diferencias significativas en las tasas de aborto o parto pretérmino al comparar por separado a las mujeres con TPO positivos y a las que presentaron exclusivamente anti-Tg, frente a las gestantes con autoinmunidad negativa.
DiscusiónLos resultados de nuestro estudio ponen de manifiesto que las gestantes con autoinmunidad tiroidea positiva y TSH < 2,5 mUI/l al inicio del embarazo, tienen un riesgo mínimo de desarrollar hipotiroidismo, similar al de mujeres con autoinmunidad negativa.
La prevalencia de autoinmunidad tiroidea positiva en gestantes es muy variable en los distintos estudios1,11, probablemente debido a los diferentes métodos analíticos empleados, puntos de corte establecidos y características de la población estudiada (etnia, estado de yodación...). En nuestro trabajo, el 17,7% de las gestantes tenían anticuerpos antitiroideos positivos en el primer trimestre, destacando que casi la mitad de ellas tenían positividad exclusivamente para anti-Tg. Aunque la presencia de anticuerpos antitiroideos se ha asociado en algunos estudios con la edad y con la paridad7, en nuestro trabajo no hemos encontrado relación entre la presencia de autoinmunidad y dichas variables. Tal y como ha sido descrito previamente10,14,15, los títulos de anticuerpos TPO y anti-Tg disminuyeron alrededor de un 80% a lo largo del embarazo, negativizándose en el 21 y 40% de las mujeres respectivamente. Por tanto, en los casos en los que se considere clínicamente adecuado, el análisis de la autoinmunidad tiroidea debe ser lo más precoz posible en el embarazo, ya que el valor diagnóstico de los anticuerpos antitiroideos en la segunda mitad de la gestación es limitado.
Con respecto a los principales eventos adversos asociados a la autoinmunidad tiroidea (aborto y parto pretérmino) no encontramos diferencias significativas entre las mujeres con anticuerpos positivos comparadas con el grupo control. En este sentido, hay que recordar que la visita presencial tuvo lugar en la semana gestacional 10 (rango 6-18) por lo que en algunos casos los abortos ya se habrían producido. El hecho de que las mujeres incluidas en este trabajo presentaran una TSH basal < 2,5 mUI/l (y no desarrollaran hipotiroidismo a lo largo del embarazo) refleja probablemente formas leves o iniciales de enfermedad tiroidea autoinmune.
Se considera que las mujeres con enfermedad tiroidea autoinmune tienen un riesgo aumentado de desarrollar hipotiroidismo en el embarazo, debido a la incapacidad de la glándula tiroidea para responder al aumento de producción hormonal ligado a la gestación16. Dos estudios previos realizados en gestantes eutiroideas con autoinmunidad positiva encontraron una progresión a hipotiroidismo cercana al 20%15,17. El riesgo de hipotiroidismo fue mayor en las gestantes con cifras de TSH basal > 2 mUI/l y en aquellas con títulos elevados de anticuerpos TPO. Basándose en los resultados de estos trabajos, las guías clínicas recomiendan monitorizar periódicamente la función tiroidea durante el embarazo en las mujeres con enfermedad tiroidea autoinmune11,18,19. Sin embargo, la aparición de hipotiroidismo en nuestro estudio fue muy baja. Además, en la mayoría de los casos el hipotiroidismo se detectó al final del embarazo, y en todos ellos la cifra de TSH fue inferior a 5 mUI/l. Las principales diferencias entre los trabajos anteriores y el nuestro son, por un lado, el punto de corte de TSH basal de las mujeres incluidas, y por otro, la prevalencia de positividad de los distintos anticuerpos antitiroideos. Con respecto al primer punto, dichos estudios incluyeron mujeres con TSH basal de hasta 4 mUI/l, mientras que en el nuestro, las gestantes con TSH entre 2,5 y 4 mUI/l no fueron incluidas, ya que la mayoría de ellas iniciaron tratamiento con levotiroxina. En lo relativo a los anticuerpos antitiroideos, las gestantes de los estudios de Glinoer et al. y de Negro et al. tenían positividad predominantemente para anticuerpos TPO (el 84% y 100% de las mujeres respectivamente) mientras que en nuestra población predominó la positividad para los anti-Tg. Además, a diferencia de los estudios anteriores, nuestra población es yodosuficiente, y un mejor estado de yodación habría podido influir en una menor frecuencia de progresión a hipotiroidismo. Otros dos estudios posteriores también han encontrado una elevada frecuencia de hipotiroidismo en mujeres con enfermedad tiroidea autoinmune, explicada en gran parte, porque en ambos se definió el hipotiroidismo como una TSH ≥2,5 mUI/l en el primer trimestre, o ≥3 mUI/l posteriormente20,21. Nuestros resultados son similares a los de un trabajo reciente realizado en 140 gestantes australianas con TSH basal < 2,5 mUI/l, en el que ninguna mujer desarrolló hipotiroidismo gestacional10.
ConclusionesEn nuestra población, el riesgo de hipotiroidismo en gestantes con enfermedad tiroidea autoinmune y TSH < 2,5 mUI/l en el primer trimestre es mínimo, y similar al de mujeres con autoinmunidad negativa.
Con los resultados obtenidos se plantea una optimización en el seguimiento de las mujeres eutiroideas con enfermedad tiroidea autoinmune durante el embarazo, en función de los valores de TSH del primer trimestre. De esta manera, se podría seleccionar a las mujeres con mayor riesgo de desarrollar hipotiroidismo, y se evitaría monitorizar de forma innecesaria a las que presentan un riesgo muy bajo.
Las gestantes con TSH < 2,5 mUI/l no precisarían más estudios, ya que incluso en el caso de que tuvieran autoinmunidad positiva (conocida antes del embarazo), el riesgo de desarrollar hipotiroidismo durante la gestación sería mínimo.
En aquellas mujeres con TSH entre 2,5 y 4 mUI/l sería útil determinar los anticuerpos antitiroideos. Si la autoinmunidad es positiva, puede considerarse iniciar tratamiento con levotiroxina (especialmente si hay antecedentes de eventos adversos en embarazos previos, o de tratamientos de reproducción asistida)11. En cuanto al riesgo de hipotiroidismo en este grupo, nuestro trabajo no permite extraer conclusiones (en el momento del estudio las gestantes con TSH > 2,5 mUI/l iniciaban tratamiento con levotiroxina). Sin embargo, en base a los datos de estudios previos, estas mujeres sí tendrían más riesgo de desarrollar hipotiroidismo durante el embarazo, por lo que si no se inicia tratamiento, sería recomendable monitorizar la función tiroidea.
En resumen, las mujeres con enfermedad tiroidea autoinmune y TSH < 2,5 mUI/l en el primer trimestre tienen un riesgo mínimo de hipotiroidismo gestacional, por lo que no sería necesario monitorizar la función tiroidea durante el embarazo en estos casos.
FinanciaciónEste trabajo ha sido financiado en parte por la Fundación de Endocrinología, Nutrición y Diabetes de Navarra.
Autoría/colaboradoresM. Dolores Ollero, Javier Pineda, Juan Pablo Martínez de Esteban, Marta Toni y Emma Anda han realizado contribuciones sustanciales para la concepción y el diseño del estudio, la adquisición, el análisis y la interpretación de los datos. Asimismo, han contribuido a la revisión crítica del contenido del estudio así como a la aprobación definitiva de la versión que se presenta. Mercedes Espada ha contribuido en el análisis de los datos, así como en la revisión crítica y aprobación definitiva de la versión que se presenta.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nos gustaría dar las gracias a las gestantes que han participado en el estudio, así como a las matronas y ginecólogos del Complejo Hospitalario de Navarra por su colaboración.