Los pacientes con enfermedad renal crónica (ERC) y diabetes mellitus (DM) tienen un elevado riesgo cardiovascular. Ambas enfermedades se relacionan con el desarrollo de ateroesclerosis sistémica y calcificación vascular. La prevalencia y la severidad de la calcificación arterial coronaria (CaC) es mayor en personas con DM, independientemente de su función renal. Los datos acerca del papel pronóstico a largo plazo de la CaC en pacientes con DM y ERC son escasos.
Material y métodosSe diseñó un estudio prospectivo que incluía a 137 pacientes (85 en hemodiálisis y 52 con ERC avanzada). Se realizó una tomografía computerizada (TC) helicoidal multicorte coronario basal. La CaC se cuantificó mediante el método de Agatston y los pacientes fueron clasificados en CaC leve-moderada (CaC<400UH) y severa (CaC≥400UH).
ResultadosEl tiempo medio de seguimiento fue de 87,5 meses. El 28% eran pacientes con DM; tenían una CaC más severa, menor nivel de albúmina y una proteína C reactiva más elevada. La albúmina se correlacionó con la CaC severa (r=–0,45; p=0,009). La mortalidad fue del 58%. Los casos con DM mostraban una tendencia lineal de mayor mortalidad en comparación con los sujetos sin DM (Chi cuadrado 3,51, p=0,061). Los pacientes con DM y CaC severa tuvieron, además, una mayor mortalidad en comparación con aquellos con CaC severa sin DM (93% vs.73%; p=0,04).
ConclusionesLos pacientes con ERC avanzada y DM presentan una CaC más severa, datos bioquímicos compatibles con una mayor inflamación-malnutrición y una mayor mortalidad en comparación con aquellos sin DM.
Patients with chronic kidney disease (CKD) and diabetes mellitus (DM) have high cardiovascular risk. Both conditions are related to systemic atherosclerosis and vascular calcification. The prevalence and severity of coronary artery calcification (CaC) is higher in patients with DM, regardless of their renal function. Data about the long-term prognostic role of CaC in diabetic patients with CKD are scarce.
Material and methodsWe carried out a prospective longitudinal study enrolling 137 patients with advanced CKD. A non-enhanced multislice coronary computed tomography (CT) was performed at baseline. CaC was assessed using Agatston method. Patients were stratified according to their CaC score: severe calcification group (CaCs≥400HU) and mild-moderate calcification group (CaCs<400HU).
ResultsThe median follow-up time was 87.5 months. DM was found in 28% of subjects. The patients with DM showed more severe CaC, lower albumin and higher C-reactive protein serum levels. Serum albumin was correlated with severe CaC (r=–0.45, P=.009). Overall mortality rate reached 58%. Patients with DM also tended to have higher mortality compared to non-diabetic subjects (X2 3.51, P=.061) especially those with severe CaC showed higher mortality than those with severe CaC without DM (93% vs.73%, P=.04).
ConclusionsPatients with advanced CKD and DM have more severe CaC, increased inflammation-malnutrition data and higher mortality compared to those without DM.
Los pacientes con enfermedad renal crónica (ERC) presentan un riesgo cardiovascular (CV) aumentado —hasta el 40% de las muertes son debidas a enfermedad CV1—. Al igual que en la ERC, la enfermedad CV es la principal causa de morbimortalidad en pacientes con diabetes mellitus (DM), siendo el riesgo de enfermedad arterial coronaria hasta 5 veces mayor en pacientes con DM tipo 2 respecto a sujetos sin la enfermedad2,3.
La DM es un factor de riesgo para el desarrollo de ateroesclerosis sistémica y calcificación vascular4. Existe una correlación entre la calcificación arterial coronaria (CaC) y la presencia de ateroesclerosis. Concretamente, el grado de CaC cuantificado mediante una tomografía computerizada (TC) se correlaciona de forma estrecha con la cuantificación histológica de calcio a este nivel en sujetos asintomáticos en todos los rangos de edad5.
Los mecanismos implicados en la calcificación vascular son múltiples y complejos, como la inflamación crónica, el estrés oxidativo y el disbalance en el metabolismo óseo-mineral6. El proceso de calcificación vascular y de las lesiones de ateroesclerosis es un proceso activo similar al implicado en la formación ósea. Existe una transformación de las células musculares lisas en células con fenotipo osteoblástico. Estudios in vitro han objetivado que la hiperglucemia es capaz de inducir dicha transformación y aumentar la expresión de proteínas de la matriz ósea, como la BMP-2 (proteína morfogenética ósea) y BMP-4 a nivel de la capa media arterial7.
La prevalencia de la CaC es mayor en pacientes con DM, independientemente de su función renal, alcanzando el 70% en algunas series8. A su vez, la CaC es especialmente prevalente en los pacientes con ERC, incluso en etapas precoces de la enfermedad renal1,9-11. Los pacientes con ERC avanzada que reciben tratamiento renal sustitutivo tienen una calcificación vascular más severa, y esta progresa de forma más rápida, especialmente en los sujetos con DM12.
Recientemente, la CaC se ha asociado con el desarrollo de eventos CV, con mortalidad total y con mortalidad CV en pacientes con ERC avanzada (estadios 4-5) y en hemodiálisis13,14. Sin embargo, existen pocos estudios que analicen la influencia de la DM en la CaC de los enfermos con ERC avanzada y su valor pronóstico de mortalidad en dichos pacientes.
En este estudio analizamos la CaC medida mediante tomografía computarizada sincronizada multicorte (TCMC) en una población con DM y ERC avanzada, tanto en hemodiálisis como en situación prediálisis. También investigamos la asociación de la CaC con la mortalidad en esta población.
MétodosCohorte de estudio y registro de datosSe realizó un análisis post-hoc de los datos basales de la serie previamente descrita15 para determinar las características diferenciales y la CaC de los pacientes con DM tipo 2 frente a los casos sin DM (cohortes), en terapia renal sustitutiva y con ERC avanzada en situación de prediálisis.
Se incluyeron 137 pacientes en seguimiento longitudinal y prospectivo durante 10 años (desde enero de 2005 hasta julio de 2015) en la Unidad de Nefrología del Hospital Universitario Príncipe de Asturias. Los datos clínicos y de laboratorio se comprobaron mediante la utilización de las historias clínicas, tanto electrónicas como las depositadas en el archivo del centro.
Los criterios de inclusión fueron: edad mayor de 18 años, ERC en estadios 4-5 y en programa de hemodiálisis crónica (con una permanencia de al menos 6 meses previos a la inclusión). Los criterios de exclusión incluyeron: fracaso renal agudo, enfermedad glomerular activa, embarazo, enfermedades intercurrentes que condicionasen un pronóstico vital inferior al año y la imposibilidad para realizar una TCMC (portadores de prótesis valvulares mecánicas o stent coronarios). Se excluyeron los pacientes con trasplante renal, tanto a su entrada en el estudio como durante el seguimiento.
Todos los pacientes firmaron el consentimiento informado. El protocolo del estudio fue aprobado por el comité ético local.
Al inicio del seguimiento se realizó a todos los pacientes una TCMC sin contraste intravenoso para valorar la CaC basal. Se empleó una TC de 16 detectores Light Speed Plus GE Medical System. El procesado de imágenes se llevó a cabo en una consola Advantage Workstation 4.0. La cuantificación de CaC se realizó siguiendo el método de Agatston, que establece un umbral de 130 unidades Hounsfield (UH) para determinar si una lesión se encuentra o no calcificada; posteriormente se calcula una puntuación para cada lesión individual, multiplicando el área por un cofactor, que depende del valor máximo de UH de cada lesión. Finalmente, el score de calcificación se calcula sumando la puntuación de la calcificación de la arteria coronaria principal izquierda, de la descendente anterior izquierda, de la circunfleja y de la coronaria derecha16.
Las puntuaciones de CaC con un score entre 100 y 400UH indican ateroesclerosis moderada y una probabilidad relativamente alta de enfermedad coronaria; los valores de calcio>400UH indican una grave y extensa enfermedad ateroesclerótica, con elevada probabilidad de enfermedad coronaria obstructiva y elevado riesgo de isquemia miocárdica sintomática17. Siguiendo esta premisa, se establecieron 2 categorías de calcificación según la puntuación o score de la CaC basal (CaCs): grupo de CaC leve-moderada (CaCs<400UH) y grupo de CaC severa (CaCs≥400UH).
Como parte de la valoración rutinaria de la unidad de nefrología, se obtuvo una muestra de sangre en el mes previo a la realización de la TCMC para la determinación de parámetros bioquímicos relacionados con la función renal, con el metabolismo lipídico y óseo-mineral.
Como control de eficacia de la hemodiálisis se recogió la estimación del aclaramiento de urea normalizado para el agua corporal total (Kt/V). Este parámetro tiene en cuenta el aclaramiento de la urea del dializador, calculado mediante dialisancia iónica (k), la duración de la terapia de diálisis (t) (en minutos) y el volumen de distribución corporal de la urea (V). El objetivo mínimo clínico para alcanzar un Kt/V adecuado se estableció entre 1,2 y 1,3 por sesión18.
El tiempo de permanencia en hemodiálisis se definió como el tiempo transcurrido desde la entrada del paciente en hemodiálisis hasta el día de la realización de la TCMC.
Durante el periodo de seguimiento se registró la mortalidad por cualquier causa. La supervivencia se definió como el tiempo desde el momento del reclutamiento hasta el fallecimiento del paciente por cualquier causa.
Análisis estadísticoLas variables cuantitativas con distribución normal se expresaron como su media y desviación estándar, mientras que aquellas con distribución no gaussiana se expresaron como mediana y rangos intercuartílicos. La distribución de las variables se comprobó con la prueba de Kolmogorov-Smirnov. Los sujetos se dividieron en 2 grupos según la presencia o no de DM tipo 2. Para comparar ambos grupos se realizó el test de Chi cuadrado y sus residuos estandarizados, según estuviera indicado; para las variables dicotómicas y cuantitativas se utilizó una prueba de la «t» de Student, o el test de Kruskal-Wallis, de acuerdo a su distribución. La correlación de Spearman se utilizó para estudiar el grado de asociación entre el CaCs en los pacientes con DM y el resto de las variables numéricas.
Para la determinación de la asociación del CaCs con la mortalidad en los pacientes con DM tipo 2, en comparación con aquellos sin DM, se utilizó una regresión proporcional de Cox univariado, con un grado de significación de la p<0,1. Los datos se presentan según el hazard ratio (HR) e intervalos de confianza del 95% (IC 95%).
Para estimar y describir la frecuencia de eventos de mortalidad en los casos con y sin DM se realizó el test de Kaplan-Meier, y para comparar las curvas de supervivencia entre los grupos definidos de CaCs la prueba de Mantel-Cox (log rank test).
Un valor de p<0,05 se consideró significativo, salvo que se especificara otro punto de corte. El análisis estadístico se realizó mediante el programa SPSS 20.0 (Chicago, IL, EE. UU.).
ResultadosSe incluyeron 137 pacientes, 85 en programa de hemodiálisis y 52 con ERC en situación de prediálisis. La mediana de tiempo de seguimiento fue de 87,5 meses (IQR 29,5-111). La mediana de edad fue de 66 años (IQR 51,5-71) y la mediana de tiempo de permanencia en hemodiálisis fue de 25 meses (IQR 10-53). El 28% de los sujetos tenía DM tipo 2 (n=38) y el 89% padecía de hipertensión arterial (según la Joint National Committee 7 y/o estar recibiendo terapia con algún fármaco antihipertensivo).
De los pacientes con DM, el 60,5% estaba en terapia renal sustitutiva; el resto estaba en situación prediálisis. De este último grupo, el 40% presentaba un estadio 4 de ERC.
La prevalencia de CaC en la muestra total fue del 87%. Los valores de CaCs oscilaban de 0 a 8.798UH, con una mediana de 600UH (70-1.794). El 61% de los sujetos presentaba una CaC severa (CaCs≥400UH).
El Kt/V global de la serie alcanzó una media de 1,39 (0,29). Realizando un análisis por cohortes, en los pacientes con DM el Kt/V estimado fue 1,26 (0,31), y en los casos sin DM de 1,43 (0,27) (p=0,027). En ambos grupos se llegó al objetivo mínimo recomendado (Kt/V≥1,2).
La prevalencia de CaC en los sujetos con DM fue del 97%. El 84,2% (n=32) de estos pacientes pertenecían a la categoría de CaC severa (CaCs≥400UH), frente al 52% (n=51) de los pacientes sin DM (p=0,001); por otra parte, solamente el 2,6% de los sujetos con DM no mostró CaC en la TCMC (CaCs=0UH), frente a un 17,3% de los pacientes sin DM (p=0,04). La media del CaCs (2,070 [1.257,47]) fue significativamente más alta en el grupo de DM de largo tiempo de evolución (más de 10 años) en comparación con aquellos con menos tiempo de evolución de la enfermedad (580,67 [505,61] [p=0,023]).
De los pacientes con DM, el 79,3% estaba en terapia con insulina. El tiempo medio de evolución de la DM fue de 20,63 años (6,89). El nivel medio de HbA1c estimado en este grupo fue del 7,07% (1,66).
No hubo diferencia significativa en el grado de CaC en los casos con DM en hemodiálisis comparado con el grupo en prediálisis (1.870,3 [IC 95%: 1.239,75-2.500,86] vs. 1.515,93 [IC 95%: 537,27-2.494,6], p=0,89).
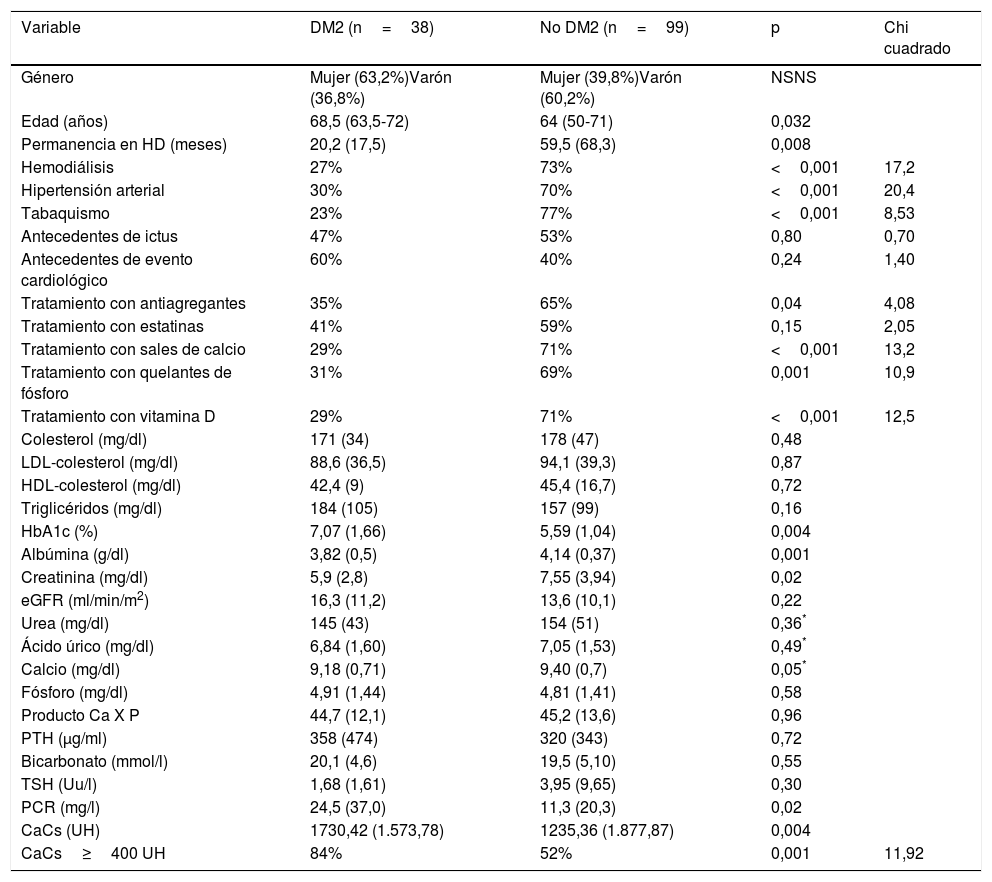
Los pacientes con DM tenían mayor edad —68,5 (63,5-72) años vs. 64 (50-71), p=0,032—, menor tiempo de permanencia previa en hemodiálisis —20,21 (17,46) meses vs. 59,48 (68,28) meses, p=0,008— y una CaC más severa —1.730,42UH (±1.573,78) vs. 1.235,36UH (±1.877,87), p=0,004— en comparación con aquellos sin DM.
En relación con los parámetros de laboratorio, los sujetos con DM tenían un valor de creatinina plasmática inferior (p=0,02), un nivel de albúmina menor (p=0,001) y una proteína C reactiva (PCR) más elevada (p=0,02). El resto de las diferencias en los valores de laboratorio se encuentran recogidos en la tabla 1.
Comparación de variables demográficas, clínicas y bioquímicas al inicio del estudio, en pacientes ERC con y sin diabetes mellitus tipo 2
| Variable | DM2 (n=38) | No DM2 (n=99) | p | Chi cuadrado |
|---|---|---|---|---|
| Género | Mujer (63,2%)Varón (36,8%) | Mujer (39,8%)Varón (60,2%) | NSNS | |
| Edad (años) | 68,5 (63,5-72) | 64 (50-71) | 0,032 | |
| Permanencia en HD (meses) | 20,2 (17,5) | 59,5 (68,3) | 0,008 | |
| Hemodiálisis | 27% | 73% | <0,001 | 17,2 |
| Hipertensión arterial | 30% | 70% | <0,001 | 20,4 |
| Tabaquismo | 23% | 77% | <0,001 | 8,53 |
| Antecedentes de ictus | 47% | 53% | 0,80 | 0,70 |
| Antecedentes de evento cardiológico | 60% | 40% | 0,24 | 1,40 |
| Tratamiento con antiagregantes | 35% | 65% | 0,04 | 4,08 |
| Tratamiento con estatinas | 41% | 59% | 0,15 | 2,05 |
| Tratamiento con sales de calcio | 29% | 71% | <0,001 | 13,2 |
| Tratamiento con quelantes de fósforo | 31% | 69% | 0,001 | 10,9 |
| Tratamiento con vitamina D | 29% | 71% | <0,001 | 12,5 |
| Colesterol (mg/dl) | 171 (34) | 178 (47) | 0,48 | |
| LDL-colesterol (mg/dl) | 88,6 (36,5) | 94,1 (39,3) | 0,87 | |
| HDL-colesterol (mg/dl) | 42,4 (9) | 45,4 (16,7) | 0,72 | |
| Triglicéridos (mg/dl) | 184 (105) | 157 (99) | 0,16 | |
| HbA1c (%) | 7,07 (1,66) | 5,59 (1,04) | 0,004 | |
| Albúmina (g/dl) | 3,82 (0,5) | 4,14 (0,37) | 0,001 | |
| Creatinina (mg/dl) | 5,9 (2,8) | 7,55 (3,94) | 0,02 | |
| eGFR (ml/min/m2) | 16,3 (11,2) | 13,6 (10,1) | 0,22 | |
| Urea (mg/dl) | 145 (43) | 154 (51) | 0,36* | |
| Ácido úrico (mg/dl) | 6,84 (1,60) | 7,05 (1,53) | 0,49* | |
| Calcio (mg/dl) | 9,18 (0,71) | 9,40 (0,7) | 0,05* | |
| Fósforo (mg/dl) | 4,91 (1,44) | 4,81 (1,41) | 0,58 | |
| Producto Ca X P | 44,7 (12,1) | 45,2 (13,6) | 0,96 | |
| PTH (μg/ml) | 358 (474) | 320 (343) | 0,72 | |
| Bicarbonato (mmol/l) | 20,1 (4,6) | 19,5 (5,10) | 0,55 | |
| TSH (Uu/l) | 1,68 (1,61) | 3,95 (9,65) | 0,30 | |
| PCR (mg/l) | 24,5 (37,0) | 11,3 (20,3) | 0,02 | |
| CaCs (UH) | 1730,42 (1.573,78) | 1235,36 (1.877,87) | 0,004 | |
| CaCs≥400 UH | 84% | 52% | 0,001 | 11,92 |
Los datos se presentan como número de pacientes y el porcentaje (N [%]); media y desviación estándar (±SD). Pruebas de Chi-cuadrado, «t» de Student o Kruskal-Wallis*, según corresponda. Permanencia en HD: tiempo desde el inicio de la hemodiálisis hasta el día de realización del MSCT; antecedentes de evento cardiológico: incluye cardiopatía isquémica (angor, infarto agudo de miocardio) e insuficiencia cardiaca.
CaCs (UH): score de calcificación arterial coronaria (unidades Hounsfield); eGFR: filtrado glomerular estimado; PTH: hormona paratiroidea; TSH: hormona tirotropa.
Valor significativo de p<0,05.
En los pacientes con DM, la CaC severa (CaCs>400UH) se correlacionó con los niveles séricos de albúmina (r=–0,45; p=0,009), con la edad (r=0,2; p=0,038) y con el antecedente de evento cardiológico previo (r=0,45; p=0,004) (tabla 2). No se encontró una correlación entre el nivel de HbA1c (%) y la CaC severa. No hubo ninguna otra asociación con el resto de las variables bioquímicas estudiadas, ni con el tiempo de hemodiálisis previo o los antecedentes de hipertensión arterial o ictus.
Variables principales y sus correlaciones con la calcificación coronaria severa (≥400UH) en la cohorte de pacientes con diabetes mellitus tipo 2
| Variables | Rho de Spearman/r de Pearson | p |
|---|---|---|
| HbA1c (%) | ρ<0,1 | 0,93 |
| Albúmina sérica (g/dl) | r=–0,45 | 0,009 |
| PCR (mg/l) | ρ<0,1 | 0,43 |
| Edad | r=0,2 | 0,038 |
| Tiempo en hemodiálisis (meses) | ρ=0,25 | 0,024 |
| Antecedente de evento cardiológico previo | r=0,45 | 0,004 |
Durante el periodo de seguimiento, la mortalidad total de la muestra fue del 58% (n=80). En el grupo de sujetos con DM fallecieron el 74% (n=28). De estos el 93% pertenecían al grupo de CaC severa frente a un 73% en el caso de los sujetos fallecidos sin DM (Chi cuadrado 4,41, p=0,04).
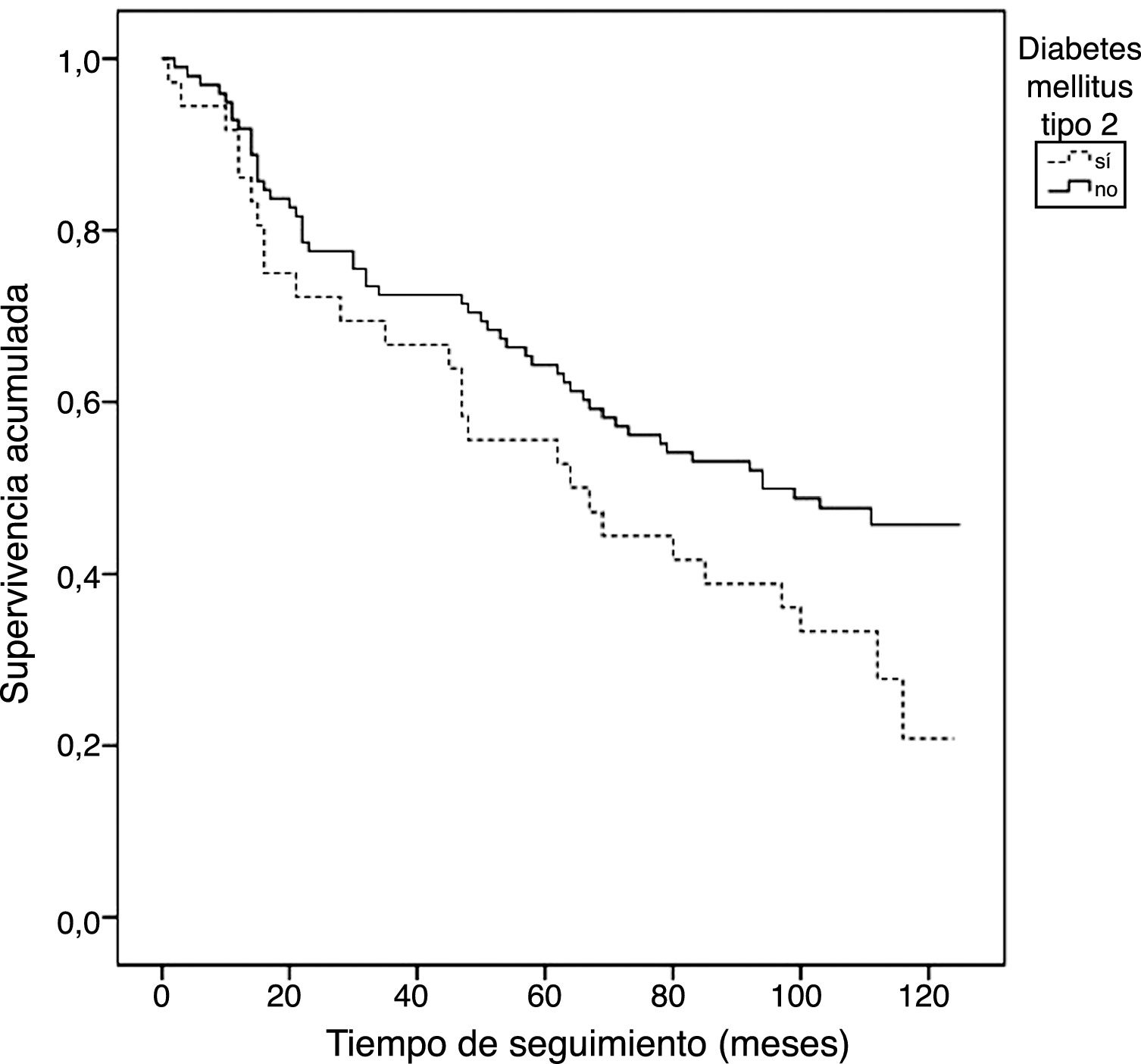
Según el análisis de supervivencia de Kaplan-Meier (no ajustado) para mortalidad total, los pacientes con DM presentaban una tendencia lineal de mayor mortalidad a lo largo del seguimiento, en comparación con los pacientes sin DM (67,72 [IC 95%: 53,11-93,34] meses vs. 81,53 [IC 95%: 72,37-90,68] meses, Chi cuadrado: 3,51, p=0,061) (fig. 1).
En el análisis de supervivencia univariado de Cox, los sujetos con DM con un CaCs≥400UH presentaban un riesgo de mortalidad aumentado a lo largo del periodo de seguimiento, aunque sin llegar a alcanzar la significación estadística (HR 1,63, IC 95%: 0,9-2,98; p=0,11). Este grupo no se pudo comparar con el grupo de casos con DM y un CaCs<400UH debido al bajo número de eventos de mortalidad registrados en este último (2 eventos). Tampoco se alcanzó la significación estadística en el caso de la mortalidad en los sujetos sin DM y con CaCs≥400UH (HR: 1,41, IC 95% 0,75-2,64; p=0,29). El resto de las variables estudiadas no se asociaron de forma significativa con un incremento de la mortalidad (datos no mostrados) en el grupo de DM.
DiscusiónEn nuestra serie los sujetos con DM tenían una PCR más elevada y un nivel sérico de albúmina, lo cual podría indicar un mayor componente de inflamación. Es conocido que el complejo malnutrición-inflamación en pacientes en diálisis es un problema frecuente, y se asocia a una mayor morbimortalidad19. Además, existe una asociación entre este complejo y la hipoalbuminemia con la calcificación vascular en pacientes en tratamiento renal sustitutivo20. A su vez, está descrita una relación entre el estado nutricional y el metabolismo óseo. En este sentido parece que la hipoalbuminemia aumenta la síntesis de citocinas proinflamatorias y se relaciona con la enfermedad ósea adinámica21,22. En nuestro estudio obtuvimos una correlación negativa entre los niveles de albúmina y la calcificación vascular severa en los pacientes con DM, siendo esta correlación más débil en los casos sin DM (r=–0,25; p=0,03). Por lo tanto, una disminución en el nivel plasmático de albúmina podría ser un marcador de mayor CaC en los sujetos con DM y ERC avanzada.
Los sujetos dializados que tenían DM presentaron un Kt/V menor que aquellos sin DM. Está bien documentado que en los pacientes con DM son más frecuentes los eventos hemodinámicos intradiálisis, además de presentar un mayor riesgo de disfunción del acceso vascular; estos factores pueden interferir en la calidad de la diálisis23. Además, hay que tener en cuenta también las limitaciones del Kt/V como parámetro de eficacia dialítica, ya que para su correcta interpretación hay que contar con diferentes factores, como el sexo, el tamaño del paciente, la masa muscular y la edad24. A pesar de lo previo, la media estimada de Kt/V en los pacientes con DM no fue inferior al objetivo mínimo de 1,2.
En nuestro estudio, los pacientes con DM y ERC tenían una mayor prevalencia de CaC y un CaCs más elevado en comparación con el grupo sin DM. Se sabe que la hiperglucemia afecta a la calcificación vascular a través de múltiples mecanismos como el estrés oxidativo, los productos finales de glicación avanzada y la disfunción endotelial. Estos factores producen un aumento de especies de oxígeno reactivas que inducen un cambio fenotípico de las células musculares vasculares a óseas7. La resistencia a la insulina y los niveles de leptina son también factores implicados en la ateroesclerosis y la calcificación vascular25. Por otro lado, no objetivamos correlación entre la HbA1c (%) y el CaC score. Este resultado podría explicarse porque la HbA1c no es un buen parámetro de control metabólico en esta población. En pacientes con ERC avanzada y en hemodiálisis, la HbA1c es un marcador que puede infraestimar el control glucémico. La supervivencia del eritrocito está disminuida, y además el tratamiento con estimulantes de la eritropoyetina aumenta la proporción de precursores jóvenes de hematíes, produciéndose un falso descenso de la HbA1c26.
Estudios previos han confirmado que existe una mayor prevalencia de CaC en la población con DM, llegando a alcanzar cifras del 80% según la serie analizada3,27,28. En el caso de pacientes con nefropatía diabética esta prevalencia era aún mayor28. El 84% de los sujetos con DM de nuestra serie tenían un CaCs severo, un porcentaje superior al observado en otras poblaciones analizadas de DM sin la enfermedad renal3,28,29. Esto puede ser debido en parte a la influencia adicional de la ERC avanzada sobre el metabolismo mineral-óseo1,11. Además, los pacientes con DM y ERC tienen mayor riesgo de progresión de la CaC y un mayor aumento cuantitativo de dicha progresión que aquellos sin DM9–10. Kronmal et al., tras analizar una serie de sujetos sin enfermedad CV conocida, concluyeron que la DM era el factor de riesgo predictivo más potente para la progresión de la CaC, permaneciendo el tiempo de evolución de la enfermedad como único factor de riesgo de progresión de la calcificación vascular30.
Aunque en sujetos con DM la CaC se asocia con la presencia de albuminuria y nefropatía diabética, no está claro si existen diferencias en la severidad de la CaC según el estadio de ERC en esta población31. En el presente estudio no se obtuvo una diferencia significativa en el grado de CaC de las personas con DM y en hemodiálisis frente a los casos con DM en prediálisis.
Los pacientes con DM tienen una menor esperanza de vida, siendo la enfermedad CV la principal responsable2. En nuestra serie, el análisis de Kaplan Meier objetivó una mayor mortalidad en los sujetos con DM a lo largo del periodo de seguimiento. Además, se observó una mayor mortalidad en los pacientes con diabetes con CaC severa respecto a aquellos con un menor grado de calcificación.
En pacientes con ERC avanzada y hemodiálisis, el CaCs tiene un papel predictivo sobre la mortalidad independientemente de otros factores de riesgo CV tradicionales1,13,14. A su vez, estudios previos han determinado que, en el caso de los pacientes con DM, aquellos con una mayor CaC tienen una mayor mortalidad y un mayor riesgo de eventos CV3,29,32. En un metaanálisis recientemente publicado los pacientes con DM con un CaCs≥10UH tenían un riesgo relativo de mortalidad y eventos cardiovasculares de 5,47 (IC 95%: 2,59-11,53; p<0,001)33.
En el análisis univariado de Cox no encontramos una asociación significativa entre el CaCs y la mortalidad en los pacientes con DM. En la literatura existen pocos estudios que analicen la capacidad predictiva de riesgo CV y de mortalidad de la CaC en el caso de los sujetos con DM y ERC10. Esta población tiene mayor prevalencia de CaC, una CaC más severa y una mayor mortalidad que aquellos sin DM. Por lo tanto, es necesario determinar la utilidad del CaCs como herramienta pronóstica en este subgrupo de pacientes con DM. Es importante aclarar si el tratamiento precoz de algunos de los factores etiopatogénicos implicados en la calcificación vascular modifica el curso de la misma.
El presente estudio es un subanálisis post-hoc y tiene un pequeño tamaño muestral, por lo que los resultados obtenidos deben considerarse como preliminares. La relativa baja prevalencia de pacientes con DM puede haber afectado a la potencia del análisis estadístico, y no nos ha permitido realizar ajustes por otros factores de riesgo CV tradicionales. Además, no disponemos de una TCMC de control para valorar la progresión de la CaC durante el seguimiento, por lo que desconocemos si la presencia de diabetes, el tratamiento o las modificaciones en el mismo pudiesen influir en la evolución de la CaC.
No registramos la proteinuria y, por tanto, no podemos descartar su influencia en las diferencias encontradas en los valores de albúmina sérica. Sin embargo, cabe destacar que son pacientes en su mayoría dializados sin prácticamente función renal residual. Los cambios en los niveles de albúmina sérica, en su caso, estarían condicionados en gran medida por una falta de ingesta de proteína y/o un aumento del catabolismo proteico. Por otro lado, señalamos que la causa más frecuente de ERC en los pacientes con DM era la nefropatía diabética, la cual no cursa de forma típica con un síndrome nefrótico; Además, el síndrome nefrótico suele aparecer en el contexto de una enfermedad glomerular activa y la prevalencia de glomerulonefritis en esta población fue<2%.
Finalmente, podemos concluir que la prevalencia y severidad de la CaC es elevada en los pacientes con ERC avanzada y hemodiálisis, siendo mayor en los sujetos con DM asociada. Los pacientes con DM y ERC tienen un menor nivel de albúmina y una PCR más elevada que aquellos sin DM. La albumina sérica se correlaciona de forma negativa con la CaC severa, siendo esta asociación más fuerte en el caso de los pacientes con DM.
Nuestro análisis mostró que los pacientes con DM con ERC avanzada y una CaC severa (≥400UH) tienen una mayor mortalidad que aquellos con CaC severa sin DM.
No obtuvimos un resultado estadísticamente significativo para atribuir al CaCs≥400UH una capacidad predictiva de mortalidad en esta población. Serían necesarios estudios con mayor tamaño muestral para determinar el potencial papel predictivo de la CaC sobre la mortalidad total y CV en los pacientes con DM y ERC avanzada, y su implicación a la hora de individualizar el tratamiento para disminuir la morbimortalidad en estos pacientes.
Conflicto de interesesNinguno.