Determinar el comportamiento de la relación triglicéridos/colesterol HDL (TG/cHDL) como indicador de riesgo cardiometabólico en niños y adolescentes escolarizados de la ciudad de Mérida.
MétodosSe estudió a 1.292 niños y adolescentes entre 7 y 18 años de edad, de instituciones educativas del Municipio Libertador. Se registraron medidas antropométricas y la presión arterial. Se determinaron glucemia, insulina y lípidos en ayunas. Se calcularon la relación TG/cHDL y los índices HOMA-IR y QUICKI. Se realizó la clasificación de individuos con riesgo y sin riesgo cardiometabólico a partir de la presencia o no de 2 o más factores de riesgo. Se determinaron puntos de corte de la relación TG/cHDL a través de la construcción de curvas operador receptor (COR).
ResultadosLa relación TG/cHDL presentó medias significativamente superiores en individuos púberes (2,2 ± 1,7) en comparación con prepúberes (1,8 ± 1,5; p = 0,001), sin diferencias según el género. El 14,7% (n = 192) de los participantes presentaba 2 o más factores de riesgo y los valores de la relación TG/cHDL fueron significativamente mayores en comparación con aquellos sin riesgo (3,5 ± 2,9 frente a 1,6 ± 0,8 en prepúberes y 4,1 ± 3,5 frente a 1,8 ± 0,9 en púberes; p = 0,0001). De acuerdo con el riesgo cardiometabólico, se obtuvieron puntos de corte para la relación TG/cHDL de 1,8 y 2,5 en prepúberes y púberes, respectivamente. Estos puntos de corte muestran riesgos (odds ratios) superiores a 2,5 para alteraciones como síndrome metabólico, colesterol no HDL elevado, obesidad abdominal y HOMA-IR elevado.
ConclusiónEn esta muestra de niños y adolescentes, la relación TG/cHDL elevada demostró ser un buen marcador para predecir riesgo cardiometabólico.
To determine the behavior of the triglycerides/HDL-cholesterol ratio (TG/HDL) as a cardiometabolic risk marker in children and adolescents from Mérida, Venezuela.
MethodsA total of 1292 children and adolescents aged 7-18 years who attended educational institutions in the Libertador Municipality were enrolled into this study. Anthropometric measurements and blood pressure values were recorded. Fasting blood glucose, insulin and lipid levels were measured. The TG/HDL ratio, HOMA-IR, and QUICKI indexes were calculated. Subjects were categorized as with and without cardiometabolic risk based on the presence or absence of 2or more risk factors. Cut-off points for the TG/HDL ratio were determined by constructing ROC curves.
ResultsSignificantly higher mean TG/HDL ratios were found in pubertal (2.2 ± 1.7) as compared to prepubertal subjects (1.8 ± 1.5; P=.001), with no sex differences. Two or more risk factors were found in 14.7% (n=192) of the participants, in whom TG/HDL ratios were significantly higher as compared to those with no risk (3.5±2.9 versus 1.6±0.8 in prepubertal and 4.1 ± 3.5 versus 1.8 ± 0.9 in pubertal subjects; P=.0001). According to cardiometabolic risk, cut-off points for the TG/HDL ratio of 1.8 and 2.5 were found for prepubertal and pubertal children respectively. These cut-off points showed risks (odds ratio) higher than 2.5 for conditions such as metabolic syndrome, elevated non-HDL-C, abdominal obesity, and elevated HOMA-IR.
ConclusionIn this sample of children and adolescents, an elevated TG/HDLc ratio was found to be a good marker for predicting cardiometabolic risk.
Las alteraciones en el metabolismo lipídico constituyen un elemento esencial en la formación de la placa ateromatosa, representando hasta un 50% del riesgo cardiovascular atribuible a la población1. Hoy en día, el colesterol de la lipoproteína de baja densidad (cLDL) constituye el primer objetivo terapéutico como prevención primaria y secundaria de enfermedad cardiovascular (ECV)2; sin embargo, existe acuerdo en que la medición del riesgo coronario basado exclusivamente en cLDL no es suficiente3,4, ya que alrededor del 40% de los pacientes que han presentado un evento coronario presentan valores de cLDL normales5,6.
Un fenotipo de LDL pequeñas y densas (patrón B) se ha relacionado con un riesgo cardiovascular 3 veces mayor que aquel con LDL grandes7,8 y se ha asociado significativamente con la llamada dislipidemia aterogénica, caracterizada por triglicéridos (TG) elevados y colesterol de la lipoproteína de alta densidad (cHDL) bajo, que puede explicar del 50 al 67% de la varianza en el tamaño de la LDL9,10. La prevalencia en adultos del denominado patrón B de LDL corresponde al 31-44% de la población general en los Estados Unidos11,12 y hasta el 34% en Japón13. En el 2004, Shimabukuro et al.14, en 586 niños japoneses entre 7 y 12 años, encontraron que un 10,8% de los niños y un 4,4% de las niñas presentaron LDL pequeñas, y los principales determinantes de este patrón lipoproteico fueron las concentraciones plasmáticas más elevadas de glucosa, insulina y TG, y más bajas de cHDL.
La relación TG/cHDL puede reflejar el balance entre lipoproteínas aterogénicas y protectoras y muestra una correlación positiva con la tasa de esterificación de la HDL e inversa con el tamaño de la LDL15. En un estudio clásico, McLaughlin et al.16 observaron que la relación TG/cHDL fue el mejor predictor de insulinorresistencia (IR) y del diámetro de las LDL, donde un punto de corte de 3,5 reconoce, con una alta sensibilidad y especificidad, a los individuos con un fenotipo B de LDL y a sujetos con IR.
En población pediátrica, Hannon et al.17, en 35 adolescentes con sobrepeso, encontraron que aquellos con un índice TG/cHDL ≥ 3 presentaban una menor sensibilidad a la insulina, determinada por clamp euglucémico-hiperinsulinémico, y mayor grasa visceral que aquellos con un valor menor a este punto de corte. En Mérida, Venezuela, Quijada et al.18, en un grupo de 67 niños en etapa prepuberal, comunicaron que el 69% de los niños obesos, el 83% de los que presentaban hipertensión y el 95% de aquellos con síndrome metabólico (SM) presentaban una relación TG/cHDL ≥ 3,5. En un grupo de 884 individuos entre los 6 y 16 años predominantemente obesos (61%), el espesor del tabique interventricular, el espesor relativo de la pared y la masa del ventrículo izquierdo se incrementaban a medida que aumentaba la relación TG/cHDL, y aquellos que superaban un valor de 2 exhibían un incremento de 2 a 3 veces el riesgo de presentar concentraciones elevadas de alanina aminotransferasa (ALT) e hipertrofia concéntrica del ventrículo izquierdo19.
En virtud de que los cambios moleculares anteceden a las manifestaciones clínicas de la enfermedad, y que muchas de las variables bioquímicas implicadas en enfermedades como el SM, diabetes mellitus tipo 2 o la ECV presentan variaciones de acuerdo con el grupo étnico o etario, es importante establecer criterios claros en la edad pediátrica, que permitan una detección temprana y una intervención preventiva apropiada de niños y adolescentes en riesgo. Por ello, el propósito de esta investigación fue determinar el comportamiento de la relación TG/cHDL como indicador de riesgo cardiometabólico, así como determinar los puntos de corte de esta relación a través de la realización de curvas operador receptor (COR) en niños y adolescentes escolarizados de la ciudad de Mérida, Venezuela.
Materiales y métodosSujetosSe realizó una investigación de tipo observacional, de corte trasversal y analítica. La muestra de sujetos proviene de 2bases de datos; en primer lugar, del estudio «Obesidad en escolares de Mérida, Venezuela: asociación con factores de riesgo cardiovascular»20, de Paoli et al., donde participaron sujetos de 7 a 9 años de edad; en segundo lugar, del proyecto denominado «Evaluación del crecimiento, desarrollo y factores de riesgo cardiometabólico en escolares y adolescentes de Mérida, Venezuela (CREDEFAR)»21,22, que se llevó a cabo en el Instituto Autónomo Hospital Universitario de Los Andes (IAHULA) desde marzo del 2010 hasta junio del 2011, con la participación de sujetos de 9 a 18 años de edad. En ambos estudios se realizó un tipo de muestreo por estratificación, proporcional, aleatorizado y polietápico, que garantizó la participación adecuada por sexo, por institución pública o privada (condición socioeconómica) y por ubicación geográfica, obteniéndose una muestra representativa de 1.292 niños y adolescentes entre 7 y 18 años de edad, cursantes desde segundo grado de educación básica hasta quinto año del ciclo diversificado de diferentes Unidades Educativas públicas y privadas del Municipio Libertador de la ciudad de Mérida20-22. La ciudad de Mérida es la capital del estado y el Municipio Libertador es el más importante en desarrollo económico y densidad de población: forma parte del Área Metropolitana de Mérida. Fueron excluidos del estudio escolares y adolescentes con enfermedades crónicas, como cardiopatías, nefropatías, enfermedades endocrinológicas, inmunológicas e infecciosas, así como individuos bajo medicación que afecte las variables a estudiar, y adolescentes embarazadas. Se cumplieron las normas éticas contempladas en la Declaración de Helsinki.
ProcedimientoSe envió a todos los padres y representantes de los niños y adolescentes seleccionados, a través de la dirección de las Unidades Educativas participantes, un folleto informativo donde se explicaban las características y los objetivos del estudio, así como, el consentimiento informado. Los participantes del estudio CREDEFAR21,22 fueron citados un día específico de la semana, a las 7 a. m., en ayunas, en el Laboratorio de Hormonas del IAHULA, en compañía de su representante, mientras que los menores de 9 años, del estudio de Paoli et al.20, fueron atendidos en las escuelas directamente. Se procedió a llenar la ficha de recolección de datos diseñada para esta investigación. Se registraron los datos de identificación personal y familiar, los antecedentes personales patológicos, la medicación actual, los antecedentes familiares, especialmente enfermedades de la esfera cardiometabólica.
Variables antropométricas y presión arterialSe midieron las variables antropométricas en ropa interior y descalzo, siguiendo las normas y técnicas descritas por la National Health and Nutrition Examination Survey 200023. Se registró el peso (en kilogramos) en una báscula estándar calibrada; la talla (en centímetros) se calculó por el promedio de 3tomas en el estadiómetro de Harpenden, con el sujeto en posición firme y la cabeza colocada en el plano de Frankfurt. Se hizo el cálculo del IMC usando la fórmula de IMC = peso (kg)/talla2 (m). La circunferencia de cintura (CC) se midió utilizando una cinta métrica inextensible, en el punto medio entre el reborde costal y la cresta ilíaca, en espiración. La presión arterial se determinó en posición sentada, con un esfigmógrafo de mercurio, con el brazo situado a nivel del corazón, con manguito de tamaño apropiado; se utilizó el método auscultatorio y se registró como presión arterial sistólica (PAS) la lectura correspondiente al primer ruido de Korotkoff y como presión arterial diastólica (PAD) el punto en que desaparecen los mismos o disminuyen en intensidad.
Variables bioquímicasPara la determinación de las variables bioquímicas en el estudio CREDEFAR22 se determinaron la glucemia y la insulina basal, y el lipidograma en ayunas. La determinación de la glucemia, el colesterol total (CT), el cHDL y los TG se realizó por métodos enzimáticos con reactivos de la casa comercial CIENVAR por medio del autoanalizador HITACHI 911 (Roche Diagnostics, USA). El cLDL se calculó mediante la fórmula de Friedewald: cLDL = CT – (TG/5 + cHDL). La concentración de insulina se determinó en 917 participantes a partir de muestra de suero almacenado a –20°C con los analizadores Immulite/Immulite 1000, ensayo inmunométrico quimioluminiscente, de SIEMENS, Diagnostic Products Corporation-DPC (Los Ángeles, California), con coeficientes de variación interensayo e intraensayo de 6,5 y 5,4%, respectivamente24. Los análisis se realizaron en el Laboratorio de Hormonas del IAHULA y, de acuerdo con las posibilidades, se procesaron por duplicado. En el estudio de Paoli et al.20, las determinaciones de glucemia y perfil lipídico se realizaron mediante una toma de muestra de sangre capilar que se procesó en el momento utilizando el sistema LDX plus de la casa comercial Cholestech y casete de reactivos, cuya validez se determinó previamente, donde se demostró alta correlación, así como adecuada sensibilidad y especificidad con las determinaciones estándar del laboratorio25. Con estos datos se obtuvo la relación TG/cHDL; la resistencia a la insulina se calculó mediante la fórmula del Homeostasis Model Assessment (HOMA-IR)26: HOMA-IR = insulina en ayuno (μIU/ml)×glucosa en ayuno (mmol/l)/22,5 y el índice de sensibilidad a la insulina Quantitative Insulin-Sensitivity Index (QUICKI), usando la fórmula: 1/([log insulin 0min] + [log glucemia 0min])27.
Categorización de las variablesPara el estado nutricional se consideró obesidad un IMC por encima del percentil (pc) 97, sobrepeso entre los pc 90 y 97, normopeso entre los pc 10 y 90, y bajo peso un valor inferior al pc 10, según edad y sexo en las curvas para niños y adolescentes venezolanos realizadas por FUNDACREDESA28. Se consideraron prepúberes aquellos con un estadio Tanner 1 y púberes individuos con un estadio Tanner 2 o mayor. Para determinar la dislipidemia se usaron las referencias locales de CREDEFAR obtenidas de la misma población ya publicadas22, y se consideró alterado para las variables TG, CT, cLDL y colesterol no HDL (cNoHDL), un valor mayor al pc 90 por edad y sexo y para cHDL un valor menor al pc 10. Para la determinación de hiperglucemia, se usó el valor de glucemia en ayunas mayor de 100mg/dl. Para diagnosticar los valores de insulina y HOMA-IR elevados, se usaron las referencias por encima del pc 95 de CREDEFAR24; esto es, insulina alta en prepúberes igual o mayor de 9μIU/ml y en púberes de 12μIU/ml; HOMA-IR alto, igual o mayor de 2 en prepúberes y de 2,5 en púberes. Para el diagnóstico de SM se utilizó la clasificación de la ATP III modificada por Cook et al.29 usando como puntos de corte las referencias locales28,29, considerándose SM al cumplir al menos 3criterios diagnósticos: CC (cm) > pc 90 (obesidad abdominal), PAS y PAD (mmHg) > pc 90, TG (mg/dl) > pc 90, cHDL (mg/dl) < pc 10 para edad y sexo, y glucemia en ayunas ≥ 100mg/dl.
Cualquier otra especificación sobre la población, la muestra y la metodología se encuentra en los artículos publicados previamente20-22,24,30. En este estudio, para la categorización del riesgo cardiometabólico se consideraron los siguientes factores de riesgo: obesidad, elevación de TG, elevación de cLDL, disminución de cHDL, HTA o pre-HTA e hiperglucemia. Los participantes se clasificaron en sin riesgo: ausencia o presencia de un solo factor de riesgo y en riesgo: presencia de 2 o más factores de riesgo.
Análisis estadísticoTodos los datos fueron cargados y procesados utilizando el programa SPSS versión 20 para Windows. Las variables cualitativas se presentan como frecuencias absolutas y porcentajes y las variables cuantitativas como medias aritméticas ± desviación estándar. La asociación entre variables cualitativas se determinó con la aplicación de la prueba chi cuadrado. La diferencia estadística entre las variables cuantitativas se determinó con la prueba t de Student para muestras no pareadas. Para buscar los puntos de corte de la relación TG/cHDL se construyeron las curvas COR; para ello, se dividió la muestra en prepúberes y púberes, y estos a su vez se clasificaron en individuos sin riesgo y en riesgo cardiometabólico. Se consideró un área bajo la curva (AUC) óptima de 1,000, mientras un AUC menor a 0,500 se consideró un test con muy poca validez. Para calcular los puntos de corte óptimos por grupo puberal a partir de la curva COR se empleó el índice de Youden calculado a través de la fórmula: (J = sensibilidad + especificidad – 1 = S – [1-Es])31. Se calculó el riesgo (odds ratio [OR]) de presentación de los factores de riesgo cardiometabólico con los puntos de corte obtenidos de la relación TG/cHDL. Se consideró significativo un valor de p < 0,05.
ResultadosLa muestra total estudiada consistió en 1.292 niños y adolescentes de la ciudad de Mérida, de los cuales un 49,5% (n = 639) fueron del sexo masculino y un 50,5% (n = 653) del femenino. La edad promedio de la población fue de 11,70 ± 3,30 años, con un rango entre los 7 y los 18,9 años de edad; el 43,2% (n = 558) eran prepúberes y el 56,8% (n = 734) púberes. El 70,1% de la población estudiada presentó normopeso, el 10,8% sobrepeso y el 8,4% obesidad.
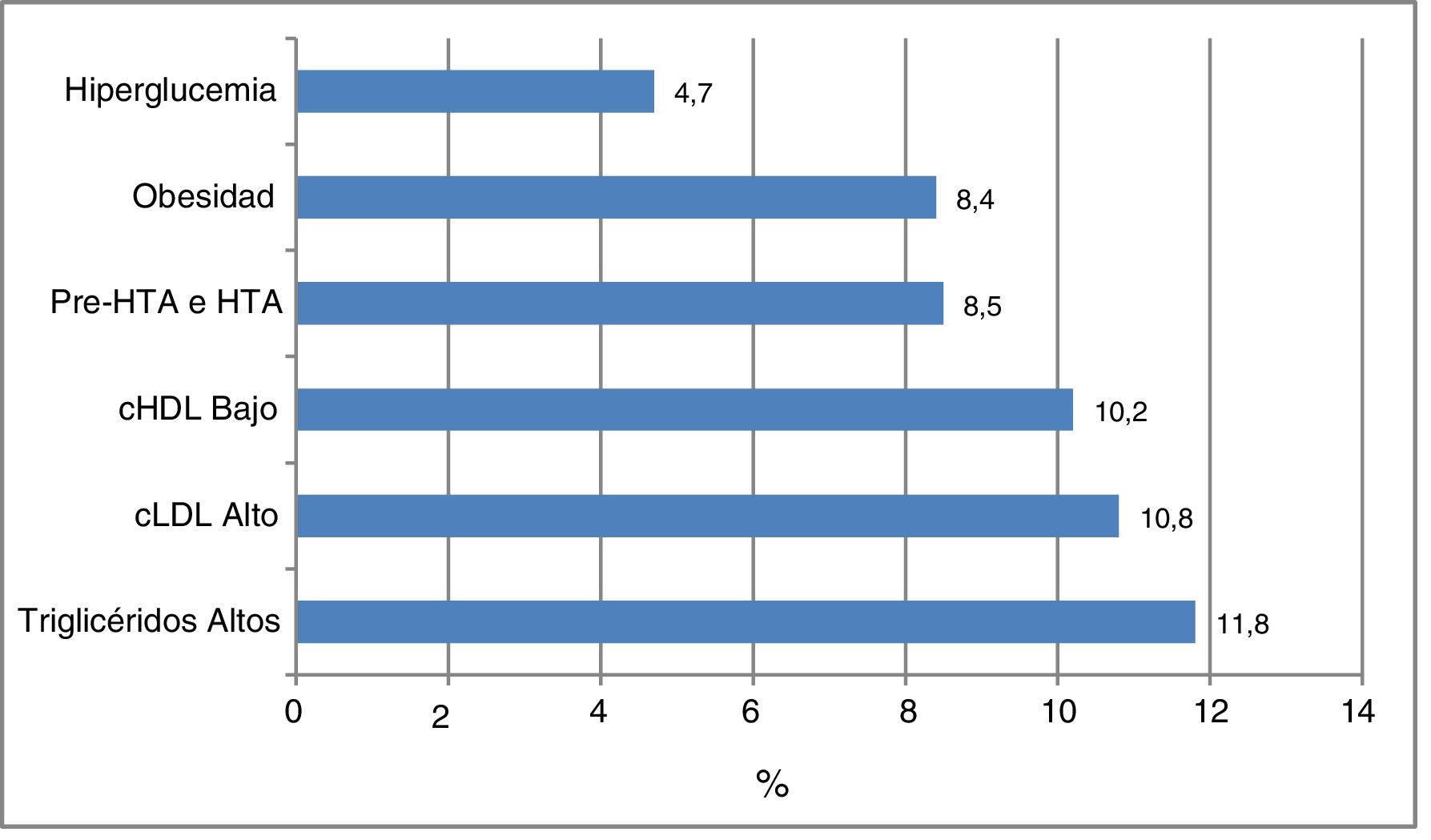
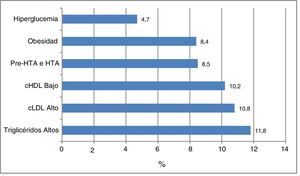
En la figura 1 se representa la frecuencia de los factores de riesgo cardiometabólico que sirvieron para categorizar la muestra de sujetos según el riesgo; hubo dislipidemia en el 28,1% de los participantes, el 11,8% presentó TG elevados, el 10,8% cLDL alto y el 10,2% cHDL bajo. El 8,5% presentó HTA o pre-HTA, el 8,4% obesidad y el 4,7% hiperglucemia. No se observaron diferencias según el sexo. La frecuencia de otros factores de riesgo cardiometabólico no usados para la clasificación de riesgo en este grupo de pacientes fueron: obesidad abdominal 10,2%, cNoHDL alto 5,3%, concentraciones elevadas de insulina 2,6%, HOMA-IR elevado 2,8% y SM 2,6%. Las concentraciones de insulina estuvieron disponibles en 917 individuos.
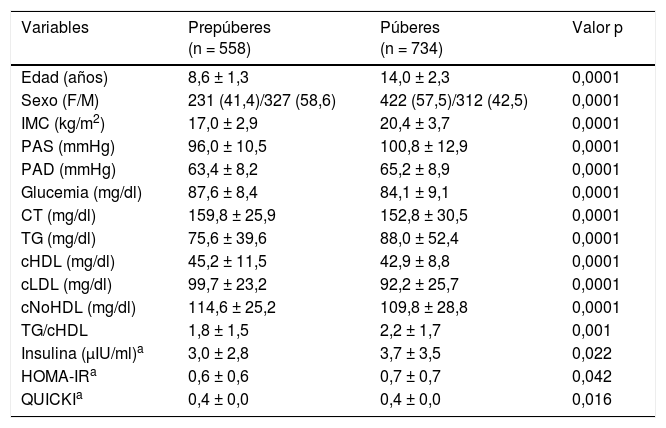
Al comparar los valores antropométricos y bioquímicos de los niños y adolescentes según el sexo, no se encontraron diferencias en la edad, el IMC, los valores de TG y cHDL, la relación TG/cHDL, la insulina basal y el índice HOMA-IR. Al analizar la población según la presencia o no de pubertad en la tabla 1, se evidencian diferencias significativas en todos los parámetros estudiados, siendo los valores de IMC, PAS, PAD, TG, relación TG/cHDL, insulina y HOMA-IR superiores en el grupo púber, mientras que la glucemia, el CT, el cHDL, el cLDL, el cNoHDL y el QUICKI fueron mayores en el prepúber. La relación TG/cHDL presentó una media de 1,89 en prepúberes vs. 2,20 en púberes (p = 0,001). No se encontraron diferencias significativas por sexo en la relación TG/cHDL en cada grupo puberal. Dadas las diferencias por desarrollo puberal, los siguientes resultados se presentan y analizan considerando esta variable.
Valores antropométricos, clínicos y bioquímicos de la muestra estudiada según estadio puberal
| Variables | Prepúberes (n = 558) | Púberes (n = 734) | Valor p |
|---|---|---|---|
| Edad (años) | 8,6 ± 1,3 | 14,0 ± 2,3 | 0,0001 |
| Sexo (F/M) | 231 (41,4)/327 (58,6) | 422 (57,5)/312 (42,5) | 0,0001 |
| IMC (kg/m2) | 17,0 ± 2,9 | 20,4 ± 3,7 | 0,0001 |
| PAS (mmHg) | 96,0 ± 10,5 | 100,8 ± 12,9 | 0,0001 |
| PAD (mmHg) | 63,4 ± 8,2 | 65,2 ± 8,9 | 0,0001 |
| Glucemia (mg/dl) | 87,6 ± 8,4 | 84,1 ± 9,1 | 0,0001 |
| CT (mg/dl) | 159,8 ± 25,9 | 152,8 ± 30,5 | 0,0001 |
| TG (mg/dl) | 75,6 ± 39,6 | 88,0 ± 52,4 | 0,0001 |
| cHDL (mg/dl) | 45,2 ± 11,5 | 42,9 ± 8,8 | 0,0001 |
| cLDL (mg/dl) | 99,7 ± 23,2 | 92,2 ± 25,7 | 0,0001 |
| cNoHDL (mg/dl) | 114,6 ± 25,2 | 109,8 ± 28,8 | 0,0001 |
| TG/cHDL | 1,8 ± 1,5 | 2,2 ± 1,7 | 0,001 |
| Insulina (μIU/ml)a | 3,0 ± 2,8 | 3,7 ± 3,5 | 0,022 |
| HOMA-IRa | 0,6 ± 0,6 | 0,7 ± 0,7 | 0,042 |
| QUICKIa | 0,4 ± 0,0 | 0,4 ± 0,0 | 0,016 |
Datos expresados en media ± DE y n (%).
cHDL: colesterol de la lipoproteína de alta densidad; cLDL: colesterol de la lipoproteína de baja densidad; cNoHDL: colesterol no HDL; CT: colesterol total; F: femenino; HOMA-IR: homeostasis model assessment for insulin resistance; IMC: índice de masa corporal; M: masculino; PAD: presión arterial diastólica; PAS: presión arterial sistólica; QUICKI: quantitative insulin sensitivity check index; TG: triglicéridos.
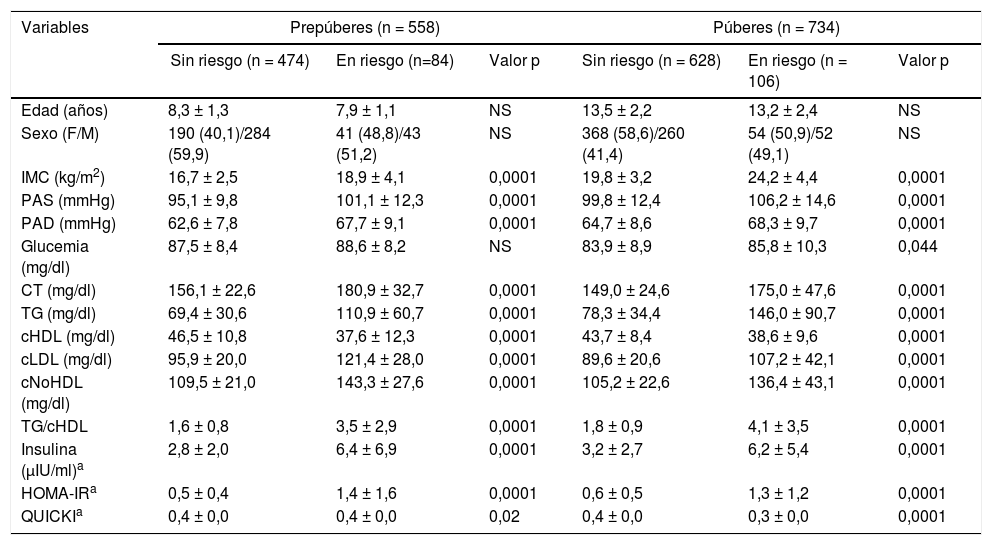
La muestra se clasificó en individuos en riesgo y sin riesgo cardiometabólico a partir de la presencia de 2 o más factores de riesgo (tabla 2). De los 1.292 niños y adolescentes participantes, el 14,7% (n = 192) presentaba 2 o más factores de riesgo. En el grupo prepuberal, el 85% no presentaba riesgo y el 15% estaba en riesgo; en el grupo puberal, el 86% estaba sin riesgo y el 14% en riesgo. No hubo diferencias en la edad ni en la distribución por sexo. Se observa que el IMC, la PA, tanto sistólica como diastólica y las variables lipídicas CT, TG, cLDL y cNoHDL (p < 0,0001) fueron significativamente mayores en los individuos en riesgo, incluyendo la relación TG/cHDL (p < 0,001), mientras que el cHDL presentó concentraciones inferiores (p < 0,001), tanto en prepúberes como en púberes. No se encontraron diferencias en las concentraciones de glucemia en el grupo prepuberal pero sí hubo valores más altos en el grupo puberal en riesgo (p = 0,04). Las variables indicativas de resistencia a la insulina como la insulina basal (p < 0,001) y el índice HOMA-IR (p < 0,001) fueron superiores y el QUICKI (p < 0,02) inferior en los individuos en riesgo tanto prepuberales como puberales.
Valores antropométricos, clínicos y bioquímicos según estadio puberal y presencia de riesgo cardiometabólico en la muestra estudiada
| Variables | Prepúberes (n = 558) | Púberes (n = 734) | ||||
|---|---|---|---|---|---|---|
| Sin riesgo (n = 474) | En riesgo (n=84) | Valor p | Sin riesgo (n = 628) | En riesgo (n = 106) | Valor p | |
| Edad (años) | 8,3 ± 1,3 | 7,9 ± 1,1 | NS | 13,5 ± 2,2 | 13,2 ± 2,4 | NS |
| Sexo (F/M) | 190 (40,1)/284 (59,9) | 41 (48,8)/43 (51,2) | NS | 368 (58,6)/260 (41,4) | 54 (50,9)/52 (49,1) | NS |
| IMC (kg/m2) | 16,7 ± 2,5 | 18,9 ± 4,1 | 0,0001 | 19,8 ± 3,2 | 24,2 ± 4,4 | 0,0001 |
| PAS (mmHg) | 95,1 ± 9,8 | 101,1 ± 12,3 | 0,0001 | 99,8 ± 12,4 | 106,2 ± 14,6 | 0,0001 |
| PAD (mmHg) | 62,6 ± 7,8 | 67,7 ± 9,1 | 0,0001 | 64,7 ± 8,6 | 68,3 ± 9,7 | 0,0001 |
| Glucemia (mg/dl) | 87,5 ± 8,4 | 88,6 ± 8,2 | NS | 83,9 ± 8,9 | 85,8 ± 10,3 | 0,044 |
| CT (mg/dl) | 156,1 ± 22,6 | 180,9 ± 32,7 | 0,0001 | 149,0 ± 24,6 | 175,0 ± 47,6 | 0,0001 |
| TG (mg/dl) | 69,4 ± 30,6 | 110,9 ± 60,7 | 0,0001 | 78,3 ± 34,4 | 146,0 ± 90,7 | 0,0001 |
| cHDL (mg/dl) | 46,5 ± 10,8 | 37,6 ± 12,3 | 0,0001 | 43,7 ± 8,4 | 38,6 ± 9,6 | 0,0001 |
| cLDL (mg/dl) | 95,9 ± 20,0 | 121,4 ± 28,0 | 0,0001 | 89,6 ± 20,6 | 107,2 ± 42,1 | 0,0001 |
| cNoHDL (mg/dl) | 109,5 ± 21,0 | 143,3 ± 27,6 | 0,0001 | 105,2 ± 22,6 | 136,4 ± 43,1 | 0,0001 |
| TG/cHDL | 1,6 ± 0,8 | 3,5 ± 2,9 | 0,0001 | 1,8 ± 0,9 | 4,1 ± 3,5 | 0,0001 |
| Insulina (μIU/ml)a | 2,8 ± 2,0 | 6,4 ± 6,9 | 0,0001 | 3,2 ± 2,7 | 6,2 ± 5,4 | 0,0001 |
| HOMA-IRa | 0,5 ± 0,4 | 1,4 ± 1,6 | 0,0001 | 0,6 ± 0,5 | 1,3 ± 1,2 | 0,0001 |
| QUICKIa | 0,4 ± 0,0 | 0,4 ± 0,0 | 0,02 | 0,4 ± 0,0 | 0,3 ± 0,0 | 0,0001 |
Datos expresados en media ± DE y n (%).
cHDL: colesterol de la lipoproteína de alta densidad; cLDL: colesterol de la lipoproteína de baja densidad; cNoHDL: colesterol no HDL; CT: colesterol total; HOMA-IR: homeostasis model assessment for insulin resistance; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; QUICKI: quantitative insulin sensitivity check index; TG triglicéridos.
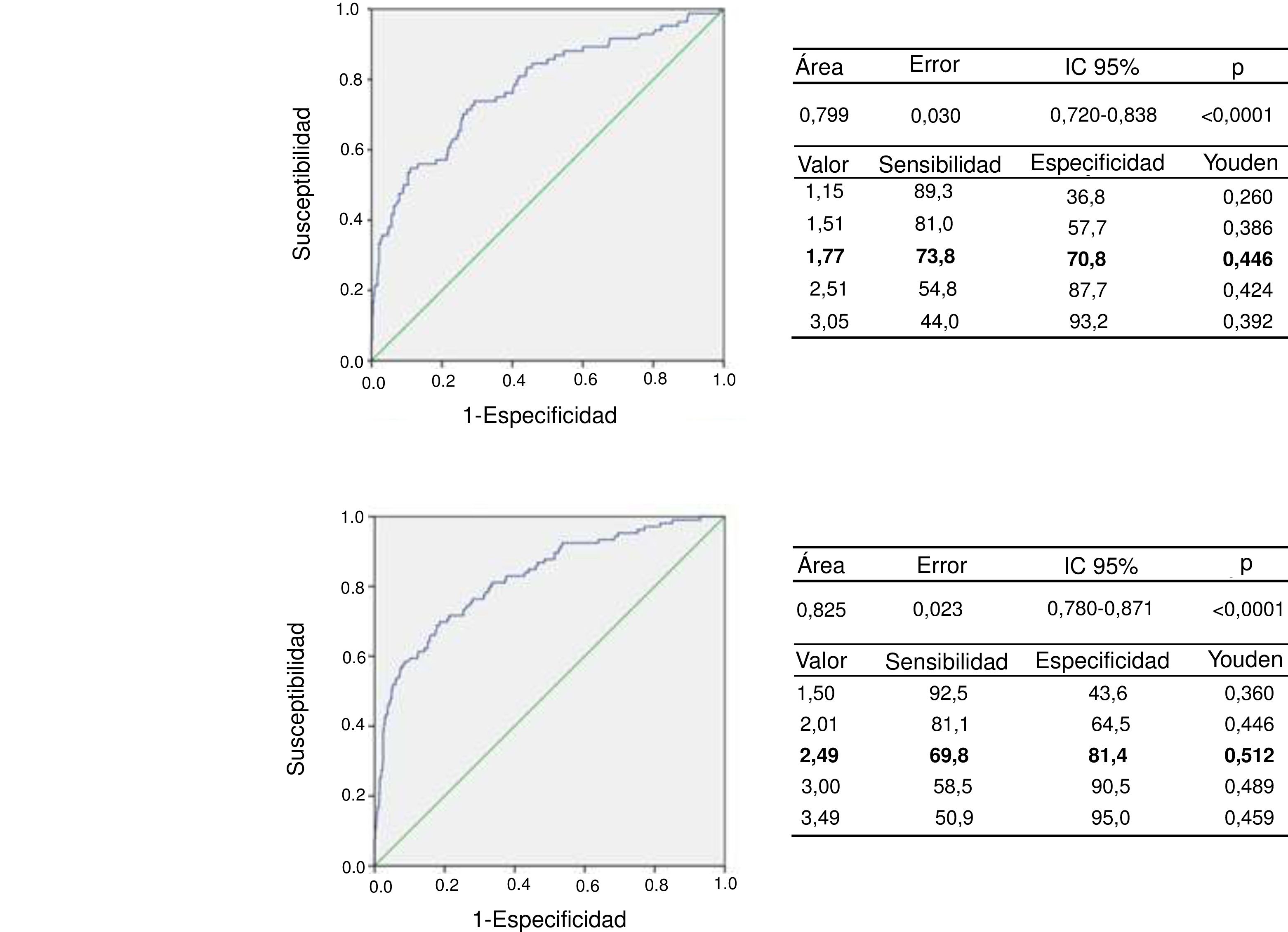
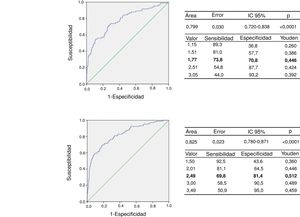
A partir de la clasificación de los individuos de acuerdo con el riesgo cardiometabólico, se procedió a la determinación del punto de corte para la relación TG/cHDL a través de la realización de curvas COR y determinación del índice de Youden. En la figura 2, panel superior, puede detallarse la curva COR para el grupo de niños prepúberes con un AUC de 0,779 (intervalo de confianza [IC] del 95%: 0,720-0,838), con una sensibilidad del 73,8% y una especificidad del 70,8% para el punto de corte de TG/cHDL de 1,77 (J = 0,446), que se podría redondear a 1,8. La curva COR para el grupo puberal puede observarse en la figura 2, panel inferior; el AUC fue de 0,826, con una sensibilidad del 69,8% y una especificidad del 81,4% para el punto de corte de 2,49 (J = 0,512), que se podría redondear a 2,5. El poder de este test para un error alfa de 0,05 y un IC del 95% con esta muestra de sujetos, tanto en prepúberes como púberes, fue de 1,00 (100%). Se determinó que el 35,1% (n = 196) de los participantes prepúberes tenían la relación TG/cHDL igual o mayor de 1,8 y el 25,9% (n = 190) de los púberes presentaron valores iguales o mayores a 2,5.
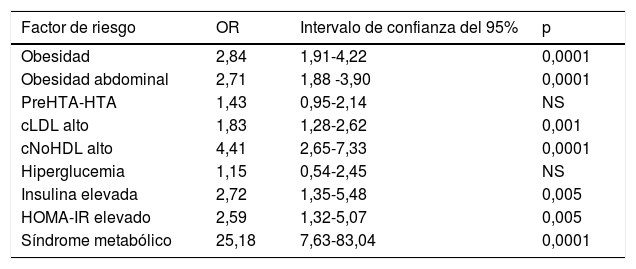
El riesgo relativo indirecto (RRi u OR) de tener factores de riesgo si presenta una relación TG/cHDL elevada (tomando como referencia los puntos de corte obtenidos en el análisis COR) se presenta en la tabla 3. En esta muestra de niños y adolescentes, el riesgo de que un individuo con una relación TG/cHDL elevada tenga obesidad es 2,76 veces mayor, obesidad abdominal 2,82 veces mayor, cLDL alto 1,8 veces mayor, cNoHDL alto 4,29 veces mayor, concentraciones elevadas de insulina 2,68 veces mayor, índice HOMA-IR elevado 2,54 veces mayor y la asociación de 3 o más componentes del SM es 24,5 veces mayor. No se encontró elevación del riesgo de presentar pre-HTA/HTA ni hiperglucemia.
Riesgo de presentar algún factor de riesgo cardiovascular de acuerdo con la relación TG/cHDL (punto de corte prepúber = 1,8 y púber = 2,5)
| Factor de riesgo | OR | Intervalo de confianza del 95% | p |
|---|---|---|---|
| Obesidad | 2,84 | 1,91-4,22 | 0,0001 |
| Obesidad abdominal | 2,71 | 1,88 -3,90 | 0,0001 |
| PreHTA-HTA | 1,43 | 0,95-2,14 | NS |
| cLDL alto | 1,83 | 1,28-2,62 | 0,001 |
| cNoHDL alto | 4,41 | 2,65-7,33 | 0,0001 |
| Hiperglucemia | 1,15 | 0,54-2,45 | NS |
| Insulina elevada | 2,72 | 1,35-5,48 | 0,005 |
| HOMA-IR elevado | 2,59 | 1,32-5,07 | 0,005 |
| Síndrome metabólico | 25,18 | 7,63-83,04 | 0,0001 |
cLDL: colesterol de la lipoproteína de baja densidad; cNoHDL: colesterol no HDL; HOMA-IR: homeostasis model assessment for insulin resistance; PreHTA-HTA: prehipertensión e hipertensión arterial.
Hoy en día, la presencia de factores de riesgo cardiometabólicos es observada cada vez con mayor frecuencia entre la población pediátrica. De los factores de riesgo analizados en el presente estudio, la dislipidemia constituyó el más prevalente, con una frecuencia del 28,1%. La hipertigliceridemia fue la alteración lipídica más frecuente (11,8%) seguida muy de cerca por la hipercolesterolemia y la hipoalfalipoproteinemia, con un 10,8 y un 10,2%, respectivamente.
Análisis de estudios prospectivos tanto en pacientes con síndrome coronario agudo como con enfermedad coronaria estable han revelado que la hipertrigliceridemia y el cHDL bajo están íntimamente asociados con un alto riesgo cardiovascular, incluso con concentraciones de cLDL en valores óptimos32,33. La relación TG/cHDL ha sido propuesta como un buen indicador de la presencia de riesgo cardiometabólico, ya que es capaz de identificar individuos con IR y concentraciones de LDL pequeñas y densas16,34, e incluso, como lo demuestra un reciente estudio de caso control, ser capaz de predecir un primer evento coronario35. Recientemente, Urbina et al.36 demostraron que la relación TG/cHDL fue un determinante independiente de la rigidez arterial en un grupo de 893 adolescentes y adultos jóvenes (10 a 26 años de edad), e indican que el uso de esta relación puede ayudar a identificar a aquellos jóvenes que requieren intervención agresiva temprana para prevenir ECV aterosclerótica temprana.
En el presente estudio no se evidenciaron diferencias significativas por sexo en los TG, cHDL ni en la relación TG/cHDL, similar a un estudio que incluyó a 943 adolescentes entre los 11 y 14 años en la ciudad de Buenos Aires y no reportó diferencias por sexo37. De allí que la mayoría de los estudios de la relación TG/cHDL realizados en población pediátrica analizan a los individuos en conjunto, sin diferenciarlos por género. Por el contrario, al hacer la comparación de la relación TG/cHDL entre prepúberes y púberes, se encontraron diferencias significativas, con medias de 1,89 y 2,20, respectivamente, datos similares a los mostrados por Olson et al.38 en un grupo de 217 individuos con una relación TG/cHDL de 1,84 para prepúberes y 2,59 para púberes. Aunque la mayoría de los autores coinciden en la relevancia del desarrollo puberal en los cambios evidenciados en la sensibilidad a la insulina en población pediátrica y sus repercusiones en el perfil lipídico, hasta el momento son pocos los trabajos publicados en la literatura médica de nuestro país e internacionalmente donde se tomen en consideración los factores de riesgo cardiometabólicos sobre la base del estadio puberal.
En el momento de definir un punto de corte para determinado parámetro metabólico, existe el problema de la generalización de las variables sin considerar las diferencias étnicas. Es bien sabido que el antecedente genético desempeña un papel fundamental en la sensibilidad a la insulina, las medidas antropométricas y la partición lipídica, por lo que usar puntos de corte universales para variables metabólicas como la relación TG/cHDL pudiera sobrestimar o subestimar el perfil de riesgo en diferentes poblaciones39. Más aún, con el hallazgo en nuestra población de bajas concentraciones de cHDL, observación que se ha venido describiendo en la región22,30, que parece constituir un rasgo fenotípico de los latinoamericanos40,41, y que resalta la necesidad de usar valores de referencia propios de cada localidad para detectar apropiadamente alteraciones lipídicas como factores de riesgo cardiometabólico.
Diversas metodologías se han propuesto para la determinación del punto de corte que discrimine de mejor manera individuos en riesgo cardiometabólico a partir del examen de la relación TG/cHDL. Un primer enfoque consiste en dividir los valores de la relación TG/cHDL en terciles o quintiles y evidenciar la correlación de los diversos factores de riesgo con los estratos superiores. En este sentido, Di Bonito et al.19 estratificaron en terciles la relación TG/cHDL en una muestra de 884 niños y adolescentes entre los 6 y los 16 años de edad, reportando que aquellos que se encontraban en el tercil superior (relación TG/cHDL ≥ 2) incrementaban su riesgo de presentar CC elevada, glucemia alterada en ayunas, presión arterial elevada, resistencia a la insulina, así como, signos preclínicos de daño a órgano blanco, como elevación de la ALT e hipertrofia ventricular izquierda concéntrica, en especial en individuos no obesos, por lo que proponen un punto de corte de 2 para la relación TG/cHDL para la identificación de individuos en riesgo. Asimismo, Weiss et al.42 realizan un estudio longitudinal a 13 años en 770 adolescentes israelíes entre 16-17 años que participaron en el Jerusalem Lipid Research Clinic Study; aquellos pacientes que presentaban una relación de TG/cHDL por encima de 2,54 (quintil superior) en los valores basales, presentaron una OR de 7,5 para ubicarse en el cuartil superior de las concentraciones de LDL pequeñas y densas en la adultez.
Las COR son aplicadas en el campo de la medicina para evaluar pruebas diagnósticas que permitan discriminar individuos sanos de enfermos43. McLaughlin et al.16 fueron de los primeros en usar este tipo de metodología en 449 individuos aparentemente sanos y establecieron un punto de corte de la relación TG/cHDL de 3,5 como predictor de IR y de concentraciones altas de LDL pequeñas y densas. Li et al.44 determinaron el punto de corte de la relación TG/cHDL para predecir IR en 2.652 individuos de diferentes grupos étnicos y proponen un punto de corte mayor de 3 en blancos no hispánicos y méxico-americanos, y mayor de 2 para el grupo de negros no hispánicos.
En población pediátrica, Giannini et al.45 estudiaron el punto de corte de la relación TG/cHDL para predecir IR en un grupo de 1.452 jóvenes obesos con diferente etnicidad y determinaron que en individuos blancos, un valor de 2,27 ofrecía una OR de 6,023 veces más riesgo de presentar IR, mientras que en hispánicos y en afroamericanos las curvas COR no fueron significativas. Recientemente, Burns et al.46, en 141 jóvenes con sobrepeso entre los 9 y 18 años, obtuvieron en el análisis COR que un punto de corte de 3 en individuos blancos y de 2,5 en negros era el mejor predictor de la concentración de LDL pequeñas y densas.
En la búsqueda de métodos de clasificación más sencillos que la determinación del patrón de las partículas de LDL, la cuantificación de la sensibilidad a la insulina o la evaluación de enfermedad ateroesclerótica subclínica, se decidió clasificar nuestra población, desde un punto de vista clínico, en individuos con riesgo y sin riesgo cardiometabólico, tomando como referencia la presencia de 2 o más factores de riesgo reconocidos, para la posterior aplicación del análisis COR. Se observa que la media de la relación TG/cHDL fue de 1,60 en individuos sin riesgo y 3,50 en individuos con riesgo en el grupo prepúber, y de 1,87 entre aquellos sin riesgo y 4,18 con riesgo en el grupo de púberes (p < 0,0001). Los puntos de corte de la relación TG/cHDL para los grupos de prepúberes y púberes fueron 1,77 y 2,49, respectivamente, que para simplificar se redondearon a 1,8 en prepúberes y 2,5 en púberes. Al realizar un análisis de la probabilidad de presentar factores de riesgo cardiometabólico a partir de estos puntos de corte se encuentra que la mayor OR para el SM fue 25,18, lo que puede explicarse por el hecho de que tanto la hipertrigliceridemia como el cHDL bajo son parte de los criterios diagnósticos de esta entidad47. En segundo lugar, de predicción de riesgo le sigue la presencia de cNoHDL alto (OR = 4,41), que estima la concentración de todas las lipoproteínas conteniendo Apo B como son VLDL, IDL, LDL e incluso Lp(a), en contraste con el cLDL, el cual no incluye el cVLDL. La relación TG/cHDL, según algunos autores, parece ser un mejor marcador que la estimación del cLDL en el establecimiento del riesgo cardiovascular y la monitorización del tratamiento, presentando una buena correlación con la concentración de LDL pequeñas48,49.
Los puntos de corte antes mencionados también predicen más de 2,5 veces el riesgo de presentar elevación de parámetros indicativos de IR, como son el índice HOMA-IR y la insulina basal. Esto se explica por la influencia que tiene la insulina en el metabolismo de las partículas ricas en TG; la lipoproteína lipasa, la proteína transferidora de esteres de colesterol, potencialmente la lipasa hepática y la proteína transferidora de fosfolípidos exhiben en presencia de IR una disminución en el metabolismo de las partículas ricas en TG, favoreciendo un intercambio de TG desde lipoproteínas conteniendo Apo B, por ésteres de colesterol desde las HDL; esto se traduce en la llamada dislipidemia aterogénica, la cual presenta concentraciones de TG y LDL patrón B elevadas, con HDL enriquecidas en TG, las cuales presentan menor actividad en el transporte en reverso del colesterol y mayor aclaramiento a nivel renal50. En esta misma línea, y entendiendo que la inflamación del tejido adiposo visceral, el depósito ectópico del tejido adiposo y la disfunción del tejido adiposo son los mediadores de la IR en humanos, independientemente de la masa grasa corporal total51-53, se encuentra en nuestro estudio que una relación TG/cHDL elevada predice un riesgo de 2,71 veces más probabilidad de presentar obesidad abdominal, un índice sustituto de la presencia de tejido adiposo visceral en el organismo.
Hasta el momento son pocos los trabajos publicados que posean muestras representativas de las diversas poblaciones donde se haya estudiado la relación TG/cHDL como un predictor de riesgo cardiometabólico, por tanto, resulta difícil comparar nuestros resultados con los de otros autores, sobre todo considerando las diferencias poblacionales, así como diferencias en la metodología empleada en las diversas investigaciones. No obstante, se proponen los valores de la relación de TG/cHDL de 1,8 y 2,5 para individuos prepúberes y púberes, respectivamente, como puntos de corte para este parámetro en los niños y adolescentes de la ciudad de Mérida, recomendándose la realización de futuras investigaciones donde se examinen estos puntos de corte con la aparición de marcadores de aterosclerosis subclínica como la determinación del espesor íntima/media carotídeo y, de ser posible, seguimiento a largo plazo para evidenciar la incidencia de desenlaces en relación con el parámetro estudiado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónSe agradece el financiamiento recibido por el Consejo de Desarrollo Científico, Humanístico, Tecnológico y del Arte de la Universidad de Los Andes (CDCHTA-ULA) bajo el proyecto M-1013-11-07-AA y ADG M-10, así como del Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT) del Ministerio del Poder Popular para Ciencia, Tecnología e Innovación, con el proyecto N.° 2012000970.