Los pacientes con diabetes mellitus tipo 2 atendidos tanto en el ámbito hospitalario como extrahospitalario suelen presentar un alto/muy alto riesgo cardiovascular, con una elevada carga de enfermedad cardiovascular. Todo ello justifica que la reducción del colesterol de las lipoproteínas de baja densidad sea el principal objetivo terapéutico en la diabetes. Sin embargo, el riesgo cardiovascular residual es muy prevalente en los sujetos con diabetes tipo 2, y suele asociarse a la dislipemia aterogénica y a la hiperlipoproteinemia(a); por tanto, es necesario revertir también estas anomalías lipoproteicas para conseguir una prevención cardiovascular eficaz.
Dado el considerable armamentario de fármacos hipolipemiantes disponibles en la actualidad, el Grupo de Trabajo de Enfermedad Cardiovascular de la Sociedad Española de Diabetes ha considerado oportuno realizar una revisión narrativa y actualización de la eficacia de dichos fármacos en la población con diabetes tipo 2, teniendo en cuenta su efecto en el perfil lipoproteico y su potencial impacto en el control glucémico.
Patients with type 2 diabetes mellitus managed in both hospital and out-ofhospital settings usually have a high/very high cardiovascular risk, with a high burden of cardiovascular disease. All this justifies that the reduction of low-density lipoprotein cholesterol is the main therapeutic goal in diabetes. However, residual cardiovascular risk is very prevalent in type 2 diabetes, and is usually associated with atherogenic dyslipidemia and hyperlipoproteinemia(a); therefore, it is also necessary to reverse these lipoprotein abnormalities to achieve effective cardiovascular prevention. Given the considerable armamentarium of lipid-lowering drugs currently available, the Cardiovascular Disease Working Group of the Spanish Diabetes Society has considered it appropriate to carry out a narrative review and update of the effectiveness of these lipid-lowering drugs in the population with type 2 diabetes taking into account their effect on the lipoprotein profile and their potential impact on glycemic control.
La enfermedad cardiovascular (ECV) con sus diferentes manifestaciones clínicas (coronaria, cerebrovascular y arterial periférica) es la principal causa de morbi-mortalidad en las personas con diabetes mellitus tipo 2 (DM2)1. Además, según datos tanto del ámbito hospitalario como de la atención primaria, la población española con DM2 es esencialmente de muy alto/alto riesgo cardiovascular2,3. Con la finalidad de reducir este riesgo, la guía europea 2019 para la prevención cardiovascular4 indica que la reducción del colesterol de las lipoproteínas de baja densidad (LDL) debe ser el principal objetivo terapéutico en la DM2. Sin embargo, también señala que el colesterol no transportado por las lipoproteínas de alta densidad (HDL) y las concentraciones de apolipoproteína (apo) B son objetivos secundarios de especial interés en personas con DM2 o dislipemia aterogénica. Si se pudiera alcanzar y mantener el perfil lipídico por debajo de los objetivos recomendados solo con un estilo de vida saludable, el beneficio sería inmenso. En este sentido, remitimos al lector a las evidencias nacionales con la dieta mediterránea de los estudios Prevención con Dieta Mediterránea (PREDIMED) y Coronary Diet Intervention with Olive Oil and Cardiovascular Prevention (CORDIOPREV) en prevención primaria y secundaria de la ECV, respectivamente. Sin embargo, los actuales índices de diabesidad infantil y de síndrome metabólico generan un inevitable escepticismo en la capacidad de corregir y/o mejorar el estilo de vida de las sociedades industrializadas.
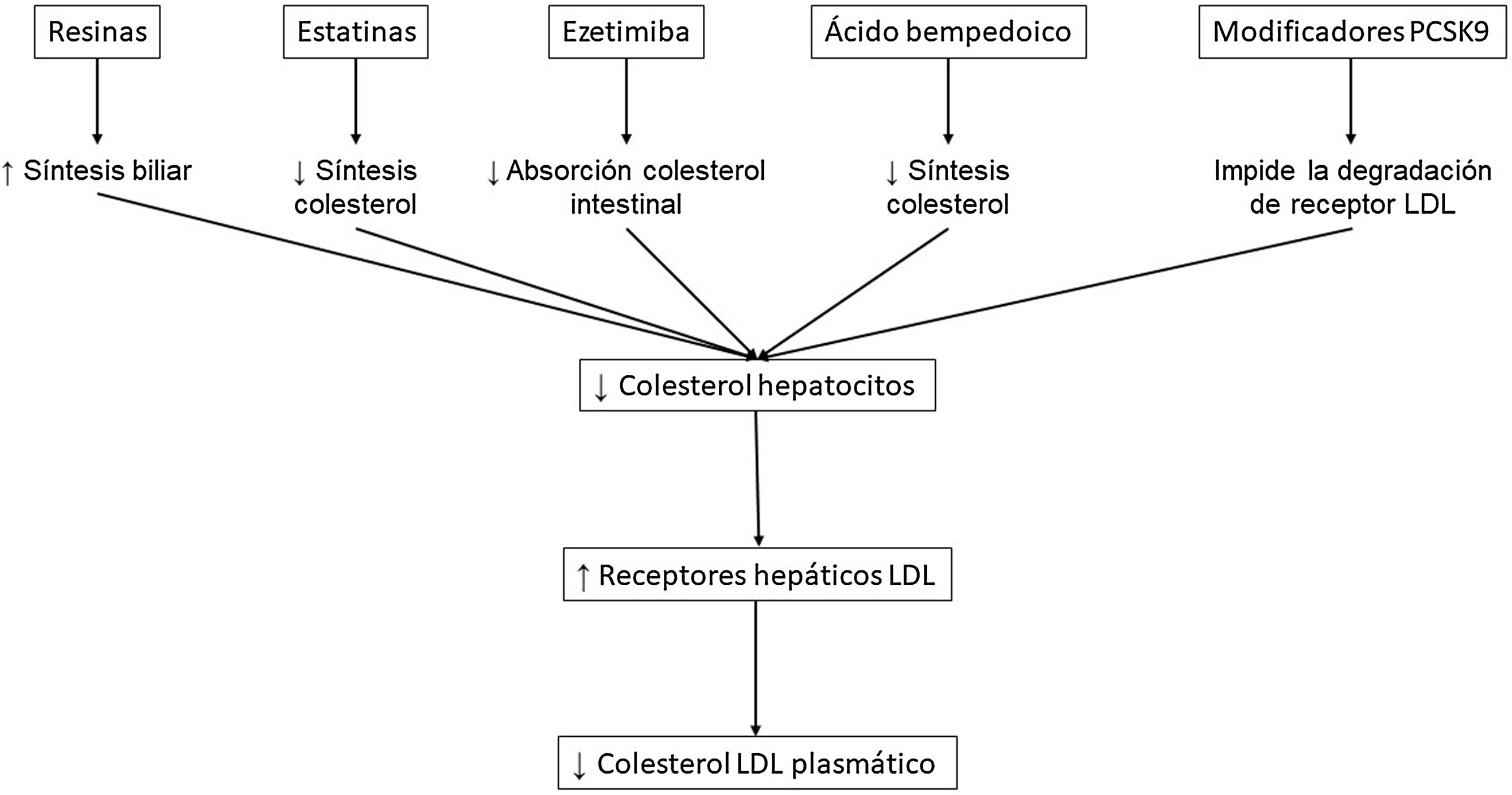
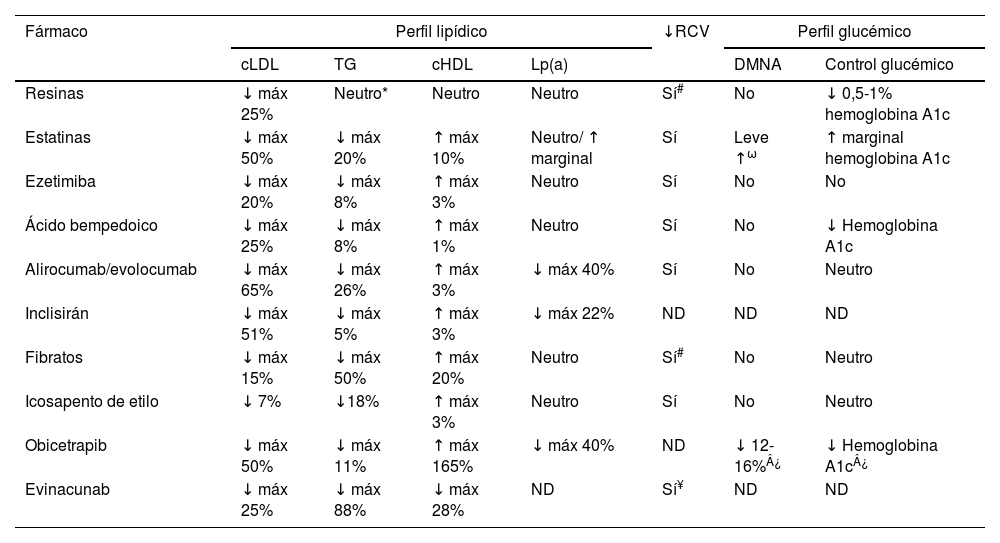
En la última década han aparecido nuevos fármacos hipolipemiantes que podrían ayudar a reducir la incidencia de episodios cardiovasculares en personas con DM2. No hay que olvidar que el mayor riesgo cardiovascular de las personas con DM2 hace que sean un grupo poblacional especialmente beneficiado por los tratamientos hipolipemiantes. El Grupo de Trabajo de Enfermedad Cardiovascular de la Sociedad Española de Diabetes ha considerado oportuno realizar una actualización de la eficacia de estos tratamientos, y en términos de seguridad indicar específicamente su potencial impacto no solo en el metabolismo lipídico sino también en el hidrocarbonado. En la tabla 1 se exponen los efectos de los principales fármacos hipolipemiantes en el perfil lipídico, el riesgo cardiovascular y la glucemia.
Efecto de los principales fármacos hipolipemiantes en el perfil lipídico, glucémico y riesgo cardiovascular
| Fármaco | Perfil lipídico | ↓RCV | Perfil glucémico | ||||
|---|---|---|---|---|---|---|---|
| cLDL | TG | cHDL | Lp(a) | DMNA | Control glucémico | ||
| Resinas | ↓ máx 25% | Neutro* | Neutro | Neutro | Sí# | No | ↓ 0,5-1% hemoglobina A1c |
| Estatinas | ↓ máx 50% | ↓ máx 20% | ↑ máx 10% | Neutro/ ↑ marginal | Sí | Leve ↑ω | ↑ marginal hemoglobina A1c |
| Ezetimiba | ↓ máx 20% | ↓ máx 8% | ↑ máx 3% | Neutro | Sí | No | No |
| Ácido bempedoico | ↓ máx 25% | ↓ máx 8% | ↑ máx 1% | Neutro | Sí | No | ↓ Hemoglobina A1c |
| Alirocumab/evolocumab | ↓ máx 65% | ↓ máx 26% | ↑ máx 3% | ↓ máx 40% | Sí | No | Neutro |
| Inclisirán | ↓ máx 51% | ↓ máx 5% | ↑ máx 3% | ↓ máx 22% | ND | ND | ND |
| Fibratos | ↓ máx 15% | ↓ máx 50% | ↑ máx 20% | Neutro | Sí# | No | Neutro |
| Icosapento de etilo | ↓ 7% | ↓18% | ↑ máx 3% | Neutro | Sí | No | Neutro |
| Obicetrapib | ↓ máx 50% | ↓ máx 11% | ↑ máx 165% | ↓ máx 40% | ND | ↓ 12-16%¿ | ↓ Hemoglobina A1c¿ |
| Evinacunab | ↓ máx 25% | ↓ máx 88% | ↓ máx 28% | ND | Sí¥ | ND | ND |
El riesgo depende de la potencia y dosis de la estatina, edad del paciente, y presencia de componentes de síndrome metabólico. La pitavastatina no tiene efecto diabetogénico.
En pacientes con hipercolesterolemia familiar homocigota.
A1c: glucosilada; cHDL: colesterol de las lipoproteínas de alta densidad; cLDL: colesterol de las lipoproteínas de baja densidad; DMNA: diabetes mellitus de nueva aparición; Lp(a): lipoproteína(a); RCV: riesgo cardiovascular; TG: triglicéridos; ND: no disponible.
Las resinas son fármacos hipocolesterolemiantes con más de 60 años de experiencia. En la actualidad están disponibles la resincolestiramina, el colestipol y el colesevelam. Actúan a nivel del intestino delgado uniéndose a los ácidos biliares, provocando su eliminación fecal y, en consecuencia, interrumpiendo el circuito enterohepático (fig. 1). Los ácidos biliares que se eliminan en exceso son remplazados por el hígado mediante la oxidación de una mayor cantidad de colesterol a través de una cadena de reacciones controladas por la enzima colesterol-7-alfa-hidroxilasa. El descenso del pool hepático de colesterol provoca, por una parte, un aumento de la actividad de la 3-hidroxi-3-metil-glutaril-coenzima A (HMG-CoA) reductasa y, por otra, un aumento de la captación hepática de colesterol gracias al incremento de la síntesis de los receptores LDL. No obstante, el aumento de la síntesis hepática de colesterol puede promover un incremento de la secreción de las lipoproteínas de muy baja densidad (VLDL), con el consiguiente agravamiento de cualquier hipertrigliceridemia preexistente5.
Las resinas son fármacos que no se absorben y, por tanto, no tienen efectos sistémicos. Por dicho motivo, se consideran los fármacos hipolipemiantes más seguros para su uso en mujeres embarazadas. Su principal inconveniente es que deben administrarse separado del resto de la medicación al poder interferir con su absorción. Sus efectos secundarios no son graves, pero suelen ser lo suficientemente molestos para el paciente como para que, con frecuencia, la tasa de cumplimiento sea baja. Los principales efectos secundarios son gastrointestinales, entre los que destacan la intolerancia gástrica y los cambios en el ritmo intestinal.
Se ha demostrado que los secuestradores de ácidos biliares reducen los niveles de glucosa en ayunas y de hemoglobina glucosilada (A1c). En este sentido, el colesevelam puede disminuir los niveles de hemoglobina A1c en aproximadamente un 0,5% a un 1,0% en pacientes ya tratados con otros fármacos hipoglucemiantes como metformina, sulfonilureas e insulina6. Con base en estos estudios, la American Association of Clinical Endocrinologists/American College of Endocrinology7 publicó un algoritmo para el control de la glucemia en el tratamiento de la DM2, en el que se incluye el colesevelam como una opción terapéutica más, y la Food and Drug Administration (FDA) aprobó en el 2009 su indicación para mejorar el control glucémico en pacientes con DM2. Aunque se han propuesto varias hipótesis, el mecanismo por el cual las resinas mejoran el metabolismo de la glucosa está todavía por esclarecerse. En la actualidad, los efectos secundarios de las resinas, la polifarmacia del paciente con DM2, y la frecuente hipertrigliceridemia, característica de la dislipemia aterogénica, junto a la disponibilidad de nuevas opciones farmacológicas, limitan su uso.
EstatinasLas estatinas constituyen el tratamiento de primera línea para disminuir la concentración plasmática de colesterol LDL. De acuerdo con el metanálisis del Cholesterol Treatment Trialists8 en personas con diabetes, la reducción de 1 mmol/L (≈ 40mg/dL) de colesterol LDL con estatinas comportó una disminución del 21% en los episodios cardiovasculares graves. Es conocido que las estatinas se asocian con un riesgo de diabetes de nueva aparición; sin embargo, este efecto diabetogénico no debe minimizar en modo alguno sus incuestionables beneficios cardiovasculares. Se ha estimado que se produce un caso adicional de diabetes por cada 1.000 personas/año de exposición a estatinas, al tiempo que se previenen cinco muertes cardiovasculares9. Cabe remarcar que el efecto diabetogénico de las estatinas es más marcado en los individuos con factores de riesgo para desarrollar diabetes, fundamentalmente los componentes del síndrome metabólico. Si bien se han postulado varias teorías, aún se desconocen los mecanismos responsables de la diabetes inducida por estatinas10. Aunque inicialmente se especuló que era un efecto de clase farmacológica, se ha demostrado que no todas las estatinas afectan por igual el metabolismo glucídico. Así, un estudio prospectivo en 1.269 pacientes con intolerancia a la glucosa constató una reducción de la incidencia acumulada de diabetes del 18% con la administración de pitavastatina comparado con el grupo control con solo la modificación del estilo de vida (odds ratio [OR]: 0,82; intervalo de confianza [IC] 95%: 0,68-0,99; p=0,041)11. También, el metanálisis de Vallejo-Vaz et al.12 concluyó que la pitavastatina no está asociada con la diabetes de nueva aparición; por todo ello, su uso se ha aconsejado en personas con alto riesgo de diabetes, prediabetes o DM213.
EzetimibaLa ezetimiba, el inhibidor de la absorción intestinal de colesterol (fig. 1), que se suele utilizar en combinación con las estatinas para conseguir mayores reducciones de colesterol LDL sin incrementar los efectos adversos, carece de riesgo diabetogénico14. Asimismo, en el estudio IMProved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT) la ezetimiba en combinación con simvastatina fue más eficaz en la prevención cardiovascular en el subgrupo de pacientes con DM2, para la misma reducción de colesterol LDL15.
Aunque las estatinas son necesarias para reducir el riesgo cardiovascular de los pacientes con DM2, cada vez se recomienda con mayor énfasis considerar la terapia combinada estatina de alta/moderada intensidad a dosis submáxima con ezetimiba en lugar de la estatina a máxima dosis en monoterapia. En pacientes con ECV se ha objetivado que la terapia combinada de estatina de moderada intensidad más ezetimiba no es inferior a la monoterapia con estatinas de máxima potencia para un objetivo cardiovascular a tres años compuesto por muerte cardiovascular, episodios cardiovasculares graves o ictus no fatal, con una mayor tasa de consecución de objetivos terapéuticos en colesterol LDL y un menor índice de reducción de dosis o suspensión de la estatina16, incluso en la población con diabetes17. En definitiva, es aconsejable la utilización de dicha terapia de combinación para reducir eficazmente el colesterol LDL y, al mismo tiempo, mitigar el riesgo potencial de un control metabólico subóptimo asociado a la terapia con estatinas a dosis altas.
Modificadores de la proproteína convertasa subtilisina/kexina 9La proproteína convertasa subtilisina/kexina 9 (PCSK9) desempeña un papel fundamental en la homeostasis intracelular del colesterol al promover la degradación del receptor LDL en los lisosomas de los hepatocitos. La inhibición de PCSK9 comporta la presencia de un mayor número de receptores LDL en la membrana de los hepatocitos, con el consiguiente incremento del catabolismo de las partículas LDL (fig. 1). La PCSK9 también se expresa en otros tejidos, incluidas las células endoteliales y musculares lisas de los vasos sanguíneos, por lo que su inhibición podría tener también un efecto local18. En los últimos 20 años se han desarrollado fármacos que reducen la concentración periférica de PCSK9 o la adhesión al receptor LDL mediante diferentes mecanismos o tecnologías: anticuerpos monoclonales, ácido ribonucleico de interferencia pequeño (ARNip), adnectinas, e incluso vacunas o modificaciones puntuales en la secuencia del gen PCSK9.
Los dos anticuerpos monoclonales disponibles frente a PCSK9, alirocumab y evolocumab, disminuyen la concentración de colesterol LDL un 50-65% y la lipoproteína(a) (Lp[a]) un 20-30%19,20. Los estudios de aleatorización mendeliana han puesto de manifiesto que las variantes genéticas con impacto similar a los inhibidores de PCSK9 se asocian con un mayor riesgo de diabetes o hiperglucemia21. Sin embargo, estos hallazgos no han sido corroborados por los estudios clínicos22,23, probablemente debido a que la unión de los anticuerpos monoclonales a la PCSK9 tiene lugar a nivel extracelular.
El inclisirán, aprobado por la European Medicines Agency (EMA) en 2020 y por la FDA en 2021, es un ARNip bicatenario dirigido frente a PCSK9, que se administra cada seis meses (después de una dosis inicial y otra a los tres meses). Produce una reducción del colesterol LDL del 50% y de la Lp(a) de hasta un 25%24. Este efecto hipocolesterolemiante es independiente del estado glucémico25, y se mantiene en el tiempo26. Al día de hoy, tres estudios clínicos están evaluando los posibles beneficios cardiovasculares del inclisirán.
En conjunto, estos fármacos cuya diana terapéutica es la PCSK9 (anticuerpos monoclonales y ARNip) son muy eficaces para reducir el colesterol LDL y el riesgo cardiovascular, con un excelente perfil de seguridad, especialmente en personas con DM2. Sin embargo, se necesitan estudios de exposición más prolongada al inclisirán para documentar el no incremento de diabetes de nueva aparición.
Ácido bempedoicoEn el 2020, la FDA y la EMA licitaron un nuevo hipolipemiante oral, el ácido bempedoico, que inhibe la adenosina trifosfato-citrato liasa (ACL), una enzima implicada en la síntesis de colesterol y ubicada dos pasos metabólicos por encima de la 3-hidroxi-3-metilglutaril-coenzima A (HMGCoA) reductasa (fig. 1). Es un profármaco que se activa intracelularmente por la conversión a ácido bempedoico-coenzima A (CoA) a través de la acil-CoA sintetasa-1 de cadenas muy largas (ACSVL1), que se expresa principalmente en los hepatocitos y en menor proporción en las células renales, estando ausente en el tejido adiposo y muscular. El ácido bempedoico disminuyó la concentración de colesterol LDL entre un 17,4% y un 28,5%27. Asimismo, redujo de forma significativa la hemoglobina A1c un 0,12% y 0,06% en sujetos con DM2 y prediabetes, respectivamente. La tasa anual de diabetes de nueva aparición en los individuos normoglucémicos o con prediabetes no aumentó en el grupo de ácido bempedoico comparado con el placebo (0,3% vs. 0,8% y 4,7% vs. 5,9%, respectivamente)28. La eficacia del fármaco para reducir el colesterol LDL fue independiente del estado glucémico. Además, el estudio de aleatorización mendeliana de Ference et al.29 no halló ninguna asociación entre las mutaciones del gen que codifica la ACL y la DM2. En el estudio Cholesterol Lowering via Bempedoic Acid, an ACL-Inhibiting Regimen (CLEAR)-Outcomes30 en pacientes intolerantes a estatinas, el tratamiento con ácido bempedoico durante 40,6 meses mostró una disminución significativa del 13% en el riesgo de episodios cardiovasculares. Un 45% de los participantes en dicho estudio tenía DM2, y no hubo deterioro metabólico, ni diabetes de nueva aparición en el grupo de tratamiento activo31. Un análisis compilado de cuatro estudios de fase 3ha apuntado que el ácido bempedoico es una terapia adecuada para pacientes con síndrome metabólico que requieren una reducción adicional de colesterol LDL32. El ácido bempedoico se considera un fármaco seguro, aunque se asocia a un mayor riesgo de gota, especialmente si existen antecedentes de la misma, así como un leve aumento transitorio de la creatinina sérica y del ácido úrico.
En síntesis, el ácido bempedoico es eficaz para reducir el colesterol LDL y el riesgo cardiovascular, con una correcta tolerancia, y un efecto neutro a positivo en los parámetros glucémicos. A pesar de ello, la DM2 sin ECV no es un criterio de financiación del ácido bempedoico por el sistema de salud español según el informe de posicionamiento terapéutico (IPT) de la Asociación Española del Medicamento y Productos Sanitarios (AEMPS).
Terapias dirigidas a la dislipemia diabéticaMás allá del colesterol LDL, el riesgo cardiovascular residual es muy elevado en los sujetos con DM2, y suele asociarse a la dislipemia aterogénica propia de esta enfermedad. Esta dislipemia se caracteriza por concentraciones elevadas de triglicéridos, bajas de colesterol HDL y normales o discretamente elevadas de colesterol LDL, pero con un predominio de partículas de LDL pequeñas y densas. Cabe recordar que las lipoproteínas que contienen la apo B como las LDL, las VLDL, las lipoproteínas de densidad intermedia (IDL) y la Lp(a) son aterogénicas, especialmente aquellas con un diámetro inferior a 70nm que les permite atravesar con facilidad la pared arterial, depositarse en la matriz extracelular del espacio subendotelial e iniciar la aterogénesis. Desafortunadamente, las evidencias revelan que la dislipemia diabética está infradiagnosticada, infratratada y, en consecuencia, infracontrolada33,34.
Fibratos y niacinaLos estudios clínicos de intervención con fármacos que reducen las concentraciones plasmáticas de triglicéridos como la niacina de liberación prolongada con laropiprant35,36 y los fibratos37,38, no han señalado beneficios cardiovasculares cuando se administran junto al tratamiento convencional, incluidas las estatinas. Las únicas evidencias favorables proceden de los análisis post-hoc de los pacientes con dislipemia aterogénica o alguno de sus componentes tratados con fibratos39,40. Recientemente, en el estudio Pemafibrate to Reduce Cardiovascular Outcomes by Reducing Triglycerides in Patients with Diabetes (PROMINENT)41 que incluyó a 10.497 individuos con dislipemia diabética y concentraciones de colesterol LDL ≤ 100mg/dL, el pemafibrato, un modulador selectivo del receptor α activado por el proliferador de peroxisomas, tuvo un impacto neutro en los objetivos cardiovasculares, probablemente porque, a pesar de reducir la trigliceridemia un 25%, no consiguió disminuir la concentración de lipoproteínas aterogénicas circulantes.
Por tanto, si bien hay un acuerdo unánime en la utilización de los fibratos en la prevención del riesgo de pancreatitis aguda en la hipertrigliceridemia grave, sigue siendo controvertido su uso para la prevención cardiovascular de los pacientes con hipertrigliceridemia leve-moderada.
Ácidos grasos omega-3En referencia a los ácidos grasos omega-3, los estudios randomizados con mezcla de ácido eicosapentaenoico (EPA) y docosahexaenoico (DHA) a dosis bajas (1g/día) como el Outcome Reduction with an Initial Glargine Intervention (ORIGIN)42, A Study of Cardiovascular Events in Diabetes (ASCEND)43 y Vitamin D and Omega-3 Trial (VITAL)44 o de 4g/día en el Long-Term Outcomes Study to Assess Statin Residual Risk with Epanova in High Cardiovascular Risk Patients with Hypertriglyceridemia (STRENGTH)45, así como un metaanálisis46 con 77.917 individuos de 10 estudios de los que en nueve el ácido graso omega-3 era una combinación de EPA y DHA, no han mostrado efectos protectores cardiovasculares en pacientes que recibían al mismo tiempo terapia con estatinas.
En el Japan EPA Lipid Intervention Study (JELIS)47, 8.645 pacientes japoneses hipercolesterolémicos fueron tratados aleatoriamente con estatinas de baja intensidad más 1,8g/día de EPA o estatinas en monoterapia. Hubo una reducción del 19% en el riesgo de episodios coronarios graves en el grupo EPA con estatinas. Años más tarde, el Reduction of Cardiovascular Events with Icosapent Ethyl–Intervention Trial (REDUCE-IT)48 ha señalado que una dosis de 4g/día de icosapento de etilo redujo el riesgo de episodios isquémicos, incluida la muerte cardiovascular, en pacientes tratados con estatinas con concentraciones de colesterol LDL de 41 a 100mg/dL (1,06 a 2,59 mmol/L) y de triglicéridos entre 135 y 499mg/dL (1,52 y 5,63 mmol/L) con ECV establecida o DM2 con al menos un factor de riesgo. Los sólidos hallazgos del REDUCE-IT y de los subanálisis preespecificados quedan reflejados con la inclusión del icosapento de etilo en los algoritmos terapéuticos de prevención secundaria de las diferentes guías para el control de las dislipemias.
Por otra parte, los estudios mecanicistas de regresión de placa han confirmado que el icosapento de etilo se asocia a una clara mejoría de las características cuantitativas y cualitativas del ateroma coronario49 y de la fisiología coronaria50.
En cuanto al perfil de seguridad del icosapento de etilo, los efectos adversos se distribuyeron por igual en los dos brazos terapéuticos, independientemente de la gravedad. En el estudio REDUCE-IT se objetivó un incremento de los episodios hemorrágicos adversos (leves y graves) del tratamiento (11,8% vs. 9,9%, p=0,006). Sin embargo, la tasa de episodios hemorrágicos graves, incluyendo ictus hemorrágico, otras hemorragias graves del sistema nervioso central y hemorragia gastrointestinal no aumentaron significativamente en el grupo de icosapento de etilo; es más, en un subgrupo de pacientes con un síndrome coronario agudo que recibía doble antiagregación, tampoco hubo un incremento de sangrados graves. Por otra parte, mientras que la tasa de hospitalización por fibrilación o flúter auricular fue mayor en el grupo de icosapento de etilo (3,1% vs. 2,1%, p=0,004), el riesgo de ictus fue menor (OR: 0,72; IC: 95% 0,55-0,93; p=0,01). El icosapento de etilo solo está contraindicado en pacientes con hipersensibilidad al principio activo, a la soja o a alguno de los excipientes.
De acuerdo con el IPT, el icosapento de etilo a la dosis de 2g/12 horas está financiado para los pacientes con ECV y cLDL<100mg/dL y triglicéridos> 150mg/dL. En un reciente subanálisis del estudio REDUCE-IT51 en pacientes tratados con estatinas y síndrome metabólico, el icosapento de etilo redujo el riesgo de episodios cardiovasculares. Estas evidencias respaldarían la utilización del icosapento de etilo como una posible opción terapéutica en los pacientes con síndrome metabólico con alto riesgo cardiovascular.
Nuevos tratamientosInhibidores de la proteína transferidora de ésteres de colesterol (CETP)La proteína transferidora de ésteres de colesterol (CETP) es una glicoproteína plasmática secretada por el hígado que media la transferencia bidireccional de ésteres de colesterol y triglicéridos entre las lipoproteínas, dando como resultado neto una cesión de ésteres de colesterol de las HDL a VLDL y LDL, y de triglicéridos de las VLDL a LDL y HDL. Su inhibición reduce estos intercambios y comporta un enriquecimiento en ésteres de colesterol de las HDL y una disminución del mismo en las lipoproteínas que contienen apoB, es decir, VLDL y LDL.
Los primeros inhibidores de la CETP como torcetrapib, dalcetrapib y evocetrapib, inducían importantes incrementos en las concentraciones plasmáticas de colesterol HDL, pero sin efectos cardioprotectores. Sin embargo, en el estudio Randomized Evaluation of the Effects of Anacetrapib through Lipid Modification (REVEAL)52 en pacientes con ECV tratados con estatinas, el aumento del 104% en los niveles de colesterol HDL se acompañó de un descenso del 17% en colesterol LDL, con una caída del 9% en los episodios coronarios graves durante un seguimiento de 4,1 años. Este descenso del riesgo relativo fue consistente con la magnitud de la reducción del colesterol LDL o no HDL. Este fármaco no fue presentado a las instituciones reguladoras para su aprobación, debido en parte a su acumulación en el tejido adiposo por su alta lipofilia. Con posterioridad, un metanálisis mostró que los inhibidores de la CETP de última generación se asocian con un menor riesgo de infarto de miocardio y de mortalidad cardiovascular53.
La inhibición de la CETP, además de modificar la transferencia de ésteres de colesterol de las HDL a las lipoproteínas que contienen apoB, también puede aumentar la excreción transintestinal de colesterol, lo que contribuirá a la excreción de esteroles fecales y aumentar la expresión del receptor scavenger clase B tipo 1 y del receptor LDL hepático. Al mismo tiempo, se ha demostrado que existe un catabolismo aumentado de las LDL y apoB, que es la principal base metabólica del descenso de sus concentraciones plasmáticas. Por tanto, la vía del receptor LDL también puede estar regulada positivamente por la inhibición de la CETP.
El obicetrapib es un inhibidor de CETP de nueva generación, cuyo desarrollo clínico ha incluido hasta la fecha nueve estudios de fase 1 en voluntarios sanos, seis de fase 2 finalizados en pacientes con dislipemia o Lp(a) elevada y tres de fase 3 en curso54. En conjunto, han demostrado que el obicetrapib a dosis bajas una vez al día por vía oral, reduce un 50% la concentración de colesterol LDL, un 44% el colesterol no HDL, un 30% la apoB, un 40% la Lp(a), así como la concentración de partículas LDL, especialmente las pequeñas y densas, y aumenta las pre-β HDL, las HDL maduras, apoA-1 y apoE. Estos efectos son evidentes no solo con obicetrapib en monoterapia sino también junto con estatinas, y en combinación con ezetimiba, con una excelente tolerancia y perfil de seguridad54.
Se ha documentado una reducción en el riesgo de diabetes de nueva aparición del 12%55 y del 16%56 en los pacientes tratados con inhibidores de la CETP (previos al obicetrapib) en comparación con el placebo. La glucemia basal también mejoró en las personas con y sin diabetes56. En marzo de 2022, arrancó el Cardiovascular Outcome Study to Evaluate the Effect of Obicetrapib in Patients With Cardiovascular Disease (PREVAIL) para evaluar el potencial de obicetrapib (10mg/día) en la reducción de episodios cardiovasculares graves, incluida la muerte cardiovascular, el infarto de miocardio no mortal, el accidente cerebrovascular no mortal y la revascularización coronaria no electiva.
Terapia dirigida frente a apoC-IIILa apoC-III desempeña un papel primordial en el metabolismo de las lipoproteínas ricas en triglicéridos (LRTG) a través de mecanismos dependientes e independientes de la lipoproteín-lipasa (LPL). No solo su concentración plasmática se relaciona de forma lineal y directa con la trigliceridemia, y aumenta en situaciones de resistencia a la insulina, sino que a nivel pancreático la apoC-III ha demostrado interferir en la funcionalidad y la supervivencia de la célula beta. Además, la hiperglucemia en individuos con diabetes tipo 1 o 2 se asocia con mayores concentraciones de apoC-III57, y parece que este incremento contribuye a la dislipemia aterogénica58.
El volanesorsen, un oligonucleótido antisentido dirigido frente a la apoC-III, ha sido eficaz para reducir la trigliceridemia en individuos con quilomicronemia monogénica59, con quilomicronemia multigénica, que incluía un 40% de participantes con DM260, y con lipodistrofia parcial familiar e hipertrigliceridemia y diabetes61. Debido a sus efectos secundarios, en particular la trombocitopenia, el volanesorsen no ha sido aprobado por la FDA, pero sí por la EMA estando disponible para su uso en España para pacientes con quilomicronemia familiar. La apoC-III está sujeta a modificaciones post-traduccionales, algunas de las cuales, como la proteoforma con dos moléculas de ácido siálico, se asocian a concentraciones más bajas de triglicéridos62. No está aún descrito hasta qué punto estas modificaciones pueden modular las intervenciones farmacológicas sobre la apoC-III.
Existen dos fármacos en investigación. El olezarsen es un oligonucleótido antisentido, pero, en este caso, conjugado con N-acetilgalactosamina, lo que mejora la selectividad hepática y puede considerarse más eficaz y seguro que volanesorsen. En un estudio fase II en 114 pacientes con hipertrigliceridemia moderada, la administración subcutánea consiguió disminuciones de triglicéridos de hasta un 60%, y de apoB de hasta un 16%, todo ello sin cambios en la función renal, hepática o recuento plaquetario. Estos resultados son mejores que los obtenidos con fibratos y podrían traducirse en una reducción de episodios vasculares a largo plazo. En segundo lugar, el ARNip plozasiran podría alcanzar una eficacia similar.
Terapia dirigida frente a la proteína similar a la angiopoyetina 3La proteína similar a la angiopoyetina 3 (ANGPTL3), que se sintetiza exclusivamente en el hígado, puede aumentar la secreción de VLDL e inhibe la actividad de dos lipasas extracelulares: la LPL con la consiguiente disminución del catabolismo de las LRTG, y la lipasa endotelial que conlleva un descenso de la captación hepática de LDL. En 2021, la EMA y la FDA aprobaron el primer anticuerpo monoclonal humano anti-ANGPTL3, el evinacumab, para su uso en la hipercolesterolemia familiar homocigota (HFHo). El evinacumab a largo plazo, y en vida real, como complemento a la estrategia hipolipemiante, incluida la aféresis de LDL, comportó una reducción mantenida del colesterol LDL y una mejoría de la supervivencia libre de episodios cardiovasculares en los pacientes con HFHo63. El mecanismo de acción del evinacumab no es dependiente de la vía del receptor LDL, ausente o ineficiente en la HFHo, sino que promovería el catabolismo de las LRTG y su eliminación de las partículas remanentes impidiendo la transformación de estas en LDL a través de un mecanismo dependiente de la lipasa endotelial.
Debido a la alta eficacia del evinacumab para disminuir los triglicéridos, se han realizado dos estudios de fase II en participantes con hipertrigliceridemia leve/moderada y colesterol LDL ≥ 100mg/dL (2,6 mmol/L) aleatorizados a evinacumab en diferentes dosis o placebo con resultados muy prometedores en al perfil lipídico, bien tolerado y sin efectos adversos graves64.
En resumen, el evinacumab es muy eficaz en la prevención cardiovascular de los pacientes con HFHo por su reducción del colesterol LDL. Además, por su capacidad de disminuir los triglicéridos debería ser muy útil para reducir el riesgo de pancreatitis aguda. Sin embargo, habrá que esperar los resultados de las futuras investigaciones clínicas. En este sentido, el zodasirán, un ARNip frente al ARN mensajero de ANGPTL3, ha demostrado con la dosis de 200mg una reducción del colesterol LDL de un 20%, triglicéridos de un 63% y apoB de un 22%.
Fármacos reductores de la lipoproteína(a)La Lp(a) es una partícula lipoproteica similar a la LDL unida mediante un puente disulfuro a la apo(a), que transporta colesterol y fosfolípidos oxidados, y exhibe propiedades proinflamatorias y protrombóticas. Las evidencias han confirmado que la hiperlipoproteinemia(a) es causal de ECV, estenosis valvular aórtica, mortalidad cardiovascular y por todas las causas65, que confiere un riesgo adicional a la población con DM2. Como las concentraciones de Lp(a) están determinadas genéticamente y poco influenciadas por factores ambientales, se aconseja su determinación al menos una vez en los individuos con DM2 para personalizar la estimación del riesgo cardiovascular. Se están desarrollando tres terapias de silenciamiento de genes dirigidas a la producción hepática de apo(a). El más avanzado es el pelacarsén (oligonucleótido antisentido), seguido de olpasirán (RNAip) y de zerlasirán (RNAip). No obstante, existe una incertidumbre sobre el riesgo de estos nuevos fármacos por acrecentar el riesgo de diabetes. Aunque los estudios de aleatorización mendeliana arrojaron resultados contradictorios66, los estudios con distintas poblaciones han indicado la existencia de una relación inversa entre las concentraciones de Lp(a) y el riesgo de DM2. Cabe resaltar que esta relación no es lineal para todo el rango de concentraciones de Lp(a), y se pone de manifiesto primordialmente con concentraciones muy bajas de Lp(a), dejando de ser patente para concentraciones medias o altas67–69. La relevancia de clarificar esta relación no es baladí, pues de ser cierta, cabría cuestionar el alcanzar concentraciones muy bajas de Lp(a) ante la posibilidad de aumentar el riesgo de DM2. Los datos epidemiológicos insinúan que para aumentar el riesgo de diabetes debería disminuirse las concentraciones de Lp(a) a valores extremadamente bajos, lo que parece un escenario clínico poco probable66. Por otro lado, no hay dudas de que el exceso de Lp(a) predispone a las complicaciones micro y macrovasculares en la población con diabetes. Los ensayos clínicos con inhibidores de PCSK9 sugieren que en los sujetos con DM2 o prediabetes el potencial riesgo diabetogénico del descenso de la Lp(a) sería ampliamente superado por el beneficio cardiovascular asociado al marcado descenso del colesterol aterogénico70.
Los estudios clínicos en curso con pelacarsén y olpasirán aportarán información relevante de la asociación entre las concentraciones muy bajas de Lp(a) y el riesgo de DM2, así como del impacto del fármaco en la ECV y la relación riesgo-beneficio en los individuos tratados.
ConclusionesA pesar de los avances conseguidos en las últimas décadas, realizar una prevención eficaz sigue siendo una asignatura pendiente en la medicina cardiovascular. En cuanto al tratamiento de las alteraciones lipídicas en la DM2, la reducción del colesterol LDL es el principal objetivo, y el tratamiento combinado de estatina con ezetimiba y/o moduladores de la actividad de PCSK9, la piedra angular. Más allá de controlar las concentraciones de colesterol LDL, es necesario revertir las anomalías lipoproteicas responsables del riesgo cardiovascular residual: la dislipemia aterogénica y la hiperlipoproteinemia(a). De los estudios clínicos encaminados a reducir el riesgo cardiovascular de personas con o sin DM2, y concentraciones elevadas de triglicéridos, solo el icosapento de etilo a dosis altas ha mostrado beneficios cardiovasculares. Los nuevos fármacos en desarrollo destinados a reducir los niveles de colesterol LDL, colesterol no HDL, o Lp(a) prometen reducir la carga de riesgo cardiovascular, en particular en los pacientes con DM2, o el riesgo de pancreatitis aguda, en el caso de los tratamientos para reducir los triglicéridos. No debemos olvidar, al evaluar estos nuevos fármacos, valorar su impacto en el metabolismo hidrocarbonado relacionado con el riesgo de diabetes de nueva aparición o el control glucémico.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este manuscrito.
Contribución de los autoresTodos los autores han contribuido significativamente al trabajo presentado en este artículo, cumplen los criterios de autoría de ICMJE (Committee of Medical Journal Editors) y aprueban la publicación del artículo.
Conflicto de interesesF. Arrieta, V. Sánchez-Margalet, J.A. Gimeno-Orna, J.I. Martínez-Montoro, E. Ortega-Martínez de Victoria y J. Ribalta declaran no tener ningún conflicto de intereses.
J. Pedro-Botet ha recibido honorarios de consultoría, por experto testimonio, por conferencias, presentaciones, manuscrito o eventos educativos, soporte para reuniones por Almirall, Amarin, Amgen, Daiichi-Sankyo, Esteve, Ferrer, Novartis, Organon, Sanofi y Viatris
M. Botana ha recibido honorarios de consultoría o ponencias de Almirall, Amgen, Daiichi-Sankyo, Esteve, Ferrer, Novartis, Sanofi y Viatris.
A. Pérez-Pérez ha sido consultor o ha recibido ayudas para la investigación, honorarios por conferencias, o asistencia a congresos por parte de Sanofi Aventis, Almirall, Novo Nordisk, Eli Lilly, MSD, Abbott, Dexcom, Boehringer Ingelheim, Esteve, Gilead, Novartis, Amgen, Menarini, Amarin, Novartis, Bayer, Daiichi Sankyo y AstraZeneca.
Miembros del Grupo de Trabajo Enfermedad Cardiovascular de la Sociedad Española de Diabetes:
Manuel Aguilar Diosdado (Hospital Puerta del Mar, Cádiz); Francisco J. Arrieta (Hospital U. Ramón y Cajal, Madrid); Antonio Becerra Fernández, Manuel Antonio Botana López (Hospital U. Lucus Augusti, Lugo); María del Mar Campos Pastor (Hospital U. Clínico San Cecilio, Granada); Santiago Durán García (Sevilla); José Antonio Fornos Pérez (Farmacia, Cangas de Morrazo); José Antonio Gimeno Orna (Hospital Clínico U. Lozano Blesa, Zaragoza); Olga González Albarrán (Hospital General Universitario Gregorio Marañón, Madrid); Montse Guardiola Guionnet (Universitat Rovira i Vigili, Reus); Gonzalo Fernando Maldonado Castro (Hospital U. de Álava, Vitoria); Carmela Teresa Manrique Mutiozábal (Hospital de Urduliz, Urduliz); Ana Belén Mañas Martínez (Hospital Clínico U. Lozano Blesa, Zaragoza); José Ignacio Martínez Montoro (Hospital U. Virgen de la Victoria, Málaga); Inés Mera Gallego (Farmacia Eduardo Satue de Velasco, Maella); Laura Montánez Fernández (Hospital U. Ramón y Cajal, Madrid); Jorge Navarro Pérez (Hospital Clínico U. de Valencia, Valencia); Juan Carlos Obaya Rebollar (C.S. Chopera, Alcobendas); Emilio Carlos Ortega Martínez de Victoria (Hospital Clínico y Provincial de Barcelona, Barcelona); Ángel Michael Ortiz Zúñiga (Hospital U. Valle de Hebrón, Barcelona); José Luis Pardo Franco (C.S. Orihuela I, Orihuela); Juan Pedro-Botet Montoya (Hospital del Mar, Barcelona); José Carlos Pérez Sánchez (C.S. Rincón de la victoria, Rincón de la Victoria); Antonio Pérez Pérez (Hospital de la Santa Creu i Sant Pau, Barcelona); Carlos Puig Jové (Hospital U. Mutua de Tarrasa, Tarrasa); Josep Ribalta Vives (Universitat Rovira i Vigili, Reus); Víctor Sánchez Margalet (Hospital U. Virgen Macarena, Sevilla); Francisco Javier Tébar Massó (Murcia); Juan Manuel Zubiría Gortázar (Complejo Hospitalario de Navarra, Pamplona).