Evaluar la adecuación de la supresión de TSH (tsTSH) al diagnóstico y en la última visita de seguimiento.
MétodosEstudio observacional retrospectivo en aquellos pacientes en seguimiento por CDT en un hospital de tercer nivel.
ResultadosSe evaluaron 216 pacientes (79,2% mujeres), edad media 59,0±13,1 años y un seguimiento medio de 6,9±4,3 años. Un 88,4% fueron carcinomas papilares.
Al diagnóstico, el 69,2% presentaban un riesgo bajo de recurrencia (RR) vs. 13,6% de RR elevado. La estadificación dinámica del riesgo (EDR) clasificó a los pacientes, inicialmente y en la última visita, como respuesta excelente (RE) en un 60% y un 70,7%, respectivamente.
Aquellos pacientes con RE en el primer y último control de seguimiento, mantuvieron tsTSH en un 30,7 y 16,3% de los casos, respectivamente (p < 0,001).
Los factores asociados a mantener la tsTSH en la última visita de control fueron la menor edad, mayor RR al diagnóstico, la EDR en el seguimiento, la presencia de multifocalidad e invasión vascular (p < 0,05).
En un modelo de regresión logística adoptando la tsTSH en el seguimiento como variable dependiente, exclusivamente la edad (β = -0,062; p < 0,001), el RR al diagnóstico (β = 1.074; p< 0,05) y la EDR en el seguimiento (β = 1.237; p < 0,05) mantuvieron la significación estadística.
ConclusionesA pesar de las recomendaciones actuales, un 30,7% de los pacientes con bajo RR y RE inicial se encuentran bajo tsTSH. Este porcentaje se redujo al 16,3% en RE tras un seguimiento medio de 6,9 años. La edad, el RR inicial y la EDR durante el seguimiento se relacionaron con mantener la tsTSH.
To evaluate the adequacy of TSH suppression therapy (TSHst) at the first disease assessment and the last follow-up visit.
MethodsRetrospective observational study of those patients under follow-up of DTC in a reference hospital.
Results216 patients (79.2% women) were evaluated, with a mean age 59.0±13.1 years-old and a mean follow-up of 6.9±4.3 years. 88.4% were papillary carcinomas.
At diagnosis, 69.2% had a low risk of recurrence (RR) compared to 13.6% with a high RR. Dynamic risk stratification (DRS) classified patients at first disease assessment and the last visit as excellent response (ER) in 60.0% and 70.7%, respectively.
Those patients with ER in the first and last follow-up control maintained TSHst in 30.7% and 16.3% of the cases, respectively (p < 0.001).
The factors associated with maintaining TSHst at the last control were younger age, higher RR at diagnosis, DRE at follow-up, presence of multifocality and histological vascular invasion (p < 0.05).
In a logistic regression analysis adopting tsTSH at follow-up as the dependent variable, exclusively age (β = -0.062; p < 0.001), RR at diagnosis (β = 1 074; p < 0.05) and EDR during follow-up (β =1 237; p < 0.05) maintained statistical significance.
ConclusionsDespite the current recommendations, 30.7% of patients with low RR and initial ER are under TSHst. This percentage reduced to 16.3% in those patients with ER after a mean follow-up of 6.9 years. Age, baseline RR, and DRE during follow-up were associated to maintaining tsTSH.
A pesar de que el carcinoma diferenciado de tiroides (CDT) constituye la neoplasia endocrina maligna más frecuente, la prevalencia en la población española es menor del 1%, afectando mayoritariamente a mujeres en edad media de la vida, y en general muestra un pronóstico excelente1. En este contexto, las guías clínicas internacionales han ido modificando sus protocolos de diagnóstico, tratamiento y seguimiento del nódulo tiroideo y de los CDT hacia formas menos agresivas de control2,3. La terapia supresiva de la TSH con levotiroxina (tsTSH) no ha sido una excepción a este cambio.
Clásicamente, el manejo a largo plazo del CDT tras la tiroidectomía total incluía el tratamiento con levotiroxina a dosis suprafisiológicas para alcanzar la inhibición de la liberación de la TSH hipofisaria2. El concepto teórico subyacente perseguía la supresión de los niveles de TSH circulantes y su inhibición como factor de crecimiento y proliferación de aquellas células foliculares aún presentes tras completar el tratamiento del CDT4. Sin embargo, los estudios clínicos hasta la fecha han demostrado resultados equívocos en aquellos pacientes con riesgo elevado o intermedio de recurrencia del CDT5,6, y claramente negativos en pacientes con CDT de bajo riesgo7. Además, la tsTSH no está exenta del riesgo de desarrollo de complicaciones cardiovasculares o esqueléticas a largo plazo, entre ellas: aumento de la frecuencia cardiaca y masa del ventrículo izquierdo, fibrilación auricular, osteoporosis, etc.8
En esta línea, la Asociación Americana de Tiroides en su guía clínica de 2015 (ATA 2015) recomienda la tsTSH con el objetivo de alcanzar valores de TSH < 0,1 mUI/L en pacientes con CDT de alto riesgo, TSH entre 0,1 y 0,5 mUI/L en pacientes con CDT de riesgo intermedio y de 0,5 a 2 mU/L en aquellos pacientes de bajo riesgo. Asimismo, la ATA aconseja la modificación de los objetivos de la tsTSH dependiendo de la respuesta al tratamiento del CDT, siguiendo los criterios de estadificación dinámica del riesgo (EDR): respuesta estructural incompleta o bioquímicamente incompleta: TSH < 0,1 mUI/L; respuesta indeterminada TSH entre 0,1 y 0,5 mUI/L y respuesta excelente de 0,5 a 2,0 mUI/L.
A pesar de las recomendaciones en las guías clínicas y la evidencia científica, los estudios realizados y encuestas en práctica clínica real demuestran una sobreutilización de la tsTSH, especialmente en aquellos pacientes con CDT de bajo riesgo9. Sin embargo, ningún estudio hasta la fecha ha analizado los cambios en los objetivos terapéuticos de los niveles de TSH, según el riesgo de recurrencia inicial y la evolución de la EDR en la práctica clínica.
El objetivo del presente estudio fue evaluar la tsTSH en una cohorte de pacientes con CDT según su riesgo de recurrencia inicial y a lo largo del seguimiento mediante la EDR, en una unidad de alta resolución de tiroides en endocrinología (UART); así como analizar los factores clínicos relacionados con el mantenimiento de la tsTSH.
Material y métodosEstudio de cohortes retrospectivo en aquellos pacientes diagnosticados de CDT en seguimiento durante 2020 en la UART del Servicio de Endocrinología y Nutrición de un hospital terciario y con un seguimiento mínimo de dos años tras completar el tratamiento inicial (tiroidectomía total±radioyodo).
Se obtuvieron datos clínicos: edad al diagnóstico, año del diagnóstico del cáncer, meses de evolución desde el diagnóstico de la enfermedad hasta la última visita; tipo y características del cáncer diagnosticado: tamaño en centímetros, multifocalidad, extensión vascular, así como estadificación TNM. Además, se registró el riesgo de recurrencia tras el diagnóstico (excluyendo marcadores moleculares) y la estadificación dinámica del riesgo a los 18 meses de seguimiento tras completar el tratamiento inicial y en la última visita de control, según los criterios de la guía ATA 2015 en aquellos pacientes sometidos a tiroidectomía total y ablación con yodo radiactivo2, y la estadificación dinámica del riesgo modificada en aquellos pacientes con tiroidectomía total que no recibieran ablación con yodo radiactivo10.
Asimismo, se determinaron los parámetros de laboratorio mediante inmunoensayo de electroquimioluminiscencia necesarios para el control del CDT con la misma metodología a lo largo del seguimiento (ECLIA) (Roche Diagnostics, Ginebra, Suiza). En concreto: tiroglobulina plasmática de segunda generación, anticuerpos antitiroglobulina y niveles de TSH a los 12 meses tras completar el tratamiento inicial y en la última visita de seguimiento. Los niveles de TSH se estratificaron siguiendo las recomendaciones de control de la guía ATA 20152: TSH < 0,1 mUI/L; TSH entre 0,1 y 0,5 mUI/L y TSH mayor de 0,5 a 2,0 mUI/L.
La clasificación histológica se realizó de acuerdo con la clasificación de la OMS11 en dos categorías principales: carcinoma papilar y carcinoma folicular. Este último incluye las variantes mínimamente y ampliamente invasivas, la variante de células claras y los carcinomas de Hürthle (o variante oncocítica). En cuanto a las variantes histológicas del carcinoma papilar se agruparon en tres categorías: carcinomas papilares clásicos, carcinomas papilares variante folicular y las variantes histológicas más agresivas (subtipos esclerosante difuso, sólida-trabecular, de células altas y de células columnares). Los tumores fueron clasificados al diagnóstico de acuerdo a la clasificación TNM según la octava edición del American Joint Committee of Cancer12.
Análisis estadísticoLos resultados se expresan como media y desviación estándar (DE). La distribución normal de las variables se analizó con el test de Kolmogorov-Smirnov. Las variables cuantitativas con distribución normal se analizaron con una prueba t de Student bilateral. Las variables no paramétricas se evaluaron mediante la prueba de U de Mann-Whitney. Las variables cualitativas se expresaron como porcentajes (%) y se analizaron con el test de χ2 (con corrección de Fisher cuando fue necesario). Por último, se utilizó un modelo de regresión logística que incorporó como variables independientes el efecto de la edad, sexo, riesgo de recurrencia al diagnóstico y la EDR en la última visita de seguimiento, así como la multifocalidad e invasión vascular histológica, sobre los niveles en la última visita de seguimiento de TSH < 0,1 mUI/L como variable dependiente.
Se utilizó el paquete estadístico SPSS versión 17.0 (SPSS Inc., Chicago, IL, EE. UU.) para el análisis. El nivel de significación estadística aceptado fue del 5% (p < 0,05). El estudio fue aprobado por el Comité Ético de Investigación Clínica (CEIC) del centro hospitalario.
ResultadosSe evaluaron un total de 216 pacientes (79,2% mujeres) con una edad media de 59,0±13,1 años y un seguimiento medio desde el diagnóstico de 6,9±4,3 años. El tamaño medio tumoral fue de 1,6±1,2 cm de diámetro. La histología predominante fue el carcinoma papilar, presentando un 49,8% multifocalidad y un 8,8% invasión vascular histológica. Al evaluar el riesgo de recurrencia al diagnóstico de los pacientes con CDT, un 69,2% de los pacientes presentaban un riesgo bajo vs. un 13,6% de riesgo elevado. La EDR clasificó a los pacientes en la categoría de respuesta excelente en un 60% y un 70,7% de los casos al completar el tratamiento inicial y en la última visita de seguimiento, respectivamente (tabla 1).
Características de los pacientes en seguimiento por carcinoma diferenciado de tiroides
| Media (DE)/Porcentaje | |
|---|---|
| Pacientes | 216 (79,2% mujeres) |
| Edad al diagnóstico (años) | 59,0 (13,1) |
| Años de evolución | 6,9 (4,3) |
| Tamaño tumoral medio (cm) | 1,6 (1,2) |
| Multifocalidad | 49,8% |
| Invasión vascular | 8,8% |
| Tratamiento con I131 al diagnóstico | 87,4% |
| Clasificación histológica | |
| Papilar | 88,4% |
| Clásico | (54,4%) |
| Variante folicular | (34,6%) |
| Variantes agresivas | (11%) |
| Folicular | 11,6% |
| Variante oncocítica | (75,9%) |
| Resto variantes | (24,1%) |
| Riesgo recurrencia (ATA 2015) | |
| Bajo | 69,2% |
| Intermedio | 17,3% |
| Alto | 13,6% |
| Estadio AJCC 8.a edición | |
| I | 81,9% |
| II | 5,6% |
| III | 11,1% |
| IV | 1,4% |
| Estadificación dinámica del riesgo | Inicial | Seguimiento |
|---|---|---|
| Respuesta excelente | 60,0% | 70,7% |
| Respuesta indeterminada | 15,3% | 8,8% |
| Respuesta bioquímica incompleta | 9,3% | 7,9% |
| Respuesta structural incompleta | 15,3% | 12,6% |
AJCC: American Joint Committee of Cancer; ATA 2015: guía de la Asociación Americana de Tiroides del 2015; DE: desviación estándar.
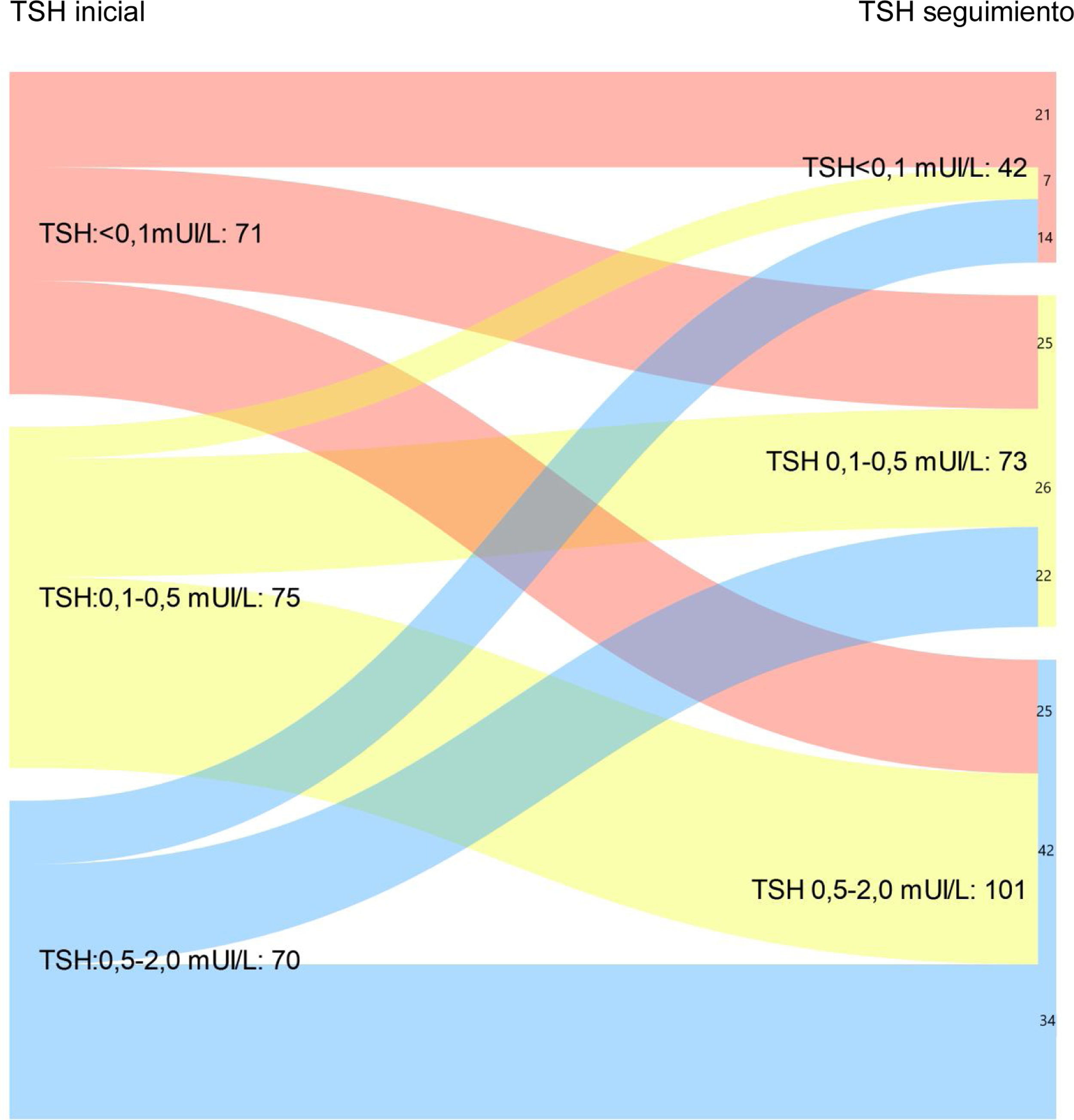
En la figura 1A se recoge la evolución de los niveles de TSH en la totalidad de la muestra analizada (216 pacientes). Se observa cómo el 50% de los pacientes con TSH < 0,01 mUI/L tras completar el tratamiento inicial mantienen el nivel de TSH suprimido en la última visita de seguimiento (p < 0,05). Igualmente, un 56% y un 48,6% de los pacientes con niveles de TSH iniciales de 0,1-0,5 mUI/L y 0,5-2 mUI/L, respectivamente, evolucionan a niveles de TSH objetivo 0,5-2 mUI/L en la última visita de control (p < 0,05).
Al evaluar a los pacientes por RR, un 29,1, 37,8 y un 44,8% de los pacientes con riesgo bajo, medio y elevado de recurrencia al diagnóstico presentaban niveles de TSH < 0,1 mUI/L tras completar el tratamiento inicial vs. un 16,2, 18,9, 34,5% en la última visita de seguimiento (p < 0,05)
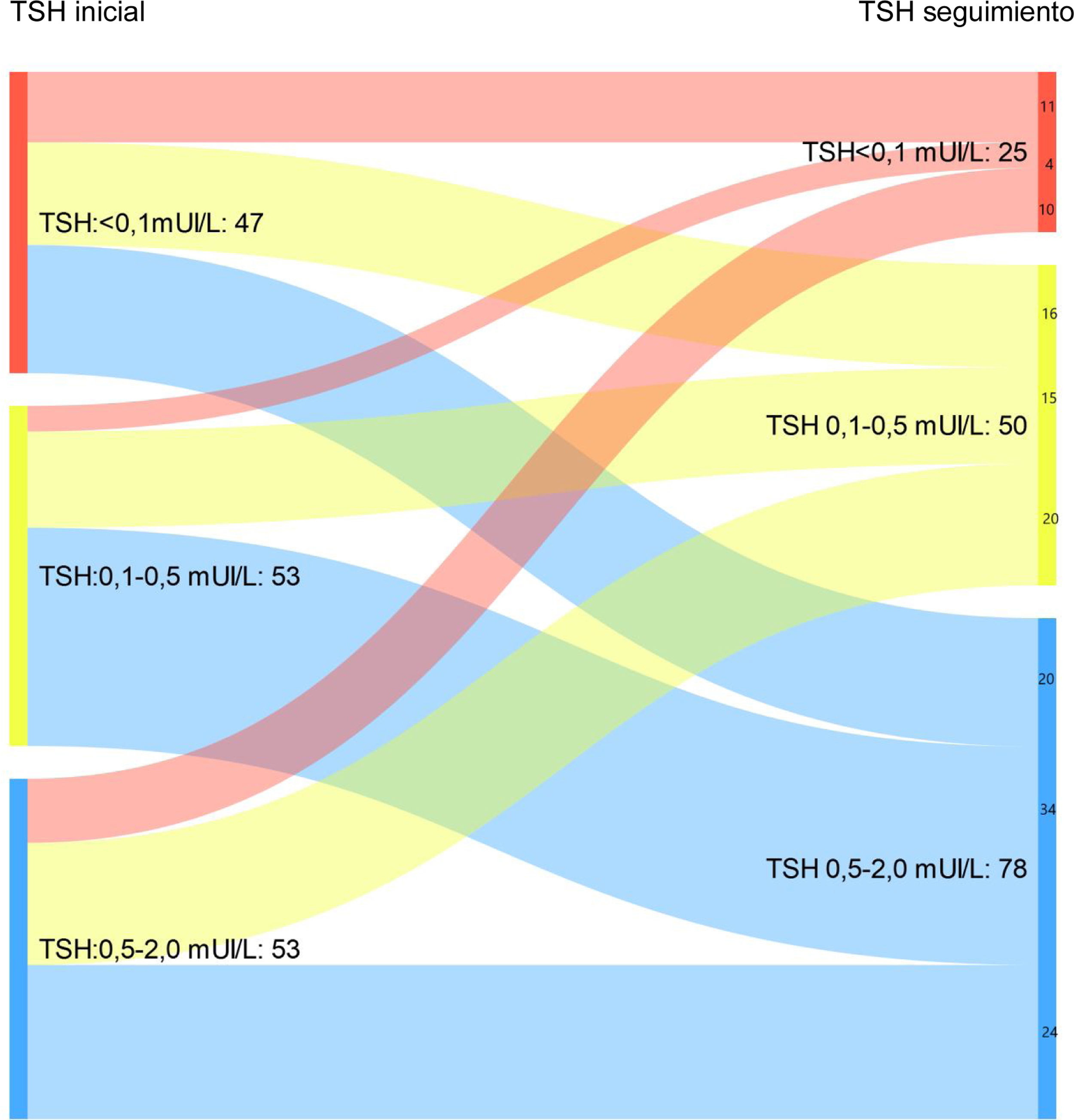
Al analizar exclusivamente aquellos pacientes con respuesta excelente en el último control de seguimiento, se observa cómo un 16,3% mantienen TSH suprimidas en la última visita de control vs. un 30,7% en la primera visita tras completar el tratamiento inicial (fig. 1B). A su vez, un 51% presentaban niveles de TSH entre 0,5-2 mUI/L en el último control vs. un 34,6% al diagnóstico (p < 0,05).
De la misma manera, al analizar exclusivamente a aquellos pacientes con respuesta bioquímica o estructural incompleta, se observa cómo un 22,7 y un 36,4% mantienen TSH < 0,1 mUI/L o TSH entre 0,1-0,5 mUI/L en la última visita de control, respectivamente. Sin embargo, en la primera visita tras completar el tratamiento inicial los niveles de TSH suprimidos o entre 0,1-0,5 mUI/L correspondían al 37,5% y a un 50% de los pacientes, respectivamente (p < 0,05).
Las características asociadas a mantener niveles de TSH < 0,1 mUI/L en la última visita de control fueron: la edad al diagnóstico (45,6±13,1 vs. 53,2±14,3 años) –p < 0,001–, el riesgo de recurrencia al diagnóstico ATA 2015, la EDR en el último control, así como la presencia de multifocalidad e invasión vascular histológica (p < 0,05) (tabla 2). Al evaluar exclusivamente a aquellos pacientes con respuesta excelente en la última visita de seguimiento, se relacionó con niveles de TSH < 0,1 mUI/L una edad más joven al diagnóstico (43,9±13,0 vs. 51,0±13,3 años) –p < 0,001–, la multifocalidad (64 vs. 44,4%) y la invasión vascular histológica (16 vs. 4,8%) (p < 0,05). Sin embargo, al analizar aquellos pacientes con respuesta bioquímica o estructural incompleta en la última visita de control, ninguna variable clínica o histológica se relacionó con mantener niveles de TSH suprimidos.
Comparativa de las características clínicas, histológicas, riesgo de recurrencia y estadificación dinámica del riesgo entre pacientes con y sin terapia supresiva de la TSH
| TSH < 0,1 mUI/L | TSH > 0,1 mUI/L | p | |
|---|---|---|---|
| Sexo (mujeres) | 71,4% | 81,0% | ns |
| Edad al diagnóstico (años) | 45,6 ± 13,1 | 53,2 ± 14,3 | p < 0,001 |
| Años de evolución | 7,2 (6,0) | 6,9 (4,8) | ns |
| Tamaño tumoral medio (cm) | 1,7 (1,1) | 1,5 (1,3) | ns |
| Multifocalidad | 63,4% | 46,5% | < 0,05 |
| Invasión vascular | 17,1% | 7,0% | < 0,05 |
| Tratamiento con I131 al diagnóstico | 92,9% | 86,1% | ns |
| Clasificación histológica | |||
| Papilar | 90,5% | 87,6 | ns |
| Clásico | (47,4%) | (56,2%) | |
| Variante folicular | (42,1%) | (32,7%) | |
| Variantes agresivas | (10,5%) | (11,1) | |
| Folicular | 9,5% | 12,4% | ns |
| Variante oncocítica | (75,0%) | (76,2%) | |
| Resto variantes | (25,0%) | (23,8%) | |
| Riesgo recurrencia (ATA 2015) | < 0,05 | ||
| Bajo | 58,5% | 71,7% | |
| Intermedio | 17,1% | 17,3% | |
| Alto | 24,4% | 11,0% | |
| Estadificación dinámica del riesgo final | < 0,05 | ||
| Respuesta excelente | 59,5% | 73,4% | |
| Respuesta indeterminada | 4,8% | 8,7% | |
| Respuesta bioquímica incompleta | 19,0% | 11,0% | |
| Respuesta estructural incompleta | 16,7% | 6,9% | |
ATA 2015: guía de la Asociación Americana de Tiroides del 2015; ns: no significativo.
En un análisis de regresión logística adoptando el nivel de TSH suprimida en el seguimiento como variable dependiente, y que incluía la edad, sexo, riesgo de recurrencia al diagnóstico y la EDR en la última visita de seguimiento, así como la multifocalidad e invasión vascular histológica como variables independientes, las únicas variables que mantuvieron la significación estadística fueron la edad (β = -0,062; p < 0,001), el riesgo de recurrencia elevado al diagnóstico (β = 1,074; p < 0,05) y la EDR final (β = 1,237; p < 0,05).
DiscusiónEl tratamiento con levotiroxina a dosis suprafisiológicas con el objetivo de lograr la supresión de los niveles de TSH circulantes se ha considerado durante décadas parte de la terapia esencial del CDT, independientemente de los niveles de riesgo o la evolución de la terapia13,14. Sin embargo, las recomendaciones actuales clasifican el nivel de TSH objetivo dependiendo del riesgo de recurrencia inicial y la evolución de la EDR a lo largo del seguimiento2,3. De hecho, la evidencia científica que sustenta la terapia supresiva en pacientes de riesgo elevado o intermedio de recurrencia es controvertida5–7, y claramente en contra en el caso de riesgo bajo7,15.
A pesar de la evidencia científica publicada y de las recomendaciones de las guías clínicas actuales, el sobretratamiento sigue siendo la norma como objetivan encuestas clínicas dirigidas a evaluar la actitud de aquellos especialistas encargados del seguimiento de los pacientes con CDT en diferentes escenarios9. En el reciente estudio de Papaleontiou et al., el mantenimiento inapropiado de los niveles de TSH suprimidos se relacionó con una sobreestimación del riesgo de recurrencia y una menor experiencia en el seguimiento del CDT9. Es más, este sobretratamiento no es exclusivo del CDT, sino común al tratamiento del hipotiroidismo (especialmente subclínico), independientemente de la causa subyacente, tal y como se ha publicado recientemente16. En ambas situaciones se persiguen objetivos sin suficiente evidencia científica: la reducción del riesgo del riesgo de recurrencia/mortalidad en el caso del CDT, y la supuesta mejoría en calidad de vida, síntomas depresivos, fatiga o función cognitiva en el caso del tratamiento del hipotiroidismo subclínico17. Asimismo comparten una clara subestimación de los riesgos relacionados con la posibilidad del desarrollo de un hipertiroidismo subclínico iatrogénico, especialmente si el mismo se mantiene indefinidamente en el tiempo8.
Los resultados del presente estudio objetivan el riesgo de sobretratamiento existente en los pacientes con CDT, también en unidades especializadas. De hecho, un 16,3% de la población evaluada con respuesta excelente mantuvieron niveles de TSH < 0,1 mUI/mL tras casi siete años de seguimiento medio. Esta última situación es especialmente preocupante, dado que la evidencia científica actual va claramente en contra de la tsTSH en pacientes con respuesta excelente y riesgo bajo o intermedio de recurrencia, incluso durante los primeros años tras el diagnóstico7,15.
A su vez, es evidenciable cómo el porcentaje de pacientes con tsTSH tras completar el tratamiento inicial es estadísticamente superior tanto en respuesta excelente (30,7%), como al evaluar el RR al diagnóstico. De hecho, se objetiva una clara reducción del porcentaje de pacientes con tsTSH en el momento de completar el tratamiento inicial frente a la última visita de seguimiento, independientemente de la categoría de riesgo inicial o EDR evaluada. Es más, a pesar de que los objetivos de las guías clínicas no se cumplen en prácticamente una quinta parte de los pacientes evaluados con respuesta excelente, existe una clara tendencia a reducir la tsTSH durante el seguimiento en todos los pacientes.
La justificación del porqué se mantiene la tsTSH, incluso con pacientes con un pronóstico excelente2, es compleja y no obedece a un solo factor. Estudios previos han relacionado esta persistencia de la terapia supresiva a una sobreestimación del riesgo de recurrencia por parte de los especialistas9,18 y a la menor evidencia científica en ciertas categorías de la EDR (respuesta bioquímica incompleta o indeterminada), incluso a pesar de una evolución hacia la respuesta excelente en un porcentaje elevado de los pacientes19. Además, es indudable que ciertas recomendaciones basadas exclusivamente en estudios de baja calidad o consensos de expertos, dificultan la implementación de las guías clínicas favoreciendo la inercia terapéutica20 y originan el retraso en implementar los cambios aconsejado en las guías, incluso durante años21. Por último, si bien los centros con menor experiencia en el manejo de CDT pudieran presentar tasas de tsTSH incluso mayores9, esta realidad no es ajena a aquellos centros con elevado volumen de pacientes complejos en seguimiento, como en nuestro estudio.
Mención aparte merece el no cumplimiento de las recomendaciones en el subgrupo de pacientes con respuesta bioquímica o estructural incompleta. Llamativamente, nuestros resultados demuestran una reducción de la terapia supresiva a lo largo del seguimiento, semejante a aquellos pacientes con respuesta excelente. Sin embargo, el porcentaje de pacientes con rangos de TSH entre 0,5-2 mUI/L en la última visita de control es inferior en el subgrupo de respuesta bioquímica y estructural incompleta frente a aquellos con respuesta excelente (40,9 vs. 51,0%, respectivamente). Es cierto que estos resultados pueden estar parcialmente sesgados por el menor número de sujetos en las categorías de mayor riesgo en nuestra cohorte. Sin embargo, no podemos olvidar la evolución heterogénea especialmente en la categoría de respuesta bioquímica incompleta19. Es más, las guías clínicas actuales recomiendan objetivos de TSH entre 0,1-0,5 mUI/L en la categoría de respuesta bioquímica incompleta en ausencia de claros signos de progresión2, lo que justificaría al menos parcialmente los resultados del presente estudio.
Por último, al intentar evaluar aquellas características clínicas, histológicas o de evolución del CDT que podrían asociarse a la tsTSH, se observó cómo criterios clínicos (edad), criterios clásicos de agresividad histológica22,23 (multifocalidad e invasión vascular), así como de categorización del riesgo (riesgo de recurrencia tras el diagnóstico y EDR en el seguimiento) jugaban el papel principal a la hora del mantenimiento de la terapia tanto globalmente como en aquellos pacientes con respuesta excelente en el seguimiento. Ahora bien, al realizar un análisis multivariante, tan solo la edad, el riesgo de recurrencia al diagnóstico y la EDR en el seguimiento se relacionaron con el mantenimiento de la tsTSH. Por lo tanto, las variables esenciales a la hora de decidir el mantenimiento de la tsTSH en el presente estudio, incluso más allá de las recomendaciones actuales, se basaron en la clasificación de la EDR en la última visita de control, pero también en el riesgo de recurrencia inicial fundamentado esencialmente en criterios de agresividad histológica al diagnóstico2. Es decir, si bien la EDR en el último control debería ser el criterio único a la hora de decidir los niveles objetivo de TSH en una cohorte de CDT con un seguimiento mínimo de dos años, la histología inicial sigue jugando un papel esencial a la hora de decidir el valor de TSH objetivo, incluso tras siete años de seguimiento medio, contraviniendo las recomendaciones actuales2. En otras palabras, la agresividad histológica del CDT al diagnóstico limita la relajación de la tsTSH, incluso en pacientes con RE tras años de evolución.
Mención aparte merece el hecho de que una edad más joven se relacionara con el mantenimiento de la tsTSH, independientemente del riesgo de recurrencia o la EDR. En este sentido, resulta llamativo cómo el CDT es el único cáncer que incluye la edad en su estadiaje11,24. Es más, aquellos pacientes menores de 55 años, debido a su mejor pronóstico, pueden alcanzar como máximo un estadiaje II, incluso en presencia de enfermedad ganglionar o metastásica11. En el presente estudio, los resultados obtenidos van en contra de esta evidencia: aquellos pacientes con tsTSH en el seguimiento eran significativamente más jóvenes (45,6 vs. 53,2 años), a pesar de presentar un tiempo de evolución similar (siete años). La justificación a esta realidad puede deberse a varios motivos: una percepción del riesgo de recurrencia sobrestimada en aquellos pacientes con una mayor esperanza de vida; o bien a una infraestimación del riesgo de aparición de complicaciones relacionadas con el hipertiroidismo subclínico iaotrogénico, algunas de las cuales estarían directamente relacionadas con el tiempo de mantenimiento de la tsTSH (osteoporosis)8.
Nuestro estudio presenta ciertas limitaciones a tener en cuenta. En primer lugar, los resultados obtenidos corresponden a la realidad de una única UART dirigida por endocrinólogos con alta experiencia en el seguimiento de la patología. Por lo tanto, los resultados podrían no ser equiparables a otros centros o unidades, o incluso por facultativos de otras especialidades9. Por otro lado, a pesar de que se tuvo en cuenta la estabilidad de la dosis de levotiroxina a la hora de recoger los niveles de TSH, estos niveles corresponden a un único valor. Además, el estrecho margen objetivo de los niveles de TSH en el seguimiento del CDT no son siempre fáciles de alcanzar y mantener (mal cumplimiento, malabsorción, etcétera)25, y en ocasiones pueden verse modificados por parte del especialista debido a comorbilidades asociadas no evaluadas en el presente estudio (osteoporosis, presencia de arritmias cardiacas, entre otras)2. Por último, y en concreto en las categorías de respuesta bioquímica y estructural incompleta el menor número de pacientes no permite asegurar una potencia suficiente para un análisis pormenorizado de los resultados en este grupo. Sin embargo, presenta ciertas fortalezas a destacar. En primer lugar, es uno de los primeros estudios que evalúa la consecución de los objetivos de TSH en una Unidad de Tiroides no solo al diagnóstico, sino también durante el seguimiento a largo plazo, según las recomendaciones actuales2 y la EDR. Además, los resultados obtenidos son coherentes y en la línea de las escasas publicaciones previas al respecto.
En conclusión, a pesar de las recomendaciones actuales, prácticamente una quinta parte de los pacientes con bajo riesgo y respuesta excelente se encuentran bajo tratamiento supresivo con levotiroxina durante el seguimiento del CDT. Las variables que se relacionaron con mantener la tsTSH fueron la edad, el riesgo de recurrencia inicial y la EDR en el seguimiento.
FinanciaciónNo ha existido ninguna fuente de financiación para la realización de este proyecto.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.