1) Determinar si una glucemia basal en el primer trimestre (GBPT) del embarazo ≥ 92 mg/dl anticipa la aparición de complicaciones materno-fetales de diabetes mellitus gestacional (DMG). 2) Valorar si la GBPT puede sustituir al diagnóstico clásico de DMG mediante sobrecarga oral de glucosa (SOG).
MétodosEstudio retrospectivo de 1.425 embarazos con GBPT y test de ÓSullivan (TOS) en el segundo trimestre más SOG según resultado del TOS. Valoración de la sensibilidad y especificidad de la GBPT respecto al diagnóstico clásico de DMG. Relación de las complicaciones materno-fetales con la GBPT en el grupo total y tras excluir a las madres que realizaron tratamiento médico específico de DMG.
ResultadosLa sensibilidad y la especificidad de la GBPT ≥ 92mg/dl respecto al diagnóstico de DMG en el segundo trimestre, usando los criterios clásicos basados en la SOG de Carpenter y Coustan, fueron respectivamente del 46,4 y el 88,8%. Respecto a las gestantes con GBPT <92 mg/dl, las gestantes con GBPT ≥ 92 mg/dl tienen mayor peso del recién nacido (3.228±86 versus 3.123±31g; p <0,05) y mayor porcentaje de macrosomía (6,9% versus 3,5%; p <0,05). Esta relación se mantuvo tras excluir a las pacientes diagnosticadas y tratadas por DMG (peso: 3.235 ± 98 versus 3.128 ± 31 g; p < 0,05; porcentaje de macrosomía: 7,2% versus 3,4%; p < 0,05).
Conclusiones1) La GBPT no es un buen sustituto del diagnóstico clásico de DMG en el segundo trimestre. 2) Las gestantes con GBPT ≥ 92 mg/dl, aun sin diagnóstico posterior de DMG, constituyen un grupo de riesgo de macrosomía fetal y podrían beneficiarse de la instauración de tratamiento nutricional y ejercicio físico.
To establish whether fasting glucose levels in the first trimester (FGFT)of pregnancy ≥ 92 mg/dL (5.1 mmol/L) (FGFT) anticipate the occurrence of maternal-fetal complications of gestational diabetes mellitus. To assess whether FGFT can replace diagnosis of GDM using the classical two-step oral glucose tolerance test (OGTT).
MethodsA retrospective study of 1425 pregnancies with FGFT and O'Sullivan Test (OST) and/or OGTT according to OST results in the second trimester. FGFT sensitivity and specificity were assessed as compared to the conventional diagnosis of GDM. The relationship between maternal-fetal complications and FGFT was assessed in the total group and after excluding mothers who received specific medical treatment for GDM.
ResultsSensitivity and specificity of FGFT levels ≥ 92mg/dL were 46.4% and 88.8% as compared to diagnosis of GDM using Carpenter and Coustan criteria. In the total group, a statistically significant relationship was found between FGFT levels ≥ 92 mg/dL and newborn weight (3228±86 versus 3123±31g; P<.05), as well as a higher rate of macrosomia (6.9% versus 3.5%; P<.05). This association persisted after excluding patients diagnosed with and treated for GDM (weight: 3235±98 versus 3128±31 g; P<.05; percentage of macrosomia: 7.2% versus 3.4%; P<.05).
ConclusionsFGFT is not a good substitute for conventional diagnosis of GDM in the second trimester. Pregnant women with FGFT levels ≥ 92 mg/dL, even with no subsequent diagnosis of GDM, are a risk group for fetal macrosomia and could benefit from dietary measures and physical exercise.
La diabetes mellitus gestacional (DMG) es una diabetes diagnosticada en el embarazo y sin evidencia de diabetes previa1. Cuando a una predisposición pregestacional a la diabetes (por carga genética, obesidad y otras causas de resistencia a la insulina)2 se añaden los efectos contrainsulares propios de la adaptación fisiológica al embarazo3, aparece la alteración patológica del metabolismo hidrocarbonado que llamamos DMG. La mayoría de las veces la DMG es un trastorno leve y autolimitado, pero aun así aumenta de manera significativa el riesgo de complicaciones obstétricas, fetales y perinatales, complicaciones que son evitables con el tratamiento médico4-6.
En general, la asociación de los efectos fisiológicos del embarazo con la predisposición a la diabetes tipo 2 no genera un resultado de todo o nada, sino una variación continua en los valores de glucemias pre y posglucosa oral. En unos casos, la predisposición pregestacional produce sobre todo resistencia a la insulina con aumento relativo de la glucemia basal respecto a la posprandial, en otros casos se produce más bien una respuesta reducida de la célula beta a la sobrecarga de glucosa, con glucemias basales normales y posprandiales elevadas, y en otras ocasiones aparecen juntas las 2 alteraciones. Estos 2 comportamientos fisiopatológicos distintos condicionan la eficacia diagnóstica de los criterios basados en los valores de glucemia basal o en los valores tras una sobrecarga de glucosa. En este sentido, el estudio HAPO7 mostró que tanto la glucemia basal como las glucemias tras sobrecarga de glucosa se relacionan con los efectos adversos obstétricos y neonatales linealmente, sin un punto de corte claro.
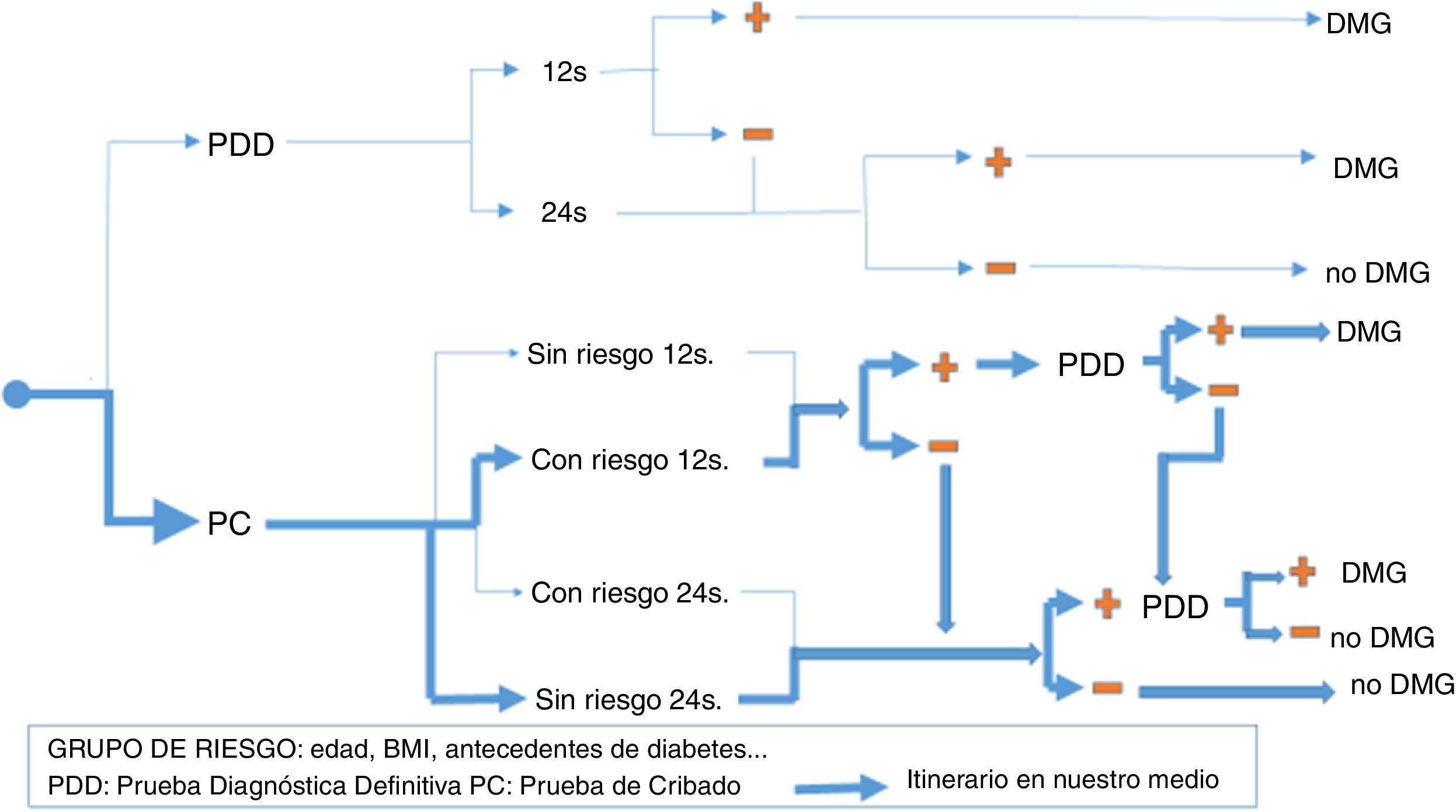
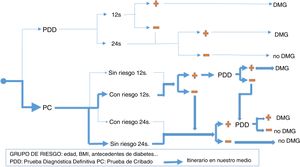
No existe un «patrón de oro» previo sobre el que poder estimar tanto la prevalencia real de la DMG como la sensibilidad y la especificidad de cada criterio diagnóstico y por eso es tan importante buscar criterios de consenso a la hora de seleccionar al grupo de gestantes que deben recibir tratamiento médico completo de la DMG, de manera que se maximicen los beneficios de este tratamiento sin disparar innecesariamente los costes. Además, dado que no todas las embarazadas tienen el mismo riesgo de tener DMG, a la decisión sobre el criterio diagnóstico se añade la decisión estratégica de si hacer en todas las embarazadas una prueba diagnóstica definitiva («criterio de un paso»), o más bien hacer pruebas de cribado y reservar las pruebas definitivas solo para los casos de cribado positivo («criterio de dos pasos»). Aún dentro del cribado, existen 2 opciones alternativas: test de O'Sullivan (TOS) o glucemia basal (GB). Y también hay controversia sobre la estrategia temporal: cribado universal en el primer trimestre, cribado en este trimestre solo si existen factores de riesgo de DMG o no hacer cribado en el primer trimestre y dejar todo el proceso diagnóstico para el segundo trimestre. En la figura 1 se muestran las distintas estrategias diagnósticas de DMG utilizadas en la actualidad y la utilizada en nuestro medio.
Respecto al criterio diagnóstico, a los criterios clásicos basados en SOG de Carpenter y Coustan (CyC)8 (SOG 100 g y diagnóstico de DMG si en 2 o más puntos de GP se superan valores de 95, 180, 155 y 140mg/dl a los 0, 60, 120, 180min) y de la National Diabetes Data Group (NDDG)9 (SOG 100 g y 2 o más valores mayores de 105, 190, 165 y 145mg/dl a los 0, 60, 120, 180min), se ha añadido más recientemente el criterio del comité de la International Association of Diabetes and Pregnancy Study Groups (IADPSG)10 establecido a partir del estudio HAPO (SOG de 75 g y diagnóstico de DMG si en uno o más puntos se superan valores de GP de 92, 180 y 153mg/dl a los 0, 60, 120min). Naturalmente, este último criterio diagnóstico eleva significativamente la prevalencia de DMG (16,1%)7 respecto a los criterios clásicos de CyC (11,6%) y de la NDDG (8,8%)11,12. Sin embargo, el cambio más relevante es que una sola glucemia elevada en la SOG es suficiente para el diagnóstico según la IADPSG y, por tanto, una glucemia basal ≥ 92mg/dl sería diagnóstica de DMG sin necesidad de SOG.
En cualquier caso, además de los criterios clásicos de CyC y la NDDG y del novedoso acercamiento de la IADPSG, existen muchos otros consensos implicados en la orientación diagnóstica de la diabetes en el embarazo. Así, la Endocrine Society, EE. UU.13, la World Health Organization14 y la Australasian Diabetes Society (ADIPS)15 recomiendan el criterio en un paso. El American College of Obstetrician and Gynecolgists (ACOG)16 recomienda el enfoque en 2 pasos. La American Diabetes Association (ADA)17 recomienda cualquiera de las 2 opciones. Respecto al momento del primer cribado, la WHO y la Endocrine Society recomiendan el cribado universal en el primer trimestre; el resto de las sociedades solo aconsejan cribado en el primer trimestre si existen factores de riesgo de DMG. Por último, The National Institute for Health and Care Excellence (NICE)18 no apoya el modelo de cribado universal recomendado por IADPSG.
En nuestro medio sanitario se realiza una analítica para el cribado prenatal en todas las embarazadas en el primer trimestre. La utilización de la glucemia basal en esa analítica como cribado o diagnóstico de DMG presenta claras ventajas con respecto al coste de las pruebas con SOG. Sin embargo, hay dudas acerca de la adecuación de la glucemia basal en el primer trimestre (GBPT) como test de cribado y más aún como test de diagnóstico definitivo.
El objetivo del presente trabajo ha sido por una parte estimar la sensibilidad y la especificidad de la GBPT como prueba de cribado y/o diagnóstico de DMG y, por otra, valorar la incidencia de complicaciones materno-fetales relacionadas con la diabetes entre el grupo de embarazadas de nuestro medio que cumplían el criterio de GBPT ≥ 92, tanto si finalmente fueron diagnosticadas y tratadas como DMG, como si no fue así.
Material y métodosEstudio retrospectivo de las 1.425 mujeres sin diagnóstico de DM previa que realizaron cribado prenatal del primer trimestre del embarazo (semana 10,2±2,6) en un año natural y que fueron atendidas a lo largo del embarazo y hasta el parto por el Servicio de Obstetricia del Hospital Severo Ochoa. Fueron excluidas las pacientes con DM previa y las 59 mujeres que realizaron el cribado prenatal pero que tuvieron un aborto con posterioridad. La extracción de las muestras de sangre se realizó en tubos de fluoruro de sodio/oxalato de potasio, centrifugándose antes de 30 min. En nuestro hospital el TOS se realiza en ayunas y se determina la glucemia en los tiempos 0 y 60 min. La determinación de la glucosa se realizó mediante un método enzimático empleando hexoquinasa en un autoanalizador Cobas 8000 de Roche® (Roche Diagnostics Gmdh).
Además de los datos analíticos procedentes del Servicio de Bioquímica, se obtuvieron los datos de la madre, del embarazo, del parto y del recién nacido de los registros informatizados de Atención Primaria y de los informes del alta obstétrica.
Los datos bioquímicos incluyeron la GBPT y las cifras del TOS en las 24-28 semanas, y en las pacientes con TOS positivo las cifras de la SOG de 100 g. Se utilizó como diagnóstico de DMG el criterio CyC.
Los datos de la madre registrados fueron: edad, peso, talla, índice de masa corporal (IMC) en el primer trimestre estratificado como normal (< 25kg/m2), sobrepeso (25-29,9kg/m2) y obesidad (≥ 30kg/m2), y los antecedentes familiares de diabetes. Los datos y las complicaciones obstétricas registradas fueron: hipertensión gestacional, preeclampsia, polihidramnios, parto prematuro (parto antes de la semana 37) y parto a término (espontáneo, inducido, eutócico, instrumental) o cesárea. Las complicaciones del recién nacido registradas fueron: macrosomía (peso> 4.000 g), hiperbilirrubinemia, poliglobulia, hipoglucemia, muerte fetal intraútero, malformaciones, lesiones traumáticas del recién nacido derivadas del trabajo de parto, distrés respiratorio e ingreso en Unidad de Cuidados Intensivos neonatal (neonatos).
Se estudiaron la sensibilidad y la especificidad de la GBPT ≥ 92 con respecto al TOS positivo y al diagnóstico de DMG (SOG de 100 g según criterio CyC). Se determinó la relación entre la GBPT con las complicaciones obstétricas y fetales. A continuación, se relacionaron las mismas variables con los grupos de glucemia <92 y ≥ 92mg/dl, una vez excluidas las pacientes diagnosticadas de DMG en el segundo trimestre y que recibieron, por tanto, tratamiento médico específico.
Se utilizaron la chi al cuadrado para relacionar 2 variables categóricas y la t de Student para comparaciones de medias, comprobando en este caso la normalidad de las variables y la homogeneidad de las varianzas. Para comparar la media de la glucemia en el primer trimestre con la media de la glucemia en el tiempo 0 del TOS se utilizó la t de Student para grupos apareados. La regresión logística binaria se utilizó para relacionar una variable dependiente binaria con distintas variables exposición. Para el análisis de los datos se utilizó el paquete IBM SPPS estatistic 19, considerando un nivel de significación estadística de p <0,05.
El trabajo fue aprobado para su realización por el Comité Ético de nuestro hospital.
ResultadosLa edad media de las embarazadas fue de 32,6 ± 5,0 años y el IMC medio de 24,9 ± 4,6. 263 (18,5%) tenían antecedentes familiares de diabetes, 24 (1,7%) tenían HTA pregestacional y 211 (14,7%) gestantes eran fumadoras. 606 (42,5%) habían tenido uno o más embarazos previos y 405 (28,4%) uno o más abortos previos. 24 (4,0%) de las 606 pacientes con embarazos previos habían tenido DMG.
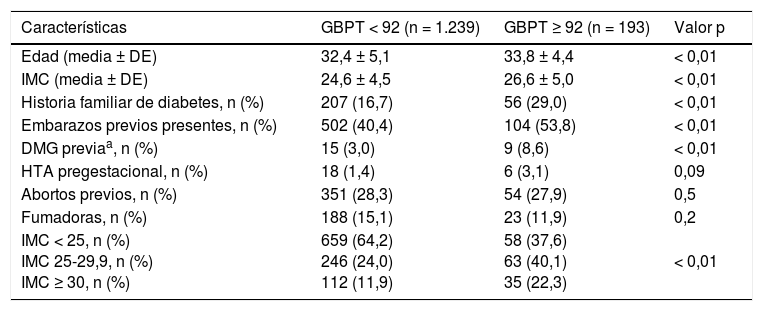
Las características de las pacientes según GBPT mayor o menor de 92 se muestran en la tabla 1.
Características de las pacientes según la glucemia basal primer trimestre (GBPT) ≥ 92 y <92
| Características | GBPT < 92 (n = 1.239) | GBPT ≥ 92 (n = 193) | Valor p |
|---|---|---|---|
| Edad (media ± DE) | 32,4 ± 5,1 | 33,8 ± 4,4 | < 0,01 |
| IMC (media ± DE) | 24,6 ± 4,5 | 26,6 ± 5,0 | < 0,01 |
| Historia familiar de diabetes, n (%) | 207 (16,7) | 56 (29,0) | < 0,01 |
| Embarazos previos presentes, n (%) | 502 (40,4) | 104 (53,8) | < 0,01 |
| DMG previaa, n (%) | 15 (3,0) | 9 (8,6) | < 0,01 |
| HTA pregestacional, n (%) | 18 (1,4) | 6 (3,1) | 0,09 |
| Abortos previos, n (%) | 351 (28,3) | 54 (27,9) | 0,5 |
| Fumadoras, n (%) | 188 (15,1) | 23 (11,9) | 0,2 |
| IMC < 25, n (%) IMC 25-29,9, n (%) IMC ≥ 30, n (%) | 659 (64,2) 246 (24,0) 112 (11,9) | 58 (37,6) 63 (40,1) 35 (22,3) | < 0,01 |
Las embarazadas con GBPT ≥ 92 tenían más edad (33,8±4,4 versus 32,4±5,1 años; p <0,01), mayor IMC (26,6±5,0 versus 24,6±4,5; p <0,01) y mayor frecuencia de historia familiar de diabetes (29,0% frente al 16,7%; p <0,01) en relación con las embarazadas con GBPT <92. Además, las mujeres con GBPT ≥ 92 habían tenido más embarazos previos (53,8 frente al 40,4%; p <0,01) y más DMG previa (8,6 frente al 3,0%; p <0,01).
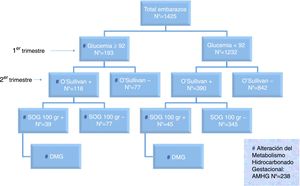
La distribución de los resultados de las pruebas de cribado y diagnóstico aparece en la figura 2.
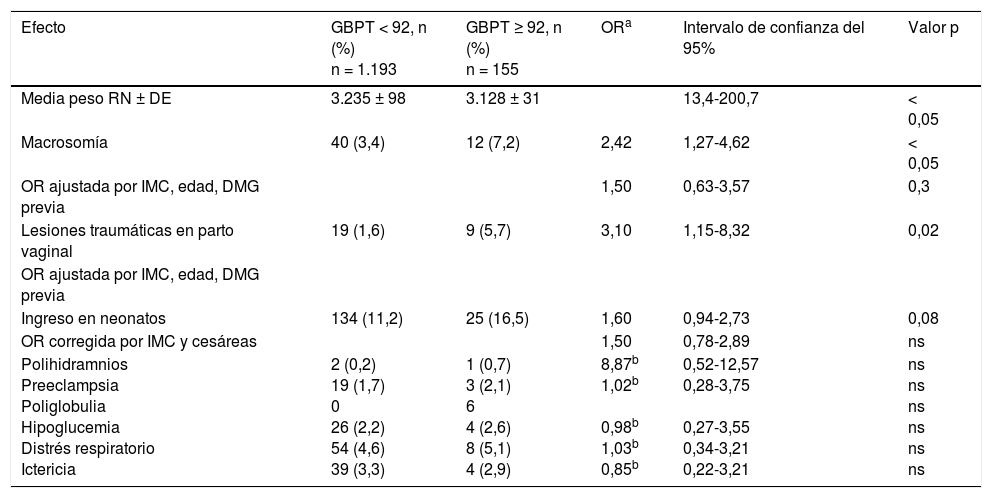
Llamando colectivamente alteración del metabolismo hidrocarbonado gestacional (AMHG) a la GBPT ≥ 92 y/o a la SOG positiva, de los 1.425 embarazos estudiados, 238 tuvieron AMHG (16,7%). Dentro de los 238 casos con AMHG, 39 tenían GBPT ≥ 92 y SOG positiva (16,4%), 45 GBPT <92 y SOG positiva (18,9%), y 154 GBPT ≥ 92 y TOS o SOG negativos (64,7%). Excluyendo los abortos (47/1.279, 3,7% en embarazadas con GBPT < 92 y 12/205, 5,9%, en embarazadas con GBPT ≥ 92, p = 0,3), los efectos adversos obstétricos y perinatales según GBPT < 92 o ≥ 92 se muestran en la tabla 2.
Resultado de complicaciones obstétricas y fetales según La Glucemia Basal Primer trimestre ≥ 92 y <92 (GBPT)
| Efecto | GBPT < 92, n (%) n = 1.239 | GBPT ≥ 92, n (%) n = 193 | ORa | Intervalo de confianza del 95% | Valor p |
|---|---|---|---|---|---|
| Media peso RN ± DE | 3.123± 31 | 3.228 ± 86 | 18,6-191,3 | < 0,05 | |
| Macrosomía | 43 (3,5) | 13 (6,9) | 2,08 | 1,07-4,07 | < 0,05 |
| OR ajustada por IMC, edad, DMG previa | 1,54 | 0,70-3,37 | 0,2 | ||
| Lesiones traumáticas en parto vaginal | 20 (1,6) | 7 (3,9) | 3,1 | 1,09-8,83 | 0,04 |
| OR ajustada por IMC, edad, DMG previa | |||||
| Ingreso en neonatos | 145 (11,7) | 37 (19,5) | 1,83 | 1,10-3,03 | < 0,05 |
| OR corregida por IMC y cesáreas | |||||
| Polihidramnios Preeclampsia Poliglobulia Hipoglucemia Distrés respiratorio Ictericia | 4 (0,3) 24 (1,9) 7 (0,6) 32 (2,6) 59 (4,8) 43 (3,5) | 2 (1,1) 245 (2,8) 1 (0,6) 7 (3,5) 11 (5,8) 7 (3,4) | 3,36b 2,74b 0,59b 1,41b 0,91b 0,97b | 0,19-58,27 0,56-13,60 0,06-5,44 0,47-4,26 0,31-2,76 0,37-2,60 | ns ns ns ns ns ns |
DE: desviación estándar; DMG: diabetes mellitus gestacional; IMC: índice de masa corporal; n: número de pacientes; ns: no significativo; OR: odds ratio; RN: recién nacido.
Los niños de madres con GBPT ≥ 92 tuvieron más peso (3.228 ± 86 versus 3.123 ± 31 g; p = 0,02) y más porcentaje de macrosomía (6,9% versus 3,5%; p = 0,02). Tras ajustar el OR (odds ratio) por IMC, edad y diabetes gestacional previa, sigue apareciendo mayor proporción de macrosomía en los niños de madres con GBPT ≥ 92 (OR 1,54; intervalo de confianza [IC] del 95%: 0,70-3,37) aunque esta diferencia no es ya estadísticamente significativa. Además, no encontramos diferencias estadísticamente significativas en los efectos adversos neonatales en las madres con GBPT ≥ 92, excepto en el ingreso en neonatos (OR 1,83; IC del 95%: 1,10-3,04; p < 0,05) y en las lesiones traumáticas en parto vaginal (OR 3,1; IC del 95% 1,09-8,83; p < 0,04).
Los efectos adversos obstétricos y perinatales según GBPT <92 o ≥ 92, excluyendo a las 84 mujeres diagnosticadas y tratadas por DMG, se muestran en la tabla 3.
Resultado de complicaciones obstétricas y fetales según la glucemia basal primer trimestre (GBPT) ≥ 92 y <92 en gestantes no diagnosticadas de diabetes
| Efecto | GBPT < 92, n (%) n = 1.193 | GBPT ≥ 92, n (%) n = 155 | ORa | Intervalo de confianza del 95% | Valor p |
|---|---|---|---|---|---|
| Media peso RN ± DE | 3.235 ± 98 | 3.128 ± 31 | 13,4-200,7 | < 0,05 | |
| Macrosomía | 40 (3,4) | 12 (7,2) | 2,42 | 1,27-4,62 | < 0,05 |
| OR ajustada por IMC, edad, DMG previa | 1,50 | 0,63-3,57 | 0,3 | ||
| Lesiones traumáticas en parto vaginal | 19 (1,6) | 9 (5,7) | 3,10 | 1,15-8,32 | 0,02 |
| OR ajustada por IMC, edad, DMG previa | |||||
| Ingreso en neonatos | 134 (11,2) | 25 (16,5) | 1,60 | 0,94-2,73 | 0,08 |
| OR corregida por IMC y cesáreas | 1,50 | 0,78-2,89 | ns | ||
| Polihidramnios Preeclampsia Poliglobulia Hipoglucemia Distrés respiratorio Ictericia | 2 (0,2) 19 (1,7) 0 26 (2,2) 54 (4,6) 39 (3,3) | 1 (0,7) 3 (2,1) 6 4 (2,6) 8 (5,1) 4 (2,9) | 8,87b 1,02b 0,98b 1,03b 0,85b | 0,52-12,57 0,28-3,75 0,27-3,55 0,34-3,21 0,22-3,21 | ns ns ns ns ns ns |
DE: desviación estándar; DMG: diabetes mellitus gestacional; IMC: índice de masa corporal; n: número de pacientes; ns: no significativo; OR: odds ratio; RN: recién nacido.
Al descartar a las pacientes tratadas por DMG, los niños de madres con GBPT ≥ 92 continúan presentando más peso (3.235 ± 98 versus 3.128 ± 31 g; p < 0,05), mayor porcentaje de macrosomía (7,2% versus 3,4%, p < 0,05) y mayor proporción de lesiones traumáticas en el parto (OR 3,10; IC del 95% 1,15-8,32, p =0,02). Tras ajustar el OR por IMC, edad y diabetes gestacional previa, sigue apareciendo mayor proporción de macrosomía en los niños de madres con GBPT ≥ 92 (OR 1,50; IC del 95%: 0,63-3,57) aunque esta diferencia no es ya estadísticamente significativa. Ademas, las diferencias encontradas en el porcentaje macrosomía, ingreso en neonatos y polihidramnios tampoco llegaron a ser significativas. El resto de los efectos adversos fueron similares entre los grupos. En este caso, tampoco la edad y el antecedente de diabetes gestacional previa modifica la significación estadística.
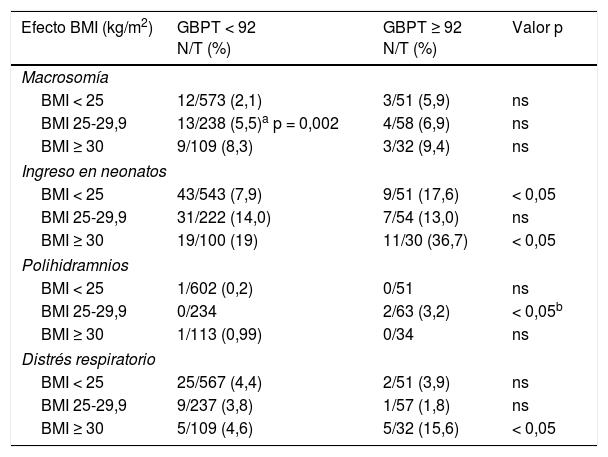
Para valorar si los efectos observados con GBPT ≥ 92 se debían solo al sobrepeso y la obesidad más prevalentes en ese grupo de gestantes, se estudió la distribución de las complicaciones neonatales más significativas según GBPT y grupos de IMC materno, como se muestra en la tabla 4.
Efectos del embarazo en la mujer con glucemia ≥ 92 y <92 en el primer trimestre (GBPT) de acuerdo con el BMI
| Efecto BMI (kg/m2) | GBPT < 92 N/T (%) | GBPT ≥ 92 N/T (%) | Valor p |
|---|---|---|---|
| Macrosomía | |||
| BMI < 25 | 12/573 (2,1) | 3/51 (5,9) | ns |
| BMI 25-29,9 | 13/238 (5,5)a p = 0,002 | 4/58 (6,9) | ns |
| BMI ≥ 30 | 9/109 (8,3) | 3/32 (9,4) | ns |
| Ingreso en neonatos | |||
| BMI < 25 | 43/543 (7,9) | 9/51 (17,6) | < 0,05 |
| BMI 25-29,9 | 31/222 (14,0) | 7/54 (13,0) | ns |
| BMI ≥ 30 | 19/100 (19) | 11/30 (36,7) | < 0,05 |
| Polihidramnios | |||
| BMI < 25 | 1/602 (0,2) | 0/51 | ns |
| BMI 25-29,9 | 0/234 | 2/63 (3,2) | < 0,05b |
| BMI ≥ 30 | 1/113 (0,99) | 0/34 | ns |
| Distrés respiratorio | |||
| BMI < 25 | 25/567 (4,4) | 2/51 (3,9) | ns |
| BMI 25-29,9 | 9/237 (3,8) | 1/57 (1,8) | ns |
| BMI ≥ 30 | 5/109 (4,6) | 5/32 (15,6) | < 0,05 |
BMI: peso/talla2; N: número de eventos; T: número total.
Los hijos de las gestantes con GBPT ≥ 92 tenían mayor proporción de macrosomía en todas las categorías de IMC. Además, en el grupo de GBPT <92 se encontró mayor proporción de macrosomía según aumenta la categoría de IMC (p <0,05). Se encontró también una proporción elevada de distrés respiratorio en las madres obesas solo si tenían GBPT ≥ 92. En el resto de las complicaciones, las proporciones tendieron a ser mayores con mayor categoría de IMC materno, aunque sin significación estadística.
La GBPT (≥ 92) tuvo una sensibilidad del 22,9% y una especificidad del 91,6% frente al TOS positivo en el segundo trimestre, y una sensibilidad del 46,4% y una especificidad del 88,8% respecto al diagnóstico de DMG con el criterio CyC. La prevalencia de la DMG con el criterio de CyC en los embarazos de nuestro medio fue del 5,9% (2,4% con el criterio de NDDG y del 14,7% con el criterio del IADPSG).
Por otra parte, la GBPT media fue de 84,4±0,2 y la glucemia basal media en el tiempo 0 del TOS de 81,53±0,2 (IC de la diferencia de medias: 2,5 a 3,3; p <0,001).
DiscusiónEn nuestro estudio, la prevalencia de la DMG ha sido del 5,9% con los criterios de CyC y del 14,7% con los criterios del IADPSG. En el año 2006, el Grupo Español de Diabetes y Embarazo (GEDE) estimó una prevalencia de la DMG según CyC del 12%12,19 y según los criterios del IADPSG del 16,1%7,12, mientras que otras publicaciones nacionales refieren cifras de prevalencia entre el 1 y el 12%19. Como se ve, aun usando los mismos criterios, la prevalencia del diagnóstico de DMG presenta una llamativa variabilidad entre estudios, que no puede ser atribuida únicamente a las distintas características de las poblaciones ni a las estrategias diagnósticas. Por ejemplo, en el estudio de Duran et al.20, desarrollado también en la Comunidad de Madrid, con una población de gestantes con edad media e IMC semejantes a la nuestra, la prevalencia de DMG con los criterios de CyC fue del 10,6% y con los criterios del IADPSG del 35,5%. La alteración del metabolismo hidrocarbonado en el embarazo es un continuo sobre el que se deciden puntos de corte para diagnosticar la DMG. Por tanto, con los mismos puntos de corte, una pequeña variabilidad en la determinación de glucosa sérica entre distintos laboratorios puede afectar muy significativamente a la proporción de gestantes diagnosticadas de DMG.
Contando con estas limitaciones de base, el primer objetivo de nuestro estudio ha sido evaluar si una determinación sencilla como es la GBPT podía sustituir a las pruebas de uso actual en el cribado (TOS) y diagnóstico (SOG 100 g) de la DMG. En este sentido, la pobre sensibilidad de la GBPT frente al TOS (22,9%) y a la SOG (46,4%) muestra que la GBPT no puede ser utilizada como sustituto de las pruebas de provocación con glucosa oral, ya que dejaría sin diagnosticar un número apreciable de pacientes con DMG. Adicionalmente, en el análisis comparativo de las pruebas hemos encontrado una diferencia significativa entre las glucemias basales del primer (84,4±0,2mg/dl) y segundo trimestre (81,53±0,2mg/dl), diferencia que quizás debería tenerse en cuenta a la hora de considerar los valores límites de las distintas pruebas diagnósticas según el trimestre del embarazo.
En realidad, la superposición solo parcial de los grupos que se seleccionan cuando se agrupan a las madres con GBPT ≥ 92 o a las madres con TOS y SOG positivos refleja la diferencia en la información obtenida por los 2 tipos de pruebas. Mientras la GBPT detecta más a las gestantes con resistencia a la insulina, la SOG está sobre todo dirigida a detectar a las gestantes con intolerancia hidrocarbonada posprandial. En nuestro estudio, esta superposición parcial da lugar, dentro de las embarazadas con alteración del metabolismo hidrocarbonado (AMHG), a 3 grupos diferentes. Primero, el grupo con GBPT elevada y TOS o SOG 100 g negativa (64,7%), que corresponde a las madres con resistencia a la insulina. Segundo, el grupo con GBPT normal y SOG positiva (18,9%), que corresponde a las madres con intolerancia hidrocarbonada posprandial. Y tercero, el grupo con GBPT elevada y SOG positiva (16,4%), que agrupa a las madres con ambas alteraciones del metabolismo hidrocarbonado.
La GBPT no es, por tanto, un parámetro útil para sustituir a las pruebas clásicas de cribado y diagnóstico de la DMG. ¿Puede con todo cumplir alguna función en el abordaje médico del embarazo? Nuestro trabajo ha mostrado que las gestantes con GBPT elevada tienen un aumento estadísticamente significativo del peso fetal y de la macrosomía. Además, aun contando con que el escaso número de complicaciones limita la significación estadística de los hallazgos en muchos de los estudios de diabetes en el embarazo, parece existir una relación entre la GBPT elevada y otras complicaciones materno-fetales atribuibles a la DMG21-25. Y lo más importante es que estas relaciones se mantienen también cuando se excluye a las gestantes diagnosticadas de DMG. Esto es, las madres con AMHG sin criterios completos de DMG (el primer grupo y más numeroso) tienen una alteración del metabolismo hidrocarbonado suficiente para producir aumento de riesgo de complicaciones de DMG.
Parece claro que la mayor parte de las complicaciones fetales atribuibles a la DMG se deben a una sobrealimentación fetal impuesta sobre un diseño evolutivo preparado más bien para afrontar una escasez nutricional. Esta sobrealimentación es achacable fundamentalmente a la hiperglucemia materna producida por la diabetes, pero también se debe en parte a la obesidad materna y a la sobrealimentación materna a lo largo del embarazo. En nuestro estudio, los hijos de las gestantes con GBPT ≥ 92 tenían mayor proporción de macrosomía en todas las categorías de IMC y, a su vez, había mayor proporción de macrosomía según el IMC, tanto en el grupo de GBPT <92 como en el de GBPT ≥92. Aunque estas diferencias no resultaron estadísticamente significativas en todas las comparaciones, posiblemente debido al pequeño número de sucesos al estratificar por el IMC, la tendencia observada parece mostrar que tanto la GBPT elevada como el sobrepeso y la obesidad son factores asociados en la generación de macrosomía.
El tratamiento de la DMG, orientado a amortiguar estos mecanismos de sobrealimentación fetal, consta de 2 partes conceptualmente unidas pero estratégicamente separables. La primera, indicación de dieta formal, ejercicio físico y ganancia de peso contenida, tiene poco coste para el sistema sanitario26, mientras que la segunda, seguimiento del proceso mediante autocontrol glucémico, supervisión médica y eventual tratamiento farmacológico con insulina u otros fármacos, puede producir, según el número de gestantes finalmente diagnosticadas de DMG y derivadas los servicios de Endocrinología y Nutrición, una sobrecarga asistencial muy significativa.
Si utilizamos un valor de GBPT mayor de 92mg/dl como cribado de una AMHG, podemos seleccionar de una manera precoz a unas madres no solo con mayor riesgo de diagnóstico de DMG en el segundo trimestre, sino sobre todo con una alteración metabólica ya presente que es potencialmente generadora de macrosomía y complicaciones neonatales. Casi con toda seguridad, este grupo se beneficiaría de la implementación de la primera parte del tratamiento de la DMG, explicación de unas medidas dietéticas saludables y de ejercicio físico reglado, tratamiento que podría indicarse en el ámbito del seguimiento obstétrico desde el primer trimestre y a lo largo de todo el embarazo, para reservar la remisión a la consulta de Endocrinología a las pacientes diagnosticadas posteriormente de DMG por TOS y SOG positivos.
Por otra parte, parece lógico pensar que un aumento de la glucemia basal encontrado en el primer trimestre del embarazo no es más que la continuación de un aumento de la glucemia basal pregestacional, como expresión de una resistencia a la insulina previa al embarazo. Por tanto, de igual manera que en el primer trimestre, tendría sentido la indicación de medidas dietéticas y ejercicio físico en todas las mujeres con glucemia basal ≥ 92mg/dl e intención de embarazo (algo así como la administración de ácido fólico pregestacional). De hecho, en un reciente estudio, las mujeres con DMG diagnosticadas antes de la semana 12 de gestación27 tenían los mismos efectos adversos que las pacientes con DM antes del embarazo.
Por último, fijándonos ahora en las madres con GBPT <92 y TOS normal, ya que las complicaciones atribuibles a la DMG aparecen también, aunque con menor frecuencia, en madres con tolerancia a la glucosa normal por una excesiva sobrealimentación en el periodo gestacional, ¿no sería razonable instaurar recomendaciones universales de dieta y ejercicio en todas las embarazadas?
El presente estudio tiene 2 limitaciones principales. Por una parte, es un estudio retrospectivo y, por otra, el número de casos ha permitido mostrar la relación entre GBPT y peso del recién nacido, y atisbar una relación entre GBPT y complicaciones materno-fetales de la DMG, pero ha sido insuficiente para determinar con claridad la existencia o no de esta relación. Queda pendiente ampliar el estudio para aumentar su potencia estadística cara a este último objetivo y, en segundo lugar, realizar un estudio de intervención en una cohorte de madres con GBPT> 92 para comprobar si la dieta formal y el ejercicio físico reglado son capaces de modificar el peso del RN, y en su caso las complicaciones materno-fetales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.