La hemoglobina glicosilada (HbA1c) describe la hemoglobina ligada a glucosa de forma irreversible a través de una reacción no enzimática1,2 y utilizamos su detección para evaluar el grado de control glucémico en pacientes con diabetes mellitus, dado que refleja la glucemia durante los últimos 120 días (correspondientes con la vida media eritrocitaria)3 y se considera un marcador útil para determinar el riesgo de desarrollo y progresión de las complicaciones crónicas relacionadas con esta enfermedad1,2. Se han descrito diversos factores que pueden interferir con la fiabilidad de la medición de HbA1c1,2, entre los que se encuentran distintas variantes de la hemoglobina que pueden ser causa de obtención de valores falsamente elevados o disminuidos de HbA1c3,4.
Describimos el caso de dos pacientes emparentados con discrepancia entre los valores de glucemia tanto plasmática como capilar y HbA1c debido a la presencia de hemoglobina Himeji, una hemoglobinopatía muy rara y clínicamente silente con una glicosilación aproximadamente 3 veces mayor que la de la hemoglobina A5.
El primer caso corresponde a un paciente de 39 años, natural de Portugal, en seguimiento por una infección VIH controlada. Seguía tratamiento antirretroviral con efavirenz, tenofovir y emtricitabina.
En los controles rutinarios destaca una discordancia entre valores elevados de HbA1c y glucemia tanto plasmática como capilar en rango de normalidad, instaurándose inicialmente medidas higiénico-dietéticas. Por persistencia de HbA1c elevada, se inició tratamiento con metformina 850mg cada 12 h y se remitió al paciente a Endocrinología. En los controles analíticos previos presentaba HbA1c 12% (abril de 2015), 11,5% (enero de 2016), 11,8% (junio de 2016) y 11,9% (abril de 2018) con concentraciones de glucosa en ayunas de 89mg/dl, 96mg/dl, 93mg/dl y 99mg/dl respectivamente. Debido a esta discordancia se decidió colocar un sensor para monitorización flash de glucosa, confirmándose valores de glucemia compatibles con la normalidad. El hemograma seriado y bioquímica incluyendo función renal y hepática fueron también normales.
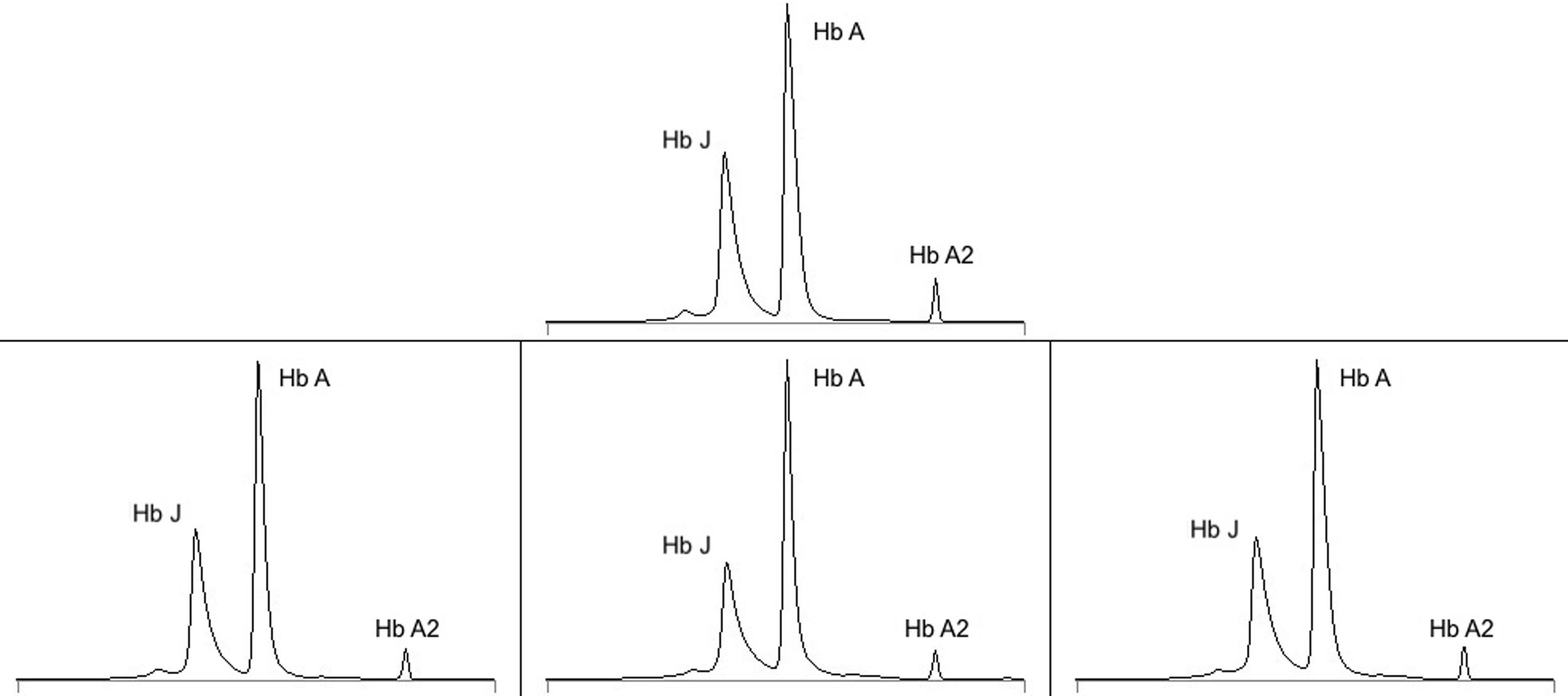
Se realizó un análisis electroforético en el que se detectó una variante de la hemoglobina que se interpretó como hemoglobina J (hemoglobina en zona 12: 39,2%) y una hemoglobina A de únicamente el 52% (fig. 1).
Electroforesis de hemoglobinas. Arriba, resultado del primer caso en 2018, interpretado como hemoglobina J (Hb J). Abajo, resultados del segundo caso interpretados en 2015 como posible hemoglobina Shephers Bush (izquierda), en 2016 como posible hemoglobina Andrew Minneapolis (centro) y en 2018 como posible hemoglobina Fannin Lubbok (derecha). En condiciones normales no existe el pico de hemoglobina J y más del 95% corresponde a hemoglobina A (Hb A). La hemoglobina A2 (Hb A2) fue normal en todos los casos.
Con estos resultados, finalmente se realizó un estudio de secuenciación génica que identificó la mutación en heterocigosis c.422C>A (p.Ala141Asp) en el gen beta-globulina (HBB), variante patogénica asociada a la producción de hemoglobina Himeji en bases de datos clínicas.
El segundo caso corresponde a una mujer de 74 años, madre del paciente anterior, natural de Portugal y con antecedentes de cardiopatía isquémica (episodios de angor inestable en 2007 y 2015), hipertensión arterial y diabetes mellitus tipo 2 en tratamiento con antidiabéticos orales desde su diagnóstico en 2005 hasta 2016, cuando se sustituyeron por insulina basal (glargina) con la que presentaba hipoglucemias frecuentes vespertinas, ninguna grave. Además, su tratamiento habitual incluía omeprazol, bisoprolol, ácido acetilsalicílico, amlodipino, valsartán, hidroclorotiazida y rosuvastatina.
Remitida para control de la diabetes, presentaba también una disociación entre los valores de glucemia en ayunas, variables entre 120 y 160mg/dl, y los valores de HbA1c obtenidos durante los últimos años, persistentemente mayores del 11%. Asociaba asimismo alteraciones en la electroforesis de hemoglobinas que se interpretaron en distintas ocasiones como posible hemoglobina Shephers Bush, Andrew Minneapolis o Fannin Lubbok (fig. 1). El hemograma seriado no presentaba alteraciones destacables.
En vista de estos resultados, la discrepancia con los controles glucémicos y el conocimiento de la hemoglobinopatía de su hijo, se realizó el estudio genético por secuenciación automática detectándose en la paciente la misma mutación en heterocigosis asociada a la producción de hemoglobina Himeji.
En la actualidad se conocen más de 1300 variantes de la hemoglobina6, aproximadamente el 80% asintomáticas mientras que el 20% restante se asocian a enfermedades como la anemia hemolítica, la policitemia o la metahemoglobinemia3,4. Con la generalización de la determinación de HbA1c ha aumentado progresivamente durante los últimos años la identificación de variantes clínicamente silentes de la hemoglobina3,7.
Dependiendo del método de detección empleado, la misma hemoglobinopatía puede causar resultados de HbA1c inesperadamente altos o bajos en comparación con el control glucémico2,4. Aunque algunas de estas alteraciones en la medición pueden detectarse y es posible tomar medidas para su corrección,2,5 si una alteración en la hemoglobina afecta a su capacidad para ser glicosilada o si intervienen factores que afectan a la tasa de recambio eritrocitario los resultados serán inexactos independientemente del método de detección empleado2,3.
La hemoglobina J define un grupo de hemoglobinas anómalas que comparten una movilidad electroforética más rápida respecto a la hemoglobina A. La hemoglobina Himeji se describió por primera vez en 1986 en un varón japonés con diabetes mellitus8 y más adelante se han comunicado casos en dos familias japonesas, en dos miembros de una familia portuguesa y en otro caso aislado también en Portugal7–10. Es una variante con mayor afinidad por el oxígeno, una cierta inestabilidad molecular y un aumento de la glicosilación del extremo NH2 de la cadena β5,9 que explicaría los resultados falsamente elevados de HbA1c que obtuvimos en nuestros casos.
En pacientes portadores de hemoglobina Himeji se puede estimar con más precisión el control glucémico utilizando métodos comerciales que midan proteínas séricas glicosiladas (fructosamina o albúmina sérica glicosilada)2,3. Sin embargo, estos análisis solo reflejan la glucemia media de aproximadamente las dos últimas semanas y ninguna de estas pruebas se ha correlacionado con el riesgo de desarrollar complicaciones crónicas de la diabetes mellitus1–3. En estos pacientes, por tanto, tiene una mayor importancia si cabe la automonitorización de la glucosa capilar o el uso de un sistema de monitorización continua de glucosa a la hora de valorar la eficacia del tratamiento de la enfermedad.
Dado que no presentan síntomas, la mayor parte de los pacientes portadores de hemoglobina Himeji desconocen que lo son. Sin embargo, se ha descrito que podrían tener un mayor grado de hemólisis y menor supervivencia de los hematíes por lo que, en situaciones de estrés hematológico, la reticulocitosis compensadora podría no ser adecuada y esto facilitaría sufrir anemia con más facilidad y con mayor gravedad que en condiciones normales10.