El gen ATXN2 presenta un VNTR (CAG)n con locus en el exón 1, los alelos largos dentro del rango normal (22-29 repeticiones) se asocian con obesidad severa en sujetos del Reino Unido, Indonesia y el Caribe.
ObjetivoAnalizar la influencia del VNTR (CAG)n del gen ATXN2 en el perfil metabólico en adultos con obesidad y preobesidad así como analizar su asociación con parámetros metabólicos y ambientales de riesgo cardiovascular.
Métodos y materialesSe incluyeron 255 adultos de origen étnico amerindio chinanteca a quienes se les realizó evaluación antropométrica y bioquímica. El VNTR fue amplificado por PCR punto final y electroforesis PAGE al 8%.
ResultadosSe encontraron diferencias en la circunferencia índice cintura/cadera e índice de masa corporal en los portadores de genotipos diferentes al homocigoto de 22 repeticiones con un valor para la prueba t de Student de 0,0041 y 0,0334 respectivamente. También encontramos asociación con la historia familiar de enfermedad crónica.
ConclusiónEl VNTR de ATXN2 se asocia al grado de obesidad en adultos mexicanos con ancestría chinanteca.
The ATXN2 gene has a VNTR (CAG)n with locus in exon1. Long alleles within the normal range (22-29 repeats) are associated with severe obesity in people from the United Kingdom, Indonesia and the Caribbean.
ObjectiveTo analyse the influence of VNTR (CAG)n on metabolic profile in adults with obesity and pre-obesity, as well as to estimate its effect on the risk of developing diabetes.
Methods and material255 adults of Chinantec Amerindian ethnic origin were included, who underwent anthropometric and biochemical evaluation. The VNTR was amplified by end-point PCR and by 8% PAGE electrophoresis.
ResultsDifferences were found in the waist/hip circumference index and body mass index in the carriers of genotypes different to the one homozygous for 22 repeats with a Student's t test value of 0.0041 and 0.0334, respectively. We also found an association with a family history of chronic disease.
ConclusionThe VNTR of ATXN2 is associated with obesity in Mexican adults of Chinantec ancestry.
Como se ha reportado anteriormente, la obesidad está relacionada directamente con el aumento de triglicéridos, glucosa y presión arterial, así como la disminución del colesterol-HDL, rasgos que forman parte del síndrome metabólico1. La obesidad es una enfermedad emergente en Latinoamérica y un problema de salud pública en México. El 80% de la población mexicana presenta obesidad o sobrepeso, pero la alteración se inicia desde la infancia o en la adolescencia con presencia de hiperinsulinemia o intolerancia a la glucosa; y en la edad adulta evoluciona a síndrome metabólico o diabetes mellitus tipo 2 (DM2)2. En un estudio de cohorte en población mexicana, se muestra que el 25% de los niños obesos y el 21% de los adultos obesos tienen valores de glucemia mayores a 140mg/dl, después de dos horas posprandiales, y el 4% tiene diabetes tipo 2 no diagnosticada3,4. La obesidad desde la infancia, ya es un problema de salud pública en América, que va evolucionando hasta la etapa adulta, llegando a ocasionar en algunos casos, hígado graso y cirrosis, por lo cual se requiere seguir explorando los mecanismos causales para establecer marcadores tempranos de riesgo.
La pandemia de obesidad en las sociedades latinoamericanas poscoloniales se puede explicar por dos hipótesis o mecanismos. La primera, es la del genotipo ahorrador (muchos genes), el cual permitió a los ancestros de los indígenas latinos durante la IV glaciación sobrevivir a los períodos de hambruna prolongada, mediante el desarrollo de la resistencia a la insulina. Un fenotipo bioquímico que permitió almacenar energía cuando no había alimento, pero también conformó un fenotipo muscular más apto, más veloz para evitar ser depredado por los grandes animales de ese tiempo5. Sin embargo, los pueblos latinos actuales que son herederos de ese genotipo, sumado a los malos hábitos alimenticios, como el consumo de alimentos energéticos con alto contenido calórico, mayor ingesta de grasas saturadas con abundancia de hidratos de carbono refinados, escasez de fibra, y por otro lado, el aumento de las actividades sedentarias y la reducción del ejercicio, acciones que llevan a los pacientes a ser más susceptibles a presentar obesidad y/o diabetes6.
La segunda hipótesis que explica el desarrollo de obesidad es la resistencia orgánica múltiple. Esta teoría explica que en múltiples tejidos (cerebro, hígado, páncreas, músculo esquelético, tejido adiposo, endotelio) de manera simultánea, se presenta disfunción en los receptores para diferentes hormonas, entre ellas la insulina, la leptina y la adiponectina; el fenotipo clínico de estas alteraciones incluye hiperfagia severa y obesidad en diferentes grados7,8. En ambas teorías el elemento en común es la resistencia a la insulina, que con el tiempo evoluciona a obesidad y DM2.
Considerando que la resistencia orgánica múltiple y el genotipo ahorrador son mecanismos de la obesidad asociada a la DM2, proponemos un nuevo gen candidato en obesidad, el gen ATXN29,10. Además, este gen fue elegido porque en modelos murinos se ha demostrado que su deficiencia conduce a obesidad central, obesidad severa, hiperinsulinemia, hígado graso, dislipidemia y disminución de la expresión del receptor de insulina en cerebelo e hígado9,10. También porque regula a la proteína adaptadora GRB2, un amplificador de la señalización del receptor de insulina11. En humanos, el gen ATXN2 presenta un polimorfismo del tipo VNTR (número variable de repeticiones en tándem) (CAG)n con locus en el exón 1, los alelos mayores a 33 repeticiones producen la ataxia espinocerebelosa tipo 2 autosómica dominante (SCA2), la cual es una factor de susceptibilidad para DM2 por la asociación con la resistencia a la insulina de origen muscular, relacionada con la neuropatía periférica12. El VNTR de ATXN2 presenta más de dos alelos con una frecuencia superior al 1% y presenta un distribución homogénea en las poblaciones, siendo el alelo de 22 repetidos el más frecuente (más del 90%), el otro 10% corresponden a los alelos de 23, 25, 29, 20, 21, y 18 repeticiones, por lo cual puede ser considerado un polimorfismo13,14. En algunas poblaciones los alelos dentro del rango normal (<31 repeticiones) se han asociado con enfermedades neurodegenerativas y con el desarrollo de DM2 en población mexicana con bajo índice dietético, pero también se asocia con obesidad en población del Reino Unido, Indonesia y del Caribe13,14. Mientras que las repeticiones a partir de 33 son responsables directamente del desarrollo de la SCA212. El efecto patogénico de las repeticiones es una frontera de investigación en el desarrollo de las enfermedades crónicas como la obesidad, sin embargo en pacientes con SCA2, las repeticiones mayores a 25 repetidos tienen un efecto dominante conocido como ganancia de la función el cual favorece a agregados anormales de proteínas, las cuales por toxicidad celular pueden afectar el metabolismo neuronal, del páncreas o tejidos adiposo, mientras que los alelos menores a 22 repeticiones tiene una efecto dominante negativo subclínico aditivo, donde la proteína tiene una función menor, sin embargo este campo de estudio tiene que ser explorado todavía9–14.
La población amerindia del Estado de Oaxaca es una sociedad poscolonial, que si bien es vulnerable, altamente marginada y con mucha pobreza, está expuesta a un mayor número de veces de consumo de comidas altamente energéticas y calóricas, lo cual sumado al genotipo ahorrador, incrementa el desarrollo de lo obesidad en sus pueblos, como el caso del grupo étnico chinanteca asentado en Tuxtepec, Oaxaca13,14. Por lo anterior, los objetivos del trabajo fueron analizar la influencia del VNTR (CAG)n del gen ATXN2 en el perfil metabólico en adultos con obesidad y preobesidad así como analizar su asociación con parámetros metabólicos y ambientales de riesgo cardiovascular en población amerindia de Oaxaca.
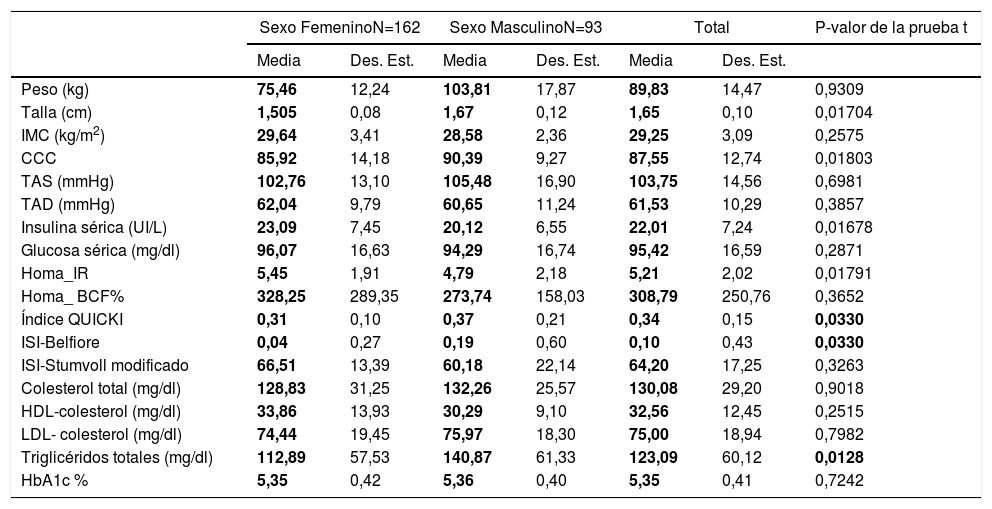
MétodosSe incluyeron adultos originarios y residentes de la ciudad de Tuxtepec, de origen étnico chinanteca, de los cuales 162 sujetos eran del sexo femenino y 93 del masculino, con rango de edad 25-35 años., que se estratificaron de acuerdo con los criterios de la OMS-2004, en 158 probandos presentaban preobesidad o sobrepeso grado II (IMC 27,0-29,9), 79 obesidad grado I (IMC 30,0-34,9) y 18 obesidad grado II (35,0-39,9)15. No se encontró ningún sujeto con obesidad de tipo III (mórbida): IMC 40,0-49,9 u obesidad de tipo IV (extrema), IMC≥ 50. A todos se les realizó un perfil metabólico, el cual consistió en una evaluación clínica, bioquímica y antropométrica que incluyó peso, talla, circunferencia cintura-cadera (CCC), índice de masa corporal (IMC), presión arterial diastólica y sistólica. A todos se les tomó una muestra de 5mL de sangre periférica por punción venosa en tubos BD Vacutainer para extraer ADN genómico y realizar las determinaciones bioquímicas. A los familiares de los probandos incluidos, se les pidió contestar un cuestionario sobre antecedentes de obesidad en la familia, enfermedad crónica (dislipidemia, hipertensión, diabetes, enfermedad coronaria), tipo de actividad física, hábitos alimenticios y bullying. En la tabla 1 se muestran las principales características clínicas y bioquímicas de la población analizada acorde al género.
Análisis bioquímicoLas muestras de sangre fueron tomadas en ayuno de 8 h. Los niveles de glucosa, colesterol, triglicéridos, LDL y HDL fueron determinados mediante kits enzimáticos-colorimétricos de Human Co. por espectrofotometría con el equipo Beckam Coulter DU730 (CA, EE. UU.). La insulina sérica se determinó por radioinmunoanálisis usando el Kit 80-INSHU-E01.1 de Alpco (Salem, NH, EE. UU.), mediante el lector Chromate Microplate Reader de Awareness-Technology, Inc. (Palm City, FL, EE. UU.).
Los índices de resistencia y sensibilidad a la insulina fueron determinados mediante las siguientes fórmulas; HOMA-IR=(insulina en ayuno (uU/ml) * glucosa en ayuno [mmol/l]) /22,5. El índice QUICKI=1/ (log insulina plasmática [uU/ml] + log glucosa plasmática en ayuno [mg/dl]). HOMA% BCF=360*insulina sérica/glucosa sérica ayuno-63). ISIStumvoll=0,222−0,00333*(índice de masa corporal-0,0000779) *(insulina120) − (0,000422*edad). De los valores de la prueba de tolerancia a la glucosa se tomaron los promedios de la insulina y glucosas séricas para obtener el ISIBelfiore=2/(GS/GN) *(IS/IN) +116.
La hemoglobina glucosilada fue determinada por inmunocromatografía por el aparato portátil SD Aiclare Biosensor Inc. a partir de sangre capilar.
Amplificación genómica por PCR-punto final (convencional) de la región donde tiene su locus la expansión CAG del gen ATXN2 y electroforesisSe utilizaron los iniciadores diseñados por Magaña et al. 2008 para la detección de alelos dentro del rango normal: cag-F (5́-GGGCCCCTCACCATGTCG-3́), llamado ATXN2-1, cag-R (5’-CGGGCTTGCGGACATTGG-3’), llamado ATXN2-2, los cuales fueron sintetizados por la compañía Sigma Aldrich. El Programa de Amplificación ATXN2 fue el reportado por Magaña et al. 2008, con cinco ciclos: 1. 96°C 3min (desnaturalización inicial). 2. 96°C 60 segundos (desnaturalización). 3. 59°C 30 segundos (hibridación). 4. 72°C 1min (polimerización). 5. Repetir 28 veces del ciclo 2 al 4. El producto de PCR se mezcló con formamida desionizada y se desnaturalizó en baño María durante 7 min, posteriormente, se sacó para colocarlo inmediatamente en hielo frappe durante 5 min para su ulterior corrimiento electroforético. Las condiciones de amplificación fueron volumen final 25μl que contenía 4μM de cada oligonucleótido, 200μM de cada dNTP; 0,6μl de la solución amortiguadora de reacción 10X (Thermo Fisher Scientific, EE. UU.), 2mM de MgCl2 (Thermo Fisher Scientific, EE. UU.), 0,5 U de la enzima Taq ADN polimerasa (Thermo Fisher Scientific, EE. UU.), 31% de betaína (Sigma-Aldrich Chemie GmbH, Steinheim, Alemania), y 100 ng de ADN de cada probando18. Los productos amplificados fueron sometidos a electroforesis en geles de poliacrilamida al 8% (19:1) 180V durante 2h. Posteriormente, los geles fueron teñidos con nitrato de plata. La identificación de las repeticiones se realizó con base en la clasificación de los productos de PCR, 103 pb corresponde al alelo menos frecuente que son 13 repeticiones, 130 pb corresponde al alelo de mayor frecuencia, 22 repeticiones y 151 para el alelo de 29 repeticiones13.
Análisis estadísticoPara estimar las diferencias entre los parámetros antropométricos clínicos y bioquímicos cuantitativos se utilizó la t de Student (muestras independientes), así como un ANOVA, se consideraron significativos los valores de p <0,05. Para analizar la relación con las variables como los hábitos de alimentación, actividad física, aspectos psicológicos, y la asociación con obesidad, así como la interacción gen-factor ambiental, se utilizó la chi-cuadrada de Pearson (X2) considerando que estas variables son características o tipos y que no tienen una distribución normal, para la cual se consideraron significativos valores de p<0,05. Se ajustó un modelo log de regresión lineal saturado para tablas de contingencia de 2 por 2, log (μij)=log(n) + log (πi+) + log (π+j)=λ + λ X i + λ Y. Este modelo analiza la relación entre todas las variables categóricas, donde todas las variables que se analizan se consideran como variables respuesta, no hay distinción entre variables independientes y dependientes, es decir los genotipos y los diferentes grados de obesidad, para identificar el tipo de asociación que se presenta entre los tipos de obesidad y los genotipos. Para calcular el valor de la X2, valores de, odds ratio, e intervalo de confianza, se realizó mediante el programa libre EpiInfoOpen. El modelo logarítmico saturado y la prueba t y ANOVA, se realizaron mediante el apoyo del programa Stata 16.1. Para este modelo r<0 denota correlación negativa, r>0 correlación positiva. Si r=0, las variables están incorrelacionadas y por lo tanto no hay una covariación.
Aspectos éticosLa presente investigación se basó en la declaración de Helsinki revisada en Fortaleza (Brasil, 2013), así como en la Ley General de Salud en México. El trabajo forma parte del proyecto Caracterización clínico-molecular de la expansión de los repetidos (CAG)n en los genes ATXN1, ATXN2 y ATXN3 en familias con ataxia espinocerebelosa, así como la asociación con hallazgos del síndrome metabólico en población considerada sana del sur de México, fue aprobado por las Comisiones Institucionales de Investigación, Ética y Bioseguridad de la Universidad de la Sierra Sur, con número de registro IISSP/BAMM/04.
Se obtuvo el consentimiento informado de los sujetos incluidos, en el que autorizaban una toma de muestra de sangre para la evaluación bioquímica y molecular. También autorizaban la publicación de los resultados clínicos, bioquímicos y moleculares con fines académicos y/o científicos, guardando el anonimato de los datos personales y legales.
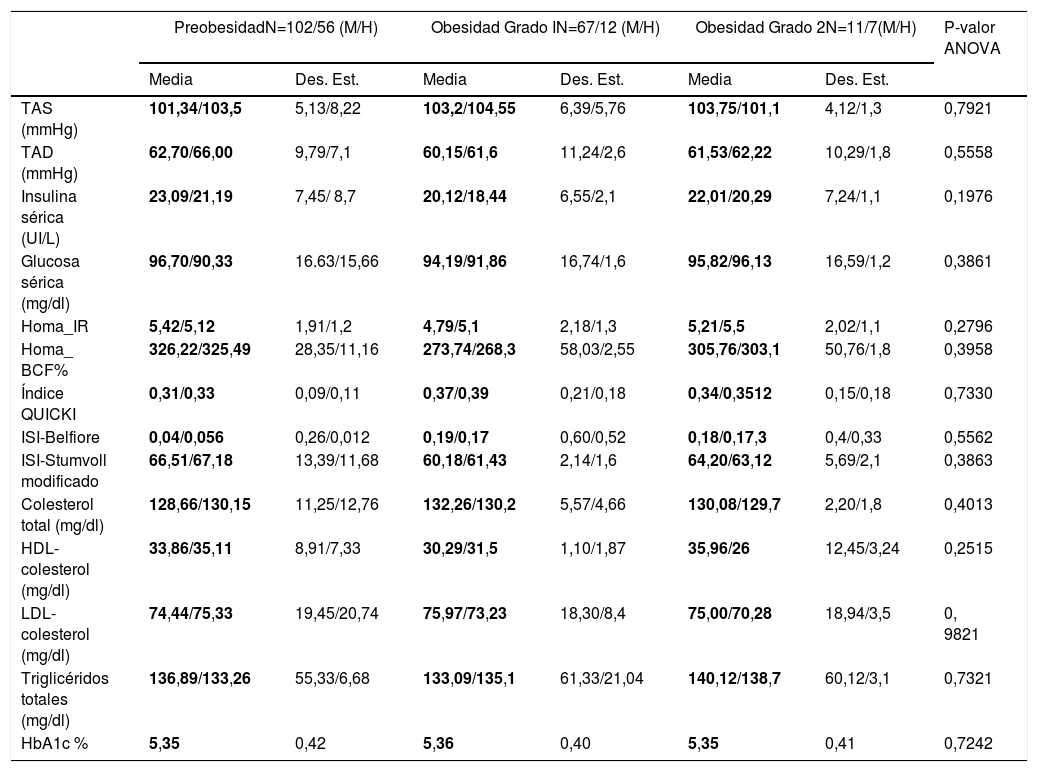
ResultadosPerfil metabólico por género y grado de obesidadAl estratificar el perfil antropométrico y bioquímico por género, encontramos que los varones comparados con las mujeres presentan valores más altos en los parámetros de talla (1,67cm versus 1,505cm), circunferencia de cintura (90,39 versus 85,92cm), niveles de triglicéridos (1,505 versus 112,89mg/dl) y una mayor sensibilidad a la insulina, acorde a los valores del índice QUICKI (0,37 versus 0,31) y del ISI-Belfiore (0,19 versus 0,04) (tabla 1). Los casos del sexo femenino incluidos presentan valores más altos de insulina sérica (23,09 versus 20,12 UI/l), así como de resistencia a la insulina (HOMA IR de 5,45 versus 4,79). En relación al grado de obesidad y el número de individuos mujer/varón mostró la siguiente distribución: preobesidad 102/56, obesidad grado I 67/12 y obesidad grado II 10/7, la cual no es significativamente estadística p=0,184.
Perfil clínico y bioquímico de la población analizada por género
| Sexo FemeninoN=162 | Sexo MasculinoN=93 | Total | P-valor de la prueba t | ||||
|---|---|---|---|---|---|---|---|
| Media | Des. Est. | Media | Des. Est. | Media | Des. Est. | ||
| Peso (kg) | 75,46 | 12,24 | 103,81 | 17,87 | 89,83 | 14,47 | 0,9309 |
| Talla (cm) | 1,505 | 0,08 | 1,67 | 0,12 | 1,65 | 0,10 | 0,01704 |
| IMC (kg/m2) | 29,64 | 3,41 | 28,58 | 2,36 | 29,25 | 3,09 | 0,2575 |
| CCC | 85,92 | 14,18 | 90,39 | 9,27 | 87,55 | 12,74 | 0,01803 |
| TAS (mmHg) | 102,76 | 13,10 | 105,48 | 16,90 | 103,75 | 14,56 | 0,6981 |
| TAD (mmHg) | 62,04 | 9,79 | 60,65 | 11,24 | 61,53 | 10,29 | 0,3857 |
| Insulina sérica (UI/L) | 23,09 | 7,45 | 20,12 | 6,55 | 22,01 | 7,24 | 0,01678 |
| Glucosa sérica (mg/dl) | 96,07 | 16,63 | 94,29 | 16,74 | 95,42 | 16,59 | 0,2871 |
| Homa_IR | 5,45 | 1,91 | 4,79 | 2,18 | 5,21 | 2,02 | 0,01791 |
| Homa_ BCF% | 328,25 | 289,35 | 273,74 | 158,03 | 308,79 | 250,76 | 0,3652 |
| Índice QUICKI | 0,31 | 0,10 | 0,37 | 0,21 | 0,34 | 0,15 | 0,0330 |
| ISI-Belfiore | 0,04 | 0,27 | 0,19 | 0,60 | 0,10 | 0,43 | 0,0330 |
| ISI-Stumvoll modificado | 66,51 | 13,39 | 60,18 | 22,14 | 64,20 | 17,25 | 0,3263 |
| Colesterol total (mg/dl) | 128,83 | 31,25 | 132,26 | 25,57 | 130,08 | 29,20 | 0,9018 |
| HDL-colesterol (mg/dl) | 33,86 | 13,93 | 30,29 | 9,10 | 32,56 | 12,45 | 0,2515 |
| LDL- colesterol (mg/dl) | 74,44 | 19,45 | 75,97 | 18,30 | 75,00 | 18,94 | 0,7982 |
| Triglicéridos totales (mg/dl) | 112,89 | 57,53 | 140,87 | 61,33 | 123,09 | 60,12 | 0,0128 |
| HbA1c % | 5,35 | 0,42 | 5,36 | 0,40 | 5,35 | 0,41 | 0,7242 |
BCF: masa de células beta; CCC: contorno de c cintura-cadera; Des. Est.: desviación estándar; HbA1c: hemoglobina glucosilada; HDL-colesterol: lipoproteína de alta densidad-colesterol; HOMA: modelo homeostático; IR: resistencia a la insulina; ISI: índice de sensibilidad a la insulina; LDL-colesterol: lipoproteína de baja densidad-colesterol; QUICKI: índice cuantitativo de sensibilidad a la insulina; TAD: presión arterial diastólica; TAS: presión arterial sistólica.
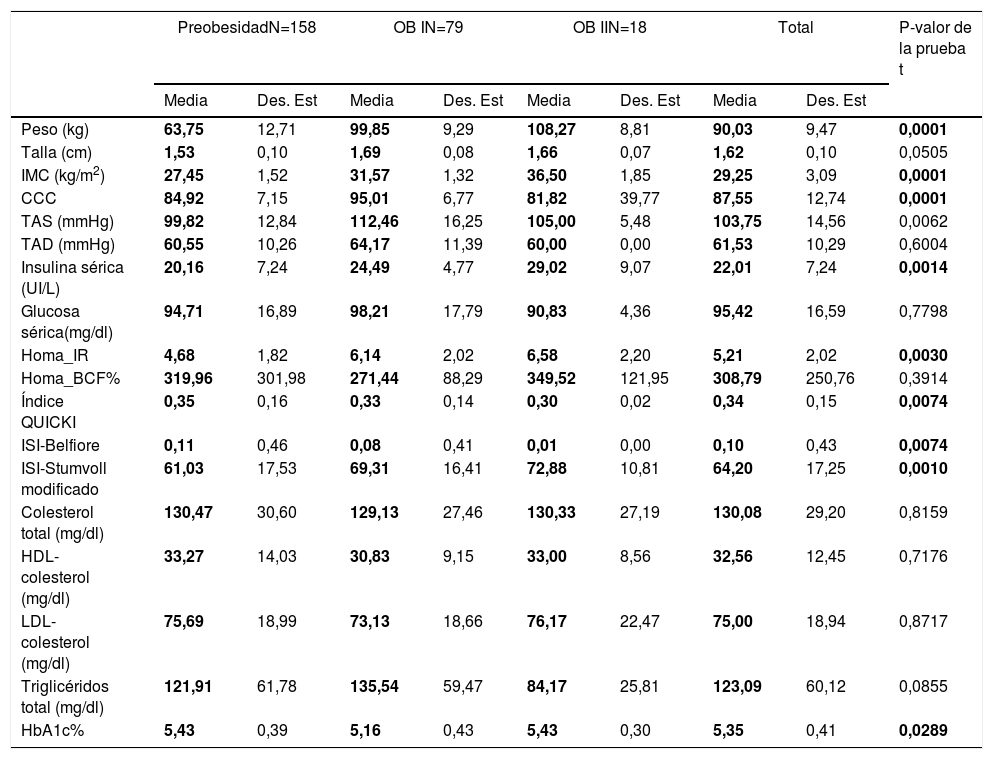
Pero al estratificar a los pacientes por el grado de obesidad en general (sumando hombres y mujeres) encontramos diferencias en niveles de TAS (preobesidad: 99,82mmHg, obesidad grado 1:112,46mm/Hg y obesidad grado 2:105mmHg), insulina sérica (preobesidad: 20,16UI/l, obesidad grado 1: 24,49UI/l y obesidad grado 2: 29,02), HOMA-IR (preobesidad: 4,68, obesidad grado 1: 6,14 y obesidad grado 2: 6,58), índice QUICKI (preobesidad: 0,35, obesidad grado 1: 0,33 y obesidad grado 2: 10,30), índice de Belfiore (preobesidad: 99,82mmHg, obesidad grado 1: 112,46mm/Hg y obesidad grado 2: 105mmHg), índice de Stumvoll (preobesidad: 61,03, obesidad grado 1: 69,31 y obesidad grado 2: 78,88), y hemoglobina glucosilada A1c (preobesidad: 5,43, obesidad grado 1: 112,46mm/Hg y obesidad grado 2: 5,43). Así los probandos con preobesidad presentan valores más bajos de TAS, insulina sérica, triglicéridos, así como mejores índices de sensibilidad a la insulina (tabla 2). Mediante el análisis ANOVA no se encontraron diferencias significativas entre género/grado de obesidad intra- e intergrupo (tabla 3).
Perfil clínico y bioquímico acorde al grado de obesidad
| PreobesidadN=158 | OB IN=79 | OB IIN=18 | Total | P-valor de la prueba t | |||||
|---|---|---|---|---|---|---|---|---|---|
| Media | Des. Est | Media | Des. Est | Media | Des. Est | Media | Des. Est | ||
| Peso (kg) | 63,75 | 12,71 | 99,85 | 9,29 | 108,27 | 8,81 | 90,03 | 9,47 | 0,0001 |
| Talla (cm) | 1,53 | 0,10 | 1,69 | 0,08 | 1,66 | 0,07 | 1,62 | 0,10 | 0,0505 |
| IMC (kg/m2) | 27,45 | 1,52 | 31,57 | 1,32 | 36,50 | 1,85 | 29,25 | 3,09 | 0,0001 |
| CCC | 84,92 | 7,15 | 95,01 | 6,77 | 81,82 | 39,77 | 87,55 | 12,74 | 0,0001 |
| TAS (mmHg) | 99,82 | 12,84 | 112,46 | 16,25 | 105,00 | 5,48 | 103,75 | 14,56 | 0,0062 |
| TAD (mmHg) | 60,55 | 10,26 | 64,17 | 11,39 | 60,00 | 0,00 | 61,53 | 10,29 | 0,6004 |
| Insulina sérica (UI/L) | 20,16 | 7,24 | 24,49 | 4,77 | 29,02 | 9,07 | 22,01 | 7,24 | 0,0014 |
| Glucosa sérica(mg/dl) | 94,71 | 16,89 | 98,21 | 17,79 | 90,83 | 4,36 | 95,42 | 16,59 | 0,7798 |
| Homa_IR | 4,68 | 1,82 | 6,14 | 2,02 | 6,58 | 2,20 | 5,21 | 2,02 | 0,0030 |
| Homa_BCF% | 319,96 | 301,98 | 271,44 | 88,29 | 349,52 | 121,95 | 308,79 | 250,76 | 0,3914 |
| Índice QUICKI | 0,35 | 0,16 | 0,33 | 0,14 | 0,30 | 0,02 | 0,34 | 0,15 | 0,0074 |
| ISI-Belfiore | 0,11 | 0,46 | 0,08 | 0,41 | 0,01 | 0,00 | 0,10 | 0,43 | 0,0074 |
| ISI-Stumvoll modificado | 61,03 | 17,53 | 69,31 | 16,41 | 72,88 | 10,81 | 64,20 | 17,25 | 0,0010 |
| Colesterol total (mg/dl) | 130,47 | 30,60 | 129,13 | 27,46 | 130,33 | 27,19 | 130,08 | 29,20 | 0,8159 |
| HDL-colesterol (mg/dl) | 33,27 | 14,03 | 30,83 | 9,15 | 33,00 | 8,56 | 32,56 | 12,45 | 0,7176 |
| LDL- colesterol (mg/dl) | 75,69 | 18,99 | 73,13 | 18,66 | 76,17 | 22,47 | 75,00 | 18,94 | 0,8717 |
| Triglicéridos total (mg/dl) | 121,91 | 61,78 | 135,54 | 59,47 | 84,17 | 25,81 | 123,09 | 60,12 | 0,0855 |
| HbA1c% | 5,43 | 0,39 | 5,16 | 0,43 | 5,43 | 0,30 | 5,35 | 0,41 | 0,0289 |
BCF: masa de células beta; CCC: contorno de c cintura-cadera; Des. Est.: desviación estándar; HbA1c: hemoglobina glucosilada; HDL-colesterol: lipoproteína de alta densidad-colesterol; HOMA: modelo homeostático; IMC: índice de masa corporal; IR: resistencia a la insulina; ISI: índice de sensibilidad a la insulina; LDL-colesterol: lipoproteína de baja densidad-colesterol; QUICKI: índice cuantitativo de sensibilidad a la insulina; TAD: presión arterial diastólica; TAS: presión arterial sistólica.
Perfil clínico y bioquímico de la población analizada por género/grado de obesidad
| PreobesidadN=102/56 (M/H) | Obesidad Grado IN=67/12 (M/H) | Obesidad Grado 2N=11/7(M/H) | P-valor ANOVA | ||||
|---|---|---|---|---|---|---|---|
| Media | Des. Est. | Media | Des. Est. | Media | Des. Est. | ||
| TAS (mmHg) | 101,34/103,5 | 5,13/8,22 | 103,2/104,55 | 6,39/5,76 | 103,75/101,1 | 4,12/1,3 | 0,7921 |
| TAD (mmHg) | 62,70/66,00 | 9,79/7,1 | 60,15/61,6 | 11,24/2,6 | 61,53/62,22 | 10,29/1,8 | 0,5558 |
| Insulina sérica (UI/L) | 23,09/21,19 | 7,45/ 8,7 | 20,12/18,44 | 6,55/2,1 | 22,01/20,29 | 7,24/1,1 | 0,1976 |
| Glucosa sérica (mg/dl) | 96,70/90,33 | 16.63/15,66 | 94,19/91,86 | 16,74/1,6 | 95,82/96,13 | 16,59/1,2 | 0,3861 |
| Homa_IR | 5,42/5,12 | 1,91/1,2 | 4,79/5,1 | 2,18/1,3 | 5,21/5,5 | 2,02/1,1 | 0,2796 |
| Homa_ BCF% | 326,22/325,49 | 28,35/11,16 | 273,74/268,3 | 58,03/2,55 | 305,76/303,1 | 50,76/1,8 | 0,3958 |
| Índice QUICKI | 0,31/0,33 | 0,09/0,11 | 0,37/0,39 | 0,21/0,18 | 0,34/0,3512 | 0,15/0,18 | 0,7330 |
| ISI-Belfiore | 0,04/0,056 | 0,26/0,012 | 0,19/0,17 | 0,60/0,52 | 0,18/0,17,3 | 0,4/0,33 | 0,5562 |
| ISI-Stumvoll modificado | 66,51/67,18 | 13,39/11,68 | 60,18/61,43 | 2,14/1,6 | 64,20/63,12 | 5,69/2,1 | 0,3863 |
| Colesterol total (mg/dl) | 128,66/130,15 | 11,25/12,76 | 132,26/130,2 | 5,57/4,66 | 130,08/129,7 | 2,20/1,8 | 0,4013 |
| HDL-colesterol (mg/dl) | 33,86/35,11 | 8,91/7,33 | 30,29/31,5 | 1,10/1,87 | 35,96/26 | 12,45/3,24 | 0,2515 |
| LDL- colesterol (mg/dl) | 74,44/75,33 | 19,45/20,74 | 75,97/73,23 | 18,30/8,4 | 75,00/70,28 | 18,94/3,5 | 0, 9821 |
| Triglicéridos totales (mg/dl) | 136,89/133,26 | 55,33/6,68 | 133,09/135,1 | 61,33/21,04 | 140,12/138,7 | 60,12/3,1 | 0,7321 |
| HbA1c % | 5,35 | 0,42 | 5,36 | 0,40 | 5,35 | 0,41 | 0,7242 |
BCF: masa de células beta; CCC: contorno de c cintura-cadera; Des. Est.: desviación estándar; HbA1c: hemoglobina glucosilada; HDL-colesterol: lipoproteína de alta densidad-colesterol; HOMA: modelo homeostático; IMC: índice de masa corporal; IR: resistencia a la insulina; ISI: índice de sensibilidad a la insulina; LDL-colesterol: lipoproteína de baja densidad-colesterol; QUICKI: índice cuantitativo de sensibilidad a la insulina; TAD: presión arterial diastólica; TAS: presión arterial sistólica.
Respecto a la frecuencia de alelos del VTNR de ATXN2 en la población total analizada fue la siguiente; el alelo de 22 repeticiones es el más frecuente con una frecuencia de 93,33% (n=476, alelos); le siguen el de 23 repeticiones con 2,94% (n=15 alelos), 18 y 19 repeticiones con 0,18 respectivamente 1,18% (n=6/n=6, alelos), el de 20 y 29 repeticiones con una frecuencia de 0,59% cada uno respectivamente (n=3/n=3, alelos), y 24 repeticiones con 0,19% (n=1, alelo), siendo estos últimos en la población analizada variantes alélicas (frecuencia menor o igual a 0,5%), encontrándose 7 de los 22 alelos posibles. En relación a la distribución de genotipos observados del VNTR del gen ATXN2 en la población estudiada (n=255 sujetos), el genotipo homocigoto de 22 repeticiones es el más frecuente con 86,67% (n=221) de los sujetos de estudio, le siguen el heterocigoto 22/23 con 5,88% (n=15 sujetos), los heterocigotos con alelos cortos; 18/22 y 19/22 con 2,35% respectivamente cada uno (n=6/n=6 sujetos), 20/22 con 1,18% (n=3 sujetos). Los heterocigotos con alelo largo 22/29 con una frecuencia relativa de 1,18% (n=3 sujetos) y 22/24 con 0,39% (n=1 sujeto), encontrándose en la población analizada 7 de los 482 posibles genotipos. Las frecuencias relativas de genotipos esperados fueron 18/22 con 2,19% (n=5,6 sujetos), 19/22 con 2,19% (n=5,6 sujetos), 20/22 con 1,09% (n=2,8 sujetos), 22/22 con 87,05% (n=222 sujetos), 22/23 con 5,49% (n=14 sujetos), 22/24 con 0,38% (n=0,9933 sujetos) y 22/29 con 1,4% (n=3,8 sujetos). Al comparar la distribución de las frecuencias genotípicas observadas con las que esperamos, no se encontraron diferencias estadísticas, por lo que el VNTR está en equilibrio de Hardy Weinberg, X2=0,1677, p=>0,05.
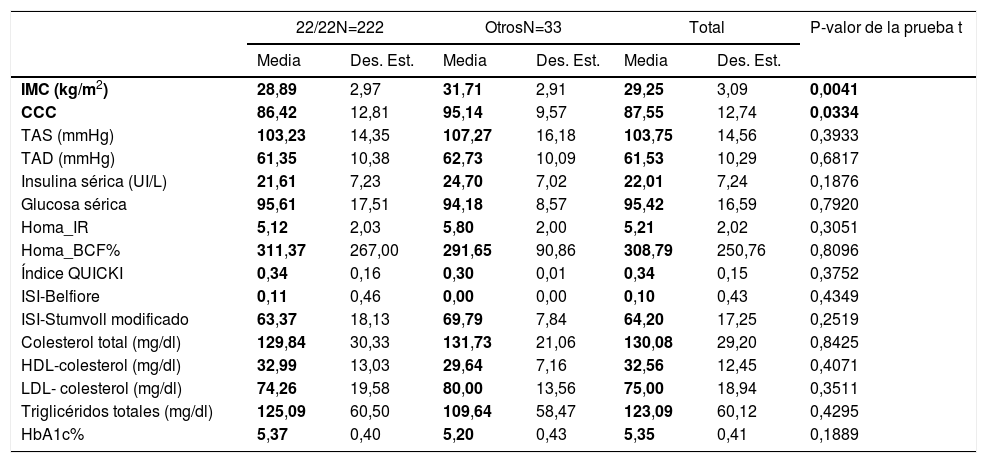
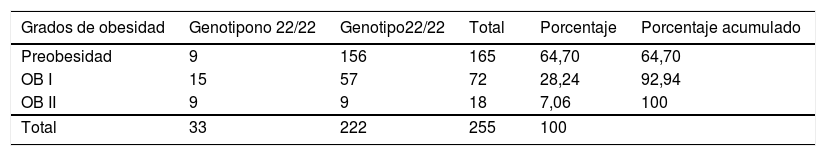
VTNR de ATXN2 y su relación con el perfil metabólicoAl agrupar la población de estudio por genotipos encontramos que los portadores homocigoto 22/22(n=222 sujetos) no muestran diferencias en los parámetros del perfil metabólico entre los grupos (tabla 4). Por lo que el genotipo 22/22 (que en general es el más frecuente en todas poblaciones en el mundo), no se asocia con la obesidad, pero al comparar el promedio de los valores IMC y el CCC de los pacientes al homocigoto de 22 repeticiones con los portadores de los genotipos distintos, estos últimos presentan una asociación con una mayor IMC y CCC (prueba t, con un valor de p <0,05), por lo tanto con la obesidad central. Lo cual se corrobora mediante el ajuste de un modelo log lineal saturado, donde todas las variables que se analizan se consideran como variables respuesta; así el genotipo no 22/22 (18/22, 19/22, 20/22, 22/23, 22/24, 22/29, n=33 sujetos), es el que sí se correlaciona positivamente con el grado de obesidad, con un coeficiente de correlación de 2,85, valores de OR de 4,56, p=0,003, X2=11.3769, error estándar de 0,816, como se muestra en la tabla 5, por lo tanto estos existe una covariación positiva entre el grado de obesidad y la distribución de genotipos del VNTR de ATXN2, lo que incrementa el riesgo de desarrollo (OR) para la obesidad.
Perfil clínico y bioquímico en relación al el VNTR de ATXN2
| 22/22N=222 | OtrosN=33 | Total | P-valor de la prueba t | ||||
|---|---|---|---|---|---|---|---|
| Media | Des. Est. | Media | Des. Est. | Media | Des. Est. | ||
| IMC (kg/m2) | 28,89 | 2,97 | 31,71 | 2,91 | 29,25 | 3,09 | 0,0041 |
| CCC | 86,42 | 12,81 | 95,14 | 9,57 | 87,55 | 12,74 | 0,0334 |
| TAS (mmHg) | 103,23 | 14,35 | 107,27 | 16,18 | 103,75 | 14,56 | 0,3933 |
| TAD (mmHg) | 61,35 | 10,38 | 62,73 | 10,09 | 61,53 | 10,29 | 0,6817 |
| Insulina sérica (UI/L) | 21,61 | 7,23 | 24,70 | 7,02 | 22,01 | 7,24 | 0,1876 |
| Glucosa sérica | 95,61 | 17,51 | 94,18 | 8,57 | 95,42 | 16,59 | 0,7920 |
| Homa_IR | 5,12 | 2,03 | 5,80 | 2,00 | 5,21 | 2,02 | 0,3051 |
| Homa_BCF% | 311,37 | 267,00 | 291,65 | 90,86 | 308,79 | 250,76 | 0,8096 |
| Índice QUICKI | 0,34 | 0,16 | 0,30 | 0,01 | 0,34 | 0,15 | 0,3752 |
| ISI-Belfiore | 0,11 | 0,46 | 0,00 | 0,00 | 0,10 | 0,43 | 0,4349 |
| ISI-Stumvoll modificado | 63,37 | 18,13 | 69,79 | 7,84 | 64,20 | 17,25 | 0,2519 |
| Colesterol total (mg/dl) | 129,84 | 30,33 | 131,73 | 21,06 | 130,08 | 29,20 | 0,8425 |
| HDL-colesterol (mg/dl) | 32,99 | 13,03 | 29,64 | 7,16 | 32,56 | 12,45 | 0,4071 |
| LDL- colesterol (mg/dl) | 74,26 | 19,58 | 80,00 | 13,56 | 75,00 | 18,94 | 0,3511 |
| Triglicéridos totales (mg/dl) | 125,09 | 60,50 | 109,64 | 58,47 | 123,09 | 60,12 | 0,4295 |
| HbA1c% | 5,37 | 0,40 | 5,20 | 0,43 | 5,35 | 0,41 | 0,1889 |
BCF: masa de células beta; CCC: contorno de c cintura-cadera; Des. Est.: desviación estándar; HbA1c: hemoglobina glucosilada; HDL-colesterol: lipoproteína de alta densidad-colesterol; HOMA: modelo homeostático; IMC: índice de masa corporal; IR: resistencia a la insulina; ISI: índice de sensibilidad a la insulina; LDL-colesterol: lipoproteína de baja densidad-colesterol; QUICKI: índice cuantitativo de sensibilidad a la insulina; TAD: presión arterial diastólica; TAS: presión arterial sistólica.
Modelo log lineal saturado, incluye obesidad y la relación entre el VNTR de ATXN2
| Grados de obesidad | Genotipono 22/22 | Genotipo22/22 | Total | Porcentaje | Porcentaje acumulado |
|---|---|---|---|---|---|
| Preobesidad | 9 | 156 | 165 | 64,70 | 64,70 |
| OB I | 15 | 57 | 72 | 28,24 | 92,94 |
| OB II | 9 | 9 | 18 | 7,06 | 100 |
| Total | 33 | 222 | 255 | 100 |
| OR | Valor de p | [95% Intervalo de | confianza] | ||
|---|---|---|---|---|---|
| Obesidad (genotipo no 22/22) | 4,56 | 0,005 | 4,462 | 4,661 | |
| Obesidad(genotipo 22/22) | 3,80 | 0,164 | 1,842 | 5,762 |
OR: riesgo de desarrollo. Genotipo no 22/22 (18/22, 19/22, 22/20, 22/23, 22/24, 22/29).
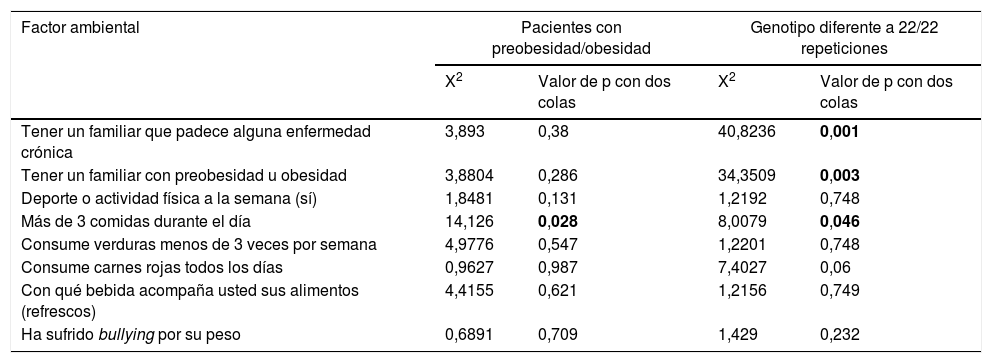
El factor ambiental más frecuente en la población amerindia chinanteca analizada fue el consumo de carnes rojas todos los días (n=252), le siguieron el consumo de verduras menos de 3 veces por semana (n=222), tener un familiar que padece alguna enfermedad crónica (diabetes, dislipidemia, obesidad e hipertensión) (n=177), con qué bebida acompaña usted sus alimentos (refrescos) (n=141), más de 3 comidas durante el día (n=135), deporte o actividad física a la semana (sí) (n=108), ha sufrido bullying por su peso (n=45), tener un familiar con preobesidad u obesidad (n=42). No se encontraron diferencias por género en cuanto esta distribución (valores de p>0,05, X2<6,89). Mostrando una asociación positiva moderada, el consumo de comida más de 3 veces al día, con la obesidad con un cociente r=0,384, X2=14.1260, p=0,028. El tener un familiar con alguna enfermedad crónica, con preobesidad u obesidad, el consumo de más de 3 comidas al día, más ser portador de un genotipo diferente al homocigoto 22/22 repeticiones, correlaciona positivamente con obesidad con cocientes r=0,189, r=0,327, r=114 respectivamente (tabla 6). El consumo de carnes rojas solo influyó en el desarrollo de obesidad en los portadores del genotipo diferentes al homocigoto de 22/22 repeticiones (tabla 6).
Factores ambientales y la interacción con el VNTR de ATXN2
| Factor ambiental | Pacientes con preobesidad/obesidad | Genotipo diferente a 22/22 repeticiones | ||
|---|---|---|---|---|
| X2 | Valor de p con dos colas | X2 | Valor de p con dos colas | |
| Tener un familiar que padece alguna enfermedad crónica | 3,893 | 0,38 | 40,8236 | 0,001 |
| Tener un familiar con preobesidad u obesidad | 3,8804 | 0,286 | 34,3509 | 0,003 |
| Deporte o actividad física a la semana (sí) | 1,8481 | 0,131 | 1,2192 | 0,748 |
| Más de 3 comidas durante el día | 14,126 | 0,028 | 8,0079 | 0,046 |
| Consume verduras menos de 3 veces por semana | 4,9776 | 0,547 | 1,2201 | 0,748 |
| Consume carnes rojas todos los días | 0,9627 | 0,987 | 7,4027 | 0,06 |
| Con qué bebida acompaña usted sus alimentos (refrescos) | 4,4155 | 0,621 | 1,2156 | 0,749 |
| Ha sufrido bullying por su peso | 0,6891 | 0,709 | 1,429 | 0,232 |
El presente estudio muestra diferencias metabólicas y en factores de riesgo cardiovascular en hombres y en mujeres amerindias con ancestría chinanteca del Estado de Oaxaca, lo cual no se había reportado. En este sentido las mujeres incluidas en el corte presentaron más resistencia a la insulina, lo cual se puede explicar por el mayor porcentaje de grasa subcutánea en la cadera y en los senos17. Lo anterior se valida con los valores más elevados del índice de Stumvoll16, el cual considera el IMC cuyo valor promedio fue más alto en las mujeres incluidas en el presente estudio. Los niveles altos de triglicéridos en varones coinciden con lo esperado por estudios epidemiológicos en la población mexicana, correlacionan directamente con la obesidad central, como en el presente estudio17,18.
En relación al grado de obesidad con los parámetros metabólicos, se encontró diferencias estadísticas en los niveles de insulina, así como índices relacionados con la resistencia a la insulina, ya que en su totalidad la población muestra como fenotipo principal este, y que es factor fisiopatológico que conduce a la obesidad, que es lo esperado acorde a la historia natural del síndrome metabólico. Cabe señalar que los pacientes con obesidad y preobesidad analizados en el presente reporte, presentaron valores normales de HbA1c, sin embargo el grupo con obesidad grado II tuvo el promedio más alto dentro del rango normal entre los pacientes, siendo significativa esta diferencia. Estos resultados son muy similares al reportado en población adulta de Costa Rica con diabetes, donde los pacientes controlados que presentaron obesidad grado 2 y resistencia a la insulina, tuvieron valores más elevados de HbA1c, muy similar a lo encontrado en el presente estudio19. Esto puede sugerir el grado de la hiperglucemia y deterioro metabólico así como de glucosilación de proteínas que tienen los sujetos con mayor grado de obesidad, los encamina más a la microangiopatía que conducen al desarrollo de diabetes mellitus tipo 2. Y por ello al analizar el perfil clínico y bioquímico por género/grado de obesidad, se hacen más pequeños los grupos, se reduce la varianza y por ello no se encontró como tal correlación los parámetros metabólicos en este sentido, ya que perse la población presenta un genotipo fenotipo ahorrativo clínicamente evidente por resistencia a la insulina, y que es mayor en las mujeres5–7, como se reporta en el presente trabajo, que esto es lo que influye realmente en las diferentes anormalidades metabólicas que se encontraron, en conjunto con otros factores genéticos.
Cabe señalar que este es el primer estudio que analiza la frecuencia de alelos y genotipos del VNTR (CAG)n del gen ATXN2 en una población adulta amerindia del Estado de Oaxaca, contribuyendo sustancialmente a la diversidad y antropología genética de la población mexicana. Las frecuencias son muy similares a las reportadas en pacientes pediátricos originarios de la Ribera de Chapala, Jalisco, Noroccidente México, de Tuxtepec Oaxaca (pacientes pediátricos), y en adultos mestizos mexicanos de la región del centro de la Ciudad de México20,21. Los índices de heterocigocidad son superiores al 80%, donde el alelo de 22 repeticiones es el más frecuente como en las otras poblaciones, lo cual es congruente con la poca divergencia evolutiva de este locus y por ello el estado de equilibrio que conserva el locus, como en el presente reporte12,13,22–28..
Por otra parte el presente estudio muestra que el VNTR (CAG)n del gen ATXN2 es un factor asociado con el grado de obesidad, ya que correlaciona directamente con el IMC y el contorno de cintura cadera, particularmente en los portadores de genotipos con alelos diferentes a 22 repeticiones en la población amerindia chinanteca del Estado de Oaxaca. Los resultados son muy similares a los encontrados en un estudio de pacientes con obesidad severa del Reino Unido, Indonesia y el Caribe14. Lo cual apoya los estudios previos de ligamiento que sugieren que el gen ATXN2 está asociado con el desarrollo de la obesidad20–24.
Así mismo, el trabajo que se presenta es el primer estudio que analiza el VNTR (CAG)n del gen ATXN2 y la influencia en el perfil metabólico de riesgo cardiovascular en humanos como tal. Se ha reportado en modelos murinos que la deficiencia de ATXN2 conduce a la disminución del receptor de insulina en hígado y cerebro, así como dislipidemia e hígado graso y obesidad9. Si bien es cierto que se postula que ATXN2 podría ser de los genes que conforman el genotipo ahorrador y estar asociado a la resistencia a la insulina, en el presente estudio no se encontró que algún genotipo de ATXN2 influenciara la resistencia a la insulina, o el perfil de lípidos como tal, lo cual se encontró más en relación con el género o al grado de obesidad. Pero la población presentaba hiperfagia e hiperinsulinemia, característico del síndrome de resistencia orgánica múltiple, que describía Corkey, clínicamente traducido en el consumo de alimentos altamente calóricos y con grasa como carnes rojas, varias veces al día, que, aunado al factor genético analizado, lo que sugiere es que la ataxina-2 puede ser uno de los desencadenantes de la obesidad y ser parte de los genes del genotipo ahorrador8.
Hay reportes previos de que otros polimorfismos que participan en la inflamación que va de la mano con la resistencia a la insulina y forman parte del genotipo ahorrador, que influyen en sus niveles séricos de triglicéridos y de otros parámetros del riesgo cardiovascular en población mestiza del Estado de Guerrero, México, como el SNP -844 G/A del PAI23, los cuales en la población amerindia de Tuxtepec no han sido estudiados, y escaparán del objetivo principal del presente reporte.
En el presente estudio se consideraron otros factores ambientales, como la actividad física, consumo de refresco, consumo de verduras, el número de veces que se consume alimentos al día, la incidencia de bullying; encontrándose asociado con el consumo de carnes rojas y el mayor número de comidas al día y su interacción con el VNTR de ATXN2, lo cual sugiere un efecto sinérgico que no había sido descrito previamente. En las poblaciones amerindias de Oaxaca, el factor alimentación es determinante de la hipertrigliceridemia, ya que tienen alto consumo regional de diferentes panes (hidratos de carbono), carnes rojas sea carne enchilada de cerdo (cecina) o de res (tasajo), por lo cual se encontró en el presente estudio una asociación positiva con este factor de riesgo26. Otros factores ambientales no tuvieron efecto. Esto sugiere que en este grupo étnico chinanteca, la obesidad que presenta tiene un componente genético alto y un efecto sinérgico con la alimentación, como se ha visto en otras poblaciones25. Además, se observó una asociación entre la presencia de algún familiar con enfermedad crónica y el genotipo diferente al homocigoto 22/22, lo cual no había sido descrito previamente en la literatura.
Existen otros factores que conducen al desarrollo de obesidad en México y a nivel mundial, entre ellos la presencia de adenovirus 36, el cual también se ha relacionado con alteraciones metabólicas en pacientes pediátricos obesos del sureste de México, y correlaciona con los niveles de triglicéridos, colesterol e IMC más altos. Su estudio en población del Estado de Oaxaca será motivo de estudios posteriores, escapó al alcance del presente estudio27.
Hay que señalar que el presente estudio tiene su limitante en que es un trabajo transversal, lo que lo limita para estimar la fracción prevenible, así como la fracción atribuible a la población con el VNTR de ATXN2, y cuyos resultados que se presentan son de riesgo atribuible y de riesgo relativo, por lo cual se requiere posteriormente estudio de casos y controles y de réplica, en los cuales se estime el riesgo de desarrollo para obesidad en comparación con la población sana mexicana.
En conclusión, el presente estudio sugiere que el VNTR (CAG)n del gen ATXN2 influye en el grado de obesidad y en los valores de la circunferencia cintura cadera en la población adulta amerindia mexicana analizada, así como también está asociado con el antecedente de enfermedad crónica, y el desarrollo de obesidad. Otros parámetros metabólicos analizados en esta población están influenciados por el género (sexo femenino) como el caso de los relacionados con la resistencia a la insulina, otros están en función del grado de obesidad y control metabólico como el porcentaje de hemoglobina glucosilada A1c. Los niveles de triglicéridos tienen una influencia del género (sexo masculino), y de la alimentación y del factor genético que se analizó en el presente trabajo.
FinanciaciónPRODEP-SEP. Fondo para la incorporación de nuevos PTC. ID del Proyecto 60800. El presente trabajo ha sido financiado por PROMEP-SEP Fondo Apoyo a la incorporación de NPT́c-2012 [beca número PROMEP/103-5/12/4528]; Fondo de Fortalecimiento de CA Convocatoria 2013 [beca número IDCA11337, UNISIS-CA-10]. México
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al personal médico y de enfermería de la Jurisdicción de Tuxtepec Oaxaca, por el apoyo para la toma de muestras de pacientes, evaluaciones y realización de estudios bioquímicos.