La fractura de cadera en la población de edad igual o superior a 75 años es una de las patologías más incapacitantes. Así mismo, la desnutrición relacionada con la enfermedad (DRE) y la sarcopenia son dos diagnósticos frecuentes en este grupo de edad, cuya prevalencia puede estar aumentada en los pacientes con fractura de cadera.
ObjetivoConocer la prevalencia de desnutrición y/o sarcopenia en pacientes ingresados por fractura de cadera y evaluar la coexistencia de DRE y sarcopenia, y las diferencias entre el grupo de pacientes con sarcopenia y aquellos que no.
MétodosSe incluyeron 186 pacientes de 75 años o más, hospitalizados por fractura de cadera desde marzo de 2018 a junio de 2019. Se recogieron variables demográficas, nutricionales y bioquímicas. El cribado nutricional se realizó con Mini-Nutritional Assessment (MNA). La presencia de DRE se estableció con los criterios The Global Leadership Initiative on Malnutrition (GLIM). Para el cribado de sarcopenia se utilizó el Strength, Assistance Walking, Rise from a chair, Climb stairs, and Falls (SARC-F) y el diagnóstico de sarcopenia se realizó mediante los criterios European Working Group on Sarcopenia in Older People (EWGSOP) revisados en 2019 (EWGSOP2). Se determinó la fuerza muscular mediante dinamometría de mano y la composición corporal mediante bioimpedanciometría.
ResultadosLa edad media fue de 86,2 años, la mayor parte de los pacientes fueron mujeres (81,7%). Un 37,1% de los pacientes estaban en riesgo nutricional (MNA 17-23,5) y un 16,7% desnutridos (MNA<17). Un 72,4% de las mujeres y un 79,4% de los varones se diagnosticaron de DRE. Presentaron baja fuerza muscular un 77,6% de las mujeres y el 73,5% de los varones. El índice de masa muscular apendicular se encontraba por debajo de los puntos de corte para sarcopenia en el 72,4% de las mujeres y el 79,4% de los varones. Los pacientes con sarcopenia presentaban un índice de masa corporal más bajo, mayor edad, peor situación funcional previa y mayor carga de enfermedad. Resultó significativa (p=0,007) la relación entre pérdida de peso y baja fuerza de prensión manual.
ConclusionesEl 53,8% de los pacientes que ingresan por fractura de cadera presentan desnutrición o están en riesgo tras cribado con MNA. La sarcopenia y la DRE afectan al menos a 3 de cada 4 pacientes mayores de 75 años que ingresan por fractura de cadera. Una mayor edad, peor situación funcional, menor índice de masa corporal y mayor número de comorbilidades se asocia con estas dos entidades. Existe una relación entre DRE y sarcopenia.
Hip fracture in the population aged 75 years and older is one of the most disabling pathologies. Likewise, disease related malnutrition (DRM) and sarcopenia are two frequent diagnoses in this age group, whose prevalence may be increased in patients with hip fracture.
AimTo determine the prevalence of malnutrition and/or sarcopenia in patients admitted for hip fracture and evaluate the existence of malnutrition related to disease and sarcopenia, and the differences between the sarcopenic and non-sarcopenic group.
Methods186 patients aged 75 years or over, hospitalised for hip fracture from March 2018 to June 2019 were included. Demographic, nutritional and biochemical variables were collected. Nutritional screening was carried out with the Mini-Nutritional Assessment (MNA), the presence of DRM was established with The Global Leadership Initiative on Malnutrition (GLIM) criteria. For sarcopenia screening, the Strength, Assistance with walking, Rising from a chair, Climbing stairs and Falls (SARC-F) was used and the diagnosis of sarcopenia was made using the criteria from the European Working Group on Sarcopenia in Older People (EWGSOP) reviewed in 2019 (EWGSOP2). Muscle strength was determined by hand-grip strength, body composition by measurement of bioelectrical impedance.
ResultsThe mean age was 86.2 years, most of the patients were women (81.7%). 37.1% of patients were at nutritional risk (MNA 17-23.5) and 16.7% were malnourished (MNA<17). 72.4% of women and 79,4% of men, were diagnosed with DRM. 77.6% of the women and 73.5% of the men had low muscle strength. The appendicular muscle mass index was below the cut-off points for sarcopenia in 72.4% of the women and 79.4% of the men. Patients with sarcopenia had a lower body mass index, older age, poorer previous functional status and higher disease burden. The relationship between weight loss and hand grip strength (HGS) was significant (p=0.007)
Conclusions53.8% of patients admitted for hip fracture present malnutrition or are at risk after screening with MNA. Sarcopenia and DRM affects at least three out of four patients older than 75 years admitted for hip fracture. Older age, worse functional status, lower body mass index and high number of comorbidities, are associated with these two entities. There is a relationship between DRM and sarcopenia.
La fractura de cadera es la fractura por fragilidad que mayores consecuencias negativas tiene en la edad geriátrica. Supone un deterioro funcional, no siempre reversible, debido al propio proceso y a la inmovilización que conlleva en el preoperatorio y postoperatorio inmediato. Además, contribuye a la institucionalización e incremento de mortalidad, de manera más marcada durante el primer año tras la fractura1.
Los procesos relacionados con la fractura y las caídas están siendo cada vez más estudiados. Esto se debe a la posibilidad de prevenir su aparición; y, en caso de que se produzcan, reducir el deterioro funcional que conllevan. Los factores que más impacto tienen a este nivel son la desnutrición2 y la sarcopenia3.
La desnutrición relacionada con la enfermedad (DRE), según los últimos criterios establecidos por The Global Leadership Initiative on Malnutrition (GLIM)4, es un diagnóstico frecuente en estos pacientes.
El primero en hablar del término sarcopenia (del griego Sarx: carne y Penia: pérdida) fue Rosenberg en 19955. Este proceso se definió como una pérdida anormal de músculo asociada con la edad, que predice el declive funcional y se asocia con pérdida de movilidad y deterioro nutricional. Posteriormente, Manini y Clark6 revisaron el concepto de «sarcopenia», como pérdida de masa muscular, frente a «dinapenia», término que se acuñó ya en 2008 para describir la pérdida de fuerza muscular7. Aunque inicialmente la pérdida de fuerza y función muscular se relacionaba directamente con la pérdida de cantidad muscular, estos autores hicieron una extensa revisión en 2012 de lo publicado hasta el momento, donde afirmaban que la pérdida de fuerza no depende únicamente de la disminución de masa muscular, que existían otros factores implicados, algunos de origen neurológico, y que, en general, la fuerza muscular se deterioraba más rápidamente que la masa. Estos investigadores revisaron estudios que relacionaban pérdida de fuerza con discapacidad, pero no encontraban relación entre la pérdida de masa muscular y este declive funcional. Por otra parte, en los algoritmos diagnósticos de «sarcopenia» publicados hasta el momento8,9 se incluyen test funcionales (velocidad de la marcha) y medición de fuerza de prensión manual (hand grip strengh). Es por ello que en el momento actual se postula que hablamos de dos entidades diferentes, dinapenia frente a sarcopenia6.
Una de las definiciones de sarcopenia más utilizadas es la que en 2010 publicó el European Working Group on Sarcopenia in Older People (EWGSOP). Esta definición se basa en masa muscular, fuerza y función8. En 2019 se publicó una revisión de los criterios por parte de este mismo grupo, con puntos de corte mejor definidos10. Además, en su algoritmo diagnóstico se inicia el estudio de sarcopenia con pruebas que miden fuerza muscular (fuerza de prensión manual, test de levantarse de la silla), siendo la cantidad de músculo una medición de confirmación (por DEXA [Double Energy X-Ray Absorptiometry], BIA [bioimpedanciometría], RNM [resonancia nuclear magnética], TAC [tomografía axial computarizada]), y volviéndose a basar en pruebas funcionales (SPPB, velocidad de la marcha, TUG) la severidad de la sarcopenia, o quizá sería mejor decir «dinapenia»6,7. En esta línea, en 2016 se reconoció la sarcopenia con un código propio en la Clasificación Internacional de Enfermedades (ICD-10)11.
Se ha visto que existe una relación entre la pérdida de masa ósea y la disminución de masa muscular (sarcopenia), por lo que se ha acuñado el término osteosarcopenia12,13. En las fracturas por fragilidad hay una asociación de ambas entidades como factor de riesgo14.
El músculo y el hueso están altamente interrelacionados por un origen embrionario común, ambos proceden de la misma célula madre mesenquimal que se diferencia hacia una u otra línea celular15. De esta célula madre proceden también los adipocitos presentes en ambos tejidos, lo que explicaría la mayor infiltración grasa en músculo y hueso del paciente mayor, pues las células pluripotenciales tienden a diferenciarse hacia esta línea con el envejecimiento15,16. Además, ambos tejidos están integrados y tienen funciones compartidas. Así pues, entre hueso y músculo existe una sofisticada regulación del equilibrio entre procesos de síntesis y degradación/reabsorción de ambos tejidos. En esta regulación participan factores genéticos, endocrinos, el sistema nervioso, citoquinas proinflamatorias, actividad física del paciente y fármacos16. Existe un mecanismo paraendocrino, de manera que el músculo secreta miocinas que afectan al hueso, y este, a su vez, secreta osteocinas con las que se comunica con el músculo15,16. Los cambios en la masa ósea afectan a la masa muscular y viceversa17.
La DRE conduce a una pérdida de masa muscular, y, por lo tanto, aunque se trate de entidades diferentes, existe relación entre DRE y sarcopenia18. Además, sería esperable que su prevalencia estuviese aumentada en pacientes con fractura de cadera por osteoporosis.
Por esta razón se realizó un estudio para conocer la prevalencia de DRE y/o sarcopenia en los pacientes que ingresaban en una Unidad de Ortogeriatría de un Hospital de tercer nivel por fractura de cadera por fragilidad.
Material y métodosDiseño del estudioSe diseñó un estudio transversal de práctica clínica habitual, de todos los pacientes de edad igual o superior a 75 años con diagnóstico de fractura de extremidad proximal de fémur (fractura de cadera) por fragilidad.
Se incluyeron los pacientes que ingresaron en la Unidad de Ortogeriatría del Hospital Clínico Universitario de Valladolid desde marzo de 2018 a junio de 2019 y a los que se les pudo realizar la valoración inicial previa a la cirugía y en menos de 48h desde el ingreso. Todos ellos o sus representantes aceptaron participar tras la firma de un consentimiento informado.
Al tratarse de un estudio de práctica clínica habitual, en todos los casos de diagnóstico de DRE se realizó intervención nutricional durante el ingreso y al alta: enriquecimiento de la dieta o suplemento nutricional para alcanzar los requerimientos energéticos y proteicos individualizados en cada paciente. Además de recomendaciones de ejercicio progresivo adaptado a la evolución del paciente: ejercicios de fuerza y potencia muscular, de equilibrio cuando el paciente mantenía bipedestación (ejercicio multicomponente).
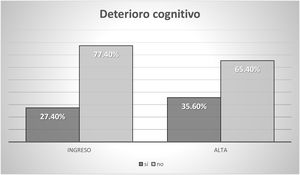
Los criterios de exclusión fueron: cirugía de urgencias; enfermedad de base que condiciona la expectativa de vida inferior a 6 meses: consideramos que una enfermedad avanzada de órgano o una neoplasia explicaban por sí mismas la DRE y/o sarcopenia y serían factores confusores; edemas persistentes que no respondían al tratamiento de su causa (insuficiencia cardiaca en la mayoría de los casos) en 24h; tratamiento previo con suplementos nutricionales: podrían influir en los resultados, aunque los valores analíticos no están incluidos en los criterios diagnósticos ni de DRE ni sarcopenia; deterioro cognitivo que impide la colaboración del paciente; ser portadores de marcapasos o prótesis metálicas bilaterales que alteran las mediciones; pacientes que no deambulaban previamente; y la no aceptación del paciente.
El estudio fue aprobado por el Comité de Ética en Investigación Médica (CEIm) del Hospital Clínico Universitario de Valladolid (PI 17-653). La investigación y los procesos se realizaron de acuerdo con las buenas prácticas recogidas en la declaración de Helsinki.
VariablesTras firmar el consentimiento informado, se recogieron datos epidemiológicos, de anamnesis y exploración física, así como una valoración geriátrica integral. La situación funcional previa se midió con el índice de Barthel19, la carga de enfermedad con la CIRS-G (Cumulative Illness Rating Scale Geriatric)20, el cribado nutricional con el MNA (Mini-Nutritional Assesment)21 considerándose desnutridos aquellos pacientes que puntuaban menos de 17, y en riesgo nutricional los que estaban entre 17 y 23,5 puntos. Para el cribado inicial de sarcopenia utilizamos SARC-F (strength, assistance walking, rise from a chair, climb stairs, and falls)22, considerándose con sarcopenia probable aquellos sujetos que puntuaron 4 o más en dicho test de cribado.
Se midió fuerza de prensión manual con un dinamómetro Jamar Hidráulico modelo J00105, se consideró disminuida, según criterios EWGSOP, cuando era menor de 16kg en mujeres y menor de 27kg en varones. Se realizó el estudio de la composición corporal, siempre con el paciente al menos 6h sin sueroterapia, mediante bioimpedanciometría usando el modelo BIA 101 Anniversary (Akern, Italia).
En las primeras 24h del ingreso se realizó analítica sanguínea, con determinación de niveles de proteínas, albúmina y prealbúmina, así como calcio, fósforo, vitamina D y PTH, además de hemograma y función renal.
Se consideró que los pacientes tenían DRE, según criterios GLIM, cuando cumplían un criterio fenotípico: pérdida de peso (>5% en los últimos 6 meses o >10% más de 6 meses), o IMC<22kg/m2, o una baja masa muscular (ALMI<7kg/m2 en varones y <5,5kg/m2 en mujeres); y un criterio etiológico (inflamación, reducción de la ingesta o de la asimilación de los nutrientes), en este caso, todos cumplieron el criterio de enfermedad aguda con inflamación4.
Para el diagnóstico de sarcopenia se utilizaron los criterios revisados por EWGSOP210, usando la fuerza de prensión manual, no pudiendo evaluarse el rendimiento físico ni con velocidad de la marcha ni SPPB ni otras pruebas, por ser los pacientes incapaces de caminar en el momento de la evaluación.
Realizamos estimaciones de masa muscular total según variables obtenidas con BIA con la ecuación de Sergi23: TLM (masa muscular total): −3,964+(0,227×RI)+(0,095×peso en kg)+(1,384×género)+(0,064×reactancia). Donde índice de resistencia (RI)=altura2 en cm/resistencia y género: varón 1, mujer 0.
Se realizó la conversión a masa muscular apendicular según el modelo descrito por Kim et al.24, y calculando finalmente el índice de masa muscular apendicular correlacionando lo anterior con la altura al cuadrado: ALM (masa muscular apendicular): TLM/1,19+1,65; ALMI (índice de masa muscular apendicular): ALM/altura2 en m.
Análisis estadísticoLos datos fueron tratados empleando el paquete estadístico SPSS (SPSS para Windows versión 22.0.00, 2013. SPSS INC, Chicago III, EE.UU.). Las variables cuantitativas con distribución normal se describieron como media y desviación estándar (media [DE]), las variables cualitativas como número total y porcentajes (número total [%]). Las pruebas de análisis utilizadas han sido: Test t de Student para comparar medias de variables cuantitativas normales y test Chi-cuadrado para comparar variables cualitativas. En caso de variables cuantitativas no normales se utilizó el test U de Mann-Whitney. El nivel de significación fue fijado convencionalmente en un valor de p de menos de 0,05 (<0,05).
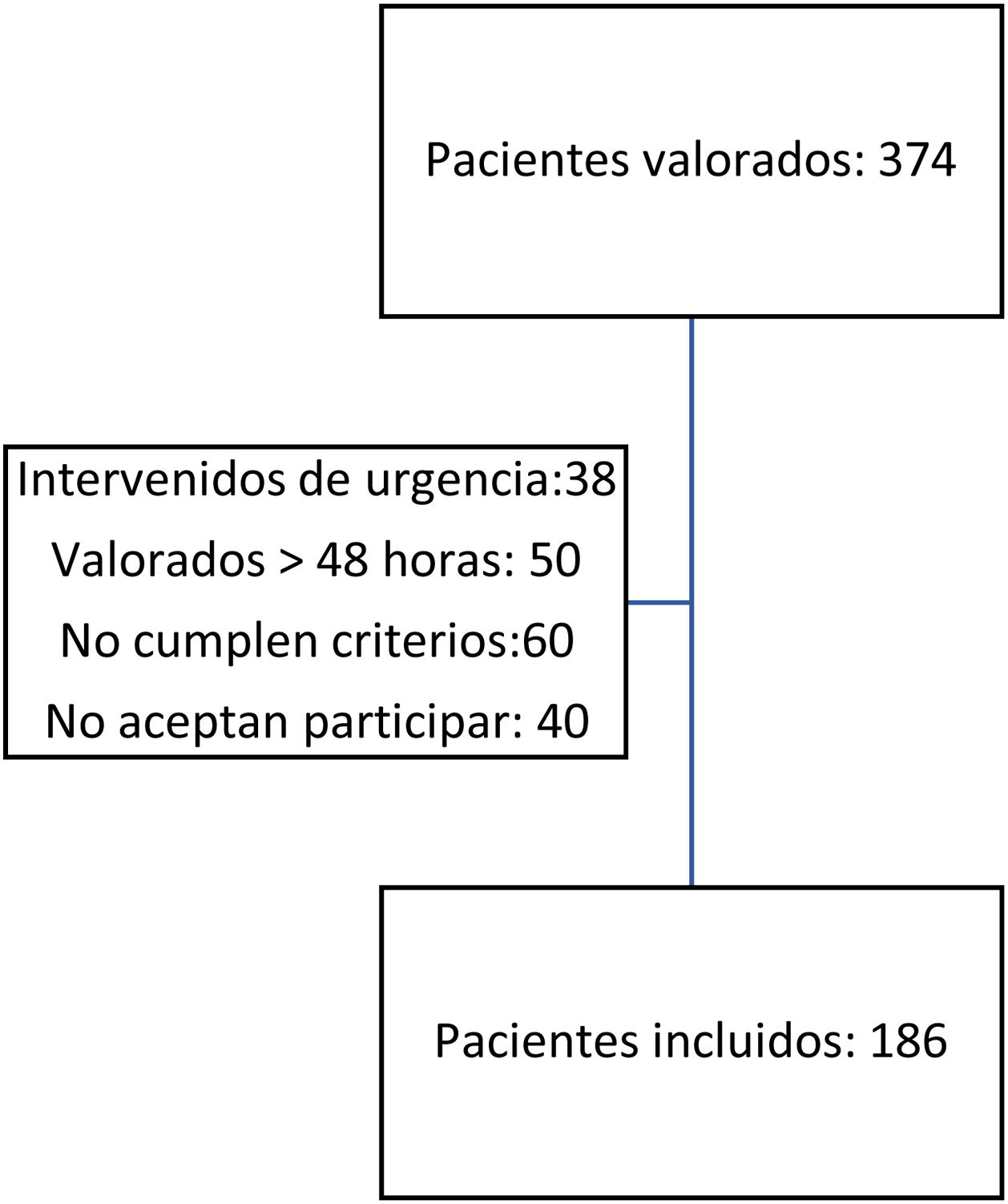
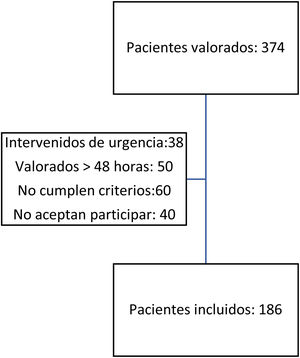
ResultadosDurante el periodo del estudio, 374 pacientes fueron diagnosticados de fractura proximal de fémur por fragilidad, e ingresaron en el Servicio de Traumatología y Cirugía Ortopédica, Unidad de Ortogeriatría.
Se incluyeron en el estudio 186 pacientes (49,73%) del total (fig. 1).
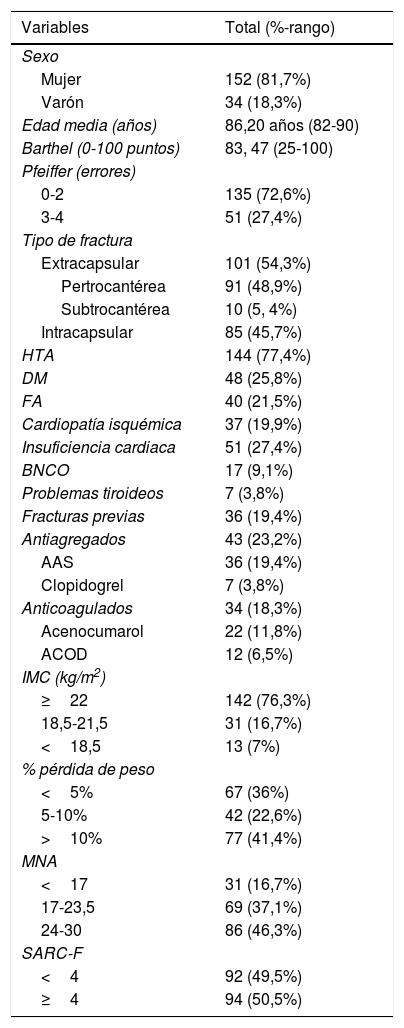
Descripción de la muestraLos datos basales se recogen en las tablas 1 y 2. La mayoría fueron mujeres, con edad media de 86,2 años. El tipo de fractura más frecuente fue la extracapsular.
Datos basales de los pacientes incluidos en el estudio
| Variables | Total (%-rango) |
|---|---|
| Sexo | |
| Mujer | 152 (81,7%) |
| Varón | 34 (18,3%) |
| Edad media (años) | 86,20 años (82-90) |
| Barthel (0-100 puntos) | 83, 47 (25-100) |
| Pfeiffer (errores) | |
| 0-2 | 135 (72,6%) |
| 3-4 | 51 (27,4%) |
| Tipo de fractura | |
| Extracapsular | 101 (54,3%) |
| Pertrocantérea | 91 (48,9%) |
| Subtrocantérea | 10 (5, 4%) |
| Intracapsular | 85 (45,7%) |
| HTA | 144 (77,4%) |
| DM | 48 (25,8%) |
| FA | 40 (21,5%) |
| Cardiopatía isquémica | 37 (19,9%) |
| Insuficiencia cardiaca | 51 (27,4%) |
| BNCO | 17 (9,1%) |
| Problemas tiroideos | 7 (3,8%) |
| Fracturas previas | 36 (19,4%) |
| Antiagregados | 43 (23,2%) |
| AAS | 36 (19,4%) |
| Clopidogrel | 7 (3,8%) |
| Anticoagulados | 34 (18,3%) |
| Acenocumarol | 22 (11,8%) |
| ACOD | 12 (6,5%) |
| IMC (kg/m2) | |
| ≥22 | 142 (76,3%) |
| 18,5-21,5 | 31 (16,7%) |
| <18,5 | 13 (7%) |
| % pérdida de peso | |
| <5% | 67 (36%) |
| 5-10% | 42 (22,6%) |
| >10% | 77 (41,4%) |
| MNA | |
| <17 | 31 (16,7%) |
| 17-23,5 | 69 (37,1%) |
| 24-30 | 86 (46,3%) |
| SARC-F | |
| <4 | 92 (49,5%) |
| ≥4 | 94 (50,5%) |
ACOD: anticoagulantes de acción directa; AAS: ácido acetilsalicílico; BNCO: broncopatía crónica obstructiva; DM: diabetes mellitus; FA: fibrilación auricular; HTA hipertensión arterial; IMC: índice de masa corporal; MNA: MiniNutritional Assessment; SARC-F: strength, assistance walking, rise from a chair, climb stairs, and falls.
Fuerza y masa muscular al ingreso
| Variables | Media (DE) |
|---|---|
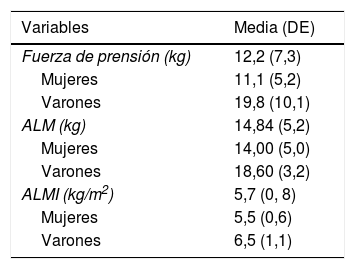
| Fuerza de prensión (kg) | 12,2 (7,3) |
| Mujeres | 11,1 (5,2) |
| Varones | 19,8 (10,1) |
| ALM (kg) | 14,84 (5,2) |
| Mujeres | 14,00 (5,0) |
| Varones | 18,60 (3,2) |
| ALMI (kg/m2) | 5,7 (0, 8) |
| Mujeres | 5,5 (0,6) |
| Varones | 6,5 (1,1) |
ALM: appendicular lean mass; ALMI: appendicular lean mass index; DE: desviación estándar.
El peso fue de 59,8 (12,3)kg, 57,9 (11)kg en mujeres y 68,5 (14,1)kg en varones. La circunferencia de la pantorrilla fue de 29,72 (3,09)cm, en mujeres 29,64 (3,13)cm, en varones 30,06 (2,93)cm. El IMC fue de 23,82 (4,2)kg/m2, 23,81 (4,2)kg/m2 en mujeres, 23,84 (4,1)kg/m2 en varones.
Tras cribado con MNA, en el 16,7% de los pacientes sospechamos desnutrición y un 37,1% estaban en riesgo nutricional.
Cumplían el criterio fenotípico de baja masa muscular (<7kg/m2 en varón y <5,5kg/m2 en mujer) un 76% del total de la muestra (72,4% de las mujeres y 79,6% de los varones). El 21,1% de las mujeres y el 29,4% de los varones habían perdido el 5-10% de peso (22,6% en el global de la muestra) y el 43,4% de mujeres y 32,4% de varones más del 10% (41,4% del total de la muestra). El IMC fue <18,5kg/m2 en el 7% de los casos, y un 16,7% presentaban IMC 18,5-21,5kg/m2. El criterio etiológico común fue el estado inflamatorio por enfermedad aguda.
El 50,5% de nuestros pacientes puntuaban 4 o más en el SARC-F.
Prevalencia de sarcopenia y desnutrición relacionada con la enfermedadSegún fuerza de prensión manual, cumplían criterios de sarcopenia probable un 76,9% (63,4% mujeres y 13,4% varones). Agrupando por el sexo, el 77,6% de las mujeres y el 73,5% de los hombres presentaban una baja fuerza de prensión manual. Finalmente, y midiendo cantidad de músculo, un 76,9% de la muestra tenía baja masa muscular: el 72,4% de las mujeres y el 79,6% de los varones estaban por debajo de los puntos de corte definidos por EWGSOP-2. Un 76,9% del total de la muestra cumplía ambos criterios: fuerza de prensión y cantidad de músculo baja.
Se diagnosticaron de DRE según criterios GLIM: un 72,4% de mujeres y el 79,6% de los varones usando el criterio fenotípico de baja masa muscular (ALMI en este caso), no diferenciando entre forma grave o moderada al no existir en la literatura puntos de corte definidos. Si como criterio fenotípico seleccionamos porcentaje de pérdida de peso, el 43,3% de mujeres y el 32,4% de varones cumplirían criterios de DRE severa (41,4% total) y un 21,1% de mujeres y 29,4% de varones moderada (22,6% global). Sin embargo, con el criterio fenotípico de IMC por debajo de los puntos de corte, solo el 7% del total de la muestra presentaba DRE severa y un 16,7% moderada.
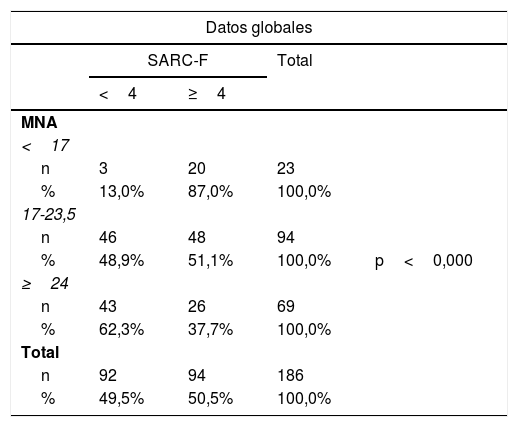
Estadística inferencialSi comparábamos las puntuaciones de cribado con MNA para DRM con la puntuación en SARC-F para cribado de sarcopenia, encontramos significación estadística tanto en el total de la muestra (p<0,001) como por sexos (p=0,008 en mujeres y p=0,005 en varones) (tabla 3).
Comparación de test de cribado de sarcopenia y de DRE
| Datos globales | ||||
|---|---|---|---|---|
| SARC-F | Total | |||
| <4 | ≥4 | |||
| MNA | ||||
| <17 | ||||
| n | 3 | 20 | 23 | |
| % | 13,0% | 87,0% | 100,0% | |
| 17-23,5 | ||||
| n | 46 | 48 | 94 | |
| % | 48,9% | 51,1% | 100,0% | p<0,000 |
| ≥24 | ||||
| n | 43 | 26 | 69 | |
| % | 62,3% | 37,7% | 100,0% | |
| Total | ||||
| n | 92 | 94 | 186 | |
| % | 49,5% | 50,5% | 100,0% | |
| Datos por sexos | ||||
|---|---|---|---|---|
| Sexo | SARC-F | Total | ||
| <4 | ≥4 | |||
| Mujer | ||||
| MNA | ||||
| <17 | ||||
| n | 3 | 15 | 18 | |
| % | 16,7% | 83,3% | 100,0% | |
| 17-23,5 | ||||
| n | 37 | 41 | 78 | |
| % | 47,4% | 52,6% | 100,0% | p=0,008 |
| ≥24 | ||||
| n | 33 | 23 | 56 | |
| % | 58,9% | 41,1% | 100,0% | |
| Total | ||||
| n | 73 | 79 | 152 | |
| % | 48,0% | 52,0% | 100,0% | |
| Hombre | ||||
| MNA | ||||
| <17 | ||||
| n | 0 | 5 | 5 | |
| % | 0,0% | 100,0% | 100,0% | |
| 17-23,5 | ||||
| n | 9 | 7 | 16 | |
| % | 56,3% | 43,8% | 100,0% | |
| ≥24 | ||||
| n | 10 | 3 | 13 | p=0,005 |
| % | 76,9% | 23,1% | 100,0% | |
| Total | ||||
| n | 19 | 15 | 34 | |
| % | 55,9% | 44,1% | 100,0% | |
DRE: desnutrición relacionada con la enfermedad; MNA: Mini-Nutritional Assessment; SARC-F: strength, assistance walking, rise from a chair, climb stairs, and falls.
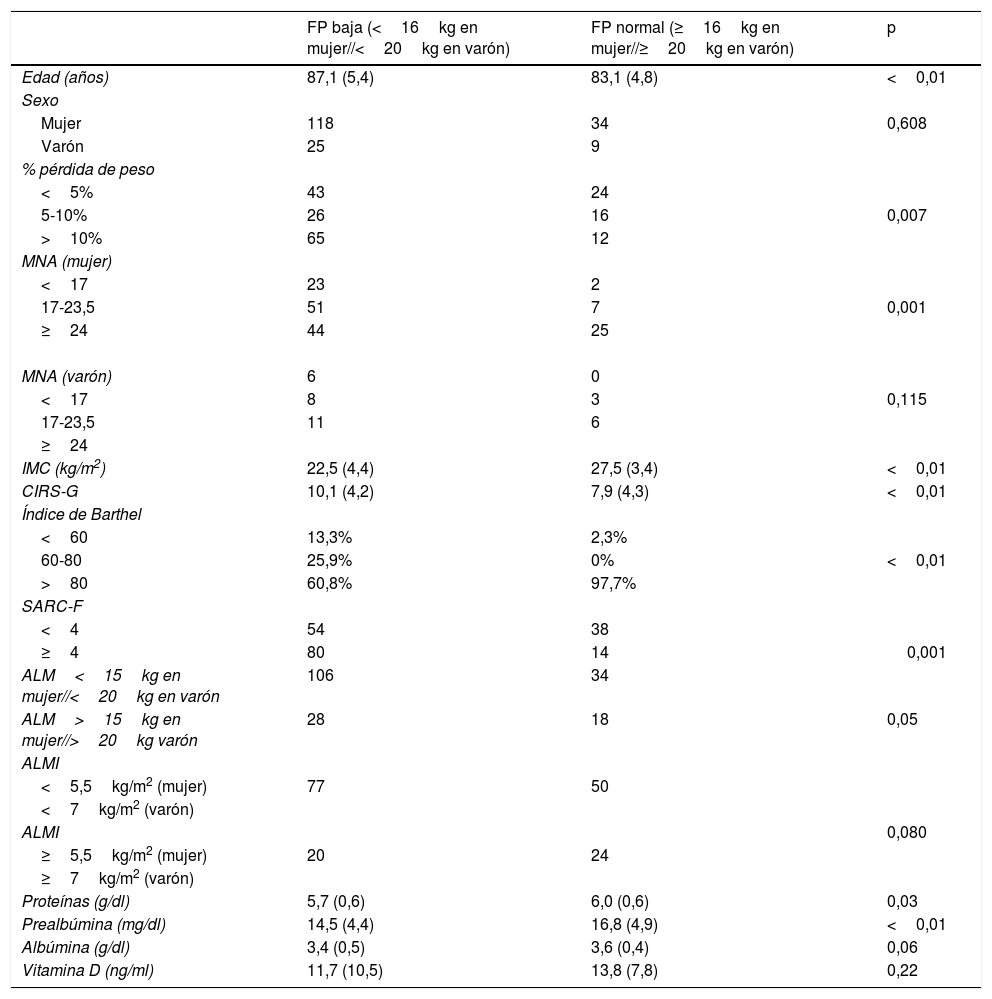
Se comparó la puntuación en SARC-F con la fuerza de prensión encontrando una relación estadísticamente significativa (p<0,001) (tabla 4).
Diferencias entre los grupos según fuerza de prensión en el momento del ingreso
| FP baja (<16kg en mujer//<20kg en varón) | FP normal (≥16kg en mujer//≥20kg en varón) | p | |
|---|---|---|---|
| Edad (años) | 87,1 (5,4) | 83,1 (4,8) | <0,01 |
| Sexo | |||
| Mujer | 118 | 34 | 0,608 |
| Varón | 25 | 9 | |
| % pérdida de peso | |||
| <5% | 43 | 24 | |
| 5-10% | 26 | 16 | 0,007 |
| >10% | 65 | 12 | |
| MNA (mujer) | |||
| <17 | 23 | 2 | |
| 17-23,5 | 51 | 7 | 0,001 |
| ≥24 | 44 | 25 | |
| MNA (varón) | 6 | 0 | |
| <17 | 8 | 3 | 0,115 |
| 17-23,5 | 11 | 6 | |
| ≥24 | |||
| IMC (kg/m2) | 22,5 (4,4) | 27,5 (3,4) | <0,01 |
| CIRS-G | 10,1 (4,2) | 7,9 (4,3) | <0,01 |
| Índice de Barthel | |||
| <60 | 13,3% | 2,3% | |
| 60-80 | 25,9% | 0% | <0,01 |
| >80 | 60,8% | 97,7% | |
| SARC-F | |||
| <4 | 54 | 38 | |
| ≥4 | 80 | 14 | 0,001 |
| ALM<15kg en mujer//<20kg en varón | 106 | 34 | |
| ALM>15kg en mujer//>20kg varón | 28 | 18 | 0,05 |
| ALMI | |||
| <5,5kg/m2 (mujer) | 77 | 50 | |
| <7kg/m2 (varón) | |||
| ALMI | 0,080 | ||
| ≥5,5kg/m2 (mujer) | 20 | 24 | |
| ≥7kg/m2 (varón) | |||
| Proteínas (g/dl) | 5,7 (0,6) | 6,0 (0,6) | 0,03 |
| Prealbúmina (mg/dl) | 14,5 (4,4) | 16,8 (4,9) | <0,01 |
| Albúmina (g/dl) | 3,4 (0,5) | 3,6 (0,4) | 0,06 |
| Vitamina D (ng/ml) | 11,7 (10,5) | 13,8 (7,8) | 0,22 |
ALM: appendicular lean mass; ALMI: appendicular lean mass index; CIRS-G: Cumulative Illness Rating-Scale Geriatric; FP: fuerza de prensión manual; IMC: índice de masa corporal; MNA: Mini-Nutritional Assessment; SARC-F: strength, assistance walking, rise from a chair, climb stairs and falls.
Al realizar la correlación entre cribado nutricional por MNA y fuerza de prensión, se encontró significación estadística en mujeres (p=0,001), no así en varones (p=0,115) (tabla 4). Del mismo modo, la comparación entre puntuación en MNA y ALMI fue estadísticamente significativa en mujeres (p<0,00), y no en varones (p=0,393) (tabla 5).
Relación entre cribado nutricional y masa muscular
| ALMI<7kg/m2 en varones o <5,5kg/m2 en mujeres | ALMI≥7kg/m2 en varones o ≥5,5kg/m2 en mujeres | p | |
|---|---|---|---|
| MNA (mujer) | |||
| <17 | 21 | 4 | |
| 17-23,5 | 25 | 33 | <0,00 |
| ≥24 | 25 | 44 | |
| MNA (varón) | |||
| <17 | 5 | 1 | |
| 17-23,5 | 10 | 1 | 0,393 |
| ≥24 | 12 | 5 | |
| IMC (kg/m2) (media) | 22,5 | 27,5 | <0,000 |
ALMI: appendicular lean mass index; IMC: índice de masa corporal; MNA: Mini-Nutritional Assessment.
Las diferencias entre los pacientes con sarcopenia probable o no según la fuerza de prensión que resultaron significativas fueron: la edad (87,13 [5,43] años vs. 83,14 [4,82] años, p<0,001), la carga de enfermedad medida por CIRS-G (10,06 [4,19] vs. 7,91 [4,26], p=0,004), la dependencia funcional medida con el índice de Barthel (p<0,001), los niveles medios de proteínas totales (5,73 [0,64]g/dl vs. 5,98 [0,63]g/dl, p=0,029) y los niveles medios de prealbúmina (14,55 [4,37]mg/dl vs. 16,76 [4,89]mg/dl, p=0,005) (tabla 4).
Entre los pacientes con sarcopenia y sin sarcopenia según índice de masa muscular apendicular se encontraron diferencias significativas(p<0,001) en el IMC (22,5 [3,24] vs. 27,5 [4,4]) (tabla 5).
La relación entre pérdida de peso y baja fuerza de prensión manual también resultó estadísticamente significativa (p=0,007) (tabla 3).
Otros datosLa demora quirúrgica fue de 58,93 (42) horas, interviniéndose en las primeras 48h el 49,9% de los pacientes. La estancia global fue de 7,05 (4,03) días.
El Barthel al ingreso fue de 83,47 (20,70) puntos (mediana 95). En el momento del alta el Barthel fue de 53,06 (20,64) (mediana 60). Esta situación supuso una pérdida de 30,41 puntos (pérdida funcional del 36,43%).
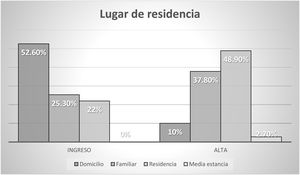
Previamente a la fractura, deambulaban sin ayuda o con una ayuda técnica tanto fuera como dentro del domicilio el 74,4% de los pacientes y un 16,6% lo hacía solo en domicilio.
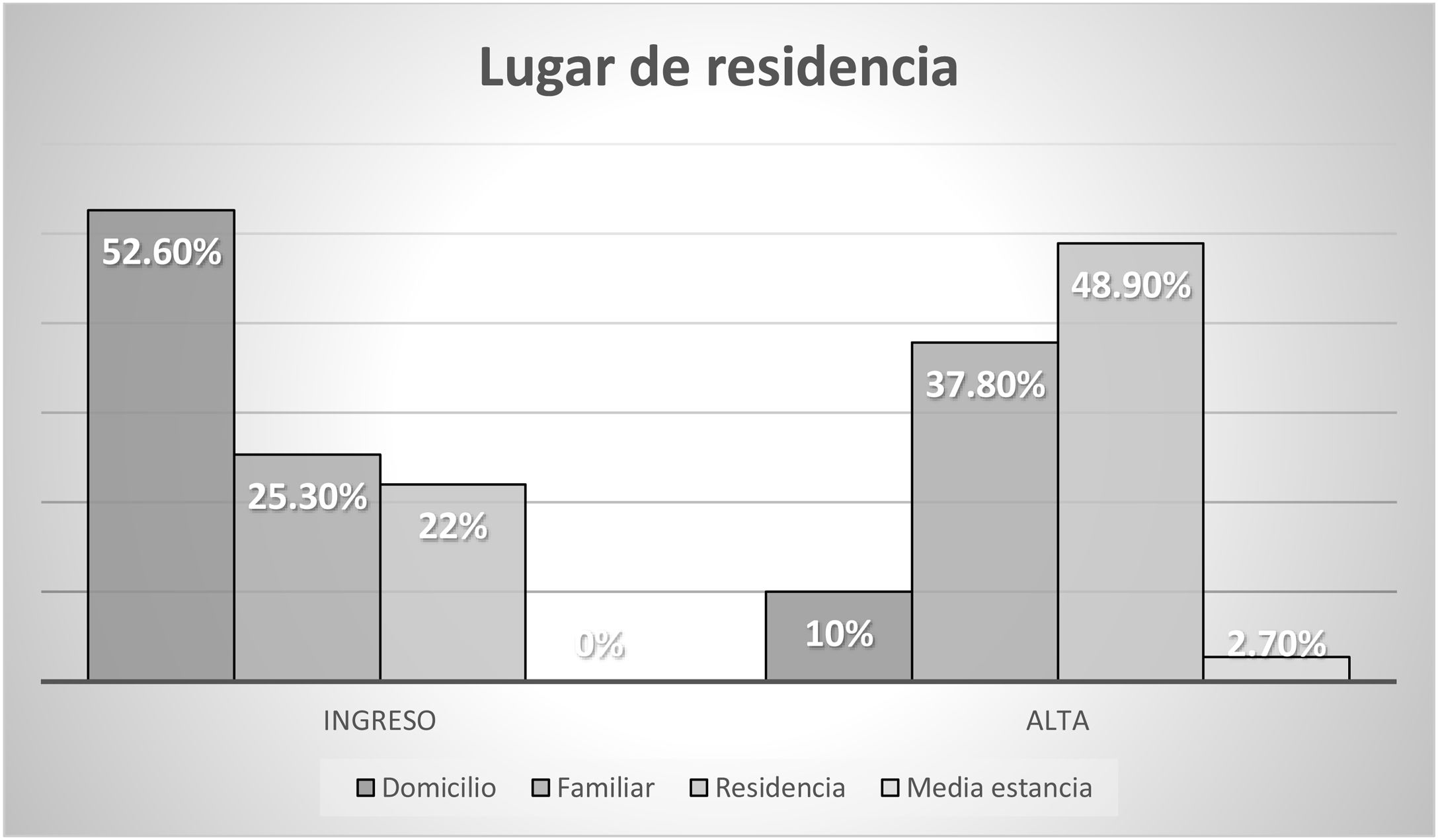
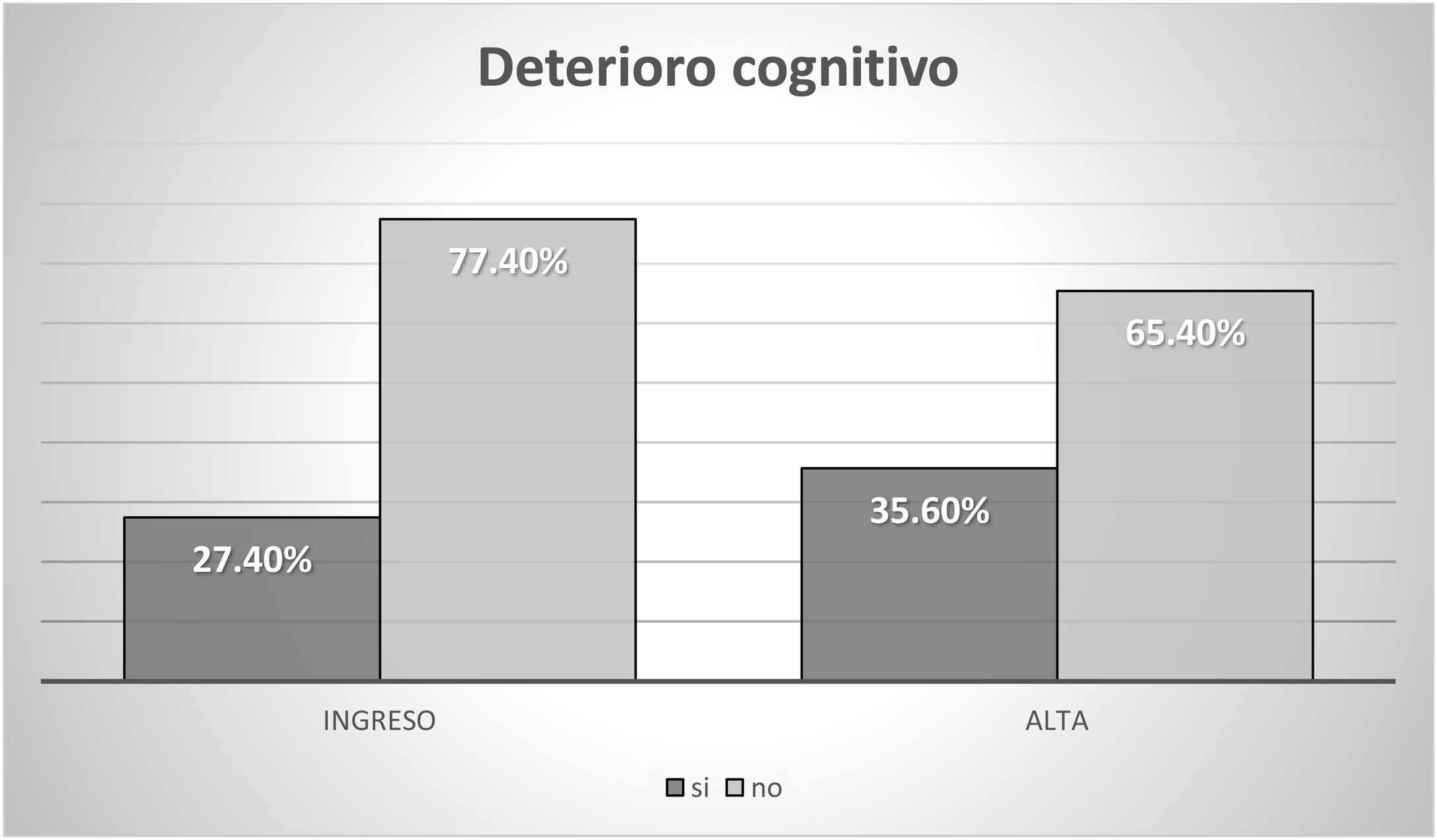
La situación sociofamiliar y cognitiva se recoge en las figuras 2 y 3.
La comorbilidad más frecuente fue la hipertensión arterial (HTA). Un 19,4% de los pacientes habían sufrido alguna fractura previa, a pesar de lo cual ninguno estaba recibiendo tratamiento osteoprotector con antirreabsortivos ni osteoformadores, ni tomaba tratamiento con suplementos de vitamina D y/o calcio.
Las complicaciones más frecuentes durante el ingreso fueron: síndrome confusional agudo (44,1%), infección de orina (9,7%) y retención aguda de orina (8,6%).
La alteración analítica más frecuente fue el déficit de vitamina D con hiperparatiroidismo secundario. Un 85,5% del total de la muestra tenía niveles <20ng/ml de vitamina D, y en un 57% eran menores de 10ng/ml. En nuestro centro se consideran niveles <10ng/ml como déficit severo y entre 10-20ng/ml por debajo del rango óptimo de vitamina D. Los niveles medios de PTH fueron 71,63 (42,93)pg/ml (rango de normalidad en nuestro centro 15-65pg/ml).
DiscusiónLa prevalencia de DRE en pacientes con fractura de cadera fue del 76,9%, si utilizábamos el criterio fenotípico de baja masa muscular y algo menor si utilizábamos la pérdida de peso. No obstante, en ambos casos, esta prevalencia fue mayor que la que se describe en pacientes hospitalizados por otras causas. Según un estudio publicado en 2008 en pacientes ingresados por otros motivos, esta era del 20-50%25, aunque Norman et al. basaron su afirmación en una revisión de estudios entre 1991 y 2006 con criterios diversos. La prevalencia no era del todo comparable entre los diferentes estudios dado que aún no se habían publicado los criterios GLIM. Posteriormente, y usando los criterios GLIM, Bellanti et al.26 encontraron una prevalencia del 46% de DRE, menor que la encontrada en el estudio realizado en pacientes con fractura de cadera. Esto apoyaría la hipótesis de que desnutrición y sarcopenia son causa de caídas y fracturas27,28, y por lo tanto su prevalencia es mayor en estos pacientes que en los que ingresan por otras causas.
En nuestro estudio, usando el criterio fenotípico de baja masa muscular todos los pacientes con sarcopenia tenían DRE y a la inversa. Los criterios GLIM y EWGSOP2 para diagnóstico de DRE y sarcopenia comparten el criterio de baja masa muscular, y, por lo tanto, en estos pacientes todos con enfermedad aguda, diagnosticar uno de los síndromes geriátricos, automáticamente llevaba al diagnóstico del otro. Un 64% de la muestra había perdido más del 5% de peso. Quizá la mayor pérdida de masa magra, frente a grasa, explicaría que el diagnóstico de DRE sea más probable si usamos los valores de ALMI.
En el estudio realizado se encontró una muy alta prevalencia de sarcopenia, superior a la de estudios previos en hospitales españoles. González-Montalvo et al., en 2015, encontraron una prevalencia del 17,1% (12,4% en varones y 18,3% en mujeres) en una población de pacientes con fractura de cadera comparable (79,3% de la muestra fueron mujeres, edad media 85,3 años) del Hospital La Paz (Madrid)29. También Sánchez-Castellano et al. en 2019 publicaron una prevalencia inferior, 11,5% (10,3% en mujeres y 16,1% en varones) en el Hospital Ramón y Cajal (Madrid) (edad media 87,6 años, 78,7% mujeres)30.
Por otra parte, un estudio en población asiática con fractura de cadera14 halló una prevalencia de sarcopenia del 73,6% en varones y 67,7% en mujeres, cifras más próximas a nuestros hallazgos. Ellos incluyeron a mayores de 60 años, aunque la edad media fue de 81,85 años, y aplicaron los criterios recomendados por el grupo de trabajo asiático en sarcopenia (AWGS), donde los puntos de corte para el índice de masa apendicular son 7kg/m2 en varones y 5,4kg/m2 en las mujeres31, similares a los que se definen en los criterios EWGSOP2 revisados de 201910.
Un estudio observacional en la Universidad de Melbourne publicado en 2019 encontró una prevalencia de sarcopenia diferente en función de los criterios que se aplicasen8,31,32: mayores de 70 años, edad media de 79,7 años, en varones entre 12-75,9%, y en mujeres entre 3,1-75,3%33, pero usaron unos puntos de corte para el índice de masa muscular apendicular diferentes a los definidos en los criterios EWGSOP de 2019 usados en nuestro estudio10. Los criterios más similares serían los del IWGS (Grupo Internacional de estudio de la sarcopenia) de 2011 (ALMI<7,23kg/m2 en varón y <5,67kg/m2 en mujer)32, en los cuales la prevalencia de sarcopenia en varones sería del 44,3% y en mujeres del 24,5%, cifras también menores que las obtenidas en nuestro estudio.
Las características basales de los pacientes con y sin sarcopenia fueron similares salvo el IMC, resultado similar al encontrado por Sánchez-Castellano et al. y González-Montalvo et al. en sus estudios29,30.
En este estudio solo se encontraron diferencias significativas entre el IMC, la situación funcional medida por el índice de Barthel, la carga de enfermedad según el CIRS-G, la edad y los niveles de proteínas totales y prealbúmina en la analítica al ingreso, entre los pacientes con sarcopenia probable o no según fuerza de prensión. Sánchez-Castellano et al.30 encontraron diferencias significativas también tanto en la situación funcional medida por Barthel como en la movilidad previa media por FAC (Functional Ambulatory Categories); esta última no se analizó entre nuestros pacientes. Tampoco se encontraron diferencias significativas según el tipo de fractura, a diferencia del estudio en el Hospital Ramon y Cajal de Madrid30 donde los pacientes con fractura pertrocantérea tenían una fuerza de prensión manual menor.
Dada la importancia que se está dando al papel de la vitamina D en esta área de conocimiento34,35, llama la atención la no existencia de diferencias en los niveles de esta entre ambos grupos. Quizá la ausencia de diferencias se relacione con la alta tasa de déficit de esta vitamina existente. Más del 85% de la muestra tenía niveles inferiores a 20ng/ml. Y un 57%, menores de 10ng/ml.
Se encontró relación entre el cribado de malnutrición usando el MNA con la disminución de fuerza de prensión y con el bajo índice de masa muscular apendicular, solo en mujeres. Esto podría deberse a que el número de varones incluidos en el estudio fue muy bajo (34 pacientes). Cabría esperar por la evidencia existente que las diferencias entre pacientes con y sin sarcopenia fueran mayores. Esto podría justificarse por el hecho de que los propios factores de riesgo que favorecen las caídas sean más relevantes que la propia sarcopenia.
Este estudio permite aportar evidencia sobre la incidencia en España de DRE y de un síndrome como la sarcopenia, tan importante sobre el desarrollo y la evolución de las fracturas por fragilidad. Así mismo, pone en relación DRE y sarcopenia en estos pacientes, la comparación entre los test de cribado usados para el diagnóstico de uno u otro proceso resultó significativa. En la literatura se encuentran pocas publicaciones que relacionen DRE y sarcopenia. En una de ellas Meyer y Valentini36 revisaron los estudios previos donde se demostraba que la presencia tanto de sarcopenia como de DRE se asociaba con peores resultados, más complicaciones y aumento de mortalidad en diferentes procesos. En muchos pacientes se presentan ambas patologías en paralelo, por lo que se ha propuesto un nuevo síndrome clínico: «malnutrition-sarcopenia síndrome» (MSS). Cabría preguntarse si es suficiente realizar un cribado de una para automáticamente diagnosticar la otra, o cuál es más importante. Si se comparan las diferencias y similitudes en los test de cribado (MNA/SARC-F) y sus criterios diagnósticos (GLIM y EWGOPS2), la DRE compartiría con la sarcopenia el criterio de baja masa muscular. En esta revisión se propuso, por lo tanto, que, aunque no existen recomendaciones oficiales, parece razonable realizar cribado nutricional y pasar a valorar sarcopenia cuando existan signos de baja fuerza (dinapenia) o de baja masa muscular. En el caso de la fractura de cadera cabría plantearse, tras los resultados de este estudio, que ambas van en paralelo.
En 2021, Ballesteros-Pomar et al. publicaron un estudio sobre DRE y sarcopenia en pacientes ingresados en un Servicio de Medicina Interna, en un hospital español37. Las diferencias con este estudio en fractura de cadera radican en que usan para cribado de riesgo nutricional el MUST (Malnutritional Universal Screening Tool). Para la valoración funcional eligen el índice de Katz, menos sensible a los cambios y en la detección de dependencia leve y necesidad de apoyo que el índice de Barthel, y para la comorbilidad el índice de Charlson. En común con este estudio, el cribado de sarcopenia se hace con SARC-F, siguiendo recomendaciones de EWGSOP2, el diagnóstico de DRE y sarcopenia se hacen con los mismos criterios (GLIM y EWGSOP). Sus objetivos fueron: conocer la prevalencia y el impacto de la hospitalización en la cantidad de masa muscular y en la fuerza y cómo influía en la evolución de los pacientes (muerte, estancia hospitalaria, readmisión a los 3 meses y calidad de vida), variables que no han sido analizadas en este estudio. Son sujetos de edad media menor (75,4 años en el global de la muestra) que los pacientes con fractura de cadera por fragilidad, de un servicio médico, frente a uno quirúrgico. Se encontró también una alta prevalencia de sarcopenia (33% al ingreso) y DRE (27,5% según criterios GLIM) y de ambas combinadas (10,5%). Al igual que en la revisión de Meyer, se observaron peores resultados (mayor mortalidad, readmisión y peor calidad de vida), que se asociaron con una baja fuerza de prensión manual. Sin embargo, no se objetivó esta relación con la cantidad de músculo, lo que apoyaría la importancia del concepto de dinapenia6. Por otra parte, evidenciaron que los pacientes sarcopénicos son más mayores y con mayor comorbilidad (carga de enfermedad), tal como sucede en nuestra muestra. Aunque la prevalencia es alta, sigue siendo inferior a la que encontramos en los pacientes con fractura de cadera, lo que reforzaría que podamos hablar de osteosarcopenia.
Llama la atención el que, a pesar de un 19% de pacientes con fracturas por fragilidad previa, a ninguno se le hubiese prescrito tratamiento con vitamina D con o sin calcio asociado, ni tratamiento antirresortivo ni osteoformador. A raíz de este estudio, creemos que es necesario reforzar la detección de osteoporosis en Atención Primaria y fomentar la creación de unidades de fracturas (Fracture Liason Services [FLS]), donde se valore a todos los pacientes que sufren una primera fractura osteoporótica: de muñeca, aplastamiento vertebral y de húmero fundamentalmente, pero cualquier fractura por traumatismo de baja energía sería subsidiaria de valoración y tratamiento si procede.
Los hallazgos de este trabajo refuerzan la importancia de incluir, en la valoración integral de todos los pacientes ingresados tras una fractura de cadera por fragilidad, el cribado nutricional y de sarcopenia, así como el establecer protocolos de tratamiento de estos dos síndromes y de osteoporosis.
A raíz de estos resultados, en nuestro centro, a todos los pacientes con fractura de cadera se les realiza cribado mediante MNA y SARC-F y se les mide la fuerza de prensión manual, estableciéndose un plan de cuidados individualizado durante el ingreso y al alta. Así mismo, hemos comenzado a tratar más y mejor la osteoporosis, a concienciar de la importancia de la primera fractura y de la valoración de la salud ósea de estos pacientes, para iniciar tratamientos y prevenir la aparición de nuevas fracturas por fragilidad.
Entre las fortalezas de estudio cabe destacar el tamaño muestral y las variables recogidas en un grupo de pacientes que, habitualmente, no son estudiados tan profundamente desde un punto de vista nutricional durante el ingreso. Aunque no formaba parte de los objetivos del estudio, es importante destacar una baja estancia media (7,05 días) y una demora quirúrgica (58,93h) menor que la publicada en el RNFC (Registro Nacional de Fracturas de Cadera) (9,8 días/64,6h, respectivamente), así como un número algo mayor de pacientes (49,9% frente a 48,1%) intervenidos en las primeras 48h38.
Las principales limitaciones del estudio fueron la no medición de la función física, por la especial situación de nuestros pacientes, solo contamos con la fuerza de prensión manual. Esta variable (medida por SPPB, test up and go…), según los criterios EWGSOP 2019, marca el grado de gravedad, y podría ser también una causa de ausencia de diferencias en alguno de los puntos. De este modo, a diferencia de DRE, en la sarcopenia no pudimos establecer los diferentes grados de severidad. Creemos, además, tras la revisión de las publicaciones previas, que habría sido más correcto hablar de dinapenia que de sarcopenia, aunque al tratarse de pacientes con limitaciones agudas de movilidad, la valoración funcional en el momento del ingreso está muy limitada. La realización de la escala de Barthel al alta nos permitía conocer la pérdida funcional aguda que supone fracturarse la cadera aun después de ser sometido a cirugía reparadora. Y, el hecho de conocer la puntuación de la escala de Barthel cuando el paciente abandonaba el hospital nos permitía valorar en la revisión al mes en la consulta de Ortogeriatría la recuperación funcional en este periodo.
Serían necesarios más estudios para conocer la relación entre DRE en este tipo de paciente y sarcopenia, o quizá mejor, hablar de dinapenia en el futuro, así como la influencia que estos dos síndromes geriátricos tienen en la recuperación funcional de los pacientes que sufren una fractura de cadera.
Se evidencia, además, la necesidad de detectar y tratar la osteoporosis, sobre todo, tras una primera fractura por fragilidad.
ConclusionesLa prevalencia de DRE y sarcopenia en los pacientes fue muy elevada, mayor de lo previamente publicado en otros estudios. La DRE afectó a más del 75% de la muestra si teníamos en cuenta la baja masa muscular, y hasta tres cuartas partes de los pacientes son diagnosticados de sarcopenia, presentándose ambos de forma paralela. Esto corrobora la importancia de estos dos síndromes en el paciente con fractura por fragilidad.
Los pacientes más mayores, con mayor dependencia funcional, más carga de enfermedad y un índice de masa corporal menor tienen una mayor tendencia a tener una peor función muscular medida por fuerza de prensión manual (dinapenia), mientras que la pérdida de cantidad de músculo solo se asocia con el índice de masa corporal. Esto apoyaría que es más importante la calidad (dinapenia) que la cantidad de músculo en los pacientes con fractura de cadera.
Consideraciones éticasLa investigación se ha llevado a cabo de conformidad con el Código de ética de la Asociación Médica Mundial (Declaración de Helsinki) y ha sido aprobado por el Comité Ético de Investigación Clínica del Hospital Clínico de Valladolid (PI 17-653).
FinanciaciónNo se recibió ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.