La hipoglucemia hiperinsulinémica posprandial es una complicación frecuente de la cirugía bariátrica. Aunque en general tiene una evolución leve y autolimitada, puede cursar con neuroglucopenia y comprometer la seguridad y la calidad de vida del paciente. El objetivo de este documento es ofrecer unas recomendaciones para facilitar la atención clínica a estos pacientes complejos, revisando la etiopatogenia, su diagnóstico y tratamiento que, de manera secuencial, incluirá medidas dietéticas, farmacológicas y cirugía en casos refractarios. Ante la ausencia de estudios de alta calidad, el abordaje diagnóstico y terapéutico propuesto se basa en el consenso de expertos del Grupo de Obesidad de la Sociedad Española de Endocrinología y Nutrición, GOSEEN. Las personas sometidas a cirugía bariátrica deben ser informadas de la posibilidad de desarrollar esta complicación.
Postprandial hyperinsulinaemic hypoglycaemia is a common complication of bariatric surgery. Although in general its evolution is mild and self-limited, it can lead to neuroglycopaenia and compromise the patient's safety and quality of life. The aim of this document is to offer some recommendations to facilitate the clinical care of these complex patients, reviewing the aetiopathogenesis, its diagnosis and treatment that, sequentially, will include dietary and pharmacological measures and surgery in refractory cases. In the absence of high-quality studies, the diagnostic and therapeutic approach proposed is based on the consensus of experts of the Grupo de Obesidad de la Sociedad Española de Endocrinología y Nutrición [Obesity Group of the Spanish Society of Endocrinology and Nutrition], GOSEEN. Those undergoing bariatric surgery should be informed of the possibility of developing this complication.
La hipoglucemia posprandial es una complicación de la cirugía bariátrica (CB) de etiología no del todo conocida y cuyo diagnóstico y abordaje terapéutico supone un reto, especialmente en los casos más graves. Descrito inicialmente como síndrome dedumpingtardío, haciendo referencia al vaciamiento gástrico acelerado, uno de los mecanismos patogénicos descritos, hoy en día se prefiere el término hipoglucemia hiperinsulinémica posprandial (HHP), si bien algunos autores incluyen bajo este epígrafe únicamente los casos más graves. Su prevalencia en diferentes series varía en función del tipo de técnica quirúrgica, la gravedad y la herramienta diagnóstica. En general, aparecen con mayor frecuencia tras técnicas que excluyen el píloro, como el bypass gástrico (BPG)1. En un estudio basado en un registro nacional sueco se observó un riesgo de ingreso hospitalario por hipoglucemia grave o subrogados (epilepsia, confusión, síncope) en personas con antecedente de BPG del 0,2%2, siendo la prevalencia del 0,47% en el registro español multicéntrico del Grupo de Obesidad de la Sociedad Española de Endocrinología y Nutrición, GOSEEN3. Sin embargo, si se incluyen hipoglucemias menos graves autorreferidas, la prevalencia es más variable: entre el 0,1% tras BPG y 0,02% tras gastrectomía vertical (GV)1, a un 30%4 y hasta un 75% si se utiliza la monitorización continua de glucosa (MCG)5.
En este trabajo revisamos la etiopatogenia, los métodos diagnósticos y el tratamiento nutricional, farmacológico y quirúrgico de las hipoglucemias posprandiales tras CB. GOSEEN ha consensuado estas recomendaciones como grupo de expertos.
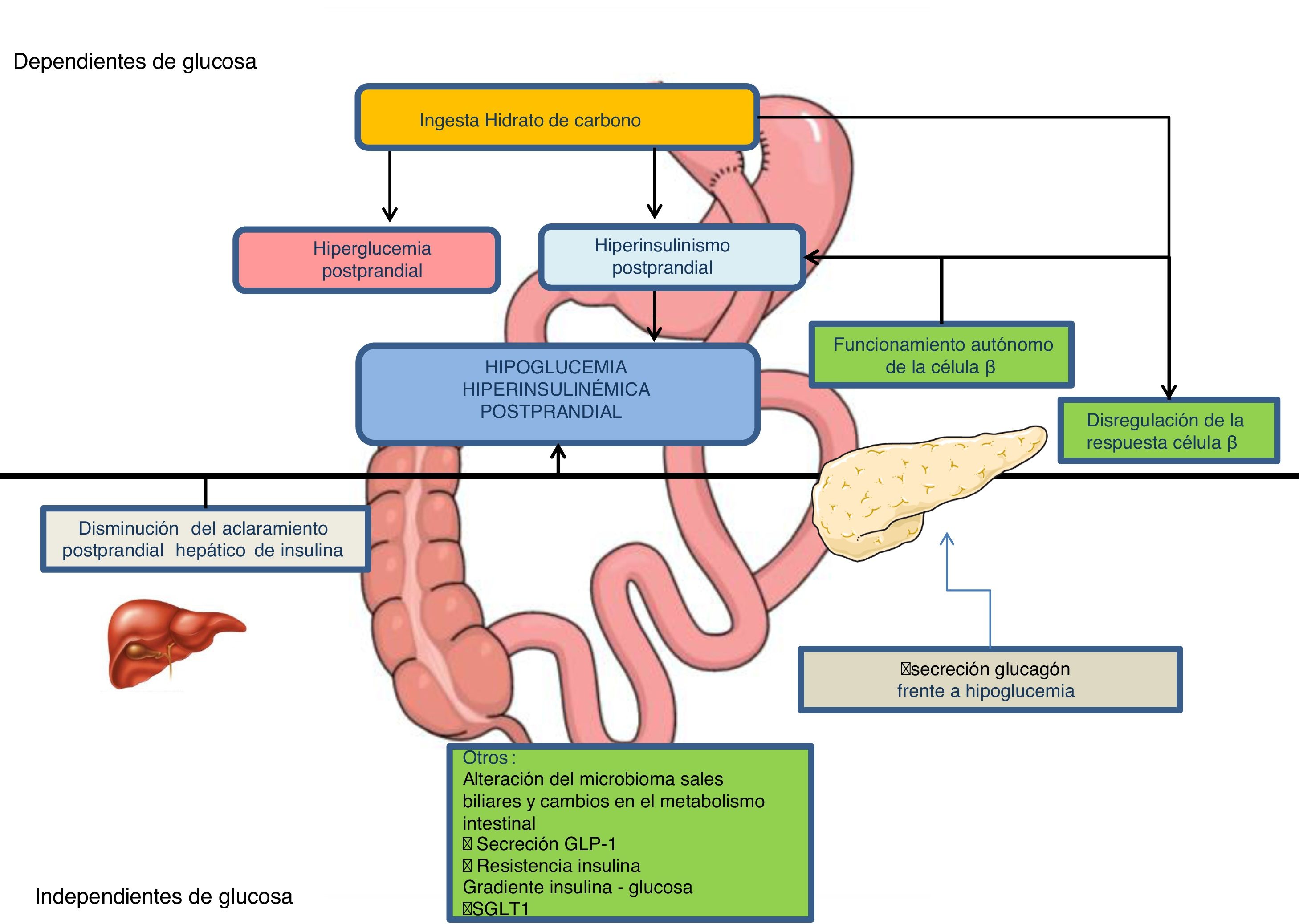
Mecanismos fisiopatológicosLa cirugía gastrointestinal produce alteraciones en la regulación del metabolismo hidrocarbonado, creando unas condiciones que favorecen la HHP6,7entre las que destacan (fig. 1):
En el BPG, el paso de nutrientes al yeyuno se acelera hasta 100 veces y existe una hipertrofia de la mucosa intestinal que favorece una absorción más rápida de la glucosa. El vaciado gástrico también está acelerado tras GV6,7.
Hiperinsulinemia posprandialTras el BPG se ha descrito una menor supresión de la secreción de insulina frente a la hipoglucemia y una mayor sensibilidad de las células β al aumento de la glucemia7, mediada tanto por factores hormonales intestinales (aumento de la secreción de GLP-1)8,9 como por factores no hormonales6–8 (elevación posprandial de ácidos biliares no conjugados)7, que se acompañará de un pico de insulinemia posprandial más temprano e intenso7,8. Una de las primeras hipótesis propuestas fue el aumento de la masa de células β pancreáticas con nesidioblastosis, como resultado de la exagerada secreción de GLP-110. Sin embargo, no se ha demostrado en los pacientes afectos una mayor masa de células β, ni de concentración de receptores de GLP-1 a nivel pancreático, ni una mayor sensibilidad de la célula β pancreática a GLP-17,10,11. Los pacientes con hipoglucemia tras BPG presentan además una disminución del 30% en el aclaramiento de insulina posprandial, fundamentalmente hepático10.
Respuesta alterada del glucagón frente a la hipoglucemiaMecanismo que perpetuaría la hipoglucemia una vez instaurada7,9.
Otros mecanismosIncluyen, entre otros, cambios en la microbiota intestinal, en el gradiente de glucosa e insulina del eje porto-sistémico, en la acción de GLP-1 sobre los aferentes vagales, disminución de la producción endógena de glucosa12, aumento de sales biliares y aumento en la absorción intestinal de glucosa por incremento en la expresión del cotransportador de sodio-glucosa de tipo 1 (SGLT1)7,13–15.
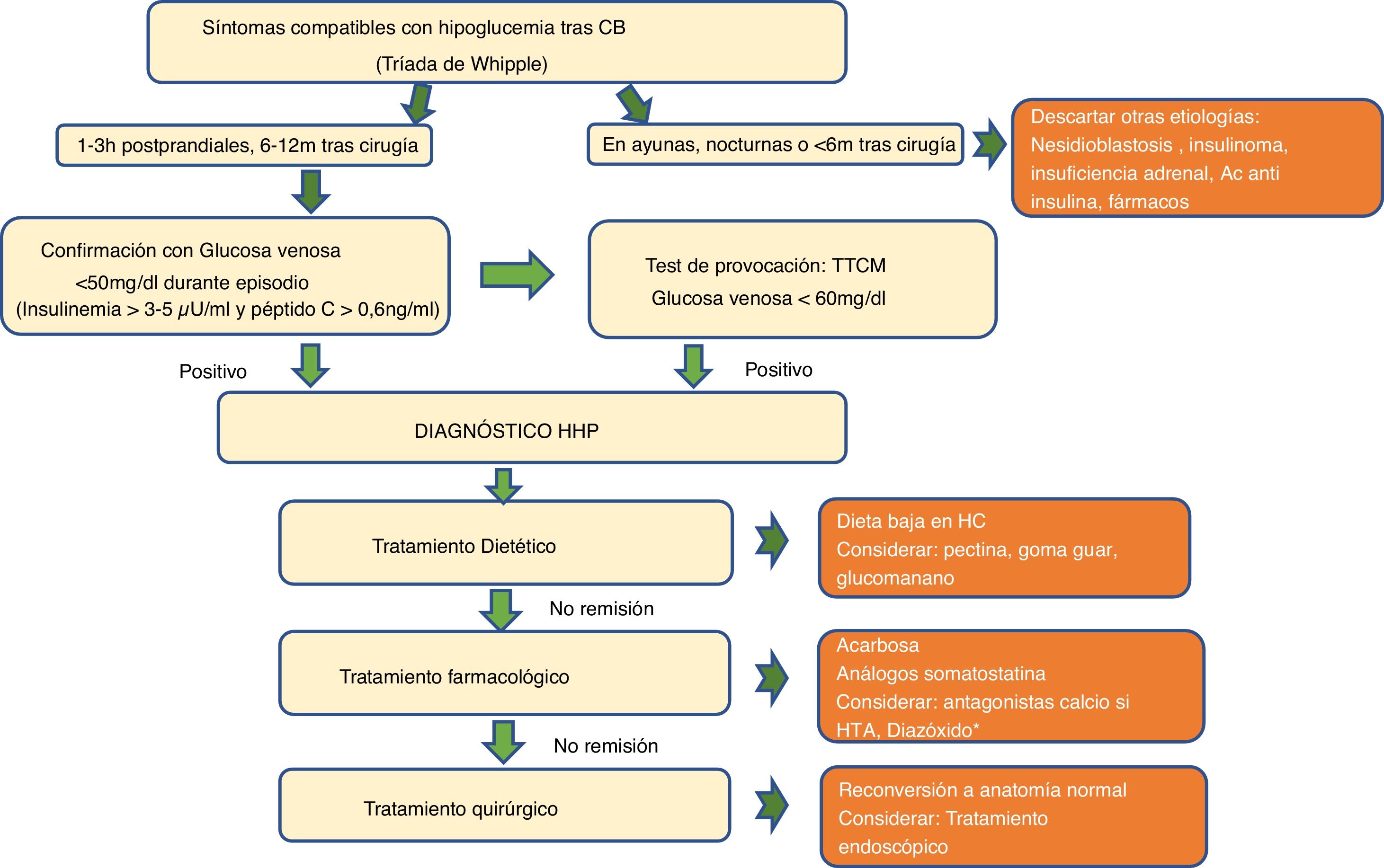
Definición y evaluación clínicaActualmente no existe consenso sobre la concentración plasmática de glucosa que define la hipoglucemia poscirugía bariátrica. Aunque algunos autores asumen la definición de la ADA (≤70mg/dl), GOSEEN como grupo de expertos, así como la mayoría de autores, está de acuerdo con utilizar umbrales inferiores a 60mg/dl o 3,3mmol/L especialmente tras pruebas de provocación o inferiores a 50mg/dl o 2,8mmol/L cuando es espontánea6,16–19.
La HHP se diagnostica cuando coexiste una glucemia posprandial baja (<50-60mg/dl), junto con una insulinemia inapropiadamente elevada (>3-5μU/ml), péptido C>0,6ng/ml), con signos y síntomas compatibles con hipoglucemia que mejoran tras su corrección (tríada de Whipple)10,20. La hipoglucemia origina síntomas adrenérgicos (palpitaciones, taquicardia, ansiedad, temblor), colinérgicos (sudoración, calor, náuseas, sensación de hambre) y, con menor frecuencia, síntomas de neuroglucopenia (mareos, debilidad, confusión, visión borrosa, déficit neurológico focal, convulsiones y coma).
La glucemia e insulinemia en ayunas son normales en estos casos. Sin embargo, en la práctica clínica es difícil obtener todos estos parámetros durante el episodio agudo.
Resulta fundamental hacer una historia clínica con una descripción detallada de los síntomas, de su gravedad (frecuencia, neuroglucopenia), su relación con el ayuno, posibles desencadenantes y el tiempo transcurrido desde la CB. Las hipoglucemias graves, que son infrecuentes, aparecen habitualmente tras 1-5 años de la cirugía. Ante hipoglucemias a los pocos meses de la cirugía (menos de 6 meses) y/o en ayunas hay que descartar otras etiologías de hipoglucemia diferentes a HHP, como nesidioblastosis o insulinoma (tabla 1).
Diagnóstico diferencial de las hipoglucemias con hiperinsulinismo posprandial
| Síndrome dumping precoz | Síndrome dumping tardíooHipoglucemias con hiperinsulinismoposprandial | Nesidioblastosis | Insulinoma | |
|---|---|---|---|---|
| Inicio | 30-60min tras la comidaPoco después de la cirugía | 1-3h tras la comida1-5 años tras la cirugía | Hipoglucemias en ayunasEn cualquier momento tras la cirugía | Hipoglucemias en ayunas y pospandrialEn cualquier momento tras la cirugía |
| Clínica | Síntomas vasomotores y gastrointestinales | Síntomas adrenérgicos y colinérgicosEn ocasiones síntomas de neuroglucopenia de distinta gravedad | Síntomas de neuroglucopenia grave | Síntomas de neuroglucopenia grave |
| Causa | Vaciado rápido contenido gástrico hiperosmolar al intestino delgado | Etiología multifactorialIncremento de la secreción posprandial de insulina mediada por GLP-1 | Proliferación anormal de las células de los islotes pancreáticos con afectación difusa del páncreas | Tumor con aumento de la masa de células β pancreáticas |
| Tratamiento | Resolución con modificaciones dietéticas | Habitualmente responden al tratamiento dietéticoLos casos graves pueden precisar tratamiento farmacológico y/o quirúrgico | No responden al tratamiento dietético. Necesidad de tratamiento médico y/o quirúrgico | Indicación de tratamiento quirúrgico |
| Frecuencia | 20-30% | 1-6%0,2-0,3% (casos graves con neuroglucopenia) | Casos aislados en literatura | Casos aislados en literatura |
Se han desarrollado varios cuestionarios para el diagnóstico del síndrome de dumping que carecen de utilidad en HHP puesto que no están validados en pacientes con CB previa. Los siguientes han sido utilizados tras CB.
- -
Dumping Severity Score (DSS)21: con este cuestionario se ha descrito una prevalencia de síndrome de dumping precoz y tardío tras BPG del 18,8% y 11,7%, respectivamente22.
- -
The Edinburgh hypoglycemia Scale valora síntomas de hipoglucemia en pacientes con diabetes; se ha utilizado una adaptación para pacientes intervenidos de CB. Hasta una tercera parte reportó síntomas compatibles con hipoglucemia posprandial4.
La valoración de la hipoglucemia es compleja, ya que la mayor parte de los métodos pueden detectar hipoglucemia en sujetos asintomáticos.
Aunque la glucemia capilar en el momento de los síntomas puede orientar el diagnóstico, no se recomienda como método de confirmación por la falta de precisión de los dispositivos en el rango de hipoglucemia23. Hasta un 50% de pacientes con BPG presentan hipoglucemia en algún momento, la mayoría de ellas asintomáticas.
La monitorización continua de glucosa (MCG) mide la glucosa intersticial y proporciona información sobre la glucemia durante las 24h; sin embargo, su fiabilidad en el rango de hipoglucemia es limitada24. Hasta el 75% de los pacientes con BPG presentan hipoglucemia en la MCG5,7.
La sobrecarga oral de glucosa prolongada no se recomienda, ya que con este test prácticamente la mitad de los pacientes presentan glucemias <47mg/dl25, incluso estando asintomáticos13,26 y además es muy mal tolerada por estos pacientes.
El Test de tolerancia a una comida mixta (TTCM) es el más indicado. Intenta evaluar la respuesta que produce una comida habitual. Se han empleado alimentos naturales, de manera no estandarizada24, pero es más aconsejable utilizar fórmulas líquidas de composición conocida (aproximadamente entre 40-50g de hidratos de carbono complejos, con proteínas y grasas, en un volumen entre 250-300ml y un aporte energético entre 250-400kcal). Hasta un 50-80% de los individuos con neuroglucopenia muestran glucemias menores de 50mg/dl con el TTCM, siendo este porcentaje menor en pacientes asintomáticos (15%)9,27,28. No existe acuerdo sobre la duración de la prueba, los puntos de corte de hipoglucemia ni la interpretación en sujetos asintomáticos. A pesar de estas limitaciones, es el test de elección por ser el más fisiológico y puede ayudar a confirmar el diagnóstico de HHP, considerando un punto de corte de glucemia menor de 60mg/dl o 3,3mmol/L.
El test de ayuno estaría indicado exclusivamente en pacientes con hipoglucemias a los pocos meses de la cirugía (menos de 6 meses) y/o en ayunas para descartar insulinoma.
Pruebas de imagenAl considerarse que HHP es una alteración funcional no está indicado realizar pruebas de imagen para localizar el foco de hipersecreción insulínica6,29,30. En casos de hipoglucemia en ayunas se podría valorar la indicación de realizar pruebas de imagen como TAC, RMN pancreática o ecoendoscopia, si bien los resultados son, en general, negativos10,31–33. Los tumores pancreáticos son excepcionales34.
TratamientoTratamiento agudo de la hipoglucemiaSi el paciente está consciente se aconseja consumir 15g de glucosa o hidratos de carbono absorción rápida, pudiéndose repetir a los 15minutos si no hay mejoría. Posteriormente se recomienda ingerir hidratos de carbono de absorción más lenta. En caso de tratamiento con acarbosa se deberá administrar glucosa pura.
La hipoglucemia grave con pérdida de conocimiento debe tratarse con la administración de glucagón (intranasal o intramuscular). El glucagón intranasal ofrece una vía de administración y manejo más conveniente, por lo que sería el más recomendable en estos pacientes. Si no mejora se debe realizar traslado a un centro hospitalario para la administración de glucosa intravenosa.
Tratamiento dietéticoLa modificación de la dieta es la base del tratamiento y resulta beneficiosa para la mayoría de pacientes35–37. Incluye una reducción de hidratos de carbono, especialmente de alto índice glucémico y cambios en la dieta para retrasar el vaciado gástrico (tabla 2).
Recomendaciones dietéticas en la hipoglucemia hiperinsulinémica posprandial
| Comer en un ambiente relajado, lentamente, masticando mucho todos los alimentos. Reposar recostado 15-30min después de las comidas principales para aumentar el tiempo de vaciado gástrico |
| La dieta debe fraccionarse en 5-6 tomas a lo largo del día, con tomas de pequeño volumen |
| No ingerir agua ni otros líquidos durante las comidas sino al menos 30min antes y después de cada comida. Los líquidos hiperosmolares (sopas, cremas, purés), o de temperaturas extremas (muy fríos o calientes), favorecen un vaciado gástrico más rápido |
| Solo las comidas principales deben contener los HC, mientras que las colaciones y snacks proporcionarán preferentemente proteínas-grasas |
| Seleccionar hidratos de carbono complejos y cereales integrales: legumbres, hummus, frutos secos, quinoa, avena, pan y pasta integral (cocida al dente), verduras de hoja, tomates, zanahorias, calabacines, berenjenas... algunas frutas (manzana, peras, plátano verde, cítricos, melocotón, kiwi, granadas, frutas del bosque) |
| Suprimir todos los azúcares e HC de alta carga glucémica, como azúcar, fructosa, polioles, refrescos y zumos, caramelos, golosinas, helados, galletas, bollos-repostería, palomitas, cereales azucarados, miel, mermelada, pan blanco, patatas, boniatos, pasta, arroz, cuscús, maíz, tapioca, algunas frutas (frutas desecadas, ciruelas, caquis, chirimoya, uvas, plátano maduro, mango, piña) |
| Control porciones de HC: de 15 a 30g/comida, 5-15g/snack |
| Enfatizar la ingesta adecuada de proteínas en cada comida (60-80g/día), añadiendo módulos de proteínas (aislado de proteína de suero lácteo) si es necesario |
| Incluir solo grasas saludables en cada comida o snack: unos 15g/comida, 5g/snack (no sobrepasar 3-4g/100kcal): aceites, aceitunas, aguacate, frutos secos, semillas, lácteos, pescados grasos (no fritos) |
| En casos graves, se puede emplear la administración de harina de maíz (Maizena®) cruda, a una dosis de 5-10g por cada toma, diluida en agua o leche a temperatura ambiente. Otras opciones interesantes, como almidones modificados (Glycosade®), maltodextrinas estarían pendientes de evaluación en la HHP |
| Evitar el consumo de cafeína, alcohol y valorar la tolerancia a la lactosa |
HC: hidratos de carbono; HHP: hipoglucemia hiperinsulinémica posprandial.
En un estudio aleatorizado en pacientes con HHP, una dieta con restricción de hidratos de carbono (30% de la energía total) y rica en proteínas (30% de la energía total) mostró una reducción significativa del pico de glucosa posprandial, un aumento del nadir de glucosa, una reducción de la secreción de insulina, GLP-1 y GIP, así como un aumento en la secreción de glucagón comparado con la dieta convencional (55% de la energía total en forma de hidratos de carbono y 15% de proteínas)38.
Algunos suplementos dietéticos (goma guar, pectina y glucomanano) aumentan la viscosidad de los alimentos, reducen la velocidad del vaciado gástrico y retrasan la absorción de glucosa, si bien la tolerancia es limitada. Estos suplementos han demostrado su eficacia en la mejora de los síntomas de hipoglucemia, si bien la mayor parte de los estudios se han realizado tras cirugía gastroesofágica pero no tras CB.
Tratamiento farmacológicoEl tratamiento farmacológico se plantea ante la refractariedad de los síntomas con modificaciones dietéticas. El nivel de evidencia de su eficacia es bajo y ninguno tiene aprobación en ficha técnica para su utilización en HHP. Los mecanismos de acción principales serían:
- -
Disminución del incremento posprandial de glucosa (acarbosa, inhibidores de SGLT1/SGLT2).
- -
Reducción de la secreción de insulina (antagonistas del calcio, diazóxido, análogos de la somatostatina, antagonista del receptor IL-1β).
- -
Enlentecimiento del vaciado gástrico (análogos de GLP-1).
- -
Incremento de la glucemia (glucagón).
- -
Bloqueo de la acción del GLP-1 (antagonistas GLP-1).
Acarbosa: es un inhibidor de la α-glucosidasa hidrolasa que enlentece y reduce la absorción de glucosa al impedir la digestión de hidratos de carbono a monosacáridos, reduciendo las excursiones posprandiales de glucosa, insulina y GLP-139,40. Las dosis habituales son 100-300mg/día, iniciándose a dosis inferiores (25mg antes de las comidas) por sus efectos adversos gastrointestinales. En un estudio multicéntrico realizado por nuestro grupo3, la acarbosa fue el primer paso terapéutico y consiguió respuesta parcial (reducción del 50% en el número de hipoglucemias y en su gravedad) en un 18% de los pacientes.
Antagonistas del calcio: inhiben la secreción de insulina mediada por calcio. Existe experiencia con verapamilo (80mg/12h) y nifedipino (30mg/d), con una respuesta parcial en el 50% de los pacientes3,41–43. El efecto adverso principal es la hipotensión.
Diazóxido: agonista del canal de potasio de las células β-ATP dependiente. Dosis de 50mg/12h hasta 150mg/8h han mostrado conseguir una respuesta parcial en un 50% de los pacientes3,44,45. Su utilización está limitada por sus efectos adversos: edema, náusea, hipotensión y cefalea.
Análogos de somatostatina: reducen el vaciado gástrico, enlentecen el tránsito intestinal, inhiben la secreción de hormonas gastrointestinales, entre ellas del GLP-1, insulina y la vasodilatación posprandial. Disponemos de análogos de acción corta (octreótida) y prolongada (octreótida–Lar, lanreótida, pasireótida). En el estudio multicéntrico de GOSEEN3, octreótida fue el fármaco más efectivo, consiguiendo respuesta parcial de las hipoglucemias en el 38,4% de pacientes y remisión clínica en el 23%. En casos descritos en la literatura esta remisión se ha mantenido a largo plazo46. Pasireótida también previene las hipoglucemias tras TTCM pero se asocia a hiperglucemia posprandial, siendo la dosis de 75μg la más adecuada47. Estos fármacos tienen alto coste y efectos secundarios (diarrea, esteatorrea, colelitiasis, dolor en el lugar de inyección y prolongación de QT).
Antagonistas del receptor de GLP-1: el antagonista del receptor de GLP-1, exendina 9-39, es un fármaco solamente disponible en el entorno de investigación8,48. En el estudio PREVENT mostró un incremento de la glucosa nadir y reducción del pico de insulina en un 20% de los pacientes con HPP tras TTCM. La dosis de 60mg en vida real consiguió reducción de los eventos hipoglucémicos hasta en un 60% sin presentar hiperglucemias49.
Análogos del receptor de GLP-1: la experiencia es muy limitada; se han tratado casos aislados con liraglutida o exenatida50 con mejoría de las hipoglucemias y reducción de la variabilidad glucémica.
Inhibidores DPP-IV: existe un estudio con sitagliptina que no mostró efectividad en esta entidad51.
XOMA358: es un anticuerpo monoclonal IG2 de administración intravenosa en investigación, que induce resistencia a la insulina al unirse al receptor de la insulina e inhibe su autofosforilación y señalización. Un estudio fase 2 mostró un incremento del pico de insulina posprandial, del nadir de glucosa y de la glucosa en ayunas del 20%52.
Otros tratamientos ensayados en series muy cortas o de forma aislada incluyen a los iSGLT2 (empagliflozina) junto con un antagonista del receptor de IL-1 (anakinra)53, canaglifozina 300mg/día (inhibidor de SGLT1/SGLT2)54 o la utilización de glucagón en bomba de infusión continua subcutánea conectada a un sensor de glucosa55.
Un estudio ha comparado la efectividad de diferentes fármacos en 11 pacientes con HHP, utilizados de manera secuencial: acarbosa 50mg/8h, sitagliptina 100mg /día, verapamilo 120mg/día, liraglutida 0,6-1,2mg/día y pasireótida 300μg dosis única. Únicamente el tratamiento con acarbosa y pasireótida redujo las hipoglucemias posprandiales de manera efectiva durante TTCM aunque pasireótida produjo hiperglucemia sostenida51.
Ante los datos actuales consideramos que el primer paso en el tratamiento médico de las hipoglucemias posprandiales sería la acarbosa (fig. 2). Si no hay mejoría y el paciente fuera hipertenso se podría introducir un antagonista del calcio. El segundo paso sería la utilización de análogos de la somatostatina de acción prolongada (octreótida-Lar, lanreótida), dejando pasireótida o diazóxido para casos refractarios.
Algoritmo diagnóstico de las hipoglucemias poscirugía bariátrica. AC: anticuerpos; CB: cirugía bariátrica; h: horas; HC: hidratos de carbono; m: meses; HHP: hipoglucemia hiperinsulinémica posprandial; HTA: hipertensión arterial; TTCM: test de tolerancia a comida mixta.
*Aunque con menor evidencia se puede valorar agonistas del receptor GLP-1, inhibidor SGLT2/SGLT1. Todavía los antagonistas del receptor GLP-1 y XOMA358 están disponibles solo en el entorno de investigación.
El tratamiento quirúrgico de las hipoglucemias tras CB se debe considerar solamente cuando el resto de los tratamientos dietéticos y farmacológicos han fracasado.
Dado que la HHP no se debe a un crecimiento o hiperfunción de las células β pancreáticas sino a los cambios en la anatomía y fisiología digestivas inducidos por la CB, la pancreatectomía parcial o total no se considera una opción terapéutica. Esta técnica conlleva una alta morbimortalidad postoperatoria y recurrencia de los síntomas.
Las técnicas quirúrgicas estarán dirigidas a retrasar el tránsito rápido del reservorio gástrico al intestino o a reconstruir el tracto gastrointestinal a anatomía normal. En el primer caso, se han empleado la colocación de un anillo de silicona, banda56 y/o la reducción del diámetro de la anastomosis y de la dilatación del reservorio gástrico (candy-cane)3, con resultados variables. Más recientemente, se han utilizado técnicas endoscópicas para reducir el diámetro de la anastomosis gastroyeyunal, como el método TORe (endoscopic transoral outlet reduction), asociadas o no al laser de coagulación con argón, o esta última técnica de manera aislada57,58.
La alimentación por sonda de gastrostomía en el estómago remanente normaliza los niveles de glucosa, GLP-1, insulina y la respuesta incretínica6; por este motivo la mayoría de autores apoyan la cirugía de reversión del BPG a anatomía normal o bien a GV, para prevenir la recuperación ponderal, siendo este tipo de cirugía efectiva en el 80-88% de los pacientes59–62. Esta cirugía no está exenta de complicaciones: persistencia de los episodios de hipoglucemia, náuseas y vómitos o limitaciones en la tolerancia oral, recuperación ponderal y reflujo gastroesofágico. Por este motivo, debe considerarse solamente en el caso de que fracase el tratamiento dietético y farmacológico.
ConclusionesLas hipoglucemias posprandiales son una complicación frecuente tras CB y en su mayoría responden al tratamiento dietético. Sin embargo, estas hipoglucemias pueden ser graves y dar lugar a síntomas de neuroglucopenia cuyo abordaje es complejo y que abarca de manera secuencial desde medidas dietéticas a farmacológicas e incluso quirúrgicas. Las recomendaciones expuestas se basan en las escasas evidencias actuales del tema y sobre todo en la experiencia clínica de GOSEEN como grupo de expertos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.