El calcitriol ha sido considerado durante años exclusivamente como una hormona reguladora del metabolismo fosfocálcico, pero últimamente se ha demostrado que numerosas células implicadas en la inmunidad innata (epitelios de barrera, monocitos/macrófagos, etc.) son capaces de reconocer determinadas moléculas repetitivas características de diversos gérmenes patógenos mediante receptores de membrana o intranucleares. La activación de estos receptores induce la síntesis de la 1α-hidroxilasa, con lo que dichas células son capaces de sintetizar calcitriol a partir de la 25 hidroxivitamina D circulante. El calcitriol, a través del receptor la vitamina D, modula la expresión de determinados péptidos antimicrobianos, como la catelicidina, la β2-defensina o la hepcidina. Estos péptidos representan un mecanismo versátil de la lucha antibacteriana innata y su producción se ve alterada en la hipovitaminosis D. Se realiza un análisis de la literatura sobre sus mecanismos de secreción, las concentraciones en diversos líquidos orgánicos, y los mecanismos de acción y su relación con la vitamina D.
Traditionally, calcitriol has been considered a calcium and phosphate regulating hormone, but has recently been shown to play a pivotal role in innate immunity. Many barrier and immune cells have membrane and intracellular receptors that recognize different microbial antigens. Activation of these receptors induces synthesis of 1α-hydroxylase, which acts on 25 hydroxyvitamin D to generate intracellular calcitriol. Calcitriol activates its receptor and enhances the synthesis of important human antibiotics like cathelicidin and β2-defensin while inhibiting hepcidin. These pluripotent peptides have an important role in innate immunity, and their regulation is abnormal in hypovitaminosis D. The literature on their secretion mechanisms, levels in different organic fluids, mechanism of action, and relationship with vitamin D is reviewed here.
El hombre obtiene la vitamina D o calciferol de la dieta (en una proporción pequeña) y, sobre todo, de la síntesis endógena en la epidermis por el efecto de los rayos ultravioleta1. Para que el calciferol sea activo ha de ser hidroxilado 2 veces, primero en posición 25 y luego en posición 1α, con lo que se transforma en el 1α,25-dihidroxicalciferol o calcitriol, que a nivel sistémico (endocrino) se comporta como una hormona esencial para el metabolismo fosfocálcico, y a nivel local (autocrino o intracrino) se comporta como una sustancia reguladora de múltiples funciones celulares independientes del metabolismo del calcio.
El calciferol se hidroxila inicialmente en el hígado, a través del efecto de la 25 hidroxilasa de la CYP2R1 microsomal2. Esta enzima está poco regulada, de manera que se produce una transformación masiva y directa del calciferol que llega al hígado hacia 25 hidroxicalciferol. Este se une a la proteína transportadora de la vitamina D y tiene una vida media larga, por lo que sus concentraciones plasmáticas son el principal indicador del estado nutricional de esta vitamina.
La segunda hidroxilación puede ocurrir en el riñón (vía clásica, hormonal) o en otras células no relacionadas con el metabolismo fosfocálcico (vía no clásica, intracrina o paracrina)2, a través de la 1α hidroxilasa (CYP27B1) que genera el metabolito activo. Esta enzima, a diferencia de la 25-hidroxilasa, está fuertemente regulada, pero la regulación a nivel renal y a nivel de otras células es diferente. La PTH y otros factores activan la enzima en el riñón, mientras que el fosfato y el factor de crecimiento fibroblástico 23 (FGF23) son reguladores negativos2.
El calcitriol ejerce sus efectos reguladores fundamentalmente, aunque no de forma exclusiva, a través de la activación de su receptor (VDR)3. El VDR es un receptor nuclear y posee 2 porciones, la carboxiterminal, que fija el calcitriol y la aminoterminal, que se une al ADN. La fijación del calcitriol al VDR induce una heterodimerización con el receptor X activado por ácido retinoico. Este se une a elementos de secuencia específicos del ADN (VDRE) en la región promotora de los genes que van a responder a la vitamina D. Finalmente, se ensambla un complejo molecular que induce o reprime la transcripción génica, con lo cual se modula la síntesis de numerosas proteínas3.
La presencia de efectos no clásicos (independientes del metabolismo fosfocálcico) del calcitriol se fundamenta en: 1) la demostración de la actividad 1α-hidroxilasa en numerosas células extrarrenales, regulada por mecanismos propios (tabla 1); 2) la existencia de VDR en múltiples células (se estima que hasta el 3% del genoma humano está modulado por el calcitriol) (tabla 2); y 3) la existencia de efectos específicos, mediados por la activación del VDR en estas células4–6. Esta vía evolutivamente es muy primitiva, anterior a la hormonal. A continuación, revisamos el efecto de la vitamina D y de su deficiencia sobre los antibióticos humanos modulados por calcitriol.
Tejidos con expresión extrarrenal de 1α-hidroxilasa y producción de calcitriol
| Monocitos/macrófagos | Células dendríticas |
| Células endoteliales | Epitelio bronquial |
| Células mesoteliales de la pleura | Cerebro |
| Mama | Islotes pancreáticos |
| Paratiroides | Piel (queratinocitos) |
| Próstata | Colon |
| Mioblastos, músculo esquelético en regeneración | |
| Placenta (trofoblastos fetales, células de la decidua maternas) |
Órganos y tejidos que se ha sugerido que expresan receptores para calcitriol
| Sistema osteomuscular: osteoblastos, médula ósea, condrocitos, músculo estriado, músculo liso |
| Aparato circulatorio: células mioendocrinas atriales, miocardiocitos, células endoteliales |
| Aparato digestivo: parótida, células epiteliales de la boca, estómago, enterocitos, colonocitos, hepatocitos, vesícula biliar |
| Riñón y vías urinarias: células epiteliales tubulares (proximales y distales), urotelio |
| Sistema inmunológico: linfocitos T y B activados, monocitos, macrófagos, células dendríticas, neutrófilos, células del bazo, del timo, de los ganglios linfáticos |
| Aparato reproductor: amnios, membrana corioalantoica, células alveolares y ductales de la mama, ovario, oviducto, útero, placenta, epidídimo, células de Sertoli y de Leydig del testículo, próstata, glándula de la cáscara del huevo (gallinas) |
| Piel: epidermis, fibroblastos, folículos pilosos, queratinocitos, melanocitos, sebocitos, glándulas sebáceas |
| Sistema nervioso: encéfalo (hipocampo, células de Purkinje y granulares del cerebelo, stria terminalis, núcleo central de la amígdala), ganglios sensoriales, médula espinal, plexos coroideos, glándulas lagrimales, retina |
| Sistema endocrino: tejido adiposo, suprarrenal (corteza y médula), células β del páncreas, hipófisis, tiroides (células foliculares, células C), paratiroides |
| Células tumorales: melanoma, leucemia mieloide, linfoma de células B, mama, próstata, estómago, colon, carcinoma de células escamosas, carcinoma de endometrio |
| Aparato respiratorio: pulmón, epitelio del tracto respiratorio |
La asociación entre raquitismo e infecciones ya se señalaba en las descripciones antiguas. En el siglo xix se aconsejaba el uso de aceite de hígado de bacalao (una fuente excelente de vitaminas A y D) no solo para tratar el raquitismo, sino también para la tuberculosis pulmonar, y poco después se puso de moda la helioterapia en sanatorios soleados. En 1903, Niels Finsen recibió el Premio Nobel de Medicina por demostrar que la luz ultravioleta podía curar la tuberculosis cutánea.
En 1981, Barbour et al. demostraron que había producción extrarrenal de calcitriol en los granulomas sarcoidóticos de un paciente hipercalcémico anéfrico7. Después se comprobó que el calcitriol promovía la fusión de macrófagos alveolares de ratón8. Esta fue la primera prueba de un efecto del calcitriol sobre las células del sistema inmune. En 1983, Proveddini et al. encontraron VDR en los leucocitos humanos9. En 1986, se evidenció que la vitamina D y el interferón-γ eran capaces de controlar la proliferación del Mycobacterium tuberculosis en monocitos humanos10.
Wang et al. demostraron que el calcitriol inducía la expresión de 2 péptidos antimicrobianos humanos, la catelicidina y la β2-defensina11. En 2006 se comprobó que el reconocimiento de antígenos de Mycobacterium tuberculosis por parte de los receptores toll-like (TLR) de la membrana de los monocitos, o de células relacionadas con la inmunidad innata (piel, epitelio respiratorio, urinario, etc.), inducía la activación de los genes de la 1α-hidroxilasa y del VDR12, lo que conducía a su vez a la activación de los genes de la catelicidina y β2-defensina. Liu et al. también demostraron que para que se produjese una adecuada liberación de estas se necesitaban unos niveles normales de 25-hidroxivitamina D en el medio12, lo que indicaba que la hipovitaminosis D limitaba la producción de dichas sustancias. El promotor del gen de ambas moléculas contiene al menos un VDRE, que curiosamente en el caso de la catelicidina se localiza en una pequeña secuencia nuclear que solo aparece en el ser humano y los primates superiores, lo cual sugiere que la regulación por vitamina D de esta faceta de la inmunidad innata es un hecho evolutivamente reciente, casi exclusivamente humano, de manera que los resultados de determinados estudios en animales no son necesariamente extrapolables a nuestra especie13. Los mediadores intracelulares por los cuales la activación de los TLR 2/1 estimula la síntesis de calcitriol y su receptor se empiezan a conocer14. Por otro lado, hay citoquinas estimuladoras (interleuquina-1, interleuquina-15, interferón-γ) e inhibidoras (interleuquina-4, interleuquina-10)14.
Evidentemente, los efectos inmunológicos y antimicrobianos de la vitamina D no se limitan a los reseñados, ya que esta también influye en muchas otras áreas de la inmunidad, tanto innata como adaptativa3–5.
Antibióticos humanos modulados por calcitriolSe incluyen aquí la catelicidina o LL-37, la β2-defensina y la hepcidina.
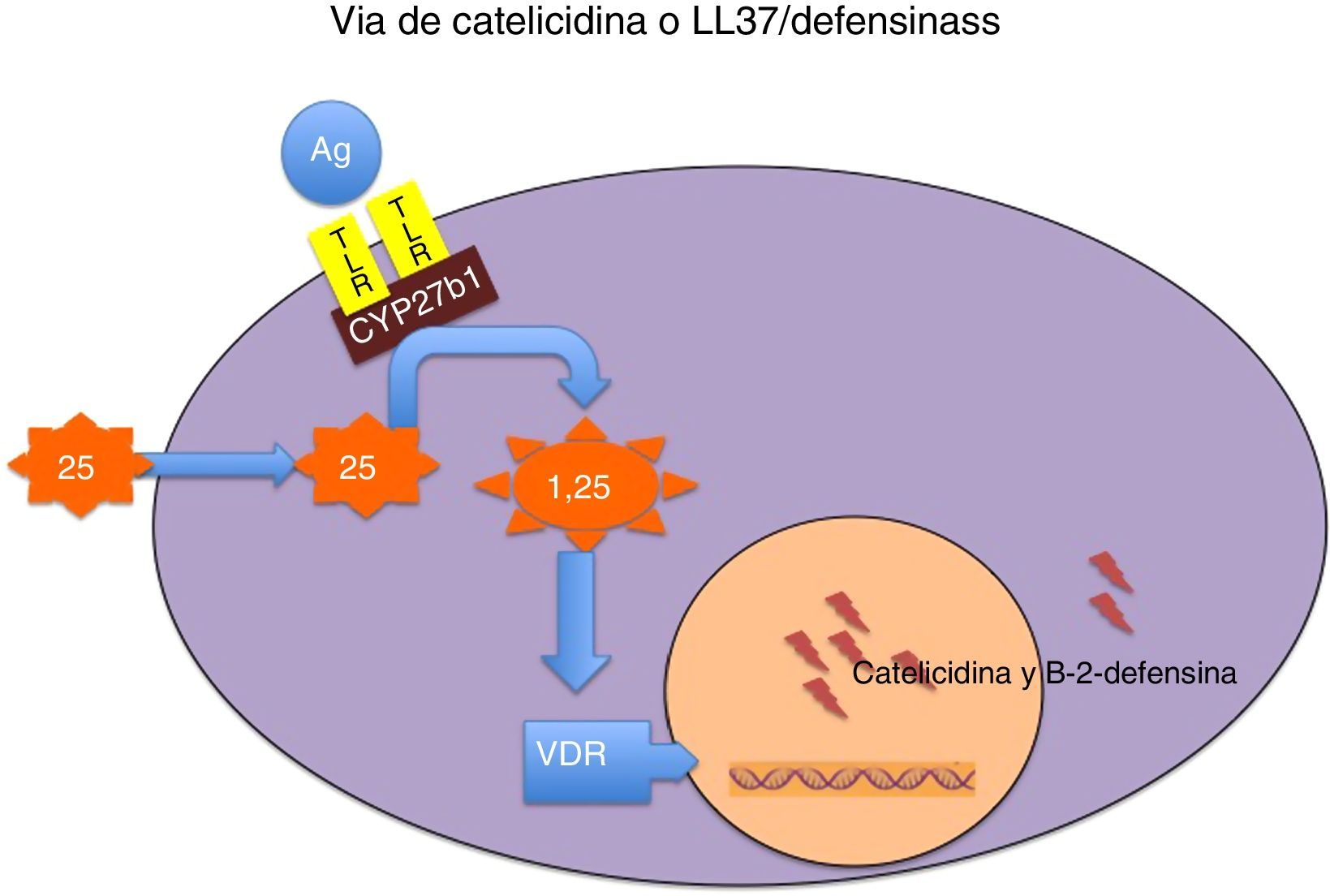
La catelicidina y las defensinas forman parte de un grupo de polipéptidos catiónicos pequeños multifuncionales, evolutivamente muy primitivos, con efectos antimicrobianos potentes (tabla 3)14–16 y resistencia a la proteólisis, por lo que los gérmenes no desarrollan resistencia frente a ellos. Su mecanismo de producción se presenta en la figura 1. Tienen, además, muchas otras funciones, ya que modulan la iniciación y activación de la respuesta inflamatoria («alarminas») y la posterior reparación de los tejidos dañados14–16.
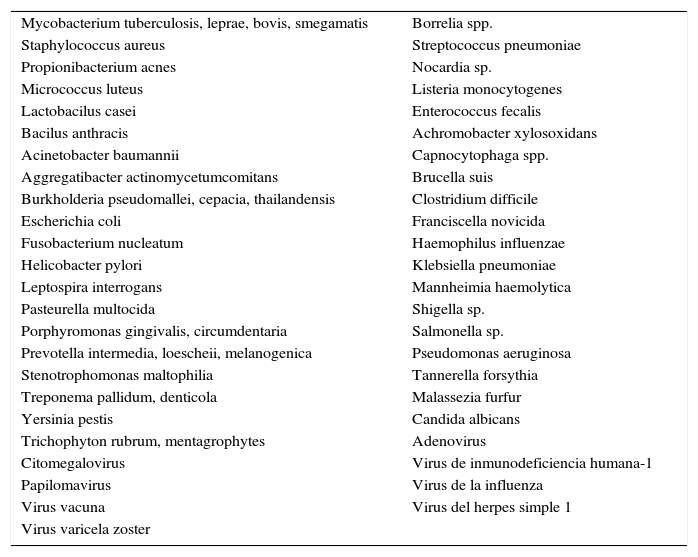
Agentes biológicos sensibles al efecto del eje vitamina D-antibióticos vitamina D dependientes
| Mycobacterium tuberculosis, leprae, bovis, smegamatis | Borrelia spp. |
| Staphylococcus aureus | Streptococcus pneumoniae |
| Propionibacterium acnes | Nocardia sp. |
| Micrococcus luteus | Listeria monocytogenes |
| Lactobacilus casei | Enterococcus fecalis |
| Bacilus anthracis | Achromobacter xylosoxidans |
| Acinetobacter baumannii | Capnocytophaga spp. |
| Aggregatibacter actinomycetumcomitans | Brucella suis |
| Burkholderia pseudomallei, cepacia, thailandensis | Clostridium difficile |
| Escherichia coli | Franciscella novicida |
| Fusobacterium nucleatum | Haemophilus influenzae |
| Helicobacter pylori | Klebsiella pneumoniae |
| Leptospira interrogans | Mannheimia haemolytica |
| Pasteurella multocida | Shigella sp. |
| Porphyromonas gingivalis, circumdentaria | Salmonella sp. |
| Prevotella intermedia, loescheii, melanogenica | Pseudomonas aeruginosa |
| Stenotrophomonas maltophilia | Tannerella forsythia |
| Treponema pallidum, denticola | Malassezia furfur |
| Yersinia pestis | Candida albicans |
| Trichophyton rubrum, mentagrophytes | Adenovirus |
| Citomegalovirus | Virus de inmunodeficiencia humana-1 |
| Papilomavirus | Virus de la influenza |
| Virus vacuna | Virus del herpes simple 1 |
| Virus varicela zoster |
Mecanismo por el que la vitamina D modula la secreción de catelicidina y de beta 2 defensina.
La fijación de determinados antígenos microbianos (Ag) a los receptores toll-like (TLR) activa la 1 α hidroxilasa de la 25 hidroxivitamina D (CYP27b1), de manera que, en función de las concentraciones intracelulares existentes de 25 hidroxivitamina D, se potencia la síntesis local de 1,25 dihidroxivitamina D. Esta, a su vez, se fija a su receptor (VDR) y el complejo intranuclear hormona-receptor activa la transcripción de los genes de la catelicidina y de la beta 2 defensina. Las concentraciones intracelulares de 25 hidroxivitamina D dependen de las concentraciones plasmáticas de esta molécula, que es el indicador más fiable del estado nutricional de esta vitamina.
La catelicidina humana o LL-37, una proteína secretoria generada enzimáticamente a partir de la preprocatelicidina humana14. Esta posee un péptido señal, al que sigue un dominio catelina altamente conservado (de ahí el nombre de la molécula) y un péptido carboxiterminal catiónico estructuralmente muy variable, con efectos antimicrobianos amplios. La molécula está codificada en el ser humano por un único gen, denominado Cathelicidin Antimicrobial Peptide. La catelicidina humana es un péptido de 37 aminoácidos, que se inicia con los aminoácidos leucina-leucina, de ahí su denominación LL-37. Se produce en numerosos tejidos (tabla 4), especialmente en las células implicadas en la inmunidad innata15,16, y es medible en casi todos líquidos biológicos humanos.
Células y tejidos que producen catelicidina
| Médula ósea |
| Granulocitos (depósito) |
| Monocitos/macrófagos |
| Mastocitos |
| Placenta |
| Piel (queratinocitos, células de las glándulas sudoríparas) |
| Células epiteliales: ojos, glándulas lagrimales, nariz, cavidad oral, células gingivales, glándulas salivares, tracto digestivo, células de Paneth, tracto genitourinario, tracto respiratorio |
| Glándula mamaria |
| Células cancerosas (melanoma, leucemia mieloide, linfoma de células B, mama, próstata, estómago, colon, cáncer de células escamosas, endometrio, ovario, mama, pulmón) (varía según las líneas celulares) |
Se supone que los niveles de catelicidina de los líquidos biológicos en una persona sana expresan la secreción basal, constitutiva, del péptido en la médula ósea, los neutrófilos y otras células, mientras que en los pacientes con infecciones, traumatismos, tumores y otras enfermedades esta cifra se ve aumentada por la secreción inducida por la activación del sistema TLR 2/1-VDR en las células de la inmunidad innata17. Se supone que a igualdad de estímulo antigénico la respuesta de catelicidina es inferior in vivo en los pacientes con hipovitaminosis D, aunque hasta ahora solo se ha confirmado en estudios in vitro. Sin embargo, esto no deja de ser una simplificación, ya que la secreción de catelicidina está influida por numerosos factores, tanto positivos como negativos18, no todos ellos dependientes de la señalización calcitriol-VDR.
Estimulan la secreción de catelicidina los agonistas de los receptores TLR (antígenos bacterianos, fúngicos o víricos)18, los agonistas del receptor de la vitamina D (por ejemplo, el paricalcitol)18, el interferón-γ18, la interleuquina-1518, determinados ácidos biliares (litocólico, ursodesoxicólico)18, el butirato y su derivado el 4-fenilbutirato18, los agentes que producen estrés del retículo endoplásmico que liberan esfingosina-1-fosfato19 y algunos componentes de la dieta (curcumina, resveratrol, genisteína, etc.)20–22. La curcumina20 y el resveratrol21 actúan mediante mecanismos independientes del VDR y potencian los efectos del calcitriol. La activación de los receptores β-estrogénicos libera catelicidina por un mecanismo independiente del VDR, mediado por la esfingosina-1-fosfato22. Por el contrario, inhiben la liberación de LL-37 determinadas endotoxinas18, la Shigella18 y el FGF2323, entre otros18. La respuesta es específica según el tipo de tejido (no es igual en el epitelio vaginal, sensible a los estrógenos, que en el urotelio, en el epitelio bronquial o en los queratinocitos de la piel).
Tiosano et al. comprobaron que los monocitos de pacientes con raquitismo por mutación inactivadora del VDR24, en los que no se puede producir señalización a través del VDR expresaban basalmente poca catelicidina (pero no cero) y su capacidad de respuesta en presencia de 25OH vitamina D era mucho menor que la de los monocitos de sujetos sanos (pero tampoco cero). Este dato resalta el papel del VDR, pero también indica que otros estímulos pueden liberar catelicidina, ya que en ausencia de señalización a través del VDR los monocitos son capaces de producirla, lo que indica que el calcitriol es un potente modulador positivo de su secreción, pero no el único.
Concentraciones de catelicidina en líquidos humanosEn 1997, Sorensen et al. publicaron el primer trabajo en el que se medía LL-37 en plasma25. No se encontraron diferencias entre plasma y suero, ni por sexos, ni por edad en personas sanas. Otros autores encontraron concentraciones más elevadas en pacientes con fibrosis quística e infección bronquial que en los pacientes no infectados26. En la sepsis grave hay resultados discrepantes: se han encontrado niveles más bajos27,28 o similares a los sujetos controles29, aunque las técnicas utilizadas para medir la LL-37 han sido diferentes.
Yamshchikov et al. encontraron hipovitaminosis D en el 85% de los pacientes con tuberculosis, siendo los niveles más altos de LL-37 en aquellos con esputo positivo, pero no se apreciaba correlación entre los niveles de LL-37 y 25 hidroxicalciferol30. En otro trabajo, tampoco se encontró correlación entre las concentraciones de catelicidina y de 25-OH-vitamina D en mujeres sanas antes del parto, ni en sus hijos, aunque existía una potente correlación entre los niveles de catelicidina en sangre materna y en la del cordón umbilical31.
Bhan et al. observaron que, tras la administración de vitamina D a sujetos sanos, los que pertenecían al tercil con mayores niveles de 25-OH-vitamina D tenían una mayor elevación en las cifras de LL-37 que los que pertenecían al tercil con menores niveles32.
Dixon et al. comprobaron que existía una correlación positiva entre las concentraciones de 25OH vitamina D y catelicidina en sujetos con niveles bajos del marcador nutricional de la vitamina D, que sin embargo no se apreciaba en aquellos con niveles normales33. Dos trabajos previos de ellos mismos no encontraron correlación entre los niveles del marcador nutricional de vitamina D y la catelicidina en pacientes en diálisis34, ni tampoco en pacientes que acudían a una clínica especializada en enfermedades metabólicas óseas35. Nuestro grupo ha observado que los ancianos sanos con mayores concentraciones de 25OH vitamina D tenían niveles más altos de catelicidina36. Lehouck et al. no encontraron correlación entre el estado nutricional en vitamina D y los niveles de LL-37 ni antes ni después de una suplementación con altas dosis de vitamina D en pacientes con enfermedad pulmonar obstructiva crónica37. Hay otros estudios posteriores similares en sujetos sanos38.
En resumen, las concentraciones de catelicidina en sangre varían dependiendo del método, tienen una dispersión importante y su correlación con los niveles simultáneos de 25OH vitamina D o no existe, o es pequeña en sujetos sanos, excepto quizás en aquellos que tienen hipovitaminosis D. Para interpretar los resultados en pacientes también debe tenerse en cuenta la fase evolutiva del proceso y el tratamiento, ya que sus niveles varían según evoluciona la enfermedad.
Se ha demostrado la presencia de LL-37 en el semen, en el líquido vaginal, en el sudor, en la saliva, en las lágrimas, en el moco nasal, en el esputo, en la leche, en el líquido pleural, en las heces y en la orina25. Se supone que en todos estos lugares ejerce un efecto antibacteriano de amplio espectro, que actúa como una primera defensa cuando las zonas de barrera del organismo detectan antígenos patógenos. En nuestra experiencia, en líquidos pleurales infectados se alcanzan las concentraciones más altas de catelicidina, comparados con los trasudados o con los exudados tumorales39. En estros pacientes la catelicidina sérica correlacionaba positivamente con el calcitriol sérico, pero no con la 25-hidroxivitamina D39.
Mecanismos de acción antibacteriana de la catelicidinaLa mayoría de los efectos antimicrobianos directos de la LL-37 se atribuyen a su estructura α-helicoidal y a sus propiedades catiónicas e hidrofóbicas40. La hélice N-terminal se relaciona con la quimiotaxis y con la resistencia a la proteólisis, mientras que la hélice C-terminal es responsable de los efectos antimicrobianos. La LL-37 alcanza la membrana microbiana, recubre su superficie y la perfora, causando la formación de poros en la membrana, que acaban destruyendo el germen. La LL-37 se fija básicamente a las membranas celulares que contienen lipopolisacáridos (gramnegativos) o ácido teicoico (grampositivo) con carga negativa, diferentes de las membranas zwiteriónicas de los eucariotas. La acción antivírica se debe asimismo a interacción con la envoltura de la membrana y la cápside proteica.
La inducción de autofagia en los monocitos/macrófagos humanos es el mecanismo que explica la capacidad que tiene este péptido para destruir patógenos intracelulares. La autofagia es un proceso biológico muy primitivo, que sirve para asegurar la homeostasia del citoplasma celular41. Al activarse la autofagia determinado material citoplasmático se ve atrapado en una vacuola de doble membrana denominada autofagosoma, que tras fusionarse con los lisosomas se convierte en un autofagolisosoma, en el cual las enzimas lisosómicas degradan todo el material atrapado. Se consideraba que la autofagia servía fundamentalmente para reciclar nutrientes a partir de moléculas dañadas, pero hoy sabemos que participa en una gran variedad de procesos, entre los que destaca la lucha antimicrobiana42,43. La autofagia se activa en respuesta a la producción de catelicidina, al ayuno celular o al tratamiento con rapamicina, y se inhibe en respuesta a nutrientes, hormonas y algunas citoquinas. Este mecanismo permite el normal funcionamiento de la célula ante situaciones metabólicas cambiantes, y activa la destrucción de determinados gérmenes intracelulares, como por ejemplo las diversas micobacterias, que de otra manera podrían mantenerse vivas indefinidamente en el interior de las células41–43.
La catelicidina es un mediador fundamental en la formación y en la función de los autofagosomas y autofagolisosomas en los monocitos humanos41–43, pero no el único, ya que se han descubierto muchos otros mecanismos inductores de autofagia independientes del sistema calcitriol-catelicidina. La LL-37 induce la expresión de 2 factores clave para el desarrollo de la autofagia, la beclina-1 y la autofagina (Atg)-5 (41-44). Estas son fundamentales para el proceso madurativo de la autofagia y para la fusión de los autofagosomas y los lisosomas. La autofagia mediada por la curcumina, el ayuno celular o la rapamicina no están reguladas por el sistema calcitriol-catelicidina44.
La catelicidina tiene más efectos, que pueden variar según la concentración local44. Por ejemplo, se ha comprobado in vitro que a dosis inferiores a 1μmol induce la quimiotaxis y supervivencia de los neutrófilos, estimula la angiogénesis y la migración y proliferación de los fibroblastos (efectos beneficiosos para la curación de las heridas), mientras que a concentraciones muy altas, en general más allá de las que se alcanzan en la respuesta habitual, tiene efectos citotóxicos y proinflamatorios44.
Las defensinas: la β2-defensina o HBD2Las defensinas son otros agentes antimicrobianos evolutivamente muy primitivos45,46. Contienen 6 residuos cisteína que forman enlaces disulfuro. Variando la alineación de estos enlaces y las estructuras moleculares se diferencian distintas familias.
El ser humano posee 8 α-defensinas, que no están moduladas por la vitamina D. Se conocen al menos 4 HBD diferentes en nuestra especie, de las cuales la HBD2 está modulada por el VDR. Las HBD se expresan en diversas células inmunológicas (monocitos, macrófagos) y epiteliales, la HBD1 de forma constitutiva, mientras que la secreción de la HBD2 está estimulada por determinados productos bacterianos (lipopolisacáridos, ácido lipoteicoico) y por las citoquinas proinflamatorias (factor de necrosis tumoral-α, interleuquina-1α)46. La HBD2 es un péptido catiónico pequeño (38 aminoácidos; 4,1kDa)47 que se expresa en el pulmón, el timo, la piel, el intestino, los leucocitos, el hígado y la tráquea.
Wang et al. demostraron que el calcitriol provocaba la liberación de HBD2, aunque en menor proporción, que la de catelicidina17. La inducción plena del gen de la HBD2 exige la convergencia de las vías de la interleuquina-1β y del calcitriol48. Por otra parte, también se ha demostrado que la activación del receptor intracelular nucleotide-binding oligomerization domain protein 2 por su ligando muramyl dipeptide derivado del catabolismo lisosómico de los peptidoglicanos de bacterias, induce la expresión del gen de la HBD249. El calcitriol induce de forma robusta la expresión del receptor nucleotide-binding oligomerization domain protein 2 en células de barrera humanas, y así potencia la expresión de la HBD250. Se conocen otros mecanismos de activación de HBD2 como el butirato, la ceramida-1-fosfato liberada por el estrés del retículo endoplásmico o el sulforafano de las crucíferas, mientras que el ácido retinoico inhibe su expresión en queratinocitos normales y el humo de tabaco bloquea su producción en el epitelio respiratorio15,16,45,46.
Existen pocos trabajos en los que se hayan medido los niveles de β2-defensina. Leow et al. encontraron que las concentraciones plasmáticas de HBD2 en pacientes con neumonía no correlacionaban con los de 25OH vitamina D ni con el riesgo de mortalidad a los 30 días51. En otro modelo Lippross et al. valoraron la evolución de los niveles de HBD2 en suero en un grupo de pacientes politraumatizados y los compararon con otros marcadores de inflamación o de inmunidad innata52. Los niveles de HBD2 al ingreso eran 7 veces superiores a los normales y bajaron progresivamente, normalizándose a los 8 días, mientras que los de catelicidina eran 15 veces superiores basalmente y se mantuvieron elevados los 14 días de seguimiento. Estos datos demuestran que en presencia de daño tisular la respuesta de catelicidina es más precoz y potente que la de β2-defensina.
La hepcidinaEn 2001, se identificó un péptido pequeño antimicrobiano de producción hepática que fue denominado hepcidina (de hep- «hígado», y -cidina de «microbicida»)53. La hepcidina es catiónica, anfipática y rica en cisteínas, que generan 4 enlaces disulfuro intramoleculares y estabilizan la molécula en una estructura de plegamiento β. Es activa contra las bacterias grampositivas, pero también inhibe el desarrollo de ciertos hongos y bacterias gramnegativas, con un espectro antibacteriano similar a la β1-defensina54. Nemeth et al. demostraron que se producía en respuesta la interleuquina-6, mientras que otras citoquinas inflamatorias también inducían su síntesis, pero en menor grado55. La hepcidina es el principal regulador de la homeostasis del hierro, ya que se fija a la ferroportina, que es el único transportador conocido de hierro hacia el exterior de la célula. La unión de la hepcidina a la ferroportina induce una internalización y degradación de la ferroportina que bloquea la salida de hierro de las células. Las células fundamentalmente afectadas por esta interacción son los enterocitos (que bloquean la absorción intestinal de hierro) y los macrófagos (que no dejan salir hierro hacia la sangre). La consecuencia es la aparición de la conocida «anemia de las enfermedades crónicas» debida a la reducción de las concentraciones circulantes de hierro. La hiposideremia limita la disponibilidad de hierro a las bacterias extracelulares, que privadas de un nutriente esencial, son más fácilmente destruibles. Sin embargo, se da la paradoja de que los patógenos intracelulares (Salmonella, Mycobacteria, Candida, etc.), al disponer de hierro en cantidad, podrían desarrollarse más fácilmente en el interior de los macrófagos, por lo que estos aumentan localmente la producción de hepcidina para destruir los gérmenes.
Se ha demostrado que el calcitriol también modula el eje hierro-hepcidina-ferroportina. Bachetta et al. han comprobado que el complejo calcitriol-VDR puede inhibir directamente la expresión de hepcidina al fijarse a un VDRE en el promotor de esta56. Por otro lado, el calcitriol baja la producción de interleuquina-6 en respuesta al lipopolisacárido y, por tanto, de disminuye indirectamente la secreción de esta. En sujetos sanos y en pacientes con insuficiencia renal se ha comprobado que al elevarse los niveles de 25 OH vitamina D desciende la hepcidina y mejora la anemia56. Curiosamente, un grupo español ya había comprobado que la administración de calcitriol por vía endovenosa en pacientes en hemodiálisis mejoraba la anemia y la necesidad de utilizar eritropoyetina57.
Comentario finalEl calcitriol interviene de forma significativa en el metabolismo de distintos péptidos antimicrobianos que actúan sobre agentes microbiológicos externos mediante distintas vías. La optimización de los niveles de vitamina D podría favorecer la formación de estas moléculas, mejorando el estado inmunológico de estos pacientes y su resistencia frente a las infecciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.