Los ritmos circadianos (aproximadamente 24 horas) están ampliamente caracterizados a nivel molecular y su generación se realiza gracias a la expresión de varios «genes reloj» y mediante la regulación de sus productos proteicos. Mientras que la adaptación general de los organismos a los ciclos ambientales de luz-oscuridad se lleva a cabo principalmente por el reloj central del núcleo supraquiasmático, este mecanismo de reloj molecular es funcional en varios órganos y tejidos. Algunos estudios muestran que un fallo del sistema circadiano (cronodisrupción [CD]) puede ser la causa de las manifestaciones del síndrome metabólico. Esta revisión resume, (1) cómo los relojes moleculares coordinan el metabolismo y su papel específico en el adipocito; (2) aspectos genéticos y evidencias científicas de la obesidad como enfermedad cronobiológica, y (3) CD, sus causas y consecuencias patológicas. Finalmente, se discuten ideas sobre el uso de la cronobiología en el tratamiento de la obesidad.
Circadian rhythms (approximately 24h) are widely characterized at molecular level and their generation is acknowledged to originate from oscillations in expression of several clock genes and from regulation of their protein products. While general entrainment of organisms to environmental light-dark cycles is mainly achieved through the master clock of the suprachiasmatic nucleus in mammals, this molecular clockwork is functional in several organs and tissues. Some studies have suggested that disruption of the circadian system (chronodisruption (CD)) may be causal for manifestations of the metabolic syndrome. This review summarizes (1) how molecular clocks coordinate metabolism and their specific role in the adipocyte; (2) the genetic aspects of and scientific evidence for obesity as a chronobiological illness; and (3) CD and its causes and pathological consequences. Finally, ideas about use of chronobiology for the treatment of obesity are discussed.
La vida es un fenómeno rítmico. Cuando estudiamos cualquier actividad vital en relación con el tiempo, nos encontramos con oscilaciones que indican que estas actividades no se desarrollan de manera continua. Los ritmos circadianos (del latín circa diem, aproximadamente un día) son una parte tan innata de nuestras vidas que raramente les prestamos atención1. El funcionamiento correcto de estos ritmos circadianos endógenos permite a los organismos predecir y anticiparse a los cambios medioambientales, así como adaptar temporalmente sus funciones conductuales y fisiológicas a estos cambios. En humanos, los hábitos sociales actuales, tales como la reducción del tiempo de sueño y el incremento de irregularidad interdiaria del sueño-vigilia (jet-lag, trabajo por turnos y un aumento de la exposición a la luz brillante durante la noche) o el elevado consumo de «snacks», actúan sobre el cerebro induciendo una pérdida de la «percepción» de los ritmos internos y externos2.
Actualmente, existen estudios que sugieren que la interrupción o desincronización interna del sistema circadiano (cronodisrupción [CD]) puede contribuir a las manifestaciones del síndrome metabólico (SM) y complicaciones que aparecen con la obesidad, como dislipidemia, intolerancia a la glucosa, disfunción endotelial, hipertensión, diabetes mellitus tipo 2 y enfermedad cardiovascular, entre otras3,4. La cronobiología (ciencia que estudia los cambios que presenta el individuo a lo largo del tiempo) está implicada en la mayoría de estas alteraciones4. De hecho, es bastante conocido el control circadiano de la función cardiovascular5, así como de hormonas involucradas en el metabolismo (insulina, glucagón, hormona del crecimiento y cortisol) y la obesidad (leptina y ghrelina)6. Todos estos ritmos diarios pueden estar implicados en las señales de hambre y saciedad, los horarios de comidas y finalmente en el grado de obesidad. Quizás en un futuro no muy lejano, las recomendaciones dietéticas incluirán no solo qué y cómo comer sino también cuándo tenemos que hacerlo. A lo largo de estas líneas trataremos de resumir los recientes descubrimientos referentes a la relación entre la cronobiología, la etiología y la fisiopatología de la obesidad.
Organización del sistema circadianoEl sistema circadiano de los mamíferos está compuesto por una red de estructuras jerárquicamente organizadas responsables de la generación de ritmos circadianos y de su sincronización con el entorno. Este sistema circadiano está formado principalmente por un marcapasos central, localizado en el núcleo supraquiasmático (NSQ) del hipotálamo. Debido a que el periodo de oscilación endógeno del NSQ no es exactamente de 24 horas, cuando los sujetos se mantienen artificialmente bajo condiciones ambientales constantes, los ritmos circadianos discurren en curso libre con un periodo ligeramente diferente a 24 horas. Sin embargo, bajo condiciones ambientales naturales, el NSQ se «reajusta» cada día mediante una señal periódica de luz/oscuridad gracias a la existencia de una ruta no visual basada en las células ganglionares provistas del pigmento melanopsina y en el tracto retinohipotalámico. Aunque la entrada luminosa (cambios luz/oscuridad) sea la principal señal entrante al NSQ, existen otras entradas periódicas, como el horario de las comidas (ingesta/ayuno) y el ejercicio programado (actividad/reposo), capaces de poner en hora el sistema circadiano de los mamíferos. El marcapasos central, a su vez, sincroniza la actividad de varios relojes periféricos fuera del NSQ mediante la secreción cíclica de hormonas y la actividad del sistema nervioso vegetativo. La diferencia entre el mantenimiento del orden interno temporal saludable y no saludable (CD) depende, entre otros efectos, de que los relojes periféricos produzcan ritmos ordenados por el marcapasos central.
Organización molecular del marcapasos centralTal y como se ha comentado, en mamíferos, el marcapasos central, localizado en el NSQ del hipotálamo, controla la expresión de los ritmos circadianos y produce ciclos de 24 horas en la mayoría de las variables fisiológicas y comportamentales. El control de la expresión de los ritmos circadianos se realiza a través de los denominados «genes reloj». Estos genes codifican una serie de proteínas que generan mecanismos de autorregulación mediante bucles de retroalimentación transcripcionales positivos y negativos7 (fig. 1). Por una parte, existen unos elementos positivos, circadian locomotor output cycles kaput (CLOCK) y brain and muscle ARNT-like protein 1 (BMAL1), dos proteínas con estructura de hélice-bucle-hélice que contienen dominios PAS (Per-ARNT-Sim; involucrados en las interacciones proteína-proteína). Alternativamente a CLOCK, existe un homólogo, neuronal PAS domain protein 2 (NPAS2) que podría compensar funcionalmente la falta de CLOCK. Los elementos positivos forman el heterodímero CLOCK/BMAL1 que se une al promotor de varios genes reloj, como Per1 (period 1), Per2 (period 2), Per3 (period 3), Cry1 (cryptochrome 1), Cry2 (cryptochrome 2), Rev-Erbα (reverse erythroblastosis virus α), Rorα (retinoid-related orphan receptor-α) y otros genes que están controlados por el reloj (CCGs: clock-controlled genes) como es el gen Pparα. El producto de la transcripción de Pparα, la proteína PPARα, induce la transcripción de Bmal1 y Rev-Ervα mediante la unión al dominio PPAR-response elements (PPRE) presente en sus promotores y es capaz de regular la actividad de BMAL1 y CLOCK. El heterodímero CLOCK/BMAL1 también estimula la transcripción de Bmal1, generado un bucle de retroalimentación positivo. Los receptores nucleares REV-ERBα y RORα participan en la regulación de la expresión de Bmal1, inhibiendo o activando su transcripción, respectivamente. Por otra parte, los elementos negativos CRY1 y PER2 forman el heterodímero CRY1/PER2, el cual se transloca al núcleo para inhibir la actividad CLOCK/BMAL18,9. Además, casein kinase I epsilon (CKI¿) mediante la fosforilación de PER realza su inestabilidad y promueve su degradación.
Maquinaria molecular del reloj circadiano. Los elementos positivos CLOCK y BMAL1 heteromerizan en el citoplasma, formando un complejo proteico. El heterodímero se transloca al núcleo y se une sobre el promotor de determinados genes (Per1, Per2, Per3, Cry1, Cry2, Reverbα, Rorα y muchos genes controlados por el reloj [CCG: Clock Controlled Genes]) controlando su expresión. El heterodímero CLOCK/BMAL1 además estimula la expresión de Bmal1, formando un bucle de retroalimentación positivo. Alternativamente a CLOCK, existe un homólogo, NPAS2 que podría compensar funcionalmente la falta de CLOCK. Por otro lado, el bucle de retroalimentación negativo está regulado principalmente por PER y CRY, que heteromerizan en el citoplasma, translocándose al núcleo e inhibiendo la transcripción de CLOCK/BMAL1. La expresión de Bmal1 también está controlada por REVERBα (la inhibe) y RORα (la estimula). La regulación de la expresión de los CCG por el reloj circadiano confiere ritmicidad a los procesos moleculares y fisiológicos. Líneas sólidas: estimulación. Líneas punteadas: inhibición.
Actualmente, se conoce muy bien cómo participa directamente en el metabolismo la maquinaria del reloj circadiano. Aproximadamente entre un 10 y un 30% de los genes, dependiendo de los tejidos, parece mantener un ritmo de expresión guiado por los genes reloj. Este es el caso de enzimas metabólicas (e.g., acil-CoA oxidasa, HMG-CoA sintasa) y numerosos sistemas de transporte tales como la proteína transportadora de ácidos grasos, la sirtuina-1 (SIRT-1) y la proteína de unión al sitio D de la albúmina (DBP), que muestran ritmos circadianos controlados por el reloj molecular por lo que se consideran genes controlados por los genes reloj (CCG). Proteínas reloj como BMAL1 y otras proteínas de CCG (PPARα y REV-ERBα) están involucrados en el metabolismo lipídico. Además, BMAL1 y CLOCK están implicados en la homeostasis de la glucosa, mientras que CLOCK y PER2 parecen asociarse con la regulación del apetito.
En resumen, hay evidencia sólida que demuestra que el sistema circadiano influye sobre el metabolismo y que a su vez diferentes señales metabólicas hacen que este sistema se regule. En esta comunicación bidireccional juega un papel importante la SIRT-1 ya que contribuye al control circadiano in vivo actuando como un reóstato enzimático de la función circadiana, y traduciendo las señales metabólicas originadas por la célula al reloj circadiano.
Los relojes periféricos. El tejido adiposo como modeloEstudios recientes muestran que la regulación del sistema circadiano intracelular no solo reside en el cerebro, sino que determinados tejidos periféricos como corazón, hígado y páncreas entre otros, presentan sus propios relojes, capaces de funcionar de forma autónoma, mediante la expresión circadiana de sus «genes reloj», aunque modulados y sincronizados por el reloj central10,11.
El tejido adiposo, como tejido periférico, posee genes reloj que juegan un papel fundamental en la fisiología del propio tejido, regulando la expresión rítmica de sustancias bioactivas secretadas como son las adipoquinas (adiponectina, leptina y resistina, entre otras) y que por lo tanto afectan el metabolismo sistémico. Investigaciones recientes muestran la importancia que tiene el funcionamiento correcto de los genes reloj del tejido adiposo y el efecto de su desincronización en el desarrollo de ciertas enfermedades como la obesidad.
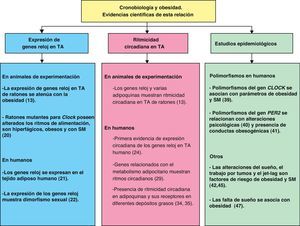
Genes reloj en el tejido adiposo de modelos de experimentación animalActualmente, la mayoría de los estudios realizados sobre los genes reloj en el tejido adiposo, se llevan a cabo en animales de experimentación, sobre todo en roedores12–17. De hecho, en estos modelos experimentales se ha demostrado que su expresión presenta ritmicidad circadiana, de manera que los ritmos de los elementos positivos (Bmal1 y Clock) están en anti-fase con los ritmos de los elementos negativos (Per2 y Cry1)12,13,18,19.
Aun así, estudios recientes han mostrado que los ritmos circadianos del tejido adiposo se encuentran alterados en diferentes patologías asociadas con la obesidad. Por ejemplo, varios grupos de investigación han estudiado los genes reloj en el tejido adiposo de ratones obesos13,18–20, y mientras que algunos autores indican que el efecto de la obesidad sobre la maquinaria de los genes reloj es leve19, otros han demostrado que esta patología atenúa de manera importante e incluso bloquea la expresión de los genes reloj13,18. En este sentido ha sido decisivo el estudio realizado por Ando et al13 que muestra cómo la expresión rítmica de los genes reloj se atenúa con diferente intensidad dependiendo del grado de obesidad; así, la atenuación de los ritmos es leve en ratones KK (obesos), mientras que en ratones KK-AY (con mayor grado de obesidad y diabéticos) se produce un aplanamiento de ritmos significativamente superior. Esta idea fue reforzada con el estudio de Turek et al20, en el que ratones mutantes knock-out homocigóticos para Clock presentaban alterados los ritmos de ingesta siendo hiperfágicos y obesos, y además desarrollaban SM caracterizado por hiperleptinemia, hiperlipidemia, esteatosis hepática, hiperglucemia e hipoinsulinemia. Este estudio fue crucial para el conocimiento de la relación entre obesidad y cronodisrupción, y ha constituido la base de estudios posteriores tanto fisiológicos como clínicos y epidemiológicos sobre obesidad, SM y cronobiología.
Genes reloj en el tejido adiposo humanoRecientemente, nuestro grupo de investigación ha demostrado, por primera vez en humanos, que los genes reloj se expresan en diferentes localizaciones adiposas, visceral y subcutánea21. Las asociaciones encontradas entre la expresión basal de los genes reloj (PER2, BMAL1 y CRY1) y el contenido de grasa abdominal y los factores de riesgo cardiovascular, sugieren que estos genes presentan un papel relevante en las perturbaciones del SM y obesidad21. Además, recientemente hemos podido observar que existe un dimorfismo sexual en la expresión basal de los genes reloj en el tejido adiposo, siendo ésta mayor en mujeres que en hombres22, resultados que concuerdan con estudios preliminares realizados en hígado de ratones23. Este dimorfismo sexual puede explicar los distintos cronotipos del hombre y la mujer, ya que diversos estudios han mostrado que el hombre tiene a ser más vespertino mientras que la mujer presenta un comportamiento más matutino24.
Una vez demostrada la expresión de los genes reloj en el tejido adiposo humano a una determinada hora del día, nos preguntamos si estos genes, presentarían un comportamiento circadiano y tras una serie de cultivos celulares pudimos demostrar la naturaleza periódica de estos genes en el tejido adiposo25. Una importante consideración fue que el ritmo de expresión persistió ex vivo al menos dos ciclos circadianos después de la cirugía. Estos resultados coinciden con estudios previos donde se analizó la expresión circadiana de los genes reloj en células de otros tejidos26–29. Al llevar a cabo este estudio también pudimos demostrar que el reloj circadiano puede oscilar independientemente del NSQ y este mecanismo intrínseco oscilatorio puede regular la puesta en hora de determinados genes implicados en el metabolismo adipocitario como el PPAR-γ y otros genes relacionados con glucocorticoides25,30. Además, hemos demostrado que estos patrones circadianos difieren entre los distintos depósitos grasos25,30. De hecho, la expresión de genes reloj en el tejido adiposo visceral se asoció más estrechamente con las características del SM que la del depósito subcutáneo25,30.
Ritmos circadianos en el metabolismo del tejido adiposoActualmente, es bien conocida la implicación de los relojes circadianos en la homeostasis de la glucosa y de lípidos, así como que muchos factores metabólicos presentan variaciones circadianas incluyendo enzimas, transportadores y hormonas. Estudios recientes muestran que los ritmos biológicos y el metabolismo están estrechamente unidos. Kennaway et al31 demostraron esta conexión en un trabajo realizado en ratones transgénicos los cuales mostraban una expresión interrumpida del gen Clock. Estos animales presentaron expresión no-rítmica de los genes reloj en hígado y músculo esquelético, en cambio, preservaron la ritmicidad en el NSQ y la glándula pineal. Aunque los ratones no desarrollaron obesidad o aumento de ácidos grasos, presentaron un aumento de la adiponectina plasmática, disminución del ARNm del transportador de glucosa Glut4 en el músculo esquelético, baja tolerancia a la glucosa, bajos niveles de insulina y descenso de la expresión génica con pérdida de la ritmicidad en enzimas relacionadas con la glucólisis y gluconeogénesis hepática. También se ha observado en determinados estudios que existe una fuerte asociación entre el metabolismo del tejido adiposo y el sistema circadiano32,33. Durante el transcurso de las 24 horas del día, el adipocito debe ajustar recíprocamente las tasas de síntesis (lipogénesis) y almacenaje de triglicéridos con las tasas de degradación (lipólisis) de los mismos.
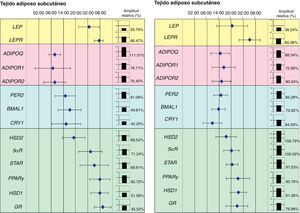
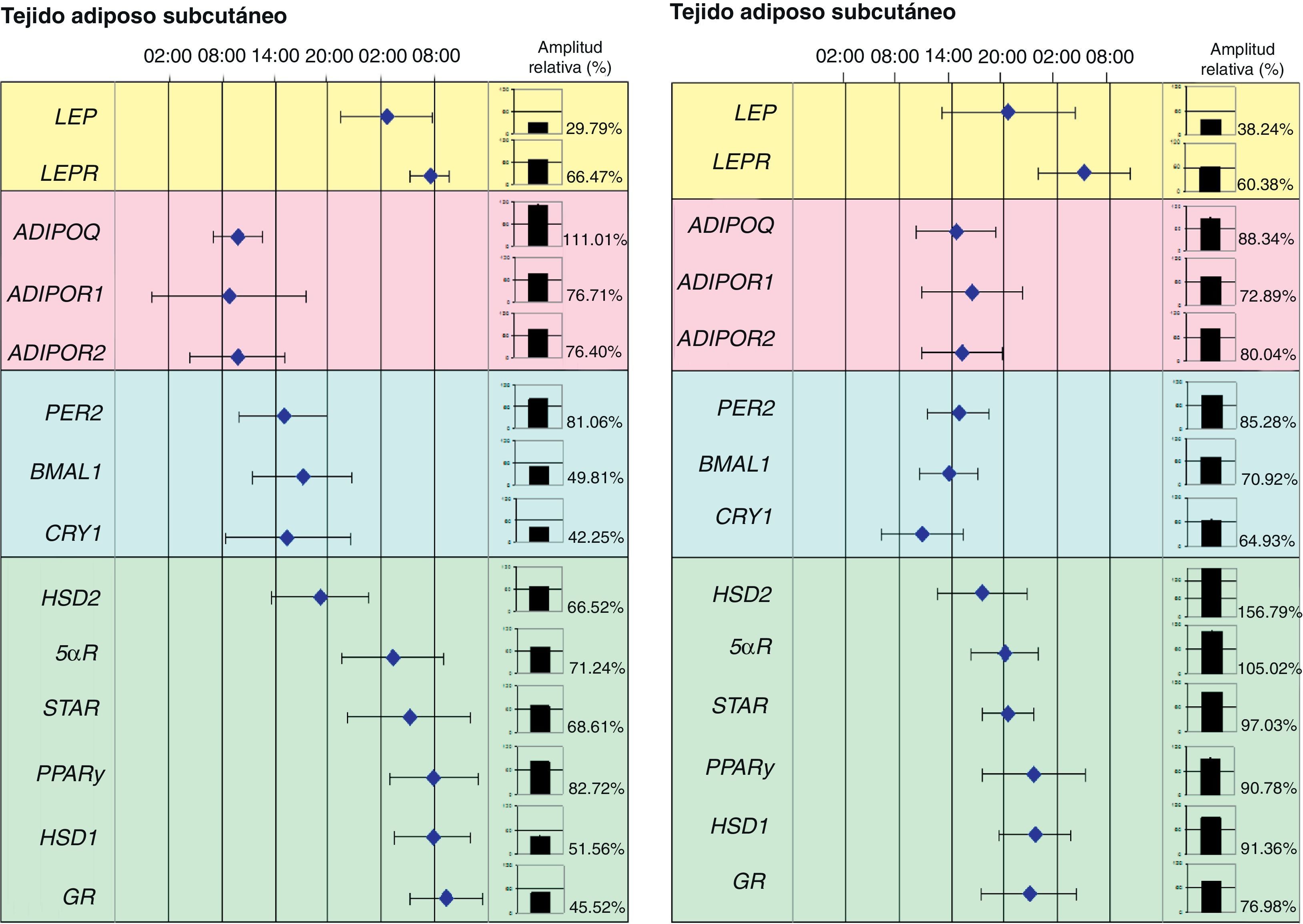
Recientemente nuestro grupo de investigación ha demostrado la relación entre los genes reloj del tejido adiposo y diferentes genes implicados en el metabolismo de este tejido. De hecho, hemos podido demostrar en pacientes obesos mórbidos, que la expresión circadiana de los genes reloj se relaciona con el contenido de grasa abdominal y determinados factores de riesgo cardiovascular, como son las concentraciones plasmáticas de LDL (lipoproteína de baja densidad), de colesterol total y la circunferencia de la cintura. Además, la expresión de los genes reloj se relacionó de forma directa con genes implicados en el metabolismo del tejido adiposo como es el caso de PPARγ. De hecho, al representar en una escala de tiempo de 24 horas las acrofases (tiempo en el que la expresión del gen es máxima) de los genes reloj (PER2, BMAL1 y CRY1), del PPARγ y de otros genes relacionados con el metabolismo de los glucocorticoides (HSD1, HSD2, 5αR, STAR y GR) observamos que las acrofases se distribuían en el tiempo en dos grupos notablemente diferentes: uno para los genes reloj y otro los genes asociados con el metabolismo del tejido adiposo (fig. 2).
Representación de un mapa de fases de los ritmos circadianos de varios genes humanos del tejido adiposo subcutáneo (TAS) y del tejido adiposo visceral (TAV). Esta figura muestra las acrofases (tiempo en el que la expresión del gen es máxima) de los ritmos de varios genes implicados en el metabolismo del tejido adiposo humano. Los valores medios de la acrofase se representan junto a la desviación estándar. En gráficos de columnas se representan la amplitud relativa de cada gen.
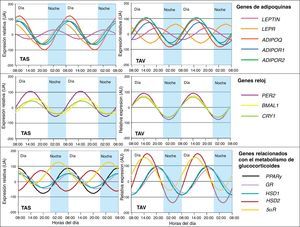
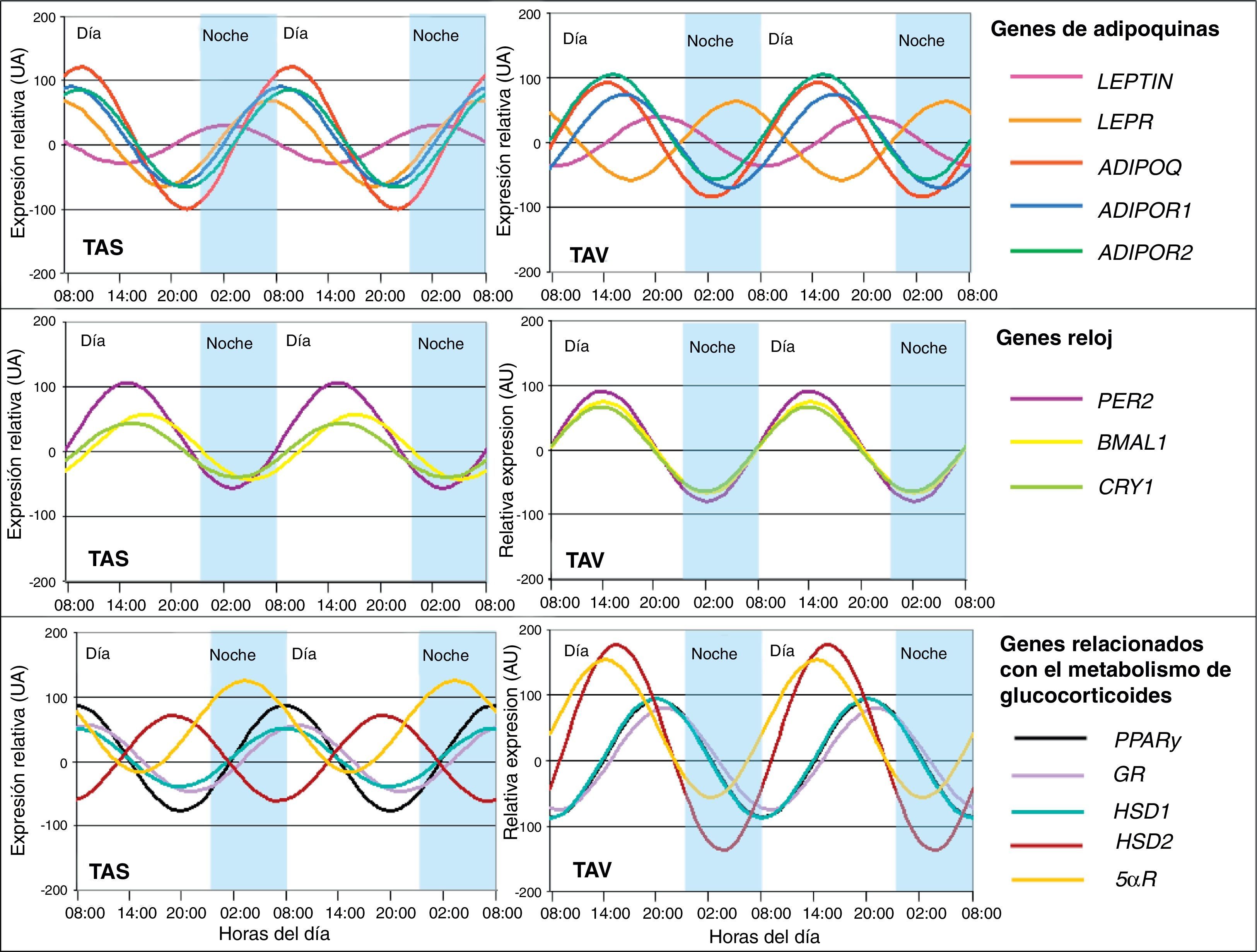
En este sentido, también hemos demostrado que determinadas citoquinas sumamente relacionadas con el tejido adiposo presentan ritmicidad. La adiponectina (ADIPOQ), considerada como factor protector frente a perturbaciones asociadas al SM, así como sus receptores ADIPOR1 y ADIPOR2 mostraron ritmicidad circadiana en el tejido adiposo de pacientes con obesidad severa34. La expresión del gen de adiponectina fluctuó en la misma fase que sus receptores (fig. 3). El análisis de correlación entre la oscilación circadiana genética y componentes del SM reveló que la adiposidad y obesidad abdominal se correlacionaron con un descenso de la amplitud del ritmo de adiponectina y sus receptores35. La alteración en los ritmos circadianos de esta adipoquina podría estar involucrada en el desarrollo del SM. Además también demostramos la existencia de ritmicidad circadiana en otra adipoquina muy estudiada como es la leptina35. La leptina (LEP), proteína secretada en el tejido adiposo y fuertemente implicada en el control de la ingesta, también presenta ritmicidad circadiana en su expresión, al igual que su receptor LEPR (fig. 3). Así su máxima expresión es por la noche en humanos, momento en el que se presenta menos apetito y menos oportunidad de ingesta35. Estos resultados eran de esperar si consideramos que esta proteína es un potente factor anorexigénico.
Representación de la expresión rítmica de los genes estudiados en tejido adiposo humano subcutáneo (TAS) y tejido adiposo visceral (TAV). Los resultados se representan en relación a la menor expresión relativa basal para cada gen. Los datos de la expresión relativa se representan en unidades arbitrarias (UA).
La biología circadiana del tejido adiposo se ha evaluado en múltiples modelos de roedores que poseen mutación y/o deficiencia en algún gen. Por ejemplo, se ha observado que los ratones que presentan una mutación en el gen Clock se caracterizan por ser obesos y por no tener una biología circadiana rítmica, mientras que los ratones Bmal-deficientes se caracterizan por presentar más cantidad de tejido adiposo que los que no poseen esta deficiencia. Sin embargo, existen estudios contradictorios en ratones que indican que Bmal1 juega un papel importante en la regulación de la diferenciación del tejido adiposo, así como en la lipogénesis de adipocitos maduros36. Tal y como describimos con anterioridad, el estudio de Turek et al ha sido el primero en mostrar la interacción molecular entre los genes reloj y la obesidad20. Este trabajo reveló que los ratones con el gen Clock mutado eran propensos al desarrollo de un fenotipo similar al SM. También se ha observado que la deficiencia de genes de adipoquinas y receptores asociados a la obesidad como son la leptina y el receptor de melanocortina, da lugar a ritmos circadianos defectuosos. Además, se ha demostrado que la interrupción del funcionamiento del reloj del tejido adiposo de ratones ob/ob (deficientes en leptina), ocasionó en estos animales una importante ganancia del peso corporal, hipertrofia adipocitaria y un aumento de triglicéridos y colesterol en mayor medida que los ratones que tan solo poseían la deficiencia en leptina10.
De acuerdo con estos descubrimientos, numerosos estudios epidemiológicos en humanos demuestran una importante asociación entre diversos polimorfismos de genes reloj con un aumento de la incidencia de obesidad y del SM37–42. A partir de estudios de nuestro propio grupo y otros, podemos deducir que la presencia de algunos polimorfismos del gen CLOCK (rs3749474, rs4580704 y rs1801260 (3111T4C)), tiene un especial interés por asociarse con el índice de masa corporal (IMC), con la ingesta energética y con diferentes variables relacionadas con la obesidad40,43. De hecho, nuestros resultados mostraron que los individuos portadores de las variantes génicas o polimorfismos, comían más, dormían menos, ingerían más grasa, y en definitiva estaban más obesos, presentando en particular una mayor obesidad abdominal, caracterizada por ser la de mayor riesgo metabólico. Algunas de estas asociaciones se pueden explicar funcionalmente, como es el caso del polimorfismo CLOCK rs3749474 que potencialmente da lugar a un cambio de estructura del ARNm que lo hace menos viable, y por tanto la expresión del gen pierde eficacia. Pero quizás de los resultados obtenidos, uno de los más interesantes fue que estas asociaciones entre el polimorfismo genético y obesidad abdominal o alteraciones del metabolismo de la glucosa solo se demostraban en individuos practicando una alimentación desequilibrada, asociada con un consumo alto de grasas saturadas (bollería industrial, embutidos, etc.) y baja proporción de grasas monoinsaturadas (aceite de oliva). Sin embargo, el polimorfismo carecía de efecto en aquellos sujetos con un consumo en aceite de oliva (ácido oleico) superior a la media. En esta línea, también se han realizado estudios con otros genes reloj. Diversos trabajos han mostrado que la presencia de ciertos polimorfismos de gen PER2 se asocia con diversas alteraciones psicológicas entre las que destacan: la depresión estacional y el trastorno bipolar44. Esto nos hizo plantearnos si, en una muestra de pacientes que presentaban sobrepeso u obesidad, existirían alteraciones emocionales o psicológicas relacionadas con la obesidad y si estas alteraciones estarían asociadas a su vez con polimorfismos en el gen PER2. Consistente con esta idea, nuestros resultados mostraron que aquellas personas portadoras de la variante génica en PER2 demostraron conductas, hábitos y emociones obesogénicas, con mayor frecuencia de abandono de tratamiento, picoteo, estrés por la dieta y consumo de alimentos como escape al aburrimiento45.
Evidencias epidemiológicasExisten otras muchas evidencias epidemiológicas de la relación existente entre obesidad y aspectos cronobiológicos. Uno de los descubrimientos más importantes es que el trabajo por turnos es un factor de riesgo independiente en el desarrollo de la obesidad y el SM46. La industrialización ha dado lugar a la realización de actividades continuas de 24 horas. Esto ha causado un aumento en la proporción de la población que, rutinariamente, desempeña un trabajo por turnos, llegando a ser dicha proporción mayor del 20% de la población industrializada. Numerosos estudios epidemiológicos muestran que el trabajo por turnos está asociado con una mayor prevalencia de obesidad, hipertrigliceridemia, bajos niveles de HDL, obesidad abdominal, diabetes y enfermedad cardiovascular47. Además, se observa que los trabajadores por turnos presentan valores aumentados de glucosa plasmática, insulina y triglicéridos como respuesta metabólica postprandial que se asocian con la alteración de la ritmicidad circadiana de melatonina48. Junto al trabajo por turnos, se han encontrado resultados interesantes relacionando los desórdenes del sueño ocasionados por el jet-lag con la obesidad. El jet-lag, no siendo en sí mismo una enfermedad, es capaz de alterar la función normal del sistema circadiano. Es por ello que el insomnio ocasionado por el jet-lag y/o el trabajo por turnos se relaciona con la obesidad y llega a representar importantes problemas sociales que necesitan asistencia médica49.
Otros trabajos muestran la asociación entre la duración del sueño y el riesgo metabólico. Diversos estudios clínicos muestran que los sujetos saludables que restringen a 4 horas la duración del sueño durante 6 noches consecutivas muestran una alteración en la tolerancia a la glucosa y una disminución de la respuesta de la insulina que tiene como consecuencia un aumento de la glucosa plasmática50. Además, las personas que duermen poco muestran reducidos los valores circulantes de leptina (hormona anorexigénica) y elevados los valores de ghrelina (hormona orexigénica)51. Esta situación es especialmente relevante en niños que duermen poco, y los efectos de este acortamiento del sueño parecen variar según del día de la semana o la estación del año que se produzca, o incluso es diferente en aquellos niños que presentan hermanos más jóvenes. Esta falta de sueño en niños se ha descrito como un factor de riesgo independiente para la obesidad52.
Cuando el sistema circadiano funciona mal: cronodisrupciónDurante estos últimos años en la ciencia de la cronobiología se ha introducido un nuevo término, la «cronodisrupción (CD)» o interrupción circadiana, que puede ser definida como una importante perturbación del orden temporal interno de los ritmos circadianos fisiológicos, bioquímicos y comportamentales. También podría definirse como la ruptura de la sincronización entre los ritmos circadianos internos y los ciclos de 24 horas medioambientales53.
En nuestra sociedad moderna (24 horas/7 días), la CD se produce por varias situaciones anteriormente comentadas como el jet-lag y el trabajo por turnos, pero también por otras como la contaminación lumínica nocturna o la realización de actividades lúdicas preferentemente durante la noche. En los últimos años, el efecto de la CD sobre la salud humana ha adquirido un papel relevante. La evidencia actual sugiere que la CD está estrechamente asociada con un aumento del riesgo de desarrollar ciertas enfermedades o el empeoramiento de patologías preexistentes como el envejecimiento prematuro, el cáncer y enfermedades cardiovasculares, y como se ha mostrado en los apartados anteriores, con la obesidad y el SM.
Envejecimiento prematuroEl funcionamiento del sistema circadiano se ve afectado por la edad. Se ha demostrado que en edades avanzadas los ritmos circadianos se caracterizan por poseer la fase anticipada, una amplitud reducida, un empeoramiento de la habilidad de resincronización después de un cambio horario así como una desincronización interna entre diferentes ritmos54. Además, determinados estudios indican que la CD tiene un efecto directo sobre la aceleración del envejecimiento. Por ejemplo, se ha observado que un cambio de 6 horas/semana en el ciclo luz-oscuridad en ratones envejecidos, produjo una reducción significativa en el periodo de vida de estos roedores. Es por ello que la interrupción de los ritmos circadianos parece reducir las expectativas de vida, mientras que su apropiado funcionamiento permite un aumento de la longevidad.
CáncerEstudios realizados tanto en animales como humanos han documentado que una de las consecuencias de la CD es la iniciación y desarrollo de cáncer55. De hecho, se ha estudiado en humanos una relación entre la CD y diagnóstico del cáncer. En pacientes con cáncer colorrectal, el hecho de poseer ritmos bien marcados se asoció con una mejor calidad de vida, mejor respuesta a la quimioterapia y mayor supervivencia56.
Enfermedad cardiovascularEl patrón circadiano normal de presión sanguínea (dipper) se caracteriza por presentar los valores más bajos de presión arterial durante la noche, alcanzando un máximo por la mañana coincidiendo con la hora del despertar de los individuos. Así, hoy en día sabemos que el mejor indicador para predecir el riesgo de infarto de miocardio es la presencia de valores de presión sanguínea elevados durante la noche57. De hecho, pacientes hipertensos que presentan una reducción normal de la presión sanguínea durante la noche presentan un riesgo de mortalidad cardiovascular similar a pacientes normotensos58. Existen casos en los que los valores de presión sanguínea no se reducen por la noche todo lo esperado y son similares a los valores diurnos. Este patrón de presión sanguínea se denomina no-dipper. Se ha observado que este tipo de patrón es característico de trabajadores por turnos o personas ancianas que poseen una alteración de los ritmos circadianos.
Obesidad y SMEs bien conocido que uno de los efectos que tiene la CD sobre la salud humana es el desarrollo de obesidad y SM. Tal y como se ha comentado a lo largo de esta revisión, estudios epidemiológicos han mostrado que el trabajo por turnos, la privación del sueño y el cambio de horario de alimentación hacia horas nocturnas se asocian con un riego elevado de padecer obesidad y SM4. Muchas de las funciones del sistema circadiano relacionadas con el metabolismo, como son la regulación metabólica de lípidos y glucosa, o la respuesta a la insulina, pueden verse perjudicadas por la CD, contribuyendo a la fisiopatología de la obesidad.
Causas de la cronodisrupciónLa cronodisrupción puede ser el resultado de alteraciones a diferentes niveles. Puede ocurrir por el empeoramiento de las entradas al oscilador central o sincronizadores, como son los ciclos de luz-oscuridad o los horarios de las comidas; fallos en el oscilador central (NSQ); o de las problemas en las salidas relacionadas con la melatonina y glucocorticoides.
EntradasSe ha observado que la deficiencia de luz o el hecho de presentar una intensidad y espectro de luz por debajo de los rangos óptimos pueden contribuir a la aparición de manifestaciones patológicas relacionadas con la CD59. Los cambios en horarios de las comidas, considerado uno de los más importantes sincronizadores externos, es también un importante factor de CD. Por ejemplo, se ha visto que sujetos con un estilo de vida nocturno, caracterizado por tomar la cena tarde y picotear durante la noche, presentan hiperglucemia y valores bajos de leptina y melatonina durante la noche60. Actualmente el hecho de llevar un estilo de vida nocturno se considera uno de los principales riesgo para la salud de la sociedad moderna, además del síndrome de comedor nocturno, la obesidad y la diabetes.
Oscilador centralLa CD, propia de fenómenos como el jet-lag o el trabajo por turnos, se produce por diferencias en las tasas de sincronización de las distintas variables biológicas. De hecho, esta desincronización se produce como consecuencia de un desfase entre los ritmos del NSQ y los producidos por los tejidos periféricos. Pero la CD también se puede producir por una alteración de la maquinaria molecular del reloj central, como es el caso de la alteración en el gen Clock en ratones mutados que se asocia con obesidad, o por ejemplo alteraciones en el gen BMAL1 que se han relacionado con envejecimiento, o en PER2 asociadas con diversos cánceres y alteraciones psicológicas.
SalidasEl tercer elemento que puede causar CD es la alteración de las salidas del sistema circadiano, que incluye, entre otras, a la anteriormente mencionada melatonina61,62. La melatonina se produce como respuesta a la acción simpática del NSQ. Además, es un conocido antioxidante que hace que se liberen radicales libres63. La acción antioxidante de la melatonina se asocia con la inducción de la expresión/actividad de enzimas antioxidantes y con la mejora de la función de la cadena de transporte electrónico en la mitocondria64,65. También se ha asociado a alteraciones relacionadas con la obesidad, actuando como una hormona protectora. De hecho, reduce la presión sanguínea y mejora el metabolismo de la glucosa66.
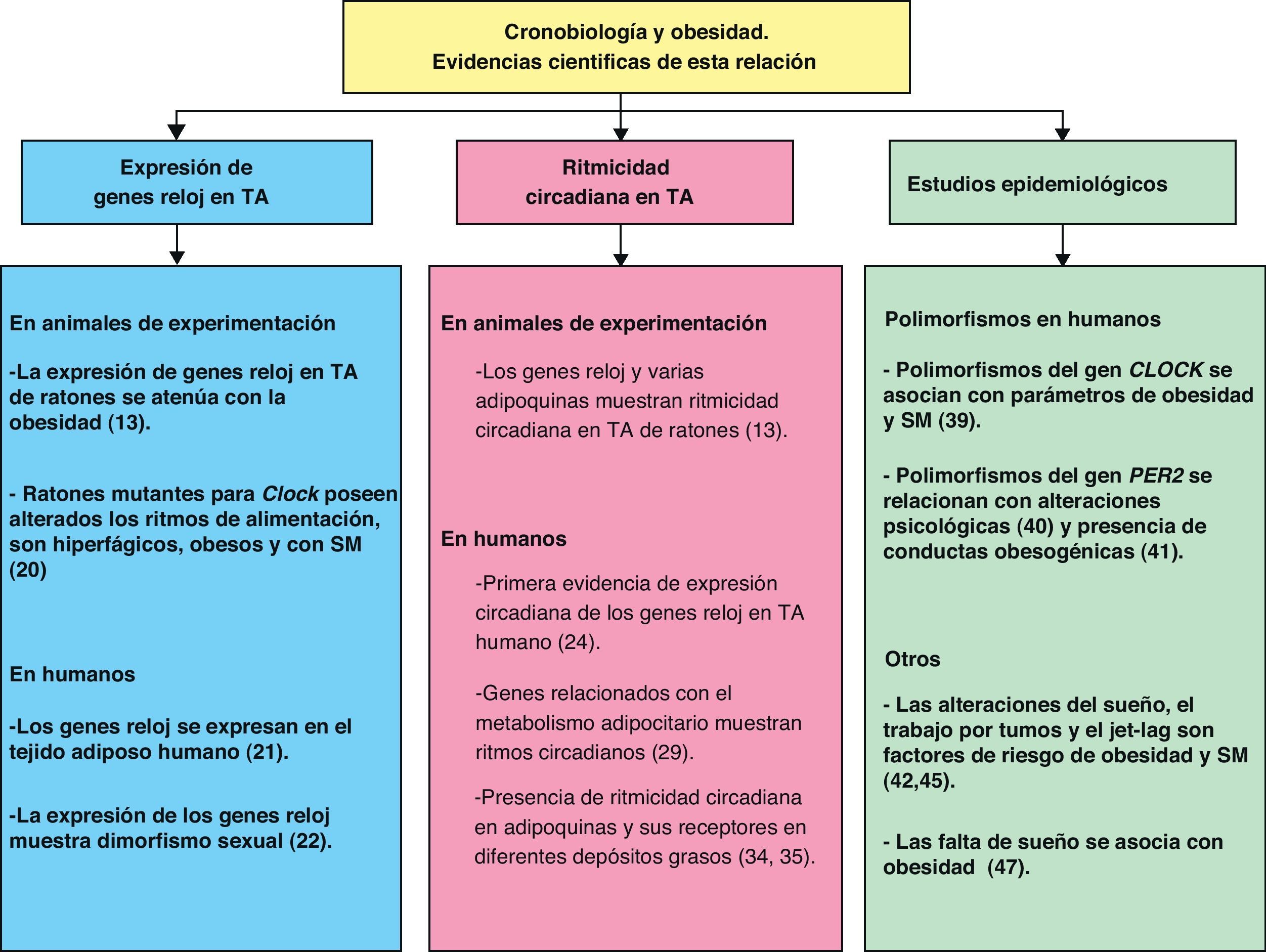
La Cronobiología en el tratamiento de la obesidad y el síndrome metabólicoA lo largo de esta revisión hemos comentado las evidencias científicas que muestran la relación entre cronobiología y obesidad (fig. 4). De esta manera podemos deducir que la cronobiología podría ser una valiosa herramienta en el futuro tratamiento de la obesidad y el SM mediante el uso de cronoterapia. Según lo anteriormente comentado, para establecer una terapia basada en esta ciencia se deberían considerar tres niveles de intervención sobre la organización funcional del sistema circadiano: las entradas hacia el oscilador central, el propio oscilador central y las salidas del mismo.
En este nivel es fundamental conseguir una exposición regular a la luz y la regulación óptima del sueño para obtener un adecuado ritmo del ciclo sueño-vigilia. Determinados estudios han mostrado que la regulación del sueño durante 4 semanas en un grupo de personas adultas, mejora de forma significativa la calidad de vida67. Además es importante establecer un horario regular de comidas. Se ha observado que cuando la ingesta se lleva a cabo por la noche, los individuos presentan un aumento del peso corporal mayor que cuando se comparan con el grupo que realiza una ingesta adecuada repartida a lo largo del día68. La actividad física regular es también una buena medida a tomar en cuenta para el tratamiento de la obesidad. Estudios epidemiológicos muestran que el hecho de realizar un ejercicio regular y prolongado en el tiempo se asocia con una mejora de la calidad del sueño durante la noche y con la disminución del cansancio durante el día68.
Marcapasos centralA este respecto, la caracterización cronobiológica del individuo podría ser de interés para la predicción de la susceptibilidad a la obesidad y a la pérdida de peso. Esto consistiría en la identificación de diversos polimorfismos de los genes reloj, que informarían de la capacidad de respuesta a estrategias para conseguir la pérdida de peso mediante dietas hipocalóricas. En este sentido nuestro grupo de investigación ha demostrado que un polimorfismo del gen CLOCK (rs1801260) puede ayudarnos a predecir el resultado de la reducción de peso corporal de pacientes que acuden a una consulta de nutrición por su sobrepeso u obesidad40. Estas nuevas estrategias pueden representar un paso hacia una asistencia médica y nutrición personalizada, ayudados por la caracterización cronobiológica del individuo.
SalidasPodrían existir soluciones farmacológicas, como es la administración de agonistas de la melatonina (ramelteon y agomelatina). Este efecto es posible gracias a que mejoran la ritmicidad circadiana de la melatonina mediante la producción de sueño y una mejora de los estados depresivos, sin el estímulo del sistema inmunológico que conllevaría la administración de melatonina69. Pero puede haber otras soluciones no farmacológicas, caracterizadas por la regulación de los ritmos del cortisol. Los ritmos circadianos de los glucocorticoides se consideran un factor clave en la sincronización de los relojes periféricos. El ritmo normal del cortisol se caracteriza por presentar un pico en el momento del despertar de los individuos y una disminución durante el resto del día. Según Van Someren et al (2007)70, puede conseguirse un ritmo normal de cortisol al establecer un horario de despertar y de comidas regular y una exposición a la luz y ejercicio físico regular y adecuados. Estas intervenciones conductuales podrían tener un efecto directo sobre la obesidad y en particular sobre la obesidad abdominal, ambas relacionadas con alteración de la ritmicidad de glucocorticoides71.
Aunque no existen estudios experimentales dirigidos expresamente hacia un tratamiento cronobiológico de la obesidad, la estrecha relación existente entre la obesidad, el SM y la cronodisrupción sugiere que cualquier tratamiento farmacológico, dietético y conductual que mejore el funcionamiento del sistema circadiano, puede ayudar a reducir el riesgo de obesidad y mejorar el éxito del tratamiento.
Conclusión generalA lo largo de esta revisión se ha presentado el sistema circadiano y su relación con la obesidad, pasando de un hito a otro de esta nueva y relevante área del conocimiento. Hemos presentado las bases del conocimiento del sistema circadiano y comentado cómo un mal funcionamiento de este complejo sistema (cronodisrupción) aumenta el riesgo de desarrollar patologías como la obesidad, desórdenes cardiovasculares y síndrome metabólico. La sociedad moderna y características inherentes a ella, tales como el estrés, el desorden de horarios, o la falta de sueño, entre otros factores, producen disrupciones en el sistema circadiano que se asocian con el reciente aumento de enfermedades metabólicas. Un aspecto interesante es que estos ritmos circadianos están personalizados y modulados por factores genéticos. Los recientes estudios sobre polimorfismos en genes reloj, y sus interacciones con la dieta, abren una nueva puerta al desarrollo de nuevas terapias basadas en la cronoterapia y la nutrigenética para el tratamiento de obesidad y otras patologías asociadas. Por ello, una aplicación importante se basaría en la caracterización cronobiológica del individuo con la finalidad de aplicar un adecuado tratamiento. Además, la utilización de terapias farmacológicas destinadas a la restauración de ritmos circadianos normales, así como la exposición regular a sincronizadores ambientales como la luz, el horario de comidas, y el ejercicio físico podría reflejar una solución a la desincronización del sistema circadiano.
FinanciaciónEste trabajo se ha financiado mediante el Proyecto BIO/FFA 07/01-0004 de la Comunidad Autónoma de Murcia y por el Proyecto AGL2008-01655/ALI del Ministerio de Educación y Ciencia.
Conflicto de interesesLos autores declaran no tener conflicto de intereses




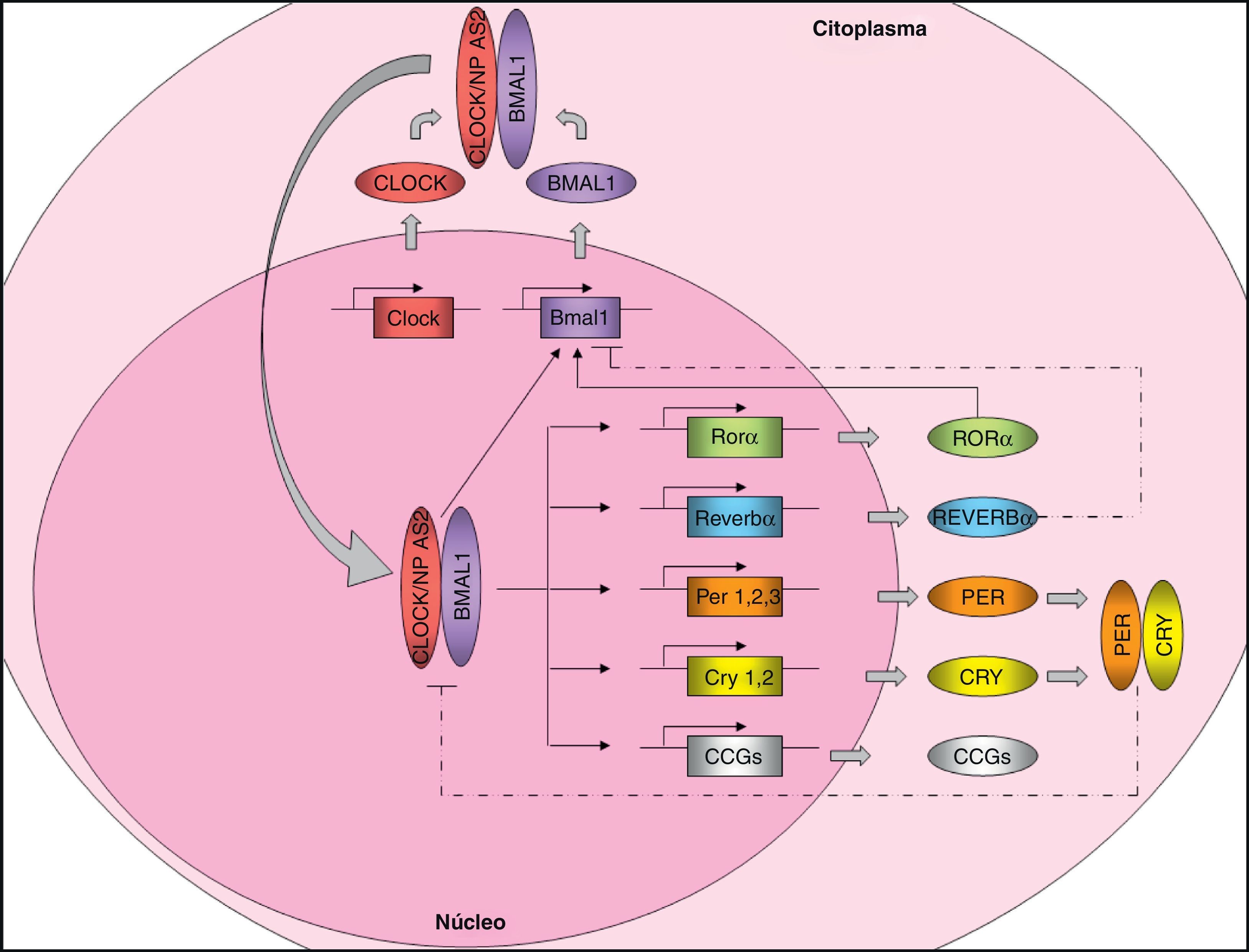
![Maquinaria molecular del reloj circadiano. Los elementos positivos CLOCK y BMAL1 heteromerizan en el citoplasma, formando un complejo proteico. El heterodímero se transloca al núcleo y se une sobre el promotor de determinados genes (Per1, Per2, Per3, Cry1, Cry2, Reverbα, Rorα y muchos genes controlados por el reloj [CCG: Clock Controlled Genes]) controlando su expresión. El heterodímero CLOCK/BMAL1 además estimula la expresión de Bmal1, formando un bucle de retroalimentación positivo. Alternativamente a CLOCK, existe un homólogo, NPAS2 que podría compensar funcionalmente la falta de CLOCK. Por otro lado, el bucle de retroalimentación negativo está regulado principalmente por PER y CRY, que heteromerizan en el citoplasma, translocándose al núcleo e inhibiendo la transcripción de CLOCK/BMAL1. La expresión de Bmal1 también está controlada por REVERBα (la inhibe) y RORα (la estimula). La regulación de la expresión de los CCG por el reloj circadiano confiere ritmicidad a los procesos moleculares y fisiológicos. Líneas sólidas: estimulación. Líneas punteadas: inhibición. Maquinaria molecular del reloj circadiano. Los elementos positivos CLOCK y BMAL1 heteromerizan en el citoplasma, formando un complejo proteico. El heterodímero se transloca al núcleo y se une sobre el promotor de determinados genes (Per1, Per2, Per3, Cry1, Cry2, Reverbα, Rorα y muchos genes controlados por el reloj [CCG: Clock Controlled Genes]) controlando su expresión. El heterodímero CLOCK/BMAL1 además estimula la expresión de Bmal1, formando un bucle de retroalimentación positivo. Alternativamente a CLOCK, existe un homólogo, NPAS2 que podría compensar funcionalmente la falta de CLOCK. Por otro lado, el bucle de retroalimentación negativo está regulado principalmente por PER y CRY, que heteromerizan en el citoplasma, translocándose al núcleo e inhibiendo la transcripción de CLOCK/BMAL1. La expresión de Bmal1 también está controlada por REVERBα (la inhibe) y RORα (la estimula). La regulación de la expresión de los CCG por el reloj circadiano confiere ritmicidad a los procesos moleculares y fisiológicos. Líneas sólidas: estimulación. Líneas punteadas: inhibición.](https://static.elsevier.es/multimedia/15750922/0000005900000001/v1_201305082256/S1575092211003196/v1_201305082256/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)