La estadificación del carcinoma diferenciado de tiroides cobra gran importancia ante la tendencia actual de reservar los tratamientos más intensivos a los casos de peor pronóstico. Aunque el más difundido es el basado en la clasificación TNM, se han desarrollado otros a partir de seguimiento de cohortes de uno o varios centros, pero al aplicarlos en otras poblaciones los resultados han sido discordantes.
El objetivo de este estudio es evaluar la adecuación de varios sistemas de estadificación del carcinoma de tiroides a una población española.
Material y métodoSe incluyeron 729 pacientes diagnosticados de carcinoma diferenciado de tiroides, de los que se disponía de todos los datos necesarios para la estadificación por los sistemas estudiados, seguidos durante una media de 10,8 años.
Se estudiaron los sistemas TNM, EORTC, AMES, Clase clínica, MACIS, Ohio, NTCTCS y español, aplicados a todos los tipos histológicos. Se analizaron las curvas de Kaplan-Meier para cada sistema y la comparación entre ellos se realizó mediante la proporción de varianza explicada.
ResultadosLas características demográficas y clínicas de nuestra población son similares a las de otras cohortes españolas e internacionales publicadas.
Los mejores sistemas fueron NTCTCS, con una proporción de varianza explicada del 74,7% y TNM (68,3%), seguidos por Ohio, MACIS, EORTC y AMES con mínimas diferencias entre ellos, y los menos adecuados el español (55,2%) y Clase clínica (47,1%).
ConclusiónPese a que NTCTCS ha resultado mejor, por su sencillez y difusión parece recomendable usar el TNM para los pacientes con carcinoma diferenciado de tiroides.
Differentiated thyroid carcinoma staging is increasingly important due to the current trends to a less intensive therapy in low-risk patients. The TNM system is most widely used, but other systems based on follow-up of several patient cohorts have been developed. When these systems have been applied to other populations, results have been discordant.
Our study evaluates the suitability of several differentiated thyroid carcinoma staging systems in a Spanish population.
Material and method729 patients with differentiated thyroid carcinoma and staging data available were enrolled. Mean follow-up time was 10.8 years.
The TNM, EORTC, AMES, Clinical class, MACIS, Ohio, NTCTCS, and Spanish systems were applied to all histological types. The Kaplan-Meier survival curves for each system were analyzed, and compared using the proportion of explained variation (PEV).
ResultsThe demographic and clinical characteristics of our population were similar to those of other Spanish and international cohorts reported.
The best systems were NTCTCS, with 74.7% PEV, and TNM (68.3%), followed by the Ohio, MACIS, EORTC, and AMES systems with minimal differences between them, while the least adequate were the Spanish (55.2%) and Clinical class (47.1%) systems.
ConclusionThe NTCTCS staging system was found to be better than TNM in our population but, because of its simplicity and greater dissemination, the TNM appears to be recommended for staging of patients with differentiated thyroid carcinoma.
El carcinoma diferenciado de tiroides es el tumor endocrino maligno más frecuente, y su incidencia está aumentando en los últimos años, no solo a expensas de microcarcinomas detectados por la mejora en el procedimiento de diagnóstico, sino también por un aumento real en la frecuencia de tumores de mayor tamaño1,2.
En general es poco agresivo, con una alta tasa de remisión completa y mortalidad a 10 años menor del 10%. Sin embargo, algunos casos evolucionan desfavorablemente, con recurrencia local, ganglionar o a distancia, lo que reduce la calidad de vida de los pacientes y puede conducir a la muerte.
Para detectar precozmente estos casos que precisan un seguimiento y tratamiento más intensivos, así como para evitar una inadecuada utilización de los recursos y un tratamiento excesivo de los pacientes que no lo precisan, se han establecido varios sistemas de estadificación del riesgo de mortalidad. El más difundido es el basado en la clasificación TNM de la American Joint Commission on Cancer, pero se han desarrollado otros a partir del seguimiento de amplias cohortes de pacientes de uno o varios centros. Estos sistemas resultan adecuados en las poblaciones en las que se han desarrollado, pero al aplicarlos en otras poblaciones su valor predictivo disminuye y sus resultados son discordantes.
El objetivo principal de este estudio es evaluar la adecuación de varios sistemas de estadificación del carcinoma de tiroides a una población española.
El objetivo secundario es describir las características demográficas, clínicas y evolutivas de una cohorte de pacientes con carcinoma diferenciado de tiroides.
Material y métodosSe realizó un estudio retrospectivo de pacientes tratados por carcinoma diferenciado de tiroides en el Hospital General Universitario Gregorio Marañón entre los años 1970 y 2013 con los siguientes criterios de inclusión:
- •
Tratamiento quirúrgico inicial.
- •
Confirmación histológica del diagnóstico de carcinoma diferenciado de tiroides.
- •
Seguimiento clínico durante al menos un año, salvo fallecimiento del paciente en ese periodo.
- •
Disponibilidad de los datos clínicos y anatomopatológicos precisos para realizar la estadificación mediante los métodos estudiados:
- -
Sexo y edad del paciente en el momento del diagnóstico.
- -
Extensión de la cirugía practicada.
- -
Tipo histológico del tumor y variante en su caso.
- -
Tamaño del tumor primitivo.
- -
Extensión del tumor a tejidos peritiroideos.
- -
Presencia de adenopatías regionales.
- -
Existencia de metástasis a distancia en el momento del diagnóstico.
- -
Se revisaron un total de 1.152 registros clínicos, de los que se excluyeron 423 casos por no cumplir alguno de los criterios de inclusión, sobre todo por carencia de alguno de los datos precisos para la estadificación.
En los 729 pacientes incluidos se definió su situación al cierre del estudio (mayo de 2013) como:
- •
En remisión (vivo y ausencia de datos clínicos, radiológicos o analíticos de persistencia o recidiva tumoral).
- •
Vivo con persistencia de la enfermedad.
- •
Fallecido por el tumor.
- •
Fallecido por otro motivo.
- •
Pérdida del seguimiento.
El manejo clínico de estos pacientes ha sido el habitual en nuestro centro durante estos años: en la mayoría de los casos tiroidectomía total con o sin linfadenectomía en función de los hallazgos en el campo quirúrgico y la práctica del cirujano correspondiente, ablación de restos tiroideos con 131I y tratamiento a largo plazo con levotiroxina a dosis supresoras de TSH; si bien en los últimos años ha aumentado el número de pacientes con tratamiento menos intensivo, de acuerdo con las últimas guías de práctica clínica. El tratamiento con quimioterapia convencional, inhibidores de las tirosina quinasas o radioterapia externa se empleó en casos aislados.
Los sistemas de estadificación evaluados son: TNM 6ª edición (2002), European Organisation for Research and Treatment of Cancer (EORTC)3, AMES4, Clase clínica5, Metastasis, Age, Completeness of resection, Invasion y Size (MACIS)6, Ohio7, National Thyroid Cancer Treatment Cooperative Study Registry Group (NTCTCS)8 y español9. Aunque Clase clínica, MACIS y el español se desarrollaron sobre cohortes de pacientes con carcinomas solo papilares, en este estudio se han aplicado al resto de tipos. Las características de estos sistemas se resumen en la tabla 1.
Sistemas de estadificación
| TNM |
| T1:≤2cm |
| T2: entre 2-4cm |
| T3:>4cm o pequeña extensión local |
| T4a: extensión local importante |
| T4b: extensión a columna o grandes vasos |
| N0: no adenopatías |
| N1a: adenopatías cervicales |
| N1b: adenopatías mediastínicas |
| M0: no metástasis |
| M1: metástasis a distancia o adenopatías no regionales |
| Menores de 45 años |
| Estadio I: cualquier T, cualquier N, M0 |
| Estadio II: cualquier T o N, M1 |
| Mayores de 45 años |
| Estadio I: T1, N0, M0 |
| Estadio II: T2, N0, M0 |
| Estadio III: T1-3, N0-1a, M0 |
| Estadio IV: T1-4a, N0-1b, M0 |
| Estadio IV: T4b, cualquier N, M0 |
| Estadio IV-C: cualquier T y N, M1 |
| Medulares: todos como mayores de 45 años |
| Anaplásicos: todos estadio iv |
| EORTC3 |
| Edad (años)+12 si ♂+10 si extensión extratiroidea+x+y |
| x: 10 si medular o folicular pobremente diferenciado, 45 si anaplásico |
| y: 15 si metástasis a distancia única, 30 si metástasis múltiples |
| Estadio I:<50 |
| Estadio II: 50-65 |
| Estadio III: 66-83 |
| Estadio IV: 84-108 |
| Estadio IV:>108 |
| AMES4 |
| Bajo riesgo: pacientes<40 (varones) o 50 años (mujeres) sin metástasis. En los pacientes mayores, aquellos cuyo tumor sea<5cm, sea intratiroideo en el caso de los carcinomas papilares o con mínima invasión capsular en los foliculares, y no presenten metástasis |
| Alto riesgo: pacientes con metástasis a distancia. En los pacientes mayores, aquellos que no cumplan alguna de las condiciones para considerarlos de bajo riesgo |
| Clase clínica5 |
| Clase I: intratiroideos |
| Clase II: adenopatías regionales |
| Clase III: extratiroideo (tumor o adenopatías irresecables) |
| Clase: metástasis a distancia |
| MACIS6 |
| (Edad×0,08 o 3,1 en<40 a.)+(0,3×tamaño cm)+1 (si resección incompleta)+1 (si invasión local)+3 (si metástasis) |
| Estadio I:<6 |
| Estadio II: 6-7 |
| Estadio III: 7-8 |
| Estadio IV:>8 |
| Ohio7 | Estadio I | Estadio II | Estadio III | Estadio IV |
|---|---|---|---|---|
| Tamaño | <1,5cm | 1,5-4,4 | ≥4,5 | Cualquiera |
| Adenopatías | No | Sí | Cualquiera | Cualquiera |
| Invasión local | No | No | Sí | Cualquiera |
| Metástasis | No | No | No | Sí |
| NTCTCS8 |
| Tamaño:<1cm/1-4/>4cm |
| Edad:≤45 años/>45 |
| Tipo histológico |
| Multifocalidad: |
| Micro/macroscópica |
| Intra/extratiroidea |
| Diferenciación tumor |
| Metástasis: cervicales/extracervicales |
| Papilares | Foliculares | Medulares | |||
|---|---|---|---|---|---|
| Edad | <45 | ≥45 | <45 | ≥45 | |
| Tamaño tumor primario (cm) | |||||
| <1 | I | I | I | II | Hiperplasia I<1cm ii>1cm o adenopatías cervicales iiiExtratiroideo o metástasis extracervicales iv |
| 1 a 4 | I | II | I | III | |
| >4 | II | III | II | III | |
| Multifocalidad | |||||
| Microscópica | I | II | I | III | AnaplásicosTodos IV |
| Macroscópica o capsular | I | II | II | III | |
| Extratiroidea microscópica | I | II | I | III | |
| Extratiroidea macroscópica | II | III | II | III | |
| Pobremente diferenciado | N.A. | N.A. | III | III | |
| Metástasis | |||||
| Adenopatías cervicales | I | III | I | III | |
| Extracervicales | III | IV | III | IV | |
| Español9 |
| Edad: un punto si<50 años, 2 si≥50 años |
| Tamaño: un punto si≤4cm, 2 puntos si>4cm |
| Extensión: un punto intratiroideos y 2 puntos extratiroideos |
| Variante histológica: |
| Un punto para las variantes clásica, folicular y esclerosante difusa |
| Dos puntos para las variantes sólida y de células altas |
| Tres puntos para la pobremente diferenciada (elevada tasa de mitosis y atipias, áreas de necrosis) |
| Índice pronóstico: (3×edad)+(2×tamaño)+(6×extensión)+(2×variante histológica) |
| Estadios de riesgo: |
| Bajo:<18 puntos |
| Intermedio: 18-22 puntos |
| Alto:>22 puntos |
PVE: proporción de varianza explicada.
Las variables cualitativas se presentan con su distribución de frecuencias. Las variables cuantitativas como su media, desviación estándar (DE) y rango. En todos los casos se ha comprobado la distribución de la variable frente a los modelos teóricos y en caso de asimetría se ha calculado la mediana y su rango intercuartílico.
Se ha evaluado la asociación entre variables cualitativas con el test de Chi cuadrado de Pearson (χ2), o la prueba exacta de Fisher en el caso de que más de un 25% de los casos esperados fuera menor de 5. Para las variables cuantitativas se ha utilizado el test de la «t» de Student cuando la distribución de la variable se ajustaba a la normalidad, o la prueba U de Mann-Withney en caso contrario.
El estudio de la relación de las distintas variables con la mortalidad se realizó mediante el análisis de las curvas de Kaplan-Meier. Para la comparación de los distintos sistemas de estadificación en la población estudiada se empleó la proporción de varianza explicada (PVE) por cada uno de ellos según el método de Royston y Sauerbrei10. Este parámetro estadístico indica el porcentaje de la varianza de la variable estudiada, en este caso la mortalidad específica por el tumor, que se explica según cada sistema predictivo; valores más altos reflejan un mayor poder predictivo y por tanto una mejor adecuación del sistema para la población en estudio.
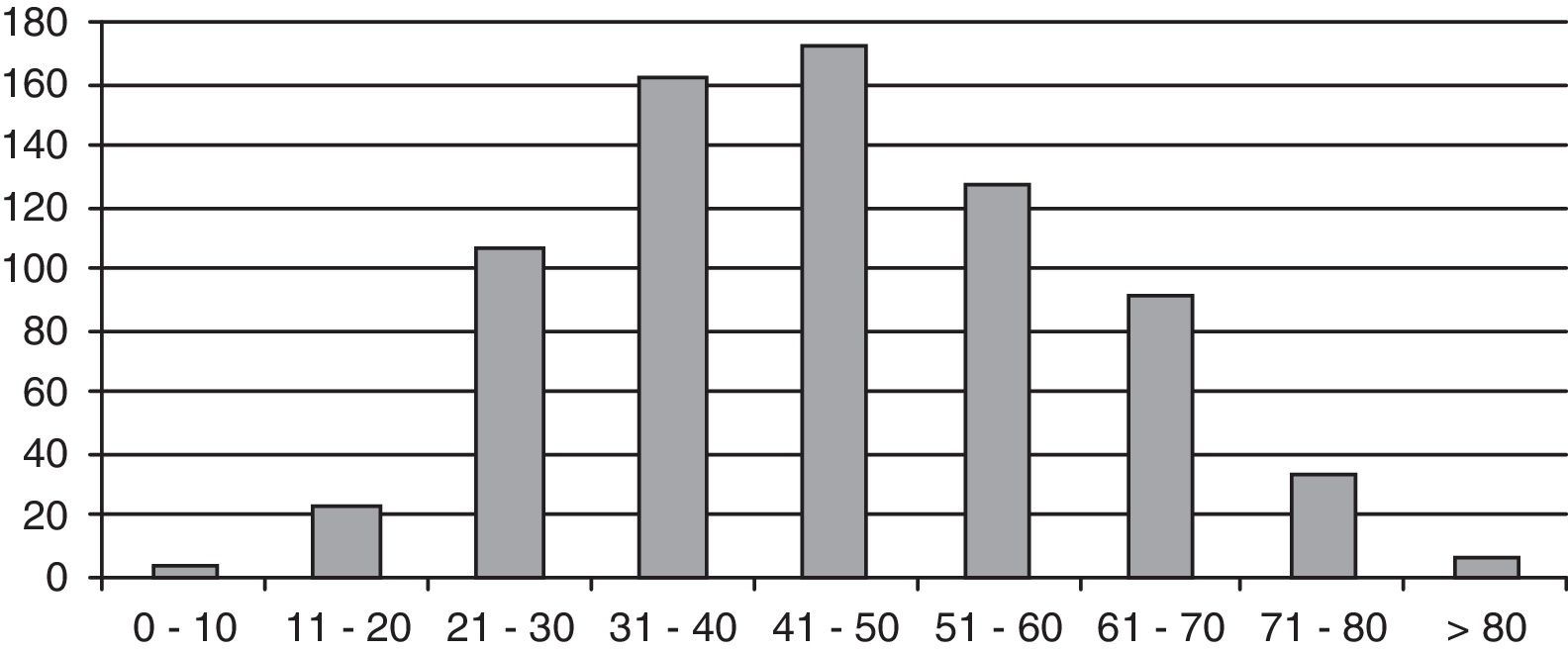
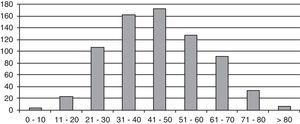
ResultadosSe estudiaron 729 pacientes, 145 varones y 584 mujeres, con un tiempo medio de seguimiento de 10,8 años (DE 8,4; rango 2 meses-42 años), lo que supone un seguimiento de 8.184 pacientes/años. La media de edad al diagnóstico fue 45,2 años (DE 15,4; rango 6-87); la distribución por edades se refleja en la figura 1.
Se perdió el seguimiento de 72 casos (20 varones y 52 mujeres) que no se incluyeron en el estudio de supervivencia, y se consideró como situación final la de la última revisión válida. Fallecieron 59 pacientes (9%), 21 de ellos (3,2%) por el carcinoma tiroideo.
El tipo histológico más frecuente fue el papilar, con 588 casos (80,7%), sobre todo las variantes clásica (442) y folicular (100); 108 fueron foliculares, 29 carcinomas de células de Hürthle y 4 insulares. La media de edad al diagnóstico fue significativamente menor en los carcinomas papilares (42,8 años; DE 17,3) que en los foliculares (46,6; DE 15,8, p<0,05) y en los de células de Hürthle (51,8; DE 14,3, p<0,005); la diferencia entre foliculares y de células de Hürthle no fue significativa.
La media del tamaño del tumor fue 2,26cm (DE 1,74), significativamente mayor en los varones (2,7; DE 2,05) que en las mujeres (2,13; DE 1,63, p<0,005), así como en los foliculares (3,39; DE 2,01) y de células de Hürthle (3,8; DE 2,13) respecto a los papilares (1,9; DE 1,5; p<0,001); no se encontraron diferencias significativas en función de la edad al diagnóstico. Sin embargo, se objetivó una progresiva disminución a lo largo del tiempo del estudio, pasando de 3,38cm (DE 1,88) en los diagnosticados entre 1970-1981 a 2cm (DE 1,58, p<0,005) a partir de 2002.
Las variables que se asociaron significativamente con la mortalidad global fueron la edad al diagnóstico, la existencia de otros tumores malignos, la presencia de metástasis del carcinoma tiroideo en el momento del diagnóstico y los niveles de tiroglobulina en el primer control analítico tras el tratamiento quirúrgico.
Con la mortalidad específica por el carcinoma tiroideo se asociaron además el tamaño del tumor, su extensión extratiroidea en el momento de la intervención, el tipo histológico (más frecuente en los foliculares) y la recidiva local, ganglionar o a distancia. Debido al bajo número de pacientes fallecidos no fue posible realizar un análisis multivariante con todas las variables estudiadas, por lo que se ha realizado en varios pasos manteniendo como variables fijas la edad al diagnóstico y el tamaño máximo del tumor, al ser las que alcanzaron mayor nivel de significación en el análisis univariante inicial.
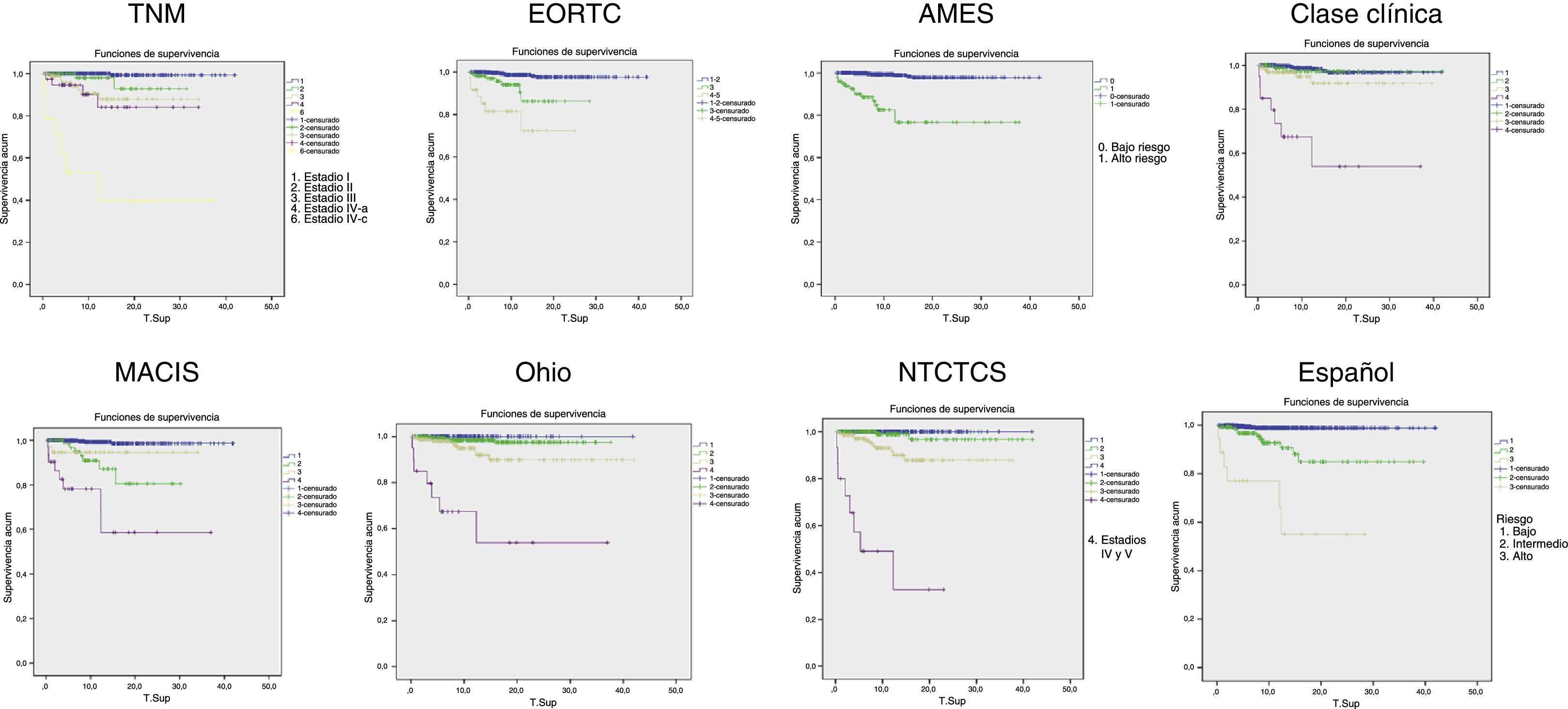
La figura 2 muestra las curvas de Kaplan-Meier de supervivencia específica por el tumor para cada sistema. En todos ellos se observa una clara correlación entre el estadio tumoral y la mortalidad, a expensas sobre todo de las diferencias entre los estadios extremos, mientras que los intermedios se aproximan más al estadio más bajo.
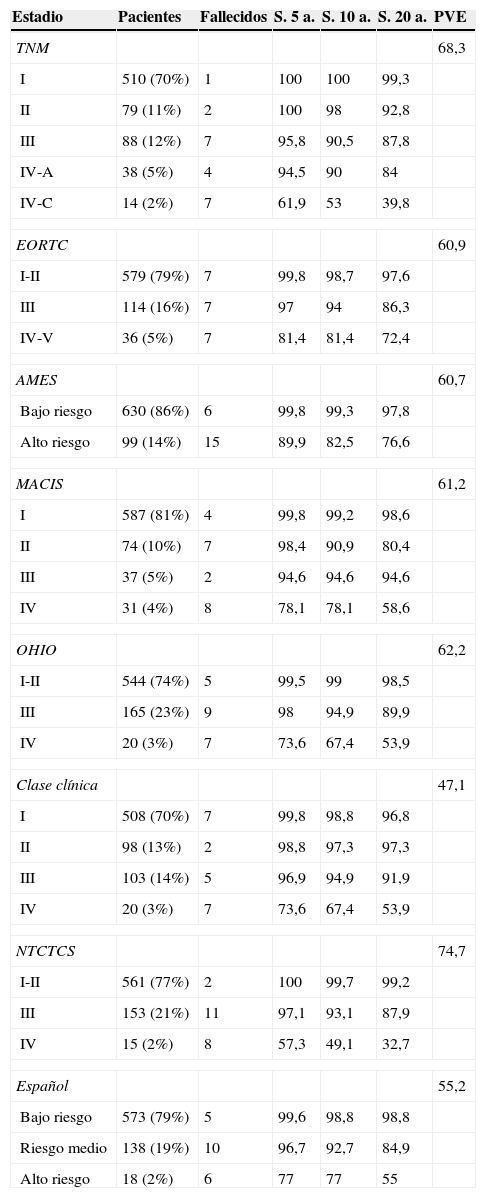
La tabla 2 muestra la distribución de los pacientes en los distintos estadios, la supervivencia a 5, 10 y 20 años y la PVE por cada sistema. En los sistemas EORTC, Ohio y NTCTCS se han agrupado los estadios i y ii porque no hubo ningún fallecimiento por el tumor en el estadio i, y en el EORTC se agruparon el iv y v porque en este último solo se incluían 3 pacientes. El sistema NTCTCS fue el que presentó una mayor PVE (74,7%), seguido por el TNM (68,3%); el resto presentaron mínimas diferencias, con PVE alrededor del 60%, salvo el sistema español (55,2%) y sobre todo la Clase clínica, que solo alcanzó un 47,1%.
Sistemas de estadificación. Pacientes incluidos en cada estadio, supervivencia a 5, 10 y 20 años y proporción de varianza explicada
| Estadio | Pacientes | Fallecidos | S. 5 a. | S. 10 a. | S. 20 a. | PVE |
|---|---|---|---|---|---|---|
| TNM | 68,3 | |||||
| I | 510 (70%) | 1 | 100 | 100 | 99,3 | |
| II | 79 (11%) | 2 | 100 | 98 | 92,8 | |
| III | 88 (12%) | 7 | 95,8 | 90,5 | 87,8 | |
| IV-A | 38 (5%) | 4 | 94,5 | 90 | 84 | |
| IV-C | 14 (2%) | 7 | 61,9 | 53 | 39,8 | |
| EORTC | 60,9 | |||||
| I-II | 579 (79%) | 7 | 99,8 | 98,7 | 97,6 | |
| III | 114 (16%) | 7 | 97 | 94 | 86,3 | |
| IV-V | 36 (5%) | 7 | 81,4 | 81,4 | 72,4 | |
| AMES | 60,7 | |||||
| Bajo riesgo | 630 (86%) | 6 | 99,8 | 99,3 | 97,8 | |
| Alto riesgo | 99 (14%) | 15 | 89,9 | 82,5 | 76,6 | |
| MACIS | 61,2 | |||||
| I | 587 (81%) | 4 | 99,8 | 99,2 | 98,6 | |
| II | 74 (10%) | 7 | 98,4 | 90,9 | 80,4 | |
| III | 37 (5%) | 2 | 94,6 | 94,6 | 94,6 | |
| IV | 31 (4%) | 8 | 78,1 | 78,1 | 58,6 | |
| OHIO | 62,2 | |||||
| I-II | 544 (74%) | 5 | 99,5 | 99 | 98,5 | |
| III | 165 (23%) | 9 | 98 | 94,9 | 89,9 | |
| IV | 20 (3%) | 7 | 73,6 | 67,4 | 53,9 | |
| Clase clínica | 47,1 | |||||
| I | 508 (70%) | 7 | 99,8 | 98,8 | 96,8 | |
| II | 98 (13%) | 2 | 98,8 | 97,3 | 97,3 | |
| III | 103 (14%) | 5 | 96,9 | 94,9 | 91,9 | |
| IV | 20 (3%) | 7 | 73,6 | 67,4 | 53,9 | |
| NTCTCS | 74,7 | |||||
| I-II | 561 (77%) | 2 | 100 | 99,7 | 99,2 | |
| III | 153 (21%) | 11 | 97,1 | 93,1 | 87,9 | |
| IV | 15 (2%) | 8 | 57,3 | 49,1 | 32,7 | |
| Español | 55,2 | |||||
| Bajo riesgo | 573 (79%) | 5 | 99,6 | 98,8 | 98,8 | |
| Riesgo medio | 138 (19%) | 10 | 96,7 | 92,7 | 84,9 | |
| Alto riesgo | 18 (2%) | 6 | 77 | 77 | 55 | |
PVE: proporción de varianza explicada.
La estadificación de los tumores malignos busca seleccionar el tratamiento más adecuado para cada caso y realizar una aproximación pronóstica, además de permitir la comparación de resultados entre distintos centros o distintos tratamientos. En el caso de los carcinomas diferenciados de tiroides su correcta estadificación está ganando importancia, dado que las guías clínicas actuales11–13 propugnan tratamientos menos intensivos que los clásicos en los tumores de bajo riesgo, que suponen la mayoría de los casos de carcinoma tiroideo.
El método más difundido es el basado en la clasificación TNM, lo que unido a su sencillez lo está convirtiendo en el «idioma común» en el cáncer de tiroides; sin embargo, presenta algunas deficiencias, sobre todo el hecho de que trata la edad como una variable categórica en vez de continua, con un punto de corte arbitrario que coincide con la media de edad de la mayoría de las cohortes publicadas, al igual que ocurre con la nuestra. Esto lleva a que con una mínima diferencia de tiempo un mismo caso puede pasar de un estadio bajo a otro mucho más grave; así Tran Cao et al.14 critican esta distinción al comprobar que en los pacientes menores de 45 años en estadio ii la mortalidad es 11 veces mayor que en el i, mientras que en los mayores no hay diferencias, concluyendo que la clasificación actual subestima la importancia pronóstica de las metástasis en la población más joven.
El resto de sistemas estudiados o no incluyen la edad como variable (Clase clínica, Ohio) o lo hacen también como variable categórica con un punto de corte similar, salvo el MACIS y el EORTC, que la incluyen como variable continua; en este último es el factor con mayor peso específico en la ecuación pronóstica, probablemente debido a que el objetivo que se marcó fue la mortalidad global y no la específica por el tumor.
Otro problema común a todos los sistemas es que incluyen variables que solo están disponibles tras la tiroidectomía, por lo que no resultan útiles para planificar el abordaje quirúrgico inicial.
Al comparar estos sistemas en poblaciones distintas a aquellas en que se desarrollaron los resultados son muy variables, aunque en general el TNM resulta el más útil15–18. Recientemente, Wong et al.19 han desarrollado un nuevo sistema de estadificación, el Cedars-Sinai Medical Center (CSMC), y al compararlo con los sistemas previos no encuentran que ninguno sea claramente superior a los demás.
En España se han publicado 2 comparaciones, Gómez Arnáiz et al.20 solo encontraron diferencias significativas al agrupar los estadios intermedios de cada sistema al de peor pronóstico en el caso del EORTC o al de mejor en el TNM y Clase clínica, concluyendo que para la práctica clínica es más útil catalogar a los pacientes como de bajo o alto riesgo, y posteriormente Donnay et al.21 refieren que el mejor modelo predictor de recidiva es el TNM y de fallecimiento por el tumor o persistencia del mismo es la clasificación de la ETA, aunque en su publicación no se hace referencia a otros sistemas.
En nuestro estudio el sistema con mayor PVE es el NTCTCS, con escasa diferencia respecto al TNM y muy por delante del resto de sistemas estudiados. Sorprendentemente al tratarse de una población de origen similar, uno de los sistemas con peor asociación ha sido el español, solo por encima de Clase clínica.
La principal limitación de este estudio radica en el elevado porcentaje de pacientes excluidos (36,7% de la muestra inicial), principalmente por no disponer de los datos necesarios para su correcta estadificación, así como la proporción de casos perdidos a lo largo del seguimiento, que supone casi el 10% de los incluidos. Pese a ello se trata de la cohorte de pacientes con carcinomas diferenciados de tiroides más amplia comunicada en España y, tras la serie conjunta de 2 hospitales publicada por Reverter et al.22, la de mayor media de tiempo de seguimiento.
Aunque a lo largo de todo este tiempo varios médicos han intervenido en el diagnóstico y tratamiento de estos pacientes, en líneas generales el protocolo de manejo se ha mantenido constante, y las diferencias entre los primeros y últimos años se deben a una mejora de los medios diagnósticos, con la introducción de la ecografía tiroidea y la PAAF con control ecográfico en el estudio de los nódulos tiroideos.
Otra limitación inherente a la duración del estudio radica en las determinaciones de TSH, tiroglobulina y AC anti-tiroglobulina, que no estaban disponibles hasta 1981, por lo que en los 45 casos diagnosticados antes de esta fecha se desconocen sus valores iniciales, y los resultados recogidos pueden no ser equivalentes a los actuales con las distintas técnicas analíticas empleadas durante este tiempo al carecer de las especificaciones de las técnicas previas.
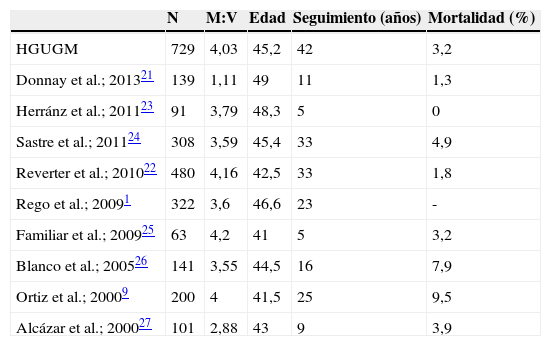
Las características clínicas y demográficas de esta cohorte son similares a las de otras series españolas1,9,21–27 (tabla 3), salvo la menor proporción mujeres:varones encontrada por Donnay et al.21, e internacionales2,19,28–32. La mortalidad específica por el tumor es también similar a las publicadas, si bien no es posible la comparación directa entre tasas brutas de mortalidad ya que, en un tumor como el carcinoma diferenciado de tiroides, con una mortalidad muy baja y a muy largo plazo, para valorar posibles diferencias en su mortalidad, hay que hacerlo en periodos de tiempo establecidos, analizando la supervivencia según las curvas de Kaplan-Meier.
Comparación con otras series españolas
| N | M:V | Edad | Seguimiento (años) | Mortalidad (%) | |
|---|---|---|---|---|---|
| HGUGM | 729 | 4,03 | 45,2 | 42 | 3,2 |
| Donnay et al.; 201321 | 139 | 1,11 | 49 | 11 | 1,3 |
| Herránz et al.; 201123 | 91 | 3,79 | 48,3 | 5 | 0 |
| Sastre et al.; 201124 | 308 | 3,59 | 45,4 | 33 | 4,9 |
| Reverter et al.; 201022 | 480 | 4,16 | 42,5 | 33 | 1,8 |
| Rego et al.; 20091 | 322 | 3,6 | 46,6 | 23 | - |
| Familiar et al.; 200925 | 63 | 4,2 | 41 | 5 | 3,2 |
| Blanco et al.; 200526 | 141 | 3,55 | 44,5 | 16 | 7,9 |
| Ortiz et al.; 20009 | 200 | 4 | 41,5 | 25 | 9,5 |
| Alcázar et al.; 200027 | 101 | 2,88 | 43 | 9 | 3,9 |
M:V: proporción mujeres:varones.
En conclusión, aunque el sistema que mejor se ajusta a nuestra población ha sido el NTCTCS, por su sencillez y amplia difusión parece más adecuado utilizar el TNM para la estadificación de los pacientes con carcinoma diferenciado de tiroides.
Sería deseable el desarrollo de un sistema predictor independiente del resultado del estudio histológico de la pieza quirúrgica, con la inclusión de variables radiológicas, citológicas o genéticas, para poder programar adecuadamente la extensión de la tiroidectomía.
Conflicto de interesesLos autores no presentan ningún conflicto de intereses en relación con el presente artículo.
Al profesor Antonino Jara, jefe emérito del Servicio de Endocrinología y Nutrición del HGUGM, por su continuo estímulo para la realización del presente trabajo y por la revisión crítica del original; al Dr. Angel Bittini, del Servicio de Medicina Nuclear, por su recogida de datos de pacientes durante décadas, su excelente manejo y la cesión de estos datos; a José María Bellón, del Instituto de Investigación Sanitaria del Hospital Gregorio Marañón, por su colaboración en el tratamiento estadístico de los datos; y a todos los compañeros que a lo largo de este tiempo han seguido y tratado a los pacientes incluidos en este estudio.