La orbitopatía de Graves (OG) constituye un desafío importante tanto clínico como terapéutico1,2. La OG es un trastorno autoinmunitario y la manifestación extratiroidea más habitual y más importante de la enfermedad de Graves, pero puede ocurrir en pacientes sin un hipertiroidismo actual o previo (eutiroideos o enfermedad de Graves oftálmica) o en pacientes que son hipotiroideos debido a una tiroiditis autoinmunitaria crónica (Hashimoto)3,4.
Aunque la patogenia de la OG5-9 está más allá del ámbito de este documento, se llama la atención sobre la relación entre la órbita y el tiroides, que tiene implicaciones importantes tanto clínicas como terapéuticas. El tratamiento óptimo de la OG requiere un abordaje coordinado y dirigido tanto a la disfunción tiroidea como a la orbitopatía10,11.
La OG a menudo es leve y autolimitada y probablemente se esté reduciendo su frecuencia, con sólo un 3-5% de casos que representan una amenaza para la visión3,4. La aparición y el progreso de la OG están influidos por factores que son potencialmente controlables, como fumar cigarrillos, la disfunción tiroidea y la elección de las modalidades de tratamiento para el hipertiroidismo12,13.
El tratamiento inadecuado de los pacientes con OG parece estar muy extendido2. El objetivo de este documento es proporcionar una información práctica para el tratamiento de los pacientes con OG, tanto para los no especialistas como para aquellos con un interés especial y experiencia en este trastorno, y de esta forma mejorar el pronóstico de los pacientes con OG. Esperamos que el documento también sea útil para los enfermeros especialistas, los optometristas y los que estén implicados en funciones directivas y que proporcione un punto de partida para la valoración y la investigación.
En este campo son poco frecuentes los ensayos clínicos aleatorizados (ECA). El documento, por lo tanto, debe ser considerado una declaración de consenso, más que una directiva.
MÉTODOSEl grupo europeo en OG (EUGOGO, del inglés European Group on Graves Orbitopathy) está formado por un consorcio multidisciplinario de clínicos procedentes de centros europeos, que comparten el compromiso de mejorar el tratamiento de los pacientes con OG (www.eugogo.org). En noviembre de 2006 se formó un grupo de trabajo y se mantuvo su primera reunión.
Las discusiones posteriores tuvieron lugar por vía electrónica y en una reunión posterior en mayo de 2007. Después de la revisión, se sometió el documento a la European Thyroid Association (ETA) y a las páginas en internet de la European Society of Ophthalmic Reconstructive and Plastic Surgeons para una consulta más amplia. El documento se presentó en la Reunión anual de la ETA en Leipzig, Alemania, en septiembre de 2007.
Los artículos relevantes se identificaron por búsqueda en MEDLINE utilizando los términos oftalmopatía u orbitopatía de Graves, oftalmopatía u orbitopatía relacionada con el tiroides y enfermedad ocular tiroidea. La definición de los tipos de evidencia y el grado de recomendaciones utilizado se ajustan a los de la Agency for Health Care Policy and Research, actualmente Agency for Healthcare Research and Quality (www.ahrq.gov) (tabla 1).
Tipos de evidencia y grados de las recomendaciones
| Nivel | Tipo de evidencia | |
| Tipo de evidencia (basado en la Agency for Health Care Policy and Research [AHCPR 1992]) | ||
| Ia | Evidencia obtenida por el metaanálisis de ensayos controlados y aleatorizados | |
| Ib | Evidencia obtenida de al menos un ensayo controlado y aleatorizado | |
| IIa | Evidencia obtenida de al menos un estudio controlado y bien diseñado sin aleatorización | |
| Ilb | Evidencia obtenida de al menos otro tipo de estudio bien diseñado y cuasiexperimental | |
| III | Evidencia obtenida por estudios descriptivos no experimentales bien diseñados, como estudios comparativos, estudios de correlación y estudios de casos y controles | |
| IV | Evidencia obtenida por informes u opiniones de comités de expertos y/o experiencia clínica de autoridades respetadas | |
| Grado | Niveles de evidencia | Descripción |
| Grado de las recomendaciones, basado en la Agency for Healthcare Research and Quality (AHRQ 1994) | ||
| A | Ia, Ib | Requiere al menos un ensayo controlado y aleatorizado como parte del cuerpo de literatura médica con buenas calidad general y coherencia dirigido a la recomendación específica |
| B | IIa, IIb, III | Requiere la disponibilidad de estudios clínicos bien dirigidos, pero no de ensayos clínicos aleatorizados sobre el tema de la recomendación |
| C | IV | Requiere la evidencia de informes u opiniones de comités de expertos y/o la experiencia clínica de autoridades respetadas. Indica la ausencia de estudios de buena calidad con aplicación directa |
| Punto de buena práctica recomendado por el grupo de desarrollo del consenso. | ||
Este artículo se ha publicado también en el número de marzo de la revista Thyroid.
RECOMENDACIONESRemisión a una clínica combinada tiroidea ocular y valoración inicial
- a.
¿Debe remitirse a todos los pacientes con OG a una clínica combinada tiroidea ocular10? (cuadro 1).
- –
Todos los pacientes con OG, excepto los casos más leves, deben ser tratados por un médico con experiencia particular en el tratamiento de la OG o, mejor, ser remitidos a una clínica combinada tiroidea ocular para evaluación y tratamiento posterior.
- –
Muchos pacientes con OG nunca llegan a la clínica combinada tiroidea ocular o son remitidos demasiado tarde para beneficiarse de los tratamientos2. Esta práctica no es deseable y puede ocasionar un resultado inadecuado y a veces la pérdida de la visión.
- –
En el cuadro 1 se recomienda y se resume una herramienta simple1 para que los médicos generales evalúen a los pacientes.
Herramientas para la remisión de pacientes con OG a una clínica combinada tiroidea ocularLos médicos de asistencia primaria, los médicos generales, los internistas generales y los especialistas sin experiencia particular en el tratamiento de una OG deben remitir a los pacientes con OG, a excepción de los casos más leves, a una clínica combinada tiroidea ocular para su evaluación y tratamiento (IV, C).
Evaluación y criterios para la remisión recomendados por EUGOGO (IV, C):
- –
Pacientes con antecedentes de enfermedad de Graves que no tienen síntomas ni signos de OG, no requieren evaluaciones oftalmológicas posteriores y no necesitan ser remitidos a una clínica combinada tiroidea ocular.
- –
Los pacientes con presentaciones poco habituales (OG unilateral o OG eutiroidea) deben ser remitidos, aunque sus síntomas o signos sean leves, para hacer un diagnóstico exacto.
- –
Todos los demás casos deben ser examinados según el protocolo indicado más abajo (IV, C), como habían recomendado previamente Wiersinga et al1.
Remitir urgentemente ante cualquiera de los siguientes:
Síntomas Deterioro inexplicable de la visión Conciencia de cambio en la intensidad o en la calidad de la visión del color en uno o en ambos ojos Antecedentes de ojo(s) que se "salen" repentinamente (subluxación ocular) Signos Opacidad evidente de la córnea Córnea aún visible cuando los párpados se cierran Inflamación de la papila óptica Remitir no urgentemente ante cualquiera de los siguientes:
Síntomas Ojos anormalmente sensibles a la luz: molestias o deterioro en los últimos 1-2 meses Ojos excesivamente arenosos y que no mejoran después de 1 semana de lubricantes tópicos Dolor en o detrás de los ojos: molestias o deterioro en los últimos 1-2 meses Cambio progresivo en el aspecto de los ojos y/o los párpados en los últimos 1-2 meses El aspecto de los ojos ha cambiado y ha causado preocupación en el paciente Visión de dos imágenes separadas cuando sólo debería haber una Signos Retracción palpebral molesta Inflamación o enrojecimiento anormal del párpado(s) o de la conjuntiva Restricción de los movimientos oculares o estrabismo manifiesto Inclinación de la cabeza para evitar la doble visión Se remite al lector a la tabla 1 para la explicación del sistema de graduación de las recomendaciones.
- –
- a.
¿Está relacionado el tabaquismo con la aparición, la gravedad y la evolución de la OG? (cuadro 2).
- –
Hay relación constante y firme entre el tabaquismo y la OG12-24.
- –
Los fumadores sufren OG más graves14,15,17 que los no fumadores.
- –
Se ha demostrado una relación dosis-respuesta entre el número de cigarrillos fumados a diario y la probabilidad de que se desarrolle una OG21.
- –
El tabaquismo aumenta la probabilidad de evolución de una OG después de terapia con yodo radiactivo para el hipertiroidismo25-27.
- –
Hay algunos indicios de que el tabaquismo retrasa o empeora los resultados de los tratamientos para la OG28,29.
- –
Existen algunas pruebas retrospectivas de que el abandono del tabaco se relaciona con un mejor pronóstico de la OG19,21.
Tabaquismo y OGSe debe informar a todos los pacientes con enfermedad de Graves sobre los riesgos del tabaquismo para la OG (IV, C) haciendo hincapié en los efectos dañinos del tabaquismo sobre:
- –
El desarrollo de una OG (Ilb, B)
- –
El deterioro de una OG preexistente (Ilb, B)
- –
La eficacia de los tratamientos para la OG (Ilb, B)
- –
El progreso de una OG tras el tratamiento con yodo radiactivo (Ib, A)
Si el consejo solo es ineficaz, hay que considerar la remisión a las clínicas para dejar de fumar u otras estrategias para acabar con el tabaquismo (IV, C).
- –
¿Es importante la corrección de las disfunción tiroidea para la OG? (cuadro 3).
- –
Los pacientes con una función tiroidea descontrolada (tanto hipertiroidismo como hipotiroidismo) tienen más probabilidad de tener una OG grave que los pacientes en eutiroidismo30-32.
Tratamiento del hipertiroidismo y de la OGEl eutiroidismo debe restablecerse inmediatamente y mantenerse estable en todos los pacientes con OG (III, B).
Es imperativo el control frecuente del estado tiroideo (cada 4-6 semanas) en las fases iniciales del tratamiento cuando se esperan cambios en el estado de la tiroides (IV, C).
Se debe ofrecer a los pacientes con una OG activa a quienes se haya administrado yodo radiactivo una cobertura profiláctica con esteroides (comenzando con 0,3-0,5 mg de prednisona/kg de peso corporal diarios por vía oral, 1-3 días después del yodo radiactivo y reduciendo progresivamente la dosis hasta su retirada unos 3 meses más tarde) (Ib, A). Períodos más cortos (1-2 meses) de terapia con glucocorticoides pueden ser igualmente protectores (IV, C).
Los pacientes con una OG inactiva pueden recibir de forma segura yodo radiactivo sin cobertura esteroidea, en tanto se evite el hipotiroidismo (IIb, B), sobre todo si otros factores de riesgo de evolución de la OG, como el tabaquismo, están ausentes (IV, C).
- –
- b.
¿Hay alguna relación entre la modalidad de tratamiento del hipertiroidismo y la evolución de la OG?
- –
La terapia con fármacos antitiroideos (FAT)27,30,33 y la tiroidectomía no afectan a la evolución de la OG26,34-36, aunque el papel de la segunda precisa de más estudios.
- –
No se ha demostrado que algún FAT o régimen o algún tipo de tiroidectomía (total o subtotal) tenga ventajas en el pronóstico de la OG.
- –
Los pocos ECA disponibles sobre los efectos de la terapia con yodo radiactivo en la OG muestran que una determinada proporción de pacientes (~15%) contraen una enfermedad ocular nueva o experimentan la evolución de una OG preexistente en los 6 meses después de la terapia con yodo radiactivo25-27. En un 5% de los pacientes, el empeoramiento se mantuvo al año y precisó de tratamiento adicional25. El riesgo está casi eliminado dando una tanda corta (~3 meses) de glucocorticoides orales (GC) tras la terapia con yodo radiactivo25,27 y evitando el hipotiroidismo después del tratamiento32. Una administración más corta de GC orales (1-2 meses) puede dar la misma protección.
- –
El riesgo de exacerbación de una OG preexistente consecutiva a la terapia con yodo radiactivo es despreciable y la cobertura con esteroides puede evitarse en pacientes con enfermedad ocular inactiva, en tanto se evite el hipotiroidismo tras el yodo radiactivo37,38 y otros factores de riesgo para la evolución de la OG, como el tabaquismo28 y los valores elevados de anticuerpos contra el receptor de la tirotropina (> 7,5 UI/l)39, estén ausentes40.
- –
- a.
¿Existen medidas sencillas y válidas que puedan aliviar parte de los síntomas de la OG? (cuadro 4).
- –
Los síntomas de la exposición corneal (sensación de arenilla, lagrimeo y fotofobia) a menudo acompañan a la OG activa y pueden persistir si la retracción palpebral es grave. Tales pacientes se pueden beneficiar del uso de lubricantes3,4.
- –
La pomada nocturna es muy beneficiosa para el cierre incompleto de los párpados, siempre que la córnea esté protegida3,4. De lo contrario será necesaria la intervención urgente.
- –
Los prismas pueden controlar la diplopía intermitente o constante y dormir con la cabeza sobreelevada puede reducir la inflamación matinal de los párpados. Los diuréticos son muy poco útiles.
- –
Las inyecciones de toxina botulínica pueden reducir la retracción del párpado superior41, pero este procedimiento debe realizarse en centros especializados.
Medidas simples que pueden aliviar los síntomas de la OGSe recomienda el uso de colirios lubricantes durante el día y/o pomadas lubricantes durante la noche a todos los pacientes con OG que tengan síntomas de exposición corneal (III, B).
Los pacientes con diplopía sintomática deben utilizar prismas ópticos si es necesario (IV, C).
Se puede considerar la inyección de toxina botulínica para la retracción del párpado superior en centros que tengan experiencia con esta técnica (IV, C).
- –
- a.
¿Qué protocolo debe seguirse para una evaluación detallada de los pacientes con OG en los centros especializados? (cuadros 5 y 6).
- –
La toma de decisiones sobre el tratamiento de los pacientes con OG requiere una evaluación detallada de los ojos, el conocimiento de la historia natural de la enfermedad, la perspectiva sobre el impacto de la OG en el paciente individual42 y la valoración de la eficacia y los efectos secundarios de las terapias.
Valoración de la actividad y de la gravedad en la OGEUGOGO recomienda las siguientes valoraciones para los pacientes con OG en los centros especializados (IV, C), como han notificado anteriormente Wiersinga et al1:
- a.
Medidas de la actividad basadas en las características clásicas de la inflamación: la puntuación de la actividad clínica (PAC) es la suma de todos los elementos presentes43,44:
- –
Dolor retrobulbar espontáneo
- –
Dolor al intentar subir o bajar la vista
- –
Enrojecimiento de los párpados
- –
Enrojecimiento de la conjuntiva
- –
Inflamación de los párpados
- –
Inflamación de la carúncula y/o de los pliegues
- –
Edema conjuntival
- –
Una PAC = 3/7 indica una OG activa
- –
- b.
Medidas de la gravedad:
- –
Apertura de los párpados (distancia entre los márgenes del párpado en milímetros con el paciente mirando en posición primaria, sentado relajado y con fijación a distancia)
- –
Inflamación de los párpados (ausente/equívoca, moderada, grave) (www.eugogo.org)
- –
Enrojecimiento de los párpados (ausente/presente) (www.eugogo.org)
- –
Enrojecimiento de la conjuntiva (ausente/presente) (www.eugogo.org)
- –
Edema de la conjuntiva (ausente, presente) (www.eugogo.org)
- –
Inflamación de la carúncula o de los pliegues (ausente, presente) (www.eugogo.org)
- –
Exoftalmos (medido en milímetros utilizando el mismo exoftalmómetro de Hertel y la misma distancia intercántica para cada paciente individual)
- –
Puntuación subjetiva de la diplopía (0 = sin diplopía; 1 = intermitente, es decir, diplopía en la posición primaria de la mirada, cuando se está cansado o al despertarse por primera vez; 2 = inconstante, es decir, diplopía en posiciones extremas de la mirada; 3 = constante, es decir, diplopía continua en posición primaria o leyendo)
- –
Afección del músculo ocular (separación en grados) (www.eugogo.org)
- –
Afección corneal (ausente/puntiforme, queratopatía/úlcera)
- –
Afección del nervio óptico (agudeza visual con la mejor corrección, visión de color, papila óptica, defecto pupilar aferente relativo -ausente/presente-, más campos visuales si se sospecha compresión del nervio óptico)
- –
Clasificaciones de la gravedad en la OGEUGOGO recomienda la siguiente clasificación de pacientes con OG (IV, C):
- 1.
OG con amenaza para la vista: pacientes con neuropatía óptica distiroidea (NOD) y/o rotura corneal. Esta categoría requiere una intervención inmediata.
- 2.
OG moderada a grave: pacientes con OG con amenaza para la vista cuya enfermedad ocular tiene un impacto suficiente en la vida diaria para justificar los riesgos de la inmunosupresión (si está activa) o de la intervención quirúrgica (si está inactiva). Los pacientes con una OG moderada a grave habitualmente tienen uno o más de los siguientes: retracción palpebral ≥ 2 mm, afección de los tejidos blandos moderada o grave, exoftalmos ≥ 3 mm por encima de lo normal para la raza y el sexo, diplopía inconstante o constante.
- 3.
OG leve: pacientes cuyas características de OG tienen solamente un impacto menor en la vida diaria, insuficiente para justificar el tratamiento inmunosupresor o quirúrgico. Habitualmente tienen sólo uno o más de los siguientes: retracción palpebral menor (< 2 mm), afección leve de los tejidos blandos, exoftalmos < 3 mm por encima de lo normal para la raza y el sexo, diplopía transitoria o ausente y exposición corneal sensible a los lubricantes.
- –
- b.
¿Es útil evaluar la gravedad de la OG?
- –
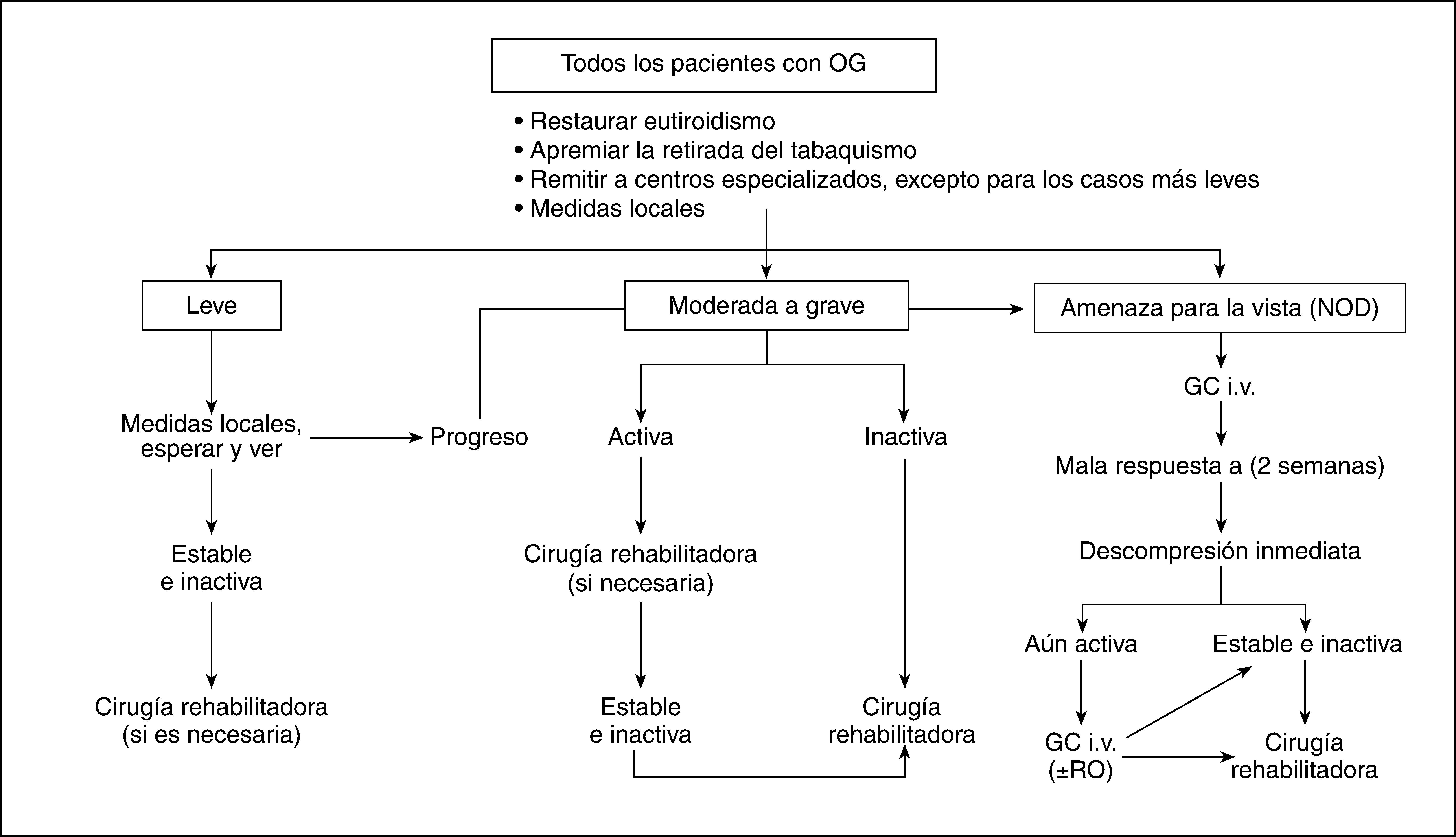
La evaluación de la gravedad de la OG está llena de dificultades; sin embargo, la clasificación de los pacientes en categorías amplias facilita la toma de decisiones (fig. 1).
Fig. 1.Tratamiento de la orbitopatía de Graves. La cirugía rehabilitadora consiste en descompresión orbitaria, cirugía del estrabismo, alargamiento del párpado y blefaroplastia/frontoplastia. Para las definiciones de la gravedad y la actividad de la OG, véase el texto. GC i.v.: glucocorticoides intravenosos; NOD: neuropatía óptica distiroidea; RO: radioterapia orbitaria.
(0.78MB). - –
La evaluación cuidadosa del impacto de la OG en la calidad de vida (CdV) con un cuestionario específico de la enfermedad (OGCdV)42 es fundamental a la hora de decidir si los tratamientos utilizados para la OG moderada a grave (véase más adelante) están justificados en los pacientes con una OG leve.
- –
- c.
¿Es útil evaluar la actividad de la OG?
- –
La evaluación de la actividad de la OG también está llena de dificultades; sin embargo, la clasificación de los pacientes en categorías de OG activa/inactiva a menudo es posible y facilita enormemente la toma de decisiones (fig. 1). Hay que considerar que los pacientes con una puntuación de actividad clínica (PAC) = 3/7 tienen una OG activa43,44.
- –
- a.
¿Cómo se puede identificar a los pacientes con OG con amenaza para la vista? (cuadros 7 y 8).
- –
La OG con amenaza para la vista se presenta habitualmente en el contexto de una neuropatía óptica distiroidea (NOD).
- –
El riesgo de rotura corneal y de perforación es significativo cuando el lagoftalmos se asocia con un fenómeno de Bell malo45.
- –
La visión también puede estar amenazada en pacientes con OG en las siguientes circunstancias raras: subluxación del globo ocular, formas graves de globo ocular congelado en presencia de lagoftalmos, pliegues coroideos y oscurecimiento visual postural46.
- –
Las entidades clínicas mencionadas precisan el reconocimiento y la atención médica inmediata1. El cuadro 1 puede utilizarse para identificar a los pacientes con OG con amenaza para la vista.
Glucocorticoides y descompresión orbitaria en NODLos glucocorticoides (GC) y la descompresión quirúrgica de la órbita son los únicos tratamientos que se han demostrado eficaces en los pacientes con NOD (III, B).
Los GC i.v. a altas dosis son la primera línea de tratamiento preferido para la NOD (III, B).
Si no hay respuesta a los GC i.v. o es mala después de 1-2 semanas, o la dosis/duración de los esteroides requeridos induce efectos secundarios significativos, se debe realizar una descompresión orbitaria inmediata (IV, C).
Se debe ofrecer inmediatamente la descompresión orbitaria a los pacientes con NOD o con rotura corneal que no puedan tolerar los GC (III, B).
Tanto la terapia con GC i.v. como la descompresión orbitaria quirúrgica deben realizarse únicamente en centros con la experiencia adecuada (IV, C).
Rotura corneal con amenaza para la vista en la OGLa rotura corneal con amenaza para la vista debe ser tratada como una emergencia (IV, C).
El tratamiento de la rotura corneal con amenaza para la vista consiste en: lubricantes tópicos frecuentes (lubricantes tópicos sin conservantes para los pacientes hiperalérgicos), cámaras de humedad, blefarorrafia, tarsorrafia u otras medidas temporales hasta que la córnea haya cicatrizado (IV, C).
Consideración de los GC sistémicos o de la descompresión quirúrgica cuando las medidas anteriores solas sean ineficaces (IV, C).
En el caso de una perforación corneal/ulceración grave, se debe considerar los antibióticos adecuados y el pegado de emergencia, la membrana amniótica como protección o el injerto corneal (IV, C).
Una vez se haya controlado la rotura corneal, es imperativo ofrecer un tratamiento para mejorar el cierre palpebral para evitar otros episodios de rotura corneal (IV, C).
- –
- b.
¿Cuál es el tratamiento de elección para la NOD?
- –
La NOD puede tratarse con GC sistémicos, cirugía o ambos.
- –
La radioterapia orbitaria no está recomendada en el caso de NOD, a menos que se utilice como ayuda de terapias comprobadas.
- –
Los GC intravenosos administrados a altas dosis de forma pulsátil son más eficaces y se asocian con menos efectos adversos que los esteroides orales o retrobulbares3,4,47-51 (tabla 2).
Tabla 2.Ensayos clínicos aleatorizados de la metilprednisolona intravenosa frente a la prednisona oral
Aleatorización del tratamiento Tasas de respuesta (%) P Bibliografía Grupo A Grupo B Grupo A (%) Grupo B (%) Metilprednisolona i.v.a + radioterapiab (n = 41) Prednisona oralc + radioterapiab (n = 41) 88 63 < 0,02 Marcocci et al47 Metilprednisolona i.v.d (n = 35) Prednisona orale (n = 35) 77 51 < 0,01 Kahaly et al50 a15 mg/kg durante cuatro ciclos; después, 7,5 mg/kg durante cuatro ciclos; cada ciclo consistió en dos infusiones a días alternos a intervalos de 2 semanas.
c100 mg diarios durante 1 semana; después, reducción semanal hasta 25 mg diarios y después reducción progresiva de 5 mg cada 2 semanas.
- –
Se puede esperar una mejoría de la función del nervio óptico tras la administración de dosis altas de GC intravenosos en 1-2 semanas52.
- –
La recaída de la NOD puede ocurrir cuando los GC sistémicos se retiran demasiado deprisa (véase "Tratamiento de la OG moderada a grave")3,4.
- –
La cirugía de descompresión puede producir una resolución rápida de la NOD, con un perfil aceptable de efectos adversos. Sin embargo, frecuentemente se necesita de los GC y la cirugía para el estrabismo y en ocasiones es necesaria una cirugía de descompresión posterior53. La cirugía de descompresión inmediata como terapia de primera elección no ofrece unos mejores resultados, en comparación con los GC intravenosos como primera elección, ni elimina la necesidad de tratar después con GC54.
- –
- e.
¿Cuál es el tratamiento de elección para la rotura corneal con amenaza para la vista?
- –
En la rotura corneal grave con amenaza para la vista, cuando la córnea no puede protegerse con el cierre del párpado, están indicados los lubricantes tópicos cada hora; sin embargo, esta intervención por sí sola puede ser insuficiente para prevenir la ulceración, la disminución del espesor y la perforación. En tales casos, se necesitan medidas específicas para mejorar el cierre palpebral.
- –
Una cámara húmeda o un cierre ocular temporal por blefarorrafia o tarsorrafia o las inyecciones de toxina botulínica pueden ayudar a ganar tiempo hasta que se produzca la cicatrización corneal55.
- –
Nunca se ha estudiado específicamente el efecto de los GC en la exposición corneal grave.
- –
La mayoría de los estudios sobre los efectos de la descompresión orbitaria notifican una reducción de los síntomas relacionada con una queratopatía por exposición; en raras ocasiones, las úlceras corneales graves pueden persistir tras la cirugía por descompresión si persiste el lagoftalmos56.
- –
- a.
¿Es necesario el tratamiento en todo paciente con una OG moderada a grave? (cuadros 9 y 10).
- –
Muchos pacientes en esta categoría deben ser tenidos en cuenta para el tratamiento, a excepción de los pacientes que son asintomáticos o que no desean ser tratados.
- –
Los pacientes con una OG moderada a grave y activa (PAC = 3/7) deben tratarse con modalidades inmunosupresoras, mientras que los que tienen una OG inactiva se pueden beneficiar de una cirugía rehabilitadora (véase más adelante) (fig. 1).
Tratamiento de la OG moderada a grave que esté activaEl tratamiento de elección para la OG moderada a grave activa (PAC = 3/7) consiste en glucocorticoides (GC) i.v. pulsados (Ib, A). Este tratamiento debe realizarse en centros con la experiencia adecuada (IV, C).
La dosis total acumulada de metilprednisolona no debe exceder los 8 g en una tanda de tratamiento (III, B).
Antes de tratar a los pacientes con GC i.v. a altas dosis, se debe explorarlos en busca de disfunción hepática, hipertensión arterial, antecedentes de úlcera, diabetes mellitus, infección urinaria y glaucoma y después controlar los efectos secundarios (IV, C).
Cuando se utiliza terapia con GC orales (dosis media diaria > 5 mg de prednisona o equivalente) a largo plazo (> 3 meses) están recomendados los bisfosfonatos (Ia, A). Es razonable indicar también la utilización de agentes antirreabsortivos cuando se utilizan los GC i.v. (IV, C).
Se debe considerar la irradiación orbitaria (RO) en pacientes con enfermedad activa que presenten diplopía o una motilidad restringida (Ib, A).
La RO con dosis acumuladas inferiores (10 Gy) puede ser tan eficaz y mejor tolerada a que la RO con dosis mayores (20 Gy) (Ib, A).
Las dosis > 20 Gy no están recomendadas (IV, C).
Hay que tener precaución antes de administrar la RO a pacientes menores de 35 años; se debe evitar la RO en pacientes con retinopatía diabética o hipertensión grave (III, B).
La combinación de GC orales con RO es más eficaz que cualquiera de los tratamientos aislados (Ib, A), pero faltan ensayos clínicos aleatorizados que demuestren que la combinación de GC i.v. con RO es mejor que los GC i.v. solos (IV, C).
Momento adecuado y secuencia de la cirugía para la OGEl momento adecuado y la secuencia de las intervenciones quirúrgicas debe ser cuidadosamente planificado (IV, C).
El tratamiento quirúrgico debe realizarse en el siguiente orden: descompresión orbitaria, cirugía del estrabismo y alargamiento del párpado con o seguido por blefaroplastia/frontoplastia, ya que los efectos secundarios de la etapa precedente pueden interferir en la etapa siguiente (III, B).
La cirugía rehabilitadora debe realizarse únicamente en pacientes que han tenido una OG inactiva durante al menos 6 meses (III, B).
La cirugía rehabilitadora debe realizarse únicamente en centros con la experiencia adecuada (IV, C).
- –
- b.
¿Cuáles son los tratamientos no quirúrgicos de elección para la OG moderada a grave?
- –
Glucocorticoides. La terapia con GC se ha utilizado en el tratamiento de la OG por vía oral, local (retrobulbar o subconjuntival) o intravenosa35. La terapia con GC orales (dosis de inicio, 80-100 mg de prednisona o ~1 mg/kg de peso corporal o equivalente) requiere dosis elevadas durante períodos prolongados. No se han realizado estudios aleatorizados controlados con placebo. Los ensayos abiertos o los estudios aleatorizados en los que se comparaban los GC con otros tratamientos47,48,50,57-62 muestran una respuesta favorable en un 33-63% de los pacientes, sobre todo para los cambios en los tejidos blandos, la afección del músculo ocular de reciente aparición y la NOD. Frecuentemente la enfermedad ocular reaparece al reducir progresivamente o retirar los GC. Los efectos secundarios son frecuentes. El tratamiento prolongado con GC orales conlleva riesgo de osteoporosis49, que puede reducirse utilizando bisfosfonatos u otros fármacos antirreabsortivos63,64. La terapia con GC retrobulbares o subconjuntivales es menos eficaz que con GC orales65. La terapia con GC intravenosos pulsada es más eficaz que con GC orales (tasas de respuesta, un 80 frente a un 50%) (tabla 2)3,4,47-51,66. Faltan las pruebas sobre la superioridad de cualquiera de los diferentes programas con GC intravenosos (tabla 2). Aunque los GC intravenosos se toleran mejor que los orales47,50, se ha notificado daño hepático agudo y riesgo de insuficiencia hepática con riesgo vital en relación con dosis acumuladas muy elevadas67,68 en un 0,8% de los pacientes68. Los GC intravenosos son seguros si la dosis acumulada es < 8 g de metilprednisolona en una tanda terapéutica69. En los pacientes que reciben GC intravenosos hay que tener en cuenta los bisfosfonatos, aunque ningún ECA ha tratado específicamente este problema.
- –
Radioterapia orbitaria (RO). La tasa de respuesta notificada a la RO en los ensayos abiertos es de un 60%3,4,66. Habitualmente se utiliza una dosis acumulada de 20 Gy por órbita, fraccionada en 10 dosis en un período de 2 semanas70; sin embargo, un régimen alternativo de 1 Gy por semana en un período de 20 semanas fue igual de eficaz y se toleró mejor71. Las dosis mayores no son más eficaces72. Se ha encontrado que una dosis acumulada < 10 Gy es tan eficaz como el régimen estándar de 20 Gy71. La respuesta a la RO no fue diferente de la obtenida con la prednisona oral en un ECA60. Dos ECA recientes han demostrado que la RO es más eficaz que la irradiación simulada para mejorar la diplopía y la motilidad muscular ocular73,74. Otro ECA ha cuestionado la eficacia de la RO75. La RO se tolera bien habitualmente, pero puede ocasionar una exacerbación transitoria de los síntomas oculares, que es evitable con la administración concomitante de GC3,66. Los datos sobre la seguridad a largo plazo son tranquilizadores76-78, pero se mantiene la preocupación teórica sobre la carcinogénesis en los pacientes más jóvenes, sobre todo los que tienen menos de 35 años70,76-78. Aunque después de una RO pueden aparecer cataratas más precozmente que de forma natural, son fácilmente tratables con cirugía. Se han detectado anomalías microvasculares retinianas en una minoría de pacientes79, principalmente en aquellos con hipertensión arterial grave o con una retinopatía diabética concomitantes, comorbilidades que se considera contraindicaciones absolutas para la RO80,81. Es posible que la diabetes mellitus, incluso en ausencia de retinopatía, represente un factor de riesgo de cambios retinianos después de una RO78, pero las pruebas no son tan claras27. Por lo tanto, se puede considerar que la diabetes mellitus sin retinopatía es una contraindicación relativa para la RO (cuadro 12). La combinación de GC (ya sea oral o localmente) con RO es más eficaz que cualquiera de los dos tratamientos aislados57,82. No está claro si los GC intravenosos con RO son más eficaces que los GC intravenosos solos. Los tratamientos con un valor marginal o no demostrado incluyen los análogos de la somatostatina83-86, azatioprina87, ciamexona88 e inmunoglobulinas intravenosas62,89. Dos estudios han demostrado la superioridad de la combinación de GC orales y ciclosporina sobre cualquiera de los dos tratamientos aislados58,59. Estudios abiertos han indicado la utilidad potencial de los agentes inmunomoduladores, como rituximab90 o etanercept91, pero hasta ahora no se ha realizado ningún ECA.
Tratamiento de la OG leveLos glucocorticoides raramente están justificados en la OG leve, ya que los riesgos superan a los beneficios (IV, C).
La espera en observación es adecuada para la mayoría de los pacientes con una OG leve (IV, C).
En una minoría de pacientes con enfermedad leve, la calidad de vida puede estar tan profundamente afectada que justifique la utilización de los tratamientos para la enfermedad moderada a grave (IV, C).
Diabetes mellitus o hipertensión arterial y OGLa diabetes mellitus y/o la hipertensión arterial no deben ser consideradas contraindicaciones para los GC o los tratamientos quirúrgicos para la OG (IV, C).
La retinopatía diabética y/o la hipertensión arterial grave son contraindicaciones absolutas para la RO (III, B).
La diabetes mellitus sin retinopatía es una contraindicación relativa para la RO, pero las pruebas son menos claras (IV, C).
- –
- c.
¿Los tratamientos no quirúrgicos reducen la posterior necesidad de la cirugía rehabilitadora o interfieren de forma adversa con ella?
- –
No se han realizado ECA para investigar específicamente si los tratamientos no quirúrgicos reducen la posterior necesidad de la cirugía rehabilitadora, por lo que esta importante pregunta permanece sin respuesta.
- –
La teórica preocupación de que la fibrosis inducida por la radiación pueda reducir la función orbitaria y después comprometer las posteriores terapias no se sustenta en las pruebas disponibles92,93.
- –
- d.
¿Cuál es el papel de la cirugía en la OG moderada a grave?
- –
La cirugía rehabilitadora consiste en uno o más de los procedimientos siguientes: a) descompresión orbitaria (las indicaciones habituales son exoftalmos desfigurante, dolor/malestar ocular molesto y/o sensación de arenilla relacionada con una queratopatía mínima por exposición no tratable con terapias tópicas94; b) corrección del estrabismo; c) alargamiento palpebral, y d) blefaroplastia/frontoplastia. Si se requiere más de un procedimiento, la secuencia debe ser como la indicada más arriba.
- –
Es mejor aplazar la descompresión orbitaria para el exoftalmos desfigurante hasta que la orbitopatía esté inactiva durante al menos 6 meses. Sin embargo, también se puede considerar la descompresión orbitaria en pacientes con una OG activa que no toleren o no respondan a los GC, si la espera para la inactivación espontánea de la OG representa un peligro potencial para la función visual.
- –
Casi todos los estudios muestran la eficacia y la seguridad relativa de la descompresión orbitaria46,94-101; sin embargo, los estudios disponibles no permiten ninguna comparación significativa de las técnicas presentes93,94,100,101.
- –
Las cirugías del párpado y del músculo ocular son tratamientos eficaces para corregir la diplopía y mejorar la función palpebral y el aspecto.
- –
La cirugía rehabilitadora ofrece los mejores resultados cuando la OG es inactiva. La duración muy larga de la OG no es una contraindicación para la descompresión rehabilitadora100.
- –
- e.
¿La descompresión orbitaria compromete la posterior terapia no quirúrgica?
- –
En el raro caso de que se reactive una OG tras la cirugía rehabilitadora, los GC sistémicos y/o la RO pueden utilizarse con la eficacia habitual esperada99.
- –
- a.
¿Están indicados o son útiles los GC y/o la radioterapia orbitaria en la OG leve? (cuadro 11).
- b.
¿Es una estrategia razonable "esperar y ver"?
- –
La OG es una enfermedad autolimitada. En ausencia de tratamientos eficaces con mínimos efectos secundarios, la espera en observación es apropiada para la mayoría de los pacientes con enfermedad leve, sobre todo aquellos con una CdV satisfactoria, valorada mediante el cuestionario EUGOGO (www.eugogo.org).
- –
- c.
¿Cómo y cuándo se debe tratar la retracción palpebral, la inflamación de los tejidos blandos y el exoftalmos leves en el curso de la enfermedad orbitaria?
- –
A veces incluso la retracción palpebral, la inflamación de los tejidos blandos o el exoftalmos leves tienen un impacto profundamente negativo en el funcionamiento psicosocial y la CdV, dependiendo de las circunstancias de cada individuo102,103.
- –
Se puede ofrecer tratamiento a estos pacientes si la consideración cuidadosa de los riesgos y los beneficios favorece la intervención.
- –
- a.
¿Cómo se debe tratar a un paciente diabético o hipertenso con una OG moderada a grave o con amenaza para la vista? (cuadros 12 y 13).
- –
Los GC sistémicos pueden inducir o exacerbar la diabetes mellitus y/o la hipertensión arterial. Sin embargo, las indicaciones para la utilización de esteroides en pacientes con diabetes mellitus y/o hipertensión arterial no son diferentes que en el resto de los pacientes. El estrecho seguimiento del control de la glucemia y presión arterial es importante. Se debe utilizar con precaución los diuréticos tiacídicos o del asa durante la terapia con GC a dosis elevadas para evitarla hipopotasemia. El mismo principio es válido para los tratamientos quirúrgicos.
- –
La RO puede aumentar el riesgo de retinopatía en los pacientes diabéticos e hipertensos77,78,80,81, al menos utilizando una dosis acumulada de 20 Gy.
- –
La diabetes mellitus y/o la hipertensión arterial no son contraindicaciones para la descompresión orbitaria quirúrgica u otros tratamientos quirúrgicos para la OG.
OG en niñosSe debe restaurar inmediatamente y mantener el eutiroidismo en los niños como en los adultos (III, B).
Los niños con OG deben tratarse de manera conservadora si no hay amenaza para la vista (IV, C).
Pueden utilizarse medidas simples para tratar los síntomas específicos como en el caso de los adultos (cuadro 4) (IV, C).
Se debe evitar los glucocorticoides en los niños (IV, C).
La radioterapia orbitaria está contraindicada en los niños (IV, C).
Se debe evitar la exposición al tabaquismo activo y, posiblemente, pasivo (IV, C).
- –
- b.
¿Cuál es la mejor estrategia terapéutica para la OG en la infancia?
- –
La OG es rara en la infancia debido a la baja incidencia de la enfermedad de Graves en ese grupo de edad104,105. La enfermedad ocular habitualmente es más leve en los niños que en los adultos y a menudo se estabiliza y finalmente se resuelve sin intervención105.
- –
Conseguir y mantener el eutiroidismo son objetivos tan importantes como en los pacientes adultos.
- –
Es probable que la exposición al tabaquismo (activa y, posiblemente, pasiva) sea tan perjudicial como en los adultos106-108.
- –
Debido a los efectos en el crecimiento, se debe evitar los GC a menos que haya una NOD. La RO está contraindicada en los niños. En casos aislados se ha utilizado análogos de la somatostatina, pero faltan ECA sobre su eficacia y su seguridad109.
- –
En los casos de exoftalmos grave puede ser necesaria la cirugía orbitaria, pero para la mayoría de los pacientes es adecuada una estrategia conservadora y expectante.
- –
- a.
Todos los pacientes con OG deben (fig. 1):
- –
Ser referidos a centros especializados.
- –
Ser animados a dejar el tabaquismo.
- –
Recibir tratamiento inmediato para restaurar y mantener el eutiroidismo.
- –
- b.
Los pacientes con OG con amenaza para la vista deben tratarse con GC intravenosos como tratamiento de primera línea; si la respuesta es mala después de 1-2 semanas, deben someterse a una descompresión quirúrgica urgente.
- c.
El tratamiento de elección para la OG moderada a grave son los GC intravenosos (con o sin RO) si la orbitopatía está activa; si la orbitopatía está inactiva, hay que considerar la cirugía (descompresión orbitaria, cirugía del estrabismo y/o cirugía palpebral, en ese orden).
- d.
En los pacientes con una OG leve, las medidas locales y una estrategia expectante son suficientes en la mayoría de los casos, pero el tratamiento puede estar justificado si la CdV está afectada de forma significativa.
Este documento está dedicado a la memoria de Mark Prummel (1956-2005), uno de los fundadores de EUGOGO, quien contribuyó enormemente a ampliar nuestro conocimiento de los aspectos clínicos y terapéuticos de la OG.
Los autores declaran que no ha habido apoyo financiero a este estudio ni conflicto de intereses que afecte a su imparcialidad.