La atención al paciente en su domicilio constituye una modalidad terapéutica en continuo crecimiento por todas las ventajas que implica no sólo para el paciente y su familia –ya que reduce claramente la probabilidad de complicaciones relacionadas con la estancia hospitalaria, como las infecciones nosocomiales, y permite mantener al paciente en su entorno familiar, más confortable–, sino porque además permite un mejor uso de los recursos sanitarios facilitando una mayor tasa de recambio de camas hospitalarias.
Uno de los tratamientos que en la actualidad está cobrando mayor interés en este campo es la nutrición artificial. Definimos la nutrición artificial domiciliaria (NAD) como la administración en el domicilio de los nutrientes y demás agentes terapéuticos adjuntos vía digestiva (nutrición enteral domiciliaria o NED) o vía endovenosa (nutrición parenteral domiciliaria o NPD) con la finalidad de mejorar o mantener, en el ambiente domiciliario, el estado de nutrición de un paciente. En este artículo hemos intentado revisar los aspectos de mayor interés en la NAD relacionados fundamentalmente con los datos conocidos de prevalencia, marco legislativo, singularidades en nuestro medio y particularidades de las dos opciones terapéuticas, la NED y la NPD (selección de pacientes, fórmulas, monitorización, complicaciones). Por último, nos ha parecido importante incidir en el concepto de que se necesita un plan sistematizado de formación-educación de pacientes y familiares, así como la integración de los distintos niveles asistenciales, para conseguir el éxito final de esta opción terapéutica, que no es otro que mejorar la calidad asistencial de nuestros pacientes.
Entendemos que la NAD es una terapia necesaria, pero está infrautilizada en nuestro país si nos comparamos con nuestro entorno. Sin embargo, estamos seguros de que la búsqueda continua de la eficiencia y la calidad en la atención y el cuidado de nuestros pacientes en breve permitirá el desarrollo de esta joven modalidad terapéutica.
Due to its multiple advantages, patient care at home is an expanding therapeutic modality. This therapeutic option benefits patients and their families by reducing the probability of complications related to length of hospital stay, such as nosocomial infections, as well as by offering the possibility of allowing patients to remain in the home environment, which is more comfortable. Furthermore, this treatment improves resource utilization by increasing hospital bed turnover.
One of the modalities that is receiving increasing interest is home artificial nutrition. This treatment consists of administering nutrients and another therapeutic agents into a tube feeding (home enteral nutrition [HEN]) or through venous access (home parenteral nutrition [HPN]) to improve or to maintain the patient's nutritional status in the home environment.
The present article aims to review some of the most interesting features of HAN related to the prevalence, legal framework, special situations in Spain and particular features of HEN and HPN (patient selection, diets, monitoring, complications). Lastly, this article analyzes the importance of education programs for patients and their families and of integration between the primary care and the specialist care teams for the success of this therapeutic modality, the aim of which is to improve quality of care.
Home artificial nutrition is a necessary but underused modality in Spain compared with other, similar countries. However, the continual search for efficiency and quality in patient care will help to improve the provision of this therapeutic option in the near future.
La nutrición artificial es una disciplina médica joven que forma parte del concepto de la medicina moderna y atiende los cuidados integrales relacionados con la prevención de la desnutrición y el soporte nutricional de los pacientes desnutridos. Las dos modalidades fundamentales que la definen son la nutrición enteral y la nutrición parenteral. Ambas pueden desarrollarse tanto en el ámbito hospitalario como en el extrahospitalario. Pero es evidente que las políticas sanitarias en todo el mundo abogan por facilitar el cuidado en el domicilio de los pacientes, especialmente de los pacientes crónicos, y restringir el ingreso hospitalario a los pacientes agudos y críticos.
La propuesta de atención al paciente en su domicilio constituye una modalidad terapéutica en continuo crecimiento por todas las ventajas que implica, no sólo para el paciente y su familia –ya que reduce claramente la probabilidad de complicaciones relacionadas con la estancia hospitalaria, como las infecciones nosocomiales, y por la posibilidad de mantener al paciente en su entorno familiar, más confortable–, sino por permitir un mejor uso de los recursos sanitarios facilitando una mayor tasa de recambio de camas hospitalarias. Pues bien, uno de los tratamientos que en la actualidad está cobrando mayor interés en este campo es la nutrición artificial.
Se entiende por nutrición artificial domiciliaria (NAD) la administración en el domicilio de los nutrientes y demás agentes terapéuticos adjuntos vía digestiva (nutrición enteral domiciliaria [NED]) o vía endovenosa (nutrición parenteral domiciliaria [NPD]) con la finalidad de mejorar o mantener, en el ambiente domiciliario, el estado de nutrición de un paciente1.
Por lo tanto, la NAD constituye una modalidad asistencial relevante de gran interés en la actualidad para el manejo eficiente de pacientes que precisan de un soporte nutricional artificial.
MARCO ORGANIZATIVO Y LEGISLATIVOLa organización y la legislación que regula el manejo de la NAD difieren de unos países a otros. En algunos países como Dinamarca, Francia o Reino Unido, la legislación permite que cualquier centro hospitalario pueda prescribir NED, pero tan sólo algunos centros, autorizados por el ministerio de sanidad correspondiente, pueden ser responsables del cuidado de la NPD2.
En España, la práctica de la NED estaba regulada, hasta septiembre de 2006, por el Real Decreto de enero de 1995, la Orden Ministerial de 30 de abril de 1997 y la Orden Ministerial de 2 de junio de 1998. Sin embargo, el desarrollo de los pormenores de estas normas ha sido muy diferente entre unas comunidades autónomas y otras: desde Cataluña, que ha podido establecer convenios con entidades privadas haciéndoles llegar al domicilio del paciente todo el material necesario y las fórmulas de nutrición, pasando por Galicia, comunidad en la que los pacientes tienen que acudir al centro hospitalario para recoger el material fungible y las fórmulas de nutrición, y el resto de las comunidades autónomas, en las que el material fungible se entrega a los pacientes tanto en atención especializada como en atención primaria y las fórmulas son recogidas en la farmacia de calle mediante receta oficial, pudiendo ser autorizados por las distintas gerencias diferentes profesionales de varios servicios clínicos (endocrinólogos, nefrólogos, geriatras, internistas, oncólogos, etc.)3,4.
El 16 de septiembre de 2006 se publicó el Real Decreto 1030/2006 por el que se establece la Cartera de Servicios Comunes del Sistema Nacional de Salud y el procedimiento para su actualización por el que se derogan todas las normas que hemos referido. Sin embargo, a pesar de la derogación de las normas anteriores, este decreto no ofrece cambios sustanciales al desarrollo de esta prestación sanitaria. Reafirma que la indicación de la NED deberán realizarla los facultativos especialistas adscritos a la unidad de nutrición de los hospitales o los que determinen los servicios de salud de las comunidades autónomas en sus respectivos ámbitos de gestión y competencias, de acuerdo con los protocolos que establezcan al efecto. Además mantiene las mismas indicaciones, con alguna redenominación en los epígrafes que agrupan distintas enfermedades y añadiendo al grupo de pacientes candidatos a dietas cetogénicas como la epilepsia refractaria en niños, la deficiencia del transportador tipo I de la glucosa, la deficiencia del complejo de la piruvato-deshidrogenasa, pacientes con adrenoleucodistrofia ligada al cromosoma X, neurológicamente asintomáticos, y los que presentan encefalopatía crónica con intolerancia a las proteínas de la dieta.
Respecto a la NPD no existe ninguna norma concreta. En el reciente decreto anteriormente comentado sólo se hace referencia a la NPT para incluirla en las prestaciones de la Cartera de Servicios de Atención Especializada tanto en el medio intrahospitalario como en el extrahospitalario. En la actualidad se realiza en distintos centros hospitalarios que cuentan con una unidad de nutrición clínica, que asume el cuidado de estos pacientes. Existe una corriente de opinión entre los profesionales dedicados a la atención de pacientes con NPD sobre la necesidad de establecer un marco regulador que dé protección jurídica y administrativa a esta prestación sanitaria, que se lleva haciendo desde hace años en España5.
PREVALENCIALa prevalencia de la NAD difiere mucho de unos países a otros por múltiples razones (tipo de financiación, registro voluntario, etc.) y los registros son distintos, lo que hace incomparables los datos de incidencia y prevalencia. Si en Estados Unidos durante el periodo 1989–1992 la prevalencia de NPD se situaba en 80 casos/millón de habitantes y la cifra de la NED era de 415 casos/millón de habitantes, en una de las últimas publicaciones de 1995 del registro americano se establecen cifras de 120 pacientes/millón de habitantes para la NPD y 800 casos/millón de habitantes para la NED, lo que supone un claro incremento de esta modalidad terapéutica6.
En Europa se había comunicado, del mismo periodo, una prevalencia de NPD de 0,9-12 casos/millón de habitantes. La media europea actual se establece en 4/millón de habitantes, con una gran variabilidad entre países, de los que destacan algunos de gran tradición como Escocia, con 14,3 pacientes/millón de habitantes, o Inglaterra, con 9,5 pacientes/millón de habitantes7.
En cuanto a conocer la prevalencia de NED, en Europa es muy complicado porque la mayoría de los pacientes son controlados en distintos centros hospitalarios por distintos colectivos sanitarios, y no existen registros oficiales obligatorios. Uno de los más estructurados es el registro británico, que en 1998 comunicó 12.000 pacientes con NED atendiendo a una población de 17,3 millones de habitantes. Algunos autores establecen un crecimiento anual del 20%, que es del 5% en el caso concreto de la NPD8.
En España la inclusión de datos en el registro es voluntaria. Su realización fue propuesta por un grupo de profesionales que, llegados de distintos ámbitos clínicos (hospitalización domiciliaria, atención primaria, endocrinología, medicina interna, pediatría, digestivo, unidades de nutrición, etc.), entendían que era conveniente conocer el alcance de este tratamiento. Se constituyeron en 1992 en un grupo de trabajo autodenominado Nutrición Artificial Domiciliaria y Ambulatoria (NADYA), que desde 1994 comunica los datos obtenidos en su registro. Funciona como un grupo de trabajo de la Sociedad Española de Nutrición Parenteral y Enteral (SENPE). Las últimas publicaciones sitúan la prevalencia de NPD en 2,15 pacientes/millón de habitantes de 17 centros del país y la de NED, en 3.858 pacientes de 21 centros hospitalarios de España; además, en el registro se recogen los datos demográficos de los pacientes, sus enfermedades más prevalentes por las que fue indicada la NAD, así como las complicaciones8,9.
NUTRICIÓN ENTERAL DOMICILIARIALas indicaciones técnicas de la NED no difieren de las indicaciones de la nutrición enteral hospitalaria y están bien definidas, pero pueden no coincidir con la consideración administrativa explícita para su financiación. Esto en algunas situaciones genera un conflicto difícil de explicar a los pacientes y familiares.
La terminología NED integra las distintas modalidades de nutrición enteral (NE), independientemente de la ruta de administración (oral, nasogástrica, nasoenteral o por sonda percutánea, etc.)10. Sin embargo, desde el punto de vista de la administración se insiste en priorizar el uso de sondas u ostomías (gastrostomías o yeyunostomías) sobre la vía oral para fórmulas completas, y no se considera la utilización de suplementos. En la figura 1 se representa el anverso del "Anexo 1", que recoge las enfermedades subsidiarias de financiación. A las que habría que añadir las recientemente incluidas y anteriormente comentadas, recogidas en el Real Decreto 1030/2006 de 15 de septiembre de 2006.
SELECCIÓN DE PACIENTESParece que existe un acuerdo unánime al considerar las ventajas de esta técnica de soporte nutricional; sin embargo, a nadie se le escapa que sus peculiaridades específicas obligan a considerar una serie de puntos que nos ayuden a seleccionar a los pacientes candidatos. Por todo ello, la mayoría de los autores consideran que el paciente candidato a NED debe reunir los siguientes requisitos:
- –
Ser incapaz para una alimentación oral con alimentos naturales adecuada y suficiente.
- –
Tener un tubo digestivo funcionante.
- –
Mantener una situación clínica estable que permita su traslado a su domicilio.
- –
Que el paciente y sus familiares acepten el tratamiento, dadas las implicaciones necesarias en su cuidado.
- –
Haber recibido una formación específica de personal entrenado de la unidad de nutrición para asegurar un correcto cuidado.
- –
Los cuidadores y/o el mismo paciente deben demostrar estar capacitados para el manejo de esta técnica de alimentación artificial.
- –
El domicilio debe reunir condiciones de limpieza e higiene, capacidad de almacenar los productos, evitar animales de compañía, etc.
- –
Haber comprobado la tolerancia a la fórmula enteral prescrita.
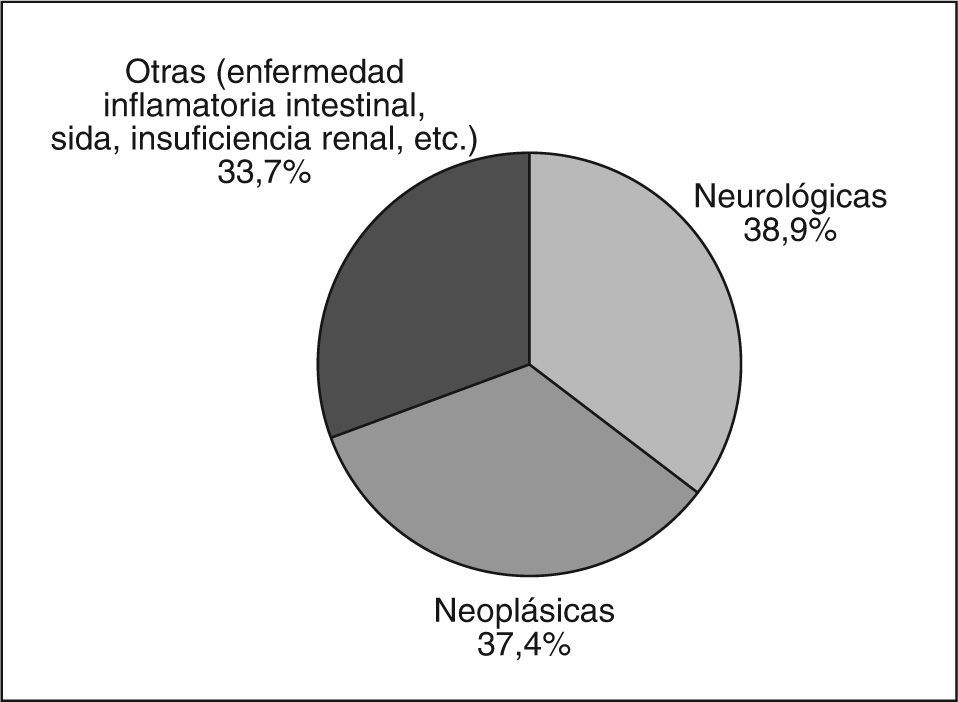
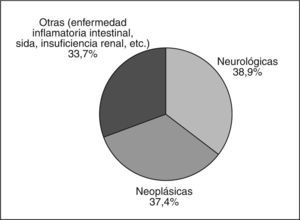
En los registros Europeos de NED se distingue una distribución de pacientes que describen un perfil bimodal, con mayor frecuencia en la infancia y en la ancianidad. Alrededor del 30% de los pacientes tienen menos de 20 años y algo más del 50% tienen más de 60 años11. En el último registro español del grupo NADYA recientemente publicado, la media de edad pediátrica estaba situada en los 6 ± 4,3 años y la de adultos, en 66,2 ± 18,9 años. La figura 2 muestra la distribución de diagnósticos de base en el registro español8.
Diagnósticos de enfermedad de base de pacientes en programas de nutrición enteral domiciliaria según el registro NADYA en España8.
En la selección de la fórmula comercial se siguen las mismas premisas que en el establecimiento de la nutrición enteral hospitalaria. En general las fórmulas más indicadas son las poliméricas estándar, las hiperproteínicas y alguna hipercalórica, dependiendo de las necesidades del paciente. Las demás fórmulas no poliméricas y especiales sólo deben indicarse en caso de trastornos relacionados con el diagnóstico de base o alteración funcional del tracto digestivo que así lo exijan12, si bien creemos que merece la pena destacar que en nuestro medio hay mayor tendencia al consumo de fórmulas diseñadas específicamente para pacientes con diabetes mellitus tipo 2 en relación con el creciente aumento de la prevalencia de esta enfermedad13.
VÍAS DE ACCESO EN NUTRICIÓN ENTERAL DOMICILIARIAUn aspecto que merece una mención especial es la vía y los métodos de administración. Es evidente que las vías de administración oral, nasogástrica, nasoenteral, por gastrostomía, por yeyunostomía, etc., dependen fundamentalmente de tres factores:
- 1.
Que la situación clínica general del paciente no ofrezca ninguna contraindicación (hemorragia digestiva, obstrucción, etc.).
- 2.
El tiempo de nutrición enteral previsto (< 4 semanas o > 4 semanas).
- 3.
Capacidad para cubrir los requerimientos (planteamiento de soporte nutricional mixto).
Parece que el eslogan "España es diferente" alcanza hasta las matizaciones de la NED, ya que sorprende que la vía oral sea la más utilizada en nuestro país, en algo más del 50% de los pacientes, mientras que en el resto de Europa lo sea la gastrostomía, utilizando sondas de bajo perfil ("botón")8,14. En nuestra opinión, para interpretar estos datos nos parece necesario recordar las diferencias en la financiación pública de esta prestación sanitaria y en la voluntariedad u obligatoriedad de los registros en los distintos países.
MÉTODOS DE ADMINISTRACIÓN DE LA NUTRICIÓN ENTERAL DOMICILIARIAEn cuanto a los métodos de administración, cuándo se utiliza una vía enteral mediante sonda depende, sobre todo, de la tolerancia del paciente y de la vía de administración elegida. El paciente y sus cuidadores suelen adaptar estas premisas a su realidad diaria de vida social.
Los tres métodos de administración de la NED posibles son:
- –
Intermitente en bolos. Consiste en administrar, de forma interrumpida y reiniciada (intermitente), pequeños volúmenes de la fórmula de nutrición enteral elegida mediante una jeringa.
- –
Intermitente o continua, mediante nutrilínea. Consiste en la administración de la fórmula comercial mediante un sistema de infusión conocido como nutrilínea (muy similar a los sistemas utilizados para la administración de sueroterapia), que en su extremo proximal conecta el recipiente que contiene la fórmula y en su extremo distal, la sonda. El ritmo de administración se regula mediante una llave tipo rueda que lleva incorporada en la mitad del sistema. En la actualidad existen sistemas de nutrilíneas "universales", que permiten adaptar su extremo proximal o cabezal a cualquier tipo de envase de los preparados comercializados en nuestro país y en el extremo distal pueden ser conectados con sondas nasogástricas de distintos calibres.
- –
Intermitente o continua mediante sistema de infusión mecanizado. Al igual que el anterior, la nutrilínea incorpora un dispositivo que se adapta a una "bomba de infusión" o sistema mecanizado (bombas no volumétricas o volumétricas) que permite prefijar el volumen y el ritmo de infusión.
Actualmente existe una amplia gama de material que permite aplicar la NE con seguridad, comodidad y eficacia para los pacientes y sus cuidadores. Entendemos que el uso racional de todos estos recursos debe realizarse en función de la enfermedad de los pacientes, la vía de acceso elegida, la habilidad y la disponibilidad de los cuidadores y la relación coste-beneficio15.
SEGUIMIENTO Y MANEJO DE COMPLICACIONESLas complicaciones que se pueden presentar en la NED son las mismas descritas en el ámbito hospitalario. Por eso es trascendental realizar una correcto seguimiento para prevenirlas y entrenar al paciente o sus cuidadores en su resolución, porque son los primeros que van a enfrentarse a ellas.
El seguimiento de los pacientes deberá asegurar la cobertura de las necesidades nutricionales en caso de que éstas cambien y resolver los problemas que pudieran producirse durante el tratamiento. Esta atención deberá mantenerse hasta que se suspenda la NED.
Un programa de seguimiento debe incluir visitas a domicilio, contactos telefónicos y escritos y visitas al centro de salud o a la unidad de nutrición correspondiente responsable de la indicación. Es recomendable individualizar el programa de visitas para poder coordinar en cada área el protocolo de actuación que interrelaciona todos los niveles asistenciales.
Asimismo, la frecuencia y la intensidad de la vigilancia dependerán fundamentalmente de la situación clínica del paciente, pues la del paciente encamado que precisa ayuda permanente para su cuidado es muy diferente de la del paciente que hace una vida sociolaboral prácticamente normal.
Por todo esto, en los pacientes con NED es importante recordar:
- –
Vigilar a diario la colocación y la fijación de la sonda para evitar migraciones.
- –
Vigilar el lugar de inserción en el caso de las ostomías.
- –
Registrar la cantidad total aportada de agua y nutrición enteral.
- –
Si el paciente además mentiene ingesta oral, también es muy importante registrarla.
- –
Controlar el estado de hidratación, y en algunos casos específicos se podrá indicar balance hídrico.
Se recomienda que cada 3 meses el equipo sanitario en relación con la unidad responsable de la indicación evalúe el tratamiento realizando:
- –
Valoración del estado nutricional.
- –
Aporte de nutrientes.
- –
Valoración bioquímica (función renal, hepática y metabolismo de hidratos de carbono y lipídico).
- –
Tolerancia al tratamiento.
El grupo NADYA propone una pauta de seguimiento que recogemos en la tabla 116.
Monitorización de los pacientes en programa de nutrición enteral domiciliaria por los equipos asistenciales
|
En cuanto a las complicaciones de la NED, se reconocen cinco grandes grupos: mecánicas, gastrointestinales, infecciosas, metabólicas y psicosociales (tabla 2).
Complicaciones de la nutrición enteral domiciliaria
| 1. | Mecánicas | La necesidad del cambio de sonda |
| Erosiones. Se debe revisar la colocación de la sonda a diario para evitar los decúbitos | ||
| Aspiración. Vigilar colocación de la sonda y método de administración, colocación del paciente, tipo de sonda, residuo gástrico | ||
| Obstrucción. Lavado correcto de la sonda, evitar los posibles grumos de la fórmula enteral y cuidado con la medicación administrada por la sonda | ||
| Irritación de la piel en las ostomías. Observar atentamente las medidas higiénicas y comprobar las dimensiones de la sonda y el orificio de la ostomía | ||
| 2. | Gastrointestinales | Molestias abdominales. Vigilar tipo de fórmula elegido y método de administración |
| Náuseas y vómitos. Valorar situación clínica del paciente. Vigilar método de administración, vaciado gástrico y medicación concomitante. Reducir los aportes de grasa y enlentecer el ritmo de administración | ||
| Diarrea. Valorar medicación concomitante, especialmente antibioterapia de amplio espectro. Comprobar hipoalbuminemia, falta de aporte de fibra en la dieta, mala absorción o intolerancia de alguno de los componentes de la dieta. Colocación de la sonda pospilórica. Administración de la fórmula a una temperatura inadecuada | ||
| Estreñimiento. Revisar estado de hidratación y la posible existencia de impacto fecal que precise extracción manual. Revisar contenido de fibra de la fórmula enteral; en caso necesario, aumentar aportes de fibra no fermentable. Revisar medicación concomitante | ||
| 3. | Infecciosas | Neumonía por aspiración. Revisar cuidados del paciente, método de administración, colocación y tamaño de la sonda. Replantear vía de administración. Si precisa tratamiento específico de la neumonía y generalmente si condiciona insuficiencia respiratoria parcial o general, precisa ingreso hospitalario |
| Otras infecciones. En general relacionadas con la falta de higiene en el cuidado del paciente o del material de administración de la nutrición enteral domiciliaria | ||
| 4. | Metabólicas | Hiperglucemia. Enfermedad de base no conocida previamente (glucosa anormal en ayunas, intolerancia a los hidratos de carbono o diabetes mellitus). Cuando aparece se puede modificar la fórmula enteral por una específica, y si persiste, se indica tratamiento individualizado (con antidiabéticos orales si no están contraindicados o se inicia insulinización) |
| Hipoglucemia. Puede aparecer por retirada brusca de la nutrición enteral. Se recomienda control de los aportes de glucosa mínimos | ||
| Deshidratación. Falta de control de aportes de agua o por aumentos de pérdidas | ||
| Cantidad de electrolitos inadecuada. Inestabilidad metabólica relacionada con la enfermedad de base (aumento de pérdidas o de necesidades no bien cubiertas). Reevaluación de la medicación concomitante. Síndrome de realimentación (obliga a replantear el soporte nutricional programado) | ||
| 5. | Psicosociales | Dificultad para adaptarse a la situación que se acompaña de cambios en la imagen corporal e incapacidad para degustar los alimentos. Precisa de información y apoyo psicológico |
Modificada de Guía de práctica clínica de nutrición enteral domiciliaria.
Probablemente la más grave sea la broncoaspiración, seguida de algunos de los trastornos metabólicos, ya que pueden tener consecuencias letales para el paciente. Según el último registro NADYA, las complicaciones más frecuentes son el cambio de sonda en un 44,5%, seguido de las gastrointestinales en un 30,5%, especialmente las diarreas; las mecánicas se registraron en un 21,7%, sobre todo la obstrucción de la sonda, y finalmente las metabólicas, en un 3,3%. Aunque en general todas se resolvieron en el domicilio, comportaron 0,02 necesidades de hospitalización por cada paciente en programas de NED8.
NUTRICIÓN PARENTERAL DOMICLIARIALa NPD es una modalidad de soporte nutricional que permite la administración de las soluciones de nutrición parenteral en el propio domicilio del paciente.
La NPD se desarrolló inicialmente en Estados Unidos a finales de los años sesenta, y en Europa se difundió a finales de los setenta17–19. En España se conoció los primeros datos de actividad tras la creación del grupo NADYA en 1992.
Como ya hemos comentado con anterioridad no existe ninguna norma legal que regule el desarrollo de esta técnica de soporte nutricional. Cada centro hospitalario, dependiendo de las condiciones individuales, ha desarrollado o no un programa de manejo de pacientes en NPD. El grupo NADYA estableció hace varios años las condiciones mínimas20.
Selección de pacientesLa NPD es una alternativa terapéutica para los pacientes con fallo intestinal permanente o transitorio que presentan déficit nutricionales y/o alteraciones hidroelectrolíticas que no se puede corregir por vía enteral y una supervivencia prevista prolongada. Sin embargo, sólo podemos considerar que la NPD es un tratamiento adecuado cuando haya una posibilidad razonable de que la técnica añada calidad y duración a la vida del paciente21,22. Existe una conciencia general de que esta técnica es eficaz en aumentar la supervivencia de los pacientes que antes de su desarrollo estaban condenados a muerte. La única alternativa al tratamiento con NPD a largo plazo sería, en algunos casos, el trasplante intestinal, cuyos resultados, por el momento, son inferiores a los de la NPD23.
Las principales causas de fallo intestinal son:
- –
La disminución de la superficie absortiva, habitualmente referida como síndrome de intestino corto (SIC). Son subsidiarios de NPD los pacientes con me nos de 50 cm de intestino delgado con colon o con menos de 1 m de intestino delgado sin colon. Lo habitual es que se llegue a esta situación tras resección masiva intestinal (en adultos por cirugía de enfermedad de Crohn, isquemia intestinal, enteritis rádica, tumores y traumatismos, y en niños por enteritis necrosante, vólvulo intestinal o malformaciones congénitas como gastroquisis o atresia intestinal).
- –
Dificultad en la digestión y absorción de nutrientes que se produce por afección extensa de la pared intestinal. En los adultos suele estar en relación con la enfermedad de Crohn, la enteritis rádica, la amiloidosis, etc., y en los niños, con diarrea secretora intratable (enteritis autoinmunitaria y enfermedad por inclusión de las microvellosidades).
- –
Alteración grave de la motilidad. Incluye la seudoobstrucción intestinal crónica idiopática y algunas formas de enfermedades de la cadena respiratoria mitocondrial que afectan al intestino.
- –
Fístulas intestinales. Generalmente de intestino proximal secundarias a afección intestinal por enfermedad de Crohn, cáncer, enteritis rádica, posquirúrgica, etc.
Aunque las causas más frecuentes son las comentadas, en los últimos años asistimos a un creciente incremento de su uso en pacientes que presentan como enfermedad de base una de las dos enfermedades que causan más emaciación, el cáncer y el sida, cuando la capacidad intestinal está mermada y es incapaz de cubrir las necesidades por vía digestiva. Así, un grupo creciente es el formado por pacientes con fallo intestinal que presentan tumores de la cavidad abdominal que se considera irresecables, no susceptibles de tratamiento oncológico curativo e imposibilitan que el paciente se alimente por vía digestiva (dieta oral, NE) por obstrucción parcial o completa, carcinomatosis peritoneal, náuseas, vómitos, etc.
Según el Informe sobre la situación de la NPD recientemente publicado por el grupo NADYA, en el último registro de 2003 se aprecian pocas modificaciones respecto a los registros de años previos, y es más prevalente su uso en pacientes con fallo intestinal por enfermedades benignas (isquemia mesentérica, enteritis rádica y alteraciones de la motilidad y enfermedad de Crohn) que en quienes padecen un cáncer (el 79 frente al 21%).
Al igual que lo ya comentado que ocurre con la NED, llama la atención que haya diferencias con la distribución de la enfermedad en Europa y en Estados Unidos, donde la indicación más frecuente es para pacientes con cáncer, seguido de la enfermedad de Crohn, la isquemia mesentérica, las alteraciones de la motilidad intestinal, la enteritis rádica y el sida6,7,24–26.
Preparación y administraciónLas soluciones de NPD se deben administrar por vía central. La vía de acceso suele ser un catéter permanente, bien tunelizado tipo Broviac o Hickman, o bien reservorios subcutáneos. La elección de la vía de acceso se determina por diversas circunstancias, como las características clínicas del paciente (la enfermedad de base impide los accesos venosos; problemas mecánicos, hemorreológicos, etc.), el tipo de vida del paciente y las ventajas de los distintos sistemas, la habilidad para la realización de una determinada técnica, disponibilidad del centro para su inserción y monitorización del cuidado fundamentalmente. En España, 2 de cada 3 pacientes utilizan un catéter tunelizado y el resto, reservorios subcutáneos.
Mayoritariamente, la fórmula infundida como NPT en el domicilio se administra de forma cíclica nocturna (a pasar en 10–12 h), lo que permite al paciente mantener una actividad cotidiana relevante.
Para asegurar un flujo constante y evitar complicaciones metabólicas, se utiliza siempre un dispositivo de infusión continua (bomba de infusión volumétrica). Tanto la bomba como el material fungible necesario para la administración de la NPD son proporcionados por el centro hospitalario responsable del cuidado y la atención del paciente.
Las soluciones estériles se preparan en campana de flujo laminar. Nos parece importante recordar que en España el desarrollo de empresas que se dediquen a esta atención domiciliaria (home care) es escaso y suele ocurrir que en cada centro la propia farmacia hospitalaria asuma el control de la elaboración y la dispensación de las fórmulas parenterales, así como los costes individuales. En un 72% de los casos, la NPD se elabora en la farmacia del centro correspondiente y son los pacientes o sus familiares quienes se desplazan a recoger las soluciones y el material fungible. Sólo en un 22,1% se establece conexión con una compañía de atención domiciliaria que se encarga de distribuir directamente las soluciones a los pacientes en su domicilio.
La NPD es uno de los tratamientos domiciliarios más costosos. Como ya hemos comentado, el sistema de financiación difiere mucho entre Estados Unidos y Europa, y en ésta, entre unos países y otros. En España el coste de este procedimiento terapéutico se imputa al centro hospitalario sin una clara partida individualizada de financiación en el contrato de gestión de los centros asistenciales, como en su momento han supuesto los tratamientos extrahospitalarios con antirretrovirales o la diálisis.
Seguimiento de los pacientesEl seguimiento de estos pacientes suele ser responsabilidad de un equipo adecuadamente formado y con experiencia en esta modalidad de soporte nutricional. En general, en nuestro país los pacientes son atendidos por las unidades de nutrición clínica y dietética de los centros hospitalarios correspondientes de cada área de salud o, en un número mucho menor, por las unidades de hospitalización a domicilio27.
A pesar de que las especiales circunstancias de esta pauta terapéutica obligan a individualizar en cada caso el seguimiento, se han establecido unas recomendaciones en sus protocolos de atención sanitaria. En general y según la estabilidad clínica y metabólica del paciente al alta, se recomienda realizar cada 1–3 meses revisión clínica y determinaciones de hemograma y bioquímica general (glucosa, urea, creatinina, sodio, potasio, calcio, fósforo, magnesio, GOT, GPT, GGT, fosfatasa alcalina, bilirrubina total y directa, albúmina, transferrina, prealbúmina y equilibrio acidobásico venoso). Se recomienda añadir a los 6 meses las determinaciones de cinc, cobre, vitamina B12, ácido fólico, vitaminas A, E, C, 25-OH-colecalciferol, TPI y tiempo de protrombina en sangre, y calciuria, fosfaturia y magnesuria. Por último, se recomienda que cada 2 años se realice una ecografía abdominal, una densitometría ósea, una resonancia magnética y determinaciones plasmáticas de selenio.
ComplicacionesA pesar de los claros beneficios que justifican el uso de esta técnica, se hace necesario conocer las cargas. Las dos más importantes son la implicación en el cuidado de la familia y las complicaciones que la técnica puede producir. En relación con la primera, es necesario recordar que los cuidadores del paciente y el propio paciente deben haber demostrado que están bien entrenados en el manejo de la administración y el cuidado de la NPT antes del alta a su domicilio. Es imprescindible invertir mucho tiempo en la educación práctica de esta medida terapéutica (entrevistas, uso de material interactivo, etc.). En el estudio realizado por Van Gossum et al28, con datos de pacientes nuevos que iniciaron NPD en diferentes países europeos entre 1993–1994, la mayoría de los pacientes eran entrenados en el hospital (con una media de 14,2 días de aprendizaje) y de acuerdo con unos protocolos establecidos en el 63% de los casos. Es fundamental mantener un estrecho contacto entre el paciente en programa de NPD, su familia, sus cuidadores y el equipo sanitario responsable.
En cuanto a las complicaciones, se sabe que su aparición es inversamente proporcional a la experiencia del equipo que atiende a estos pacientes, por lo que parece deseable plantear el control centralizado de esta población en unos cuantos centros. En general, las complicaciones de la NPD no se diferencian de las complicaciones de la NP hospitalaria. Clásicamente se distinguen complicaciones infecciosas, mecánicas y metabólicas, a las que habría que añadir hepáticas y del metabolismo óseo. Probablemente la complicación más temida sea la infección del catéter. Su frecuencia varía de unas series a otras entre 1 caso cada 11 meses y 1 caso cada 113 meses. La tasa de incidencia media es de 1 caso/paciente/año de NPD28. El último informe de NADYA ha comunicado que las complicaciones más frecuentes son las infecciosas (0,3-0,5/paciente/año; 1-2/1.000 días de catéter). En su mayoría se deben a bacterias grampositivas (estafilococo coagulasa negativo). Las causas más frecuentes de la infección suelen ser la diseminación de dichas bacterias desde la piel a la punta del catéter y la contaminación de las conexiones de los catéteres29. Recientemente, el grupo NADYA ha propuesto un protocolo de actuación para el manejo de la infección por catéter en los pacientes con NPD30. Otras complicaciones, como la rotura u obstrucción del catéter, deben ser manejadas en el ámbito hospitalario y constituyen un motivo de preocupación en el seguimiento de estos pacientes.
En este apartado me gustaría recordar que las complicaciones hepatobiliares suelen ser más frecuentes en los niños. Entre ellas se consideran la esteatosis, la colestasis y las alteraciones biliares (barro biliar y colelitiasis). El origen es multifactorial y la falta de alimentación oral suele ser un factor determinante. Los casos más graves producen una insuficiencia hepática que conduce a la muerte del paciente si no se realiza un trasplante combinado (hígado e intestino).
Por último, también la complicación metabólica ósea es muy frecuente. Podemos encontrar a pacientes con osteomalacia, osteopenia y osteoporosis y un mayor riesgo de fracturas. Su origen también es multifactorial. Debemos prevenirlas y tratarlas porque en gran medida pueden deteriorar la calidad de vida de los pacientes.
Calidad de vidaSe ha comunicado que un 65-75% de los pacientes con NPD tienen una calidad de vida aceptable, que les permite mantener un empleo o su actividad habitual31. La supervivencia de estos pacientes en general depende en un 95% de su enfermedad primaria y su edad y no de los aportes de la NPD9.
En el último registro NADYA de 2003, el tiempo medio de NPD de un paciente es 8,5 ± 4,6 meses; se mantiene en NPD por un periodo > 6 meses el 67,4% de los pacientes, y durante 1 año, el 57%. Las principales causas de retirada fueron la muerte en un 55% y el paso a la vía oral en un 45%. Como en comentarios anteriores, debemos decir también aquí que España es diferente, porque los datos de los registro estadounidenses muestran que la media de tiempo en NPD de sus pacientes fue de 100 días y las causas principales de retirada fueron la finalización del tratamiento en el 55% de los casos y la muerte en el 22%9.
En palabras de Howard, "la NPD es una técnica invasiva y que requiere del paciente tiempo y esfuerzos. Por lo tanto, el paciente sólo la aceptará cuando le reporte beneficios. Asimismo, mientras sea éste quien se responsabilice de su cuidado, el uso excesivo o inadecuado parece poco probable"32.
PROGRAMAS INTEGRALES DE EDUCACIÓNComo hemos comentado a lo largo de esta revisión, la clave para prevenir las complicaciones de la NAD en la mayoría de las ocasiones está relacionada con la formación de los pacientes y sus cuidadores. Entendemos que, tanto en la NED como en la NPD, la educación dirigida al cuidado del paciente en programa de soporte nutricional domiciliario les da seguridad y confianza y les asegura una mejor calidad de vida.
En la implantación de un programa integral de educación para NED o NPD, el médico desempeña un papel decisivo no sólo por la toma de decisiones técnicas, sino por las interconexiones entre las personas y los circuitos que forman parte de la red necesaria que hay que establecer para obtener buenos resultados. El enfermero es el responsable de la formación y el aprendizaje técnico del paciente y sus cuidadores33.
Desde que se considera que un paciente es candidato a nutrición parenteral, es imprescindible establecer un especial lazo de comunicación entre equipo sanitario, paciente y familia. El paciente o representante deben estar correctamente informados sobre la enfermedad de aquél, sobre todo de la técnica de NAD recomendada y el impacto que ésta puede tener en su enfermedad de base y su calidad de vida. Por lo tanto, se ha de recabar el consentimiento informado; si bien aún no existe ningún documento escrito oficial, algunos centros están comenzando a utilizar algunos diseñados por cada unidad y actualmente los grupos NADYA y de ética de la SENPE están definiendo los documentos de consentimiento informado para las distintas modalidades de soporte nutricional.
Lo más recomendable es que la educación se realice bajo la tutela de un programa estructurado que asegure toda la información necesaria. Se recomienda que sea muy interactivo y utilizar métodos de ayuda audiovisual. Por razones obvias, no podemos detenernos a analizar todas y cada una de las peculiaridades de la educación para la NED y la NPD, pero sí queremos recordar que el respeto a las medidas de asepsia es fundamental en el éxito del cuidado de los pacientes con NPT y los cuidados en la administración (posición del paciente, temperatura del preparado, ritmo de infusión, etc.) son esenciales para la buena tolerancia de los pacientes con NED.
Nunca se debe dar el alta a un paciente si no se ha comprobado con simulaciones prácticas que los cuidadores son capaces de realizar todos los pasos de la aplicación de la NAD sin problemas.
Entendemos que la NAD es una terapia necesaria pero infrautilizada en nuestro país, comparado con los de nuestro entorno. Sin embargo, estamos seguros de que la búsqueda continua de la eficiencia y la calidad en la atención y el cuidado de nuestros pacientes en breve permitirá que esta joven modalidad terapéutica se desarrolle.