INTRODUCCIÓN
Enzimología, modelo estructural y papel fisiológico de la glucocinasa
La glucocinasa (GK) o hexocinasa IV es una enzima fosforilante en la que, a diferencia del resto de las hexocinasas I-III, el único sustrato fisiológico relevante es la glucosa; de ahí su nombre1. Sus características cinéticas y funcionales, junto con su distribución tisular en el humano, hacen que el papel que esta enzima desempeña en el mantenimiento de la homeostasis de la glucosa sea de una gran importancia. La GK es una enzima de 50 kD con 3 isoformas, GK-I GK-L1 y GK-L2, compuestas por 458 a 466 aminoácidos2. El comportamiento cinético de sus 2 sustratos, glucosa y la forma de la adenosintrifosfato (ATP) MgATP2, aunque comparables en todas sus isoformas, es diferente del de resto de las hexocinasas I-III. La GK posee una actividad catalítica (Kcat) de 60-90 s1, un comportamiento cooperativo para la glucosa con un coeficiente de Hill (nH) de 1,5-1,9 (nH no posee unidades de expresión) y una baja afinidad por la glucosa (S0,5 = 6-10 mmol/l) con preferencia por los *-anómeros. No obstante, con respecto a su segundo sustrato, MgATP2, presenta un comportamiento no cooperativo, con una afinidad (Km) de 0,3-0,6 mmol/l1,3,4.
La manoheptulosa es un inhibidor competitivo muy útil de la GK (Ki de aproximadamente 0,5 mM)5. La GK no está regulada por sus metabolitos (glucosa-6-P) o cofactores (p. ej., Pi) del metabolismo de la glucosa en la célula ß, y se activa ante compuestos sulfidrilos, incluido el glutatión, a concentraciones fisiológicas intracelulares (p. ej., 2-6 mM). La GK es inhibida por el ácido graso palmitoil-CoA con concentraciones de µM3, y es también inhibida competitivamente con glucosa por una proteína reguladora (GKRP), a la que a su vez contrarregula la fructosa-1-fosfato6. La unión de GK a GKRP permite la transferencia reversible de GK a la matriz nuclear7.
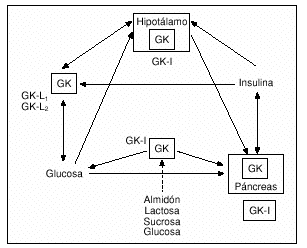
La GK se expresa en células productoras de insulina (células ß pancreáticas)8, células productoras de glucagón (células * pancreáticas)9, hepatocitos10, enterocitos11 e hipotálamo12. Esta distribución tisular única de la GK, junto con evidencias fisiológicas, fortalece el emergente concepto de una red de señales neuroendocrinas entre los órganos productores de GK encargada del mantenimiento de la homeostasis de la glucosa11 (fig. 1). La GK que se expresa en células ß y *pancreáticas, hipotálamo y enterocitos es del tipo islote (GK-I), mientras que la expresada en el hígado es la GK de tipo hepático, que a su vez presenta 2 isoformas; GK-L1 y GK-L211.
Fig. 1. Tejidos involucrados en la homeostasis de la glucosa y cuyas células contienen el sensor de glucosa glucocinasa (GK). La adecuada interconexión de estos componentes por medio de la glucosa, hormonas y neurotransmisores es necesaria para el control apropiado de dicha homeostasis.
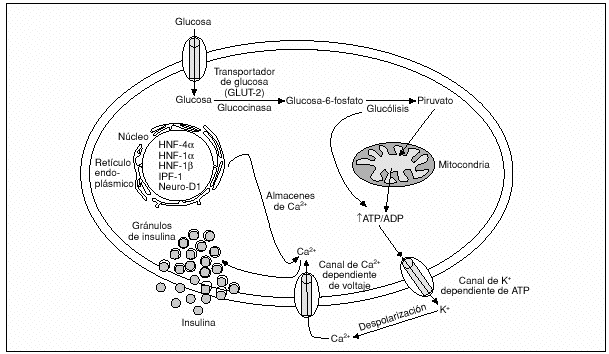
En las células donde se expresa la GK y donde el transporte de glucosa hacia el interior de la célula no es limitante, la GK cataliza la transferencia de un fosfato desde la ATP a la glucosa para dar lugar a glucosa-6-fosfato en la primera y limitante reacción de la glucólisis; de esta forma controla la entrada de glucosa a la ruta glucolítica1, que en la célula ß implica la estimulación de la secreción de insulina, y por esta razón se considera a la GK el sensor de la glucosa sanguínea para la secreción de insulina estimulada por la glucosa (SIEG) por dicha célula (fig. 2)8. El papel que la GK desempeña en otros tejidos es importante, ya que en la célula * pancreática está implicada en la secreción de glucagón9, y en el hepatocito es de gran importancia en la capacidad de almacenamiento de glucógeno, sobre todo en el estado posprandial13, debido a su efecto sobre la enzima glucógeno sintetasa13.
Fig. 2. Producción de insulina por la célulaßpancreática. La glucosa, una vez transportada de forma facilitada hacia el interior de la célulaß, es fosforilada por la glucocinasa. La consiguiente producción de piruvato incrementará la relación adenosintrifosfato/adenosinbifosfato (ATP/ADP) intracitoplasmática, lo que cerrará los canales de potasio dependientes de la ATP, que a su vez despolarizará la membrana; esto dará lugar a la entrada de Ca2+ extracelular, lo cual causará la secreción de insulina a la circulación. HNF: factor nuclear hepático; IPF-1: factor 1 promotor de la insulina; Neuro-D1: factor 1 de diferenciación neurogénica..
El mecanismo de la SIEG por la célula ß pancreática comienza con el transporte de glucosa a través de la proteína específica transportadora de glucosa GLUT-2, situada en su membrana citoplasmática. Dicha glucosa se transporta de forma facilitada desde el exterior hacia el interior de la célula ß y de esta manera se igualan las concentraciones a ambos lados de la membrana citoplasmática. La GK fosforila la glucosa a glucosa-6-fosfato en el primer y limitante paso de la glucólisis. Este flujo glucolítico estará determinado por las concentraciones intracelulares de GK, sus características cinéticas y las concentraciones de glucosa y MgATP2. La consecuente producción de piruvato y su introducción en el metabolismo mitocondrial incrementará la producción de ATP y la relación ATP/adenosinbifostato (ADP) intracitoplasmática, lo que hará que los canales de K+ dependientes del ATP se cierren; esto producirá en la membrana citoplasmática una despolarización que dará lugar a una apertura de los canales de Ca2+ dependiente del voltaje, y así se permitirá la entrada de Ca2+ hacia el interior celular, de manera que esta entrada de Ca2+ extracelular, junto con la movilización de los almacenes intracelulares de Ca2+, dará lugar a que los gránulos contenedores de insulina se aproximen a la membrana citoplasmática y se lleve a cabo la secreción de insulina a la circulación (fig. 2)8.
El umbral fisiológico para la SIEG es de 5 mmo/l, que es la misma cantidad que la glucemia fisiológica en ayunas (p. ej., 90 mg/dl); teniendo en cuenta la característica funcional única de la GK, como es su comportamiento cooperativo con respecto a la glucosa, a glucemias de 90 mg/dl la GK mantiene el flujo glucolítico de la célula ß pancreática aproximadamente a un 25% de su capacidad total, suficiente para mantener una secreción basal de insulina adecuada. Una vez superado este umbral, como es el estado posprandial, la GK aumentará su actividad y hará que a valores de glucemia posprandial el flujo glucolítico aumente (a valores de glucemia de 180 mg/dl habrá aumentado hasta un 60% aproximadamente), lo que implica un aumento en la secreción de insulina suficiente para disminuir las elevadas cifras de glucemia posprandial5.
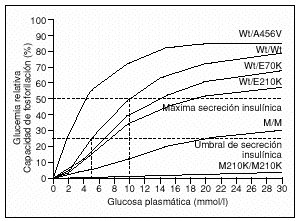
La estrecha relación fisiológica entre el metabolismo de la glucosa en la célula ß pancreática, gobernado por la GK, y la secreción de insulina por dicha célula indica que una correcta funcionalidad de la GK es imprescindible para el mantenimiento del umbral fisiológico para la SIEG en 90 mg/dl (5 mmol/l). Por lo tanto, es predecible que alteraciones, tanto en la expresión celular como en las características cinéticas de la GK, harán que dicho umbral fisiológico cambie (fig. 3) afectando tanto a la secreción de insulina como al equilibrio de la red de señales neuroendocrinas entre los órganos productores de GK, lo que alterará el mantenimiento de la homeostasis de la glucosa (figs. 1 y 2).
Fig. 3. Impacto de diversas mutaciones en el gen de la glucocinasa sobre el umbral fisiológico de secreción insulínica por la célula ßpancreática.En la figura se observa cómo el umbral de secreción de insulina, tanto basal como máxima, se desplaza dependiendo del tipo de mutación. En el caso de mutaciones inactivantes el desplazamiento será hacia la derecha, y será más pronunciado dependiendo de la gravedad de la mutación (Wt/E70K, Wt/M210K y M210K/M210K). En las mutaciones activadoras el desplazamiento del umbral, por el contrario, será hacia la izquierda (Wt/A456V).
PATOLOGÍA DE LA GLUCOCINASA
Mutaciones en el gen que codifica la enzima GK pueden dar lugar a la creación de una proteína con características cinéticas y funcionales alteradas que afectará al adecuado mantenimiento de la homeostasis de la glucosa e implicará la aparición de diferentes cuadros patológicos. Éstos, dependiendo del tipo de mutación, van desde la ausencia total de secreción insulínica hasta una grave hipersecreción insulínica incompatible con la vida si no recibe tratamiento adecuado14-16.
Diabetes debida a alteraciones de la glucocinasa
El cuadro diabético está producido por mutaciones de carácter inactivantes en el gen de la GK y puede ser tanto de carácter leve, como es el caso de la diabetes monogénica conocida como MODY (maturity onset diabetes of the young) 214, como de carácter grave, caso de la diabetes neonatal persistente con necesidad de tratamiento insulínico para poder sobrevivir15,17. En la actualidad existen más de 150 mutaciones inactivantes descritas en el gen de la GK, tanto de carácter heterocigótico como homocigótico, que causan diabetes y afectan a todas las etnias y razas14,15,17-19. La enzima resultante de mutaciones inactivantes en GK va a dar lugar a una serie de defectos tales como una disminución de la afinidad de la GK por sus 2 sustratos (glucosa y MgATP2), una disminución de su actividad catalítica o bien una inestabilidad térmica4 que, solos o en combinación, reducirán la actividad y eficacia de la GK en la célula ß pancreática, lo que afectará negativamente a la secreción de insulina (tabla 1).
Diabetes monogénica leve o MODY 2
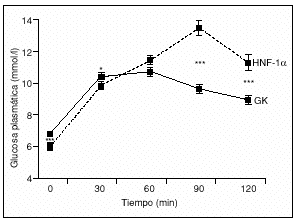
La hiperglucemia en las personas afectadas de MODY 2 es el resultado de una reducción de la sensibilidad de la célula ß a la glucosa20, así como de una disminución de la síntesis hepática de glucógeno posprandial21. La disminución de la actividad de la GK y la consiguiente reducción de la sensibilidad de la célula ß a la glucosa darán lugar a un desplazamiento hacia la derecha en la curva dosis-respuesta de la secreción de insulina inducida por glucosa, sin reducir la secreción máxima de insulina20. Si en condiciones fisiológicas normales la concentración de glucosa en sangre necesaria para la estimulación de insulina (umbral fisiológico para la SIEG) es de alrededor de 90 mg/dl (5 mmol/l), en estos pacientes dicho umbral se encuentra aumentado hasta aproximadamente 108-126 mg/dl (6-7 mmol/l) (fig. 3). Este aumento en el umbral hace que las concentraciones plasmáticas de glucosa, tanto basal como a las 2 h tras una sobrecarga oral de glucosa, se encuentren tan sólo levemente elevadas (fig. 4)22, característica que la diferencia de otros tipos de diabetes monogénicas MODY.
Los pacientes con MODY 2 presentan una hiperglucemia en ayunas leve y no progresiva14,23, y menos de un 50% de ellos evolucionan a una diabetes franca; en estos casos, la mayoría de los pacientes son obesos o ancianos. Esta ausencia de progresión de la hiperglucemia está relacionada con mecanismos fisiológicos de compensación dentro de la célula ß pancreática, que darán lugar a un relativo incremento de la respuesta secretora insulínica. De manera que la hiperglucemia leve va a originar un incremento en la expresión del alelo sano del gen de la GK, con lo que se limitará la gravedad del defecto de la secreción de insulina estimulada por la glucosa24. La posibilidad de que los mecanismos de compensación se den sólo en la célula ß es debida a que el promotor de la GK de la célula ß está regulado principalmente por la glucosa, mientras que el promotor de la GK hepática está regulado principalmente por la insulina.
Este tipo de diabetes es habitualmente asintomática en el momento del diagnóstico y por lo general el tratamiento consiste en dieta y ejercicio. El tratamiento con antidiabéticos orales, aunque en algunos casos es necesario, no es habitual y aproximadamente un 2% de los pacientes necesitará tratamiento insulínico25. La aparición de complicaciones conocidas asociadas a la diabetes es rara en esta forma de diabetes monogénica. La glucemia en ayunas que presentan estos pacientes oscila entre 110 y 145 mg/dl (6,1 a 6,8 mmol/l), y la intolerancia glucídica en los portadores de mutaciones en el gen de la GK puede detectarse, en la mayoría de los casos, a edades tempranas, y en algunos incluso días después del nacimiento14,26. Las mutaciones heterocigóticas en el gen que codifica a la GK están también relacionadas con la diabetes gestacional, y aproximadamente un 50% de la mujeres portadoras de este tipo de mutación presentarán diabetes gestacional27, cuyo tratamiento usual es insulínico.
Fig. 4. Concentraciones plasmáticas de glucosa, tanto basal como a las 2 h de una sobrecarga oral de glucosa en pacientes con diabetes monogénica MODY 2 y MODY 3. La diferencia en las concentraciones plasmáticas de glucosa entre los minutos 0 y 120 es menor en los pacientes afectados de MODY 2. Asimismo, las glucemias en estos pacientes en ayunas es superior a las que presentan los pacientes afectados de MODY 3. HNF: factor nuclear hepático; GK: glucocinasa. (Adaptada de Stride et al22.)
En este punto, es importante destacar el efecto de las mutaciones heterocigóticas en el gen de la GK sobre el crecimiento fetal intrauterino y el peso fetal al nacer. Si un feto no presenta mutación en el gen de la GK y está expuesto a un ambiente hiperglucémico intrauterino, debido a que la madre es portadora de una mutación también heterocigótica en el gen de la GK, la combinación de una hiperglucemia intrauterina con una secreción de insulina aumentada por parte del feto, como respuesta a esta hiperglucemia, dará lugar a un mayor peso al nacimiento (aproximadamente 0,5 kg). En el caso de que tanto la madre como el feto posean una mutación heterocigótica en el gen de la GK, el peso del feto al nacer será normal debido al equilibrio entre la hiperglucemia de la madre y la incapacidad del feto para captar esa hiperglucemia y, por lo tanto, para aumentar la secreción de insulina. Otra posibilidad es que el feto sea portador de una mutación heterocigótica y la madre no. En este caso el feto, debido a que su umbral para la SIEG es más alto que el de la madre, tendrá una secreción de insulina insuficiente y, por lo tanto, una disminución del peso al nacimiento que por lo general es de aproximadamente 0,5 kg28.
Diabetes neonatal permanente debida a alteraciones de la glucocinasa
La diabetes neonatal se define como la hiperglucemia que se diagnostica durante el primer mes de vida, necesita tratamiento insulínico para su control y, a menudo, se acompaña de un retraso del crecimiento intrauterino del feto. En todos los casos de diabetes neonatal permanente debida a mutaciones en el gen de la GK los 2 alelos están afectados, bien por una mutación de carácter homocigótico o de carácter heterocigótico compuesto (p. ej., cada alelo posee una mutación distinta)15,17. En estos fetos existe una deficiencia completa de GK que va a dar lugar a un acusado retraso del crecimiento fetal intrauterino. En estos casos, aunque se encuentra en un ambiente hiperglucémico debido a la diabetes materna, la cual posee una mutación heterocigótica para el mismo gen, el feto es incapaz de percibir la hiperglucemia de la madre, por lo que el resultado será un peso al nacer muy bajo, con una media de 1.728 g15,17.
La clínica que presentan los pacientes con este tipo de diabetes es muy similar. Todos presentan un retraso del crecimiento uterino de carácter moderado a grave y la enfermedad se manifiesta durante los 10 primeros días de vida con hiperglucemias no cetósicas que oscilan entre 500 y 1.500 mg/dl (27-83 mmol/l) y con necesidad de tratamiento insulínico. El desarrollo psicomotor de estos pacientes es normal. Tampoco presentan ninguno de los marcadores de diabetes tipo 1 ni signos de complicaciones diabéticas típicas de la diabetes tipo 1. Una característica muy interesante de estos pacientes es la negatividad en la detección del péptido C, lo cual refuerza la importancia de la GK en la secreción de insulina incluso basal, la cual es el 50% de la secreción diaria y no sólo en la SIEG.
Hiperinsulinismo debido a alteraciones de la glucocinasa
Las mutaciones activadoras del gen de la GK van a dar lugar a la creación de una proteína que, debido a sus características funcionales, hará que disminuya el umbral para la SIEG (fig. 3). Esta disminución del umbral para la SIEG hará que la célula ß del islote pancreático comience la secreción de insulina con cifras de glucemia inferiores a las fisiológicas (5 mmol/l), y dicha secreción se mantendrá hasta que la glucemia descienda hasta valores que serán aún más bajos de los necesarios para las estimulación de la SIEG.
El fallo en la supresión de insulina durante la hipoglucemia por parte de la célula ß pancreática es la base fisiopatológica de la hipoglucemia hiperinsulinémica persistente de la infancia (HHPI)29. Mutaciones en el receptor de la sulfonilurea 130 de la célula ß pancreática, en el rectificador interno de los canales de potasio (Kir6.2)31 de la misma célula y en el gen que codifica la enzima glutamato deshidrogenasa32, junto con mutaciones en el gen de la GK16,33-35, son responsable del 50% de todos los casos de HHPI. Estos pacientes corren el riesgo de presentar una lesión cerebral permanente debido a la recurrente y continua hipoglucemia. Por lo tanto, el diagnóstico temprano y adecuado de esta enfermedad es de gran importancia.
Desde que en 1998 se publicó el primer caso de HHPI debido a una mutación activadora de carácter heterocigótico en el gen de la glucocinasa (V455M)16, se han descrito otras 4 mutaciones activadoras (T65I, W99R, Y214C y A456V) causantes de HHPI33-35. La clínica que presentan estos pacientes abarca desde formas leves con excelente respuesta tanto al tratamiento dietético como al farmacológico hasta formas muy graves refractarias al tratamiento incluso quirúrgico. Esta heterogeneidad en todos los aspectos de la enfermedad hace necesario un profundo conocimiento de esta patología, tanto para evitar posibles daños irreversibles como para impartir un adecuado consejo genético.
La presentación clínica y la edad de diagnóstico del hi perinsulinismo debido a mutaciones en el gen de la GK varían incluso entre personas portadoras de la misma mutación y pertenecientes a la misma familia33,34, de manera que en un paciente la enfermedad puede manifestarse en el momento del nacimiento como una hipoglucemia neonatal, mientras que otros miembros de la misma familia, incluso uno de los progenitores, pueden no haber presentado síntomas de hipoglucemia hasta la adolescencia o hasta entrada la edad adulta33,34. Es de destacar la observación de la aparición de diabetes en la edad adulta tardía en algunos portadores de mutaciones activantes de la GK16. De todos los pacientes diagnosticados hasta la fecha, un tercio de los casos presentaron hipoglucemias neonatales no cetósicas durante el primer día de vida. Éstas pueden ser tanto asintomáticas y no necesitar tratamiento farmacológico alguno como graves, en las que el tratamiento intensivo con infusión intravenosa de glucosa y esteroides se hace necesario. Aproximadamente la mitad de todos los casos presentaron convulsiones hipoglucémicas antes de los 15 años de edad sin haber presentado ningún síntoma relacionado con la hipoglucemia antes de la aparición de las convulsiones, y al resto de los paciente se les diagnosticó en la edad adulta y en ningún caso la presentación de la enfermedad fue grave.
El peso al nacer de los pacientes también carece de homogeneidad, ya que las personas portadoras de mutaciones activadoras en el gen de la CK pueden tener un peso al nacer tanto elevado como disminuido e incluso normal. Asimismo, los valores de glucemia e insulina en el paciente son también diferentes según la mutación que presente; unos pueden mostrar valores de glucemia bajos y consistentes con una secreción de insulina alta pero regulada a dichas glucemias, mientras que otros pueden presentar glucemias bajas y erráticas, y una secreción de insulina que siempre se mantiene alta, con una respuesta contrarreguladora anormal. No obstante, en todos los casos la secreción de insulina y péptido C es inapropiada para las cifras de glucemia, y el perfil lipídico es normal. La respuesta al tratamiento farmacológico y quirúrgico fue excelente en todos los casos16,33,34, excepto en los muy graves35.
Un hallazgo que cabe esperar en estas personas, en las que el metabolismo del hepatocito está aumentado considerablemente, es la presencia de acumulción grasa en el hígado. Resulta interesante el hecho de que esta acumulación grasa hepática no se observa en los pacientes con HHPI debida a mutaciones en el gen de la GK, en los que, además del perfil lipídico normal antes comentado, no existe hepatomegalia. No obstante, en un caso concreto35, la paciente presentó una hepatomegalia con un perfil lipídico normal. Este hallazgo demuestra el importante papel de la GK en varios aspectos del metabolismo hidrocarbonado y, por lo tanto, otra vez, en el mantenimiento de la homeostasis de la glucosa en el humano. La GK es necesaria para la activación de la glucógeno sintetasa y, por lo tanto, para la capacidad del hepatocito de formar y almacenar glucógeno13. Esto implica que un aumento o una disminución de la funcionalidad de la GK afectará a dicha sintetasa. Efectivamente, al contrario que en la diabetes producida por mutaciones inactivantes de la GK, donde la acumulación de glucógeno por el hígado está disminuida, es plausible pensar que las mutaciones activantes de la GK den lugar a un aumento de la síntesis y almacenamiento de glucógeno hepático, por lo que la hepatomegalia que presentaba la paciente afectada de HHPI grave35 se debía principalmente a una importante acumulación de glucógeno debido a la constante activación de la glucógeno sintetasa por la GK; de ahí la ausencia de alteraciones lipídicas.
Estudio genético
Una pregunta importante es a qué pacientes hay que estudiar genéticamente para la GK. En el caso de pacientes que presentan un cuadro diabético, sería lógico seguir los siguientes criterios: a) historia familiar de diabetes en al menos 3 generaciones; b) uno de los padres presenta intolerancia hidrocarbonada o diabetes mellitus leve; c) ausencia de marcadores de diabetes mellitus tipo 1; d) madre con diabetes gestacional y tratada tras el embarazo sólo con dieta; e) bajo peso al nacer (aproximadamente 500 g); f) obesidad rara en la familia; g) niños con diabetes neonatal, con un retraso en el crecimiento intrauterino de carácter moderado o grave y cuyos padres presentan intolerancia a la glucosa, y h) en ciertas culturas, estudiar la consanguinidad entre los padres.
En el caso de pacientes que presentan síntomas de hipoglucemia, los criterios lógicos a seguir serían: a) historia familiar de hipoglucemia en al menos 2 generaciones; b) uno de los padres presenta historia o síntomas indicativos de hipoglucemia; c) concentraciones de amonio plasmático normales; d) perfil lipídico normal; e) respuesta contrarreguladora afectada, y f) historia familiar de hipoglucemia que ha evolucionado a diabetes.
Defectos en la glucocinasa. Implicaciones terapéuticas
El gran control ejercido por la GK sobre el metabolismo de la glucosa hace que esta enzima sea una diana adecuada para compuestos que actúan sobre ella y sobre su funcionalidad. Recientemente, se ha descrito un activador alostérico de la GK36 que aumenta la actividad de esta enzima y su afinidad por la glucosa en 1,5 y 4 veces, respectivamente, produciendo un descenso del umbral de la SIEG, lo que aumentará la secreción de insulina. Aunque el efecto de este activador es claro sobre la GK nativa sana y, por lo tanto, su potencial como tratamiento para la diabetes tipo 2 es obvio, no ocurre lo mismo cuando este activador se añade a diferentes mutaciones de la GK. Este efecto varía, ya que en algunos casos la enzima GK mutada restaura completamente su función, en otros la función sólo se restaura parcialmente y en otros no hay efecto37. Es interesante observar que cuando el activador se añade a mutaciones activadoras de la GK no se produce ningún efecto, lo que indica un cierre conformacional de la molécula debido a la mutación que hace que se imposibilite la unión del activador a la GK.