INTRODUCCIÓN
La diabetes tipo MODY (maturity onset diabetes of the young) es una enfermedad monogénica, para la que se han identificado hasta la actualidad 6 genes diferentes, que permiten diagnosticar al 80% de las familias con esta enfermedad1. De ellos, la mayoría son factores de transcripción, cuya expresión no suele ser exclusiva de la célula β pancreática, por lo que su alteración puede repercutir en otros órganos.
Aunque su prevalencia es relativamente baja, entre el 1 y el 5% de la diabetes tipo 2 y hasta un 10% de la diabetes etiquetada como tipo 1 (sin autoinmunidad pancreática y sin haplotipos del complejo principal de histocompatibilidad de riesgo), su diagnóstico es de gran utilidad porque define el subtipo de diabetes; en las familias en las que se ha identificado la alteración génica, su hallazgo en aquellos miembros que no presenten todavía diabetes puede tener un valor predictivo, y puede condicionar el tipo de tratamiento en función de la clase de alteración encontrada.
El diagnóstico de este tipo de diabetes incluye una serie de características clínicas, bioquímicas y genéticas que con frecuencia pueden no estar en su totalidad presentes.
DIAGNÓSTICO CLÍNICO DE LA DIABETES TIPO MODY
Los criterios para el diagnóstico serían los siguientes:
1. Debe existir una historia familiar de diabetes de inicio temprano, lo que significa que al menos 2 miembros de la familia hayan sido diagnosticados antes de los 25 años, sin que esto signifique que otros miembros lo hayan sido en edad más tardía2.
2. Debe tratarse de una diabetes no dependiente de insulina dentro de los 5 primeros años del diagnóstico o con concentraciones de péptido C detectables.
3. Debe presentar una herencia autosómica dominante, con al menos 3 generaciones de diabetes con el mismo fenotipo, especialmente en primos y primos segundos.
Además esta diabetes suele cursar sin marcadores de autoinmunidad pancreática ni obesidad y raramente existe resistencia a la insulina.
De los diversos tipos de MODY, los más frecuentes entre la población europea son MODY 2 y MODY 3, cuyos genes responsables son el de la glucocinasa (GK) y el que codifica el factor de transcripción nuclear hepático HNF-1α, respectivamente3. Desde el punto de vista clínico, los pacientes con mutaciones en el gen de la GK presentan una evolución que se mantiene estable prácticamente a lo largo de la vida y que en muchos casos no requiere de tratamiento especial. Por el contrario, los pacientes portadores de mutaciones en el gen HNF-1α presentan un empeoramiento progresivo de la enfermedad, que requerirá en muchos de ellos tratamiento con insulina y comportará la aparición de las complicaciones típicas de la diabetes. Por lo que se refiere a las otras formas de MODY, se conoce menos su evolución y su posible tratamiento; sin embargo, el saber que la mutación está presente puede facilitar el seguimiento y recalcar la necesidad de un buen control metabólico.
Dado que las diferencias genéticas condicionan en gran manera diferencias clínicas y bioquímicas, intentaremos analizar cómo el estudio de éstas puede aproximarnos al estudio genético de los pacientes con posible diabetes tipo MODY.
EXPLORACIÓN BIOQUÍMICA Y FUNCIONAL DE LA DIABETES MODY
En los pacientes que por historia familiar y características clínicas son candidatos a presentar una diabetes tipo MODY, es importante descartar la presencia de marcadores de autoinmunidad pancreática, principalmente anticuerpos antiácido glutámico descarboxilasa, antitirosinfosfotasa y antiinsulina si se trata de pacientes en edad infantil o juvenil.
Otra prueba que puede aportar una valiosa información sobre el tipo de diabetes es la sobrecarga oral de glucosa, realizada tras 8-10 h de ayuno y la ingesta de 75 g de glucosa por vía oral, con toma de muestras en los minutos 0, 30, 60, 90 y 120 y determinación de la glucemia en cada uno de ellos. La experiencia del estudio llevado a cabo en varios centros europeos con 362 miembros de familias con MODY demostró que esta prueba presenta un perfil distinto en función del gen implicado4. Los pacientes con mutaciones en el gen de la GK presentaban concentraciones de glucosa basal más elevadas (6,8 ± 0,8 mmol/l) que los que tenían mutaciones en el gen HNF-1α (6,0 8 ± 1,9 mmol/l). Asimismo, se observó que sólo un 2% de los pacientes con mutaciones en el gen de la GK tenían valores de glucemia basal inferiores a 5,5 mmol/l, mientras que esto se producía en el 46% de los pacientes con mutaciones en HNF-1α. Sin embargo, a los 120 min de la sobrecarga oral de glucosa, la glucemia de los pacientes con mutaciones en GK no sobrepasaba los 11 mmol/l, mientras que sí lo hacía en la mayoría de los pacientes con mutaciones en HNF-1α; por tanto, el incremento de la glucosa plasmática, entendido como la diferencia entre la glucosa a los 120 min y la determinada en el minuto 0, fue inferior en los pacientes con MODY 2 que en los MODY 3.
Además de los valores absolutos de glucemia, el patrón de ésta a lo largo de la curva fue distinto para ambos grupos de pacientes, de manera que las concentraciones de glucosa eran significativamente diferentes en todos los puntos de la curva, excepto a los 60 min. El pico máximo se situaba entre los 30 y 60 min para un 85% de los pacientes con mutaciones en GK mientras que estaba entre los 90 y 120 min en el 73% de los pacientes con mutaciones en HNF-1α.
El área bajo la curva de glucosa fue significativamente más elevada en los pacientes con mutaciones en HNF-1α que en los GK; además, en estos últimos no se observó correlación entre la glucemia basal y la determinada a las 2 h, al contrario de lo observado en los pacientes con positividad en HNF-1α, en los que la correlación entre las 2 concentraciones fue de 0,8. Cuando se estudió la evolución de ambos parámetros con la edad, se observó un deterioro progresivo de la glucemia basal en todos los pacientes, con un incremento de 0,8 mmol/l para los portadores de GK frente a 3,3 mmol/l para los de HNF-1α. Esta evolución fue distinta para la glucosa plasmática a las 2 h, que sólo se incrementaba de forma significativa en los MODY3. A partir de estos resultados, a la mayoría de los pacientes con MODY 2 se les etiquetó como "glucosa basal alterada" o diabéticos basándose en su glucemia en ayunas, mientras que los MODY 3 presentaron en su mayoría una glucosa basal normal por debajo de los 20 años.
En el subgrupo de sujetos en los que se valoró la insulina a lo largo de la sobrecarga oral de glucosa, se demostró que los pacientes con mutaciones en GK tenían valores más elevados que los portadores de HNF-1α, alcanzando significación estadística en los minutos 0 y 120. Los pacientes con mutaciones en HNF-1α que no presentaban diabetes tenían una secreción de insulina normal para concentraciones normales de glucosa, pero la insulina no respondía adecuadamente al aumentar la glucosa por encima de 8 mmol/l; esta falta de respuesta de la célula β se agravó con el tiempo, de forma que los pacientes con diabetes franca tenían concentraciones bajas de insulina para todas las concentraciones de glucosa.
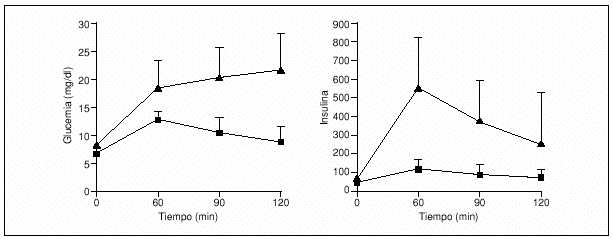
En el estudio realizado en pacientes de familias españolas se observó que el área de glucosa bajo la curva era significativamente mayor para los MODY 3 que para los MODY 2 (1.996 frente a 1.200 mmol/l min), mientras que el área de insulina era significativamente más baja en los pacientes MODY 3 que en los MODY 2 (12,8 frente a 44,8 nmol/l min, respectivamente) (fig. 1)3.
Fig. 1. Concentraciones de glucemia y de insulinemia durante la prueba de sobrecarga oral de glucosa en pacientes con MODY 2 (¿) y MODY 3 (¿)). Los valores se presentan como media ± desviación estándar. (Adaptada de Costa et al3.)
De estos estudios, se puede concluir que la respuesta a la glucosa oral es muy diferente para estos 2 tipos de alteraciones genéticas, de forma que la glucosa basal y el incremento tras la sobrecarga oral diferencian claramente los 2 subgrupos de pacientes y pueden usarse como guía para el estudio molecular (tabla 1 y anexo 1).
Un grupo italiano5 que estudió la prevalencia de mutaciones en el gen GK en un grupo de 132 niños aportó resultados similares. En condiciones basales, a la mayoría de los pacientes se les etiquetó como "glucosa basal alterada", con valores medios de 6,3 mmol/l, mientras que la respuesta a la sobrecarga oral mostraba un amplio espectro de valores que iban desde la normalidad (6,7 mmol/l) hasta la diabetes (11,5 mmol/l). No encontraron correlación entre la "gravedad" de la mutación de la GK, la respuesta de la insulina a la glucosa intravenosa y las variaciones en la tolerancia a la glucosa oral, lo que indicaría que pueden existir otros factores, además de la célula β, que condicionen el incremento de la glucosa en este tipo de pacientes.
En otro estudio realizado en población española6, se analizaron las mutaciones de GK, HNF-1α y HNF-4β en 22 pacientes pediátricos y en 97 familiares de primer grado. Las mutaciones en GK fueron las más frecuentes, representando un 64% de las familias; se hallaron mutaciones en HNF-1α en el 18%, y sólo una de las familias (4%) era portadora de una mutación en HNF-4α. Todos los casos de MODY 2 se diagnosticaron en edad prepuberal, no presentaban diabetes franca, no tenían complicaciones y comparativamente tenían menor peso al nacer. Por el contrario, a los pacientes con MODY 3 se les diagnosticó en estadio pospuberal, presentaban diabetes y las complicaciones crónicas propias de la enfermedad estaban presentes en el 40% de ellos. Por tanto, este estudio confirma una vez más que la mayoría de las mutaciones en GK, a pesar de su heterogeneidad, cursan con ligera hiperglucemia o intolerancia a la glucosa, de manera que la mayoría de los pacientes mantienen un buen control glucémico sin necesidad de insulina ni hipoglucemiantes orales. Por el contrario, las mutaciones en MODY 3 reflejan una alteración importante en la capacidad secretora de la célula β; además, hay que tener en cuenta que una de las mutaciones más frecuentes en el gen HNF-1α es la P291fsinsC, localizada en el exón 4, que comporta una grave alteración de la actividad transcripcional de la proteína resultante7.
El único paciente con MODY 1 presentaba hiperglucemia en ayunas, con valores superiores a 13 mmol/l a las 2 h de la sobrecarga y microalbuminuria intermitente, tanto en el momento del diagnóstico como durante el seguimiento. Aunque el patrón parece coincidir con otros casos de mutaciones en el mismo gen, dada la baja prevalencia de éstas, es difícil generalizar la evolución de este tipo de pacientes8. La mayoría de ellos presentan hiperglucemia que aumenta progresivamente, al tiempo que disminuye la capacidad de respuesta de la célula β; este defecto en la secreción de insulina se puede poner de manifiesto en los portadores de mutaciones, no diabéticos, si se les somete a una perfusión prolongada de glucosa o a la estimulación con arginina. Asimismo, estos pacientes tienen anomalías en las respuestas del glucagón y el polipéptido pancreático a diferentes estímulos.
Los pacientes con MODY5 (HNF-1β) presentan un patrón de diabetes muy parecido a los MODY 3, y son frecuentes las complicaciones microvasculares, especialmente la retinopatía y la proteinuria, así como los quistes renales de aparición temprana debidos a un fallo en el desarrollo de la nefrona. En algunos casos se ha asociado con agenesia gonadal, aunque, dada la escasa frecuencia de este tipo de diabetes, es difícil saber si estas alteraciones tienen un carácter general9.
ESTUDIO GENÓMICO DE LA DIABETES TIPO MODY
El diagnóstico genético de la diabetes tipo MODY comporta el análisis mediante técnicas de biología molecular de los genes implicados. Teniendo en cuenta que hasta el momento se han descrito 6 genes responsables de este tipo de diabetes, el análisis de la historia familiar, la evolución de la enfermedad, el tipo de tratamiento, los datos de la glucemia y, en su caso, de la insulina nos pueden orientar sobre cuál puede ser el gen implicado en un paciente concreto.
El estudio se lleva a cabo en el ADN extraído a partir de los linfocitos de sangre periférica mediante precipitación salina. El ADN se amplifica por reacción en cadena de la polimerasa utilizando los cebadores específicos, diseñados para cada uno de los exones del gen correspondiente. Tras la amplificación, y atendiendo a la gran diversidad de mutaciones encontradas, la estrategia más utilizada es la técnica de polimorfismos de conformación de cadena sencilla, que consiste en una electroforesis en gel de poliacrilamida en la cual los fragmentos genómicos portadores de alguna alteración migrarán de forma distinta de los no portadores. Se secuencian las bandas anómalas para confirmar la presencia de mutaciones y poder definir de qué mutación o polimorfismo se trata. Una vez detectada la mutación en el paciente considerado caso índice, debería estudiarse en el resto de familiares.
La mayoría de estudios publicados hasta la fecha y la experiencia propia permiten concluir que las mutaciones más prevalentes en la población caucásica implican el gen de la GK y el HNF-1α, que permiten explicar el 80% de los casos de MODY.
Por lo que respecta a las mutaciones en el gen de la GK, su prevalencia oscila entre el 13 y el 56% de todos los MODY dependiendo del tipo de población estudiada. Se han descrito más de 130 mutaciones distintas a lo largo de todo el gen, la mayoría de las cuales son poco recurrentes. Las mutaciones en este gen son frecuentes en niños con hiperglucemia leve o en mujeres que han sido diagnosticadas de diabetes gestacional10, sin descartar que en un 50% de los portadores de mutaciones en este gen puede no manifestarse nunca una diabetes franca. Esta diversidad en la manifestación clínica es consecuencia de la localización de la mutación, con el consiguiente efecto sobre la proteína, que puede comportar desde una ligera disminución de la afinidad de la enzima por la glucosa hasta su inactividad total. En general, el efecto de la mayoría de las mutaciones se traduce en una disminución de la sensibilidad de la célula β a la glucosa, con el consiguiente incremento del umbral de respuesta o, lo que es lo mismo, un desplazamiento a la derecha de la curva dosis-respuesta de la insulina a la glucosa.
Se han descrito mutaciones en homocigosis que comportan la pérdida total de la actividad enzimática, se asocian clínicamente con diabetes neonatal permanente, bajo peso al nacer y requieren tratamiento permanente con insulina.
Las mutaciones en el gen de HNF-1α son las más frecuentes en población eu ropea de diversos orígenes. Se han identificado más de 120 distintas, repartidas a lo largo de sus 10 exones, algunas de ellas recurrentes, como la P291fsinsC del exón 4. Se han descrito también polimorfismos en este gen, algunos de los cuales se han relacionado con la presencia de diabetes o alteraciones lipídicas, mientras que otros tienen un significado desconocido11.
No se ha encontrado relación entre el genotipo y el fenotipo en la mayoría de los pacientes portadores de estas mutaciones, de forma que una misma mutación condiciona una gran variabilidad en la gravedad de la enfermedad, tanto en una misma familia como en familias distintas. La mayoría de estas mutaciones condicionan una ligera hiperglucemia en ayunas, con aumento exagerado tras la sobrecarga oral de glucosa y respuesta insuficiente de la secreción de insulina, que puede comportar, en algunos casos, la aparición de poliuria y polidipsia, y hacer necesario el tratamiento con insulina. Este defecto de la secreción de insulina aparece ya en los portadores de mutaciones en el gen HNF-1α en los que la diabetes no está todavía presente, lo que demuestra la existencia de alteraciones intrínsecas de la célula β previas a su manifestación clínica. Las alteraciones de este gen pueden afectar también el funcionamiento renal, con la disminución de la reabsorción de glucosa y la aparición de glucosuria.
En resumen, podemos concluir que el diagnóstico molecular de la diabetes tipo MODY es posible en un 80% de los casos. Este diagnóstico genético permite la confirmación de este tipo de diabetes y definir el subtipo, lo que facilita un pronóstico más preciso de la evolución y, en su caso, permite adecuar el tratamiento. En este sentido existen estudios que permiten concluir que los pacientes con MODY 3 podrían beneficiarse del tratamiento con sulfonilureas al mantener una capacidad de respuesta importante a estos fármacos12.