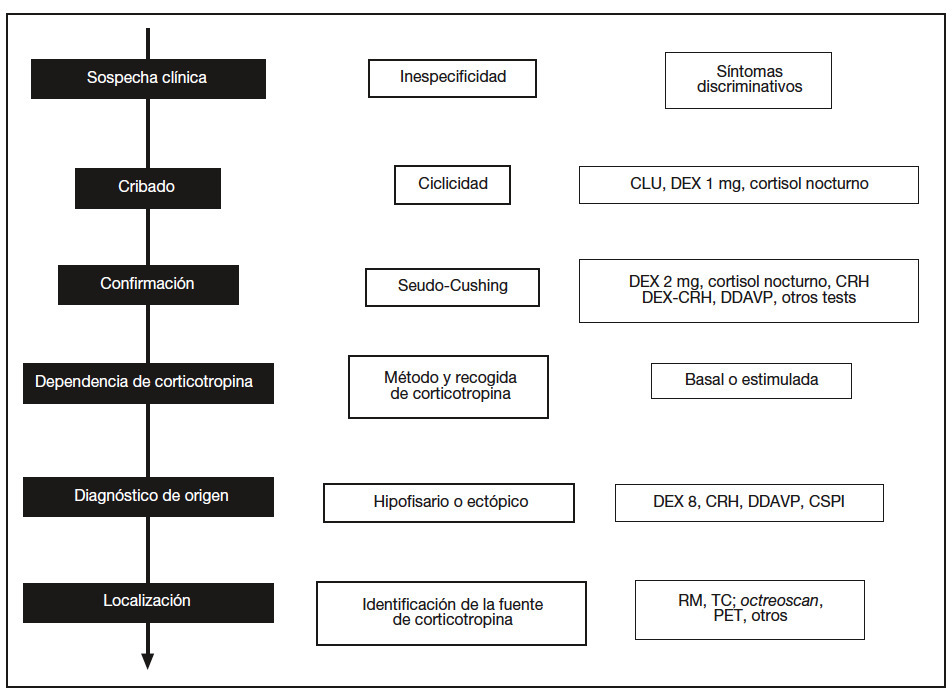
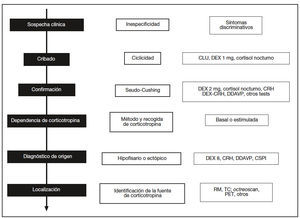
Dada la escasa frecuencia del síndrome de Cushing y la especificidad de su tratamiento, es necesario contar con un protocolo diagnóstico bien establecido que escalonadamente discrimine a los pacientes con hipercortisolismo endógeno mediante datos clínicos y pruebas sencillas para proceder después con exploraciones más complejas y específicas que permitan conocer su origen y su tratamiento (fig. 1).
Fig. 1. Esquema secuencial del diagnóstico diferencial del síndrome de Cushing (columna izquierda) con los retos en cada fase (columna central) y las pruebas necesarias (columna derecha). CLU: cortisol libre urinario; DEX: dexametasona; CRH: corticoliberina; DDAVP: deltadesamino-arginina-vasopresina; RM: resonancia magnética; TC: tomografía computarizada; PET: tomografía por emisión de positrones; CSPI: cateterismo de senos petrosos inferiores.
SOSPECHA CLÍNICAEl diagnóstico del síndrome de Cushing debe comenzar con la realización de una cuidadosa historia clínica que, entre otros aspectos, recoja la posible administración exógena de glucocorticoides y preste especial atención a las situaciones causantes de síndrome de seudo-Cushing (depresión, etilismo) que pueden dar lugar a un cuadro clínico similar.
Los síntomas y signos del síndrome de Cushing pueden dividirse en aquellos que son frecuentes y poco específicos y los que alcanzan un grado de discriminación alto para diferenciar el síndrome de Cushing de la obesidad complicada o el síndrome del ovario poliquístico1-3.
Tal y como se observa en la tabla 1 son numerosos los síntomas y signos que expresan los pacientes con síndrome de Cushing. De todos ellos, los que reflejan el efecto catabólico de la hipercortisolemia mantenida (hematomas, miopatía, atrofia dérmica, estrías vinosas) son los que, con mayor especificidad, apuntan a la sospecha clínica de síndrome de Cushing1,4, por lo que, sistemáticamente, se debe explorar su aparición en el amplio colectivo de pacientes obesos, hipertensos y diabéticos y, por lo tanto, candidatos al diagnóstico de hipercortisolismo. La historia de reciente ganancia de peso, alteraciones en la tolerancia hidrocarbonada y/o hipertensión arterial resistente al tratamiento en personas jóvenes debe suscitar la posibilidad diagnóstica.
En general, tanto los pacientes con rasgos específicos de hipercortisolismo como aquellos con signos o síntomas inespecíficos, pero inapropiados para la edad (hipertensión arterial, osteoporosis), y los que presentan masa adrenal son candidatos a la evaluación de posible síndrome de Cushing1.
Cuando la causa es una producción ectópica de corticotropina (ACTH) y/o corticoliberina (CRH) la sintomatología cardinal derivada del proceso de fondo puede predominar sobre la característica de hipercortisolismo. En tales casos puede aparecer hiperpigmentación, hipopotasemia y sus síntomas, así como astenia, anorexia y pérdida de peso. Sin embargo, los tumores carcinoides habitualmente no suelen producir síndrome constitucional; potencialmente dan lugar a síndrome ectópico oculto que remeda el cuadro clásico de la enfermedad de Cushing de origen hipofisario y plantea serios problemas en el diagnóstico diferencial5,6.
En el caso de los niños, la obesidad y el retraso de crecimiento es la combinación más específica que debe suscitar la sospecha de hipercortisolismo1,7.
Habida cuenta de que en cualquier caso la expresión clínica no suele tener suficiente especificidad, es necesario basar el diagnóstico definitivo en pruebas bioquímicas y técnicas de imagen cuya realización debe ser adecuadamente escalonada para alcanzar el máximo rendimiento. No debe olvidarse que todos los tipos de síndrome de Cushing pueden cursar con hipersecreción de cortisol intermitente8, por lo que en presencia de sospecha clínica, la negatividad de las pruebas analíticas obliga a repetir la valoración.
FASES DEL DIAGNÓSTICO DEL SÍNDROME DE CUSHINGLas características del eje hipotálamo-hipofisarioadrenal incluyen, además de una tasa normal de secreción de cortisol, el ritmo circadiano, que muestra respuesta al estrés y el mantenimiento de los mecanismos de retroalimentación o feedback. Las pruebas funcionales encaminadas a evaluar el síndrome de Cushing basan su razón de ser en la demostración de alteraciones en estos parámetros (fig. 1).
Las fases del diagnóstico bioquímico del síndrome de Cushing se clasifican en:
Su objetivo es delimitar qué pacientes son potenciales portadores de síndrome de Cushing. Son candidatos los pacientes con obesidad de distribución central, especialmente si presentan diabetes mellitus tipo 2 de mal control, hipertensión arterial, dislipemia y alteraciones menstruales o hiperandrogenismo1,9,10. La alteración de cualquiera de las pruebas que se describen a continuación hace tributario al paciente de pasar a la fase de confirmación.
Cortisol libre urinario
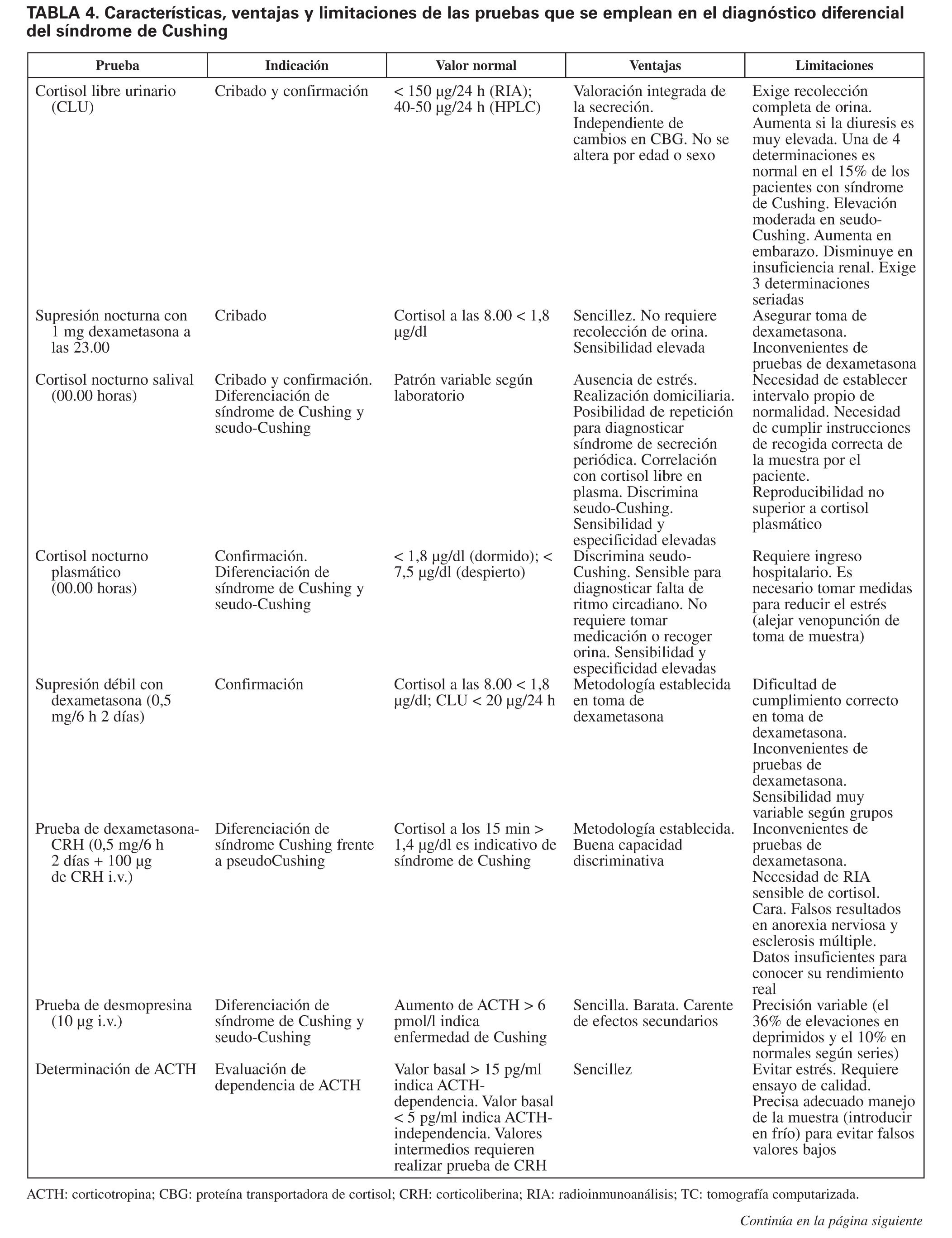
La prueba por excelencia más adecuada para establecer que hay una hiperproducción suprarrenal de cortisol es la valoración del cortisol libre en orina de 24 horas1-3,9,10. Habitualmente se lleva a cabo mediante radioinmunoanálisis, aunque se obtiene más especificidad con HPLC que, no obstante, no está libre de interferencias. Cada laboratorio debe establecer sus límites de normalidad, si bien un valor 4 veces superior al límite alto de normalidad se considera diagnóstico10. Una cifra menor de 150 μg/día es normal con radioinmunoanálisis, mientras que con HPLC los valores de normalidad se encuentran entre 40 y 50 μg/ día1-3,9,10.
Su determinación ofrece una valoración integrada de la concentración plasmática de cortisol en 24 horas, que no se ve afectada por las variaciones en la proteína transportadora de cortisol (CBG), como ocurre bajo tratamiento estrogénico. La valoración simultánea de la creatinina en orina aumenta su rendimiento dado que corrige una posible recolección incompleta de la orina de 24 horas. No se altera por la edad. No obstante, exige un alto grado de colaboración del paciente para asegurar la completa recolección de la muestra. Su valor aumenta en los últimos meses del embarazo como consecuencia de la producción de CRH de origen placentario por lo que se reduce su capacidad diagnóstica en esta condición11.
La cifra de cortisol libre urinario (CLU) aumenta cuando la ingesta de líquidos y el volumen urinario es muy elevado (aumento del 64% si la ingesta es mayor de 5.000 ml) y desciende si el aclaramiento de creatinina es menor de 30 ml/min11. Se ha propuesto la medición durante el período nocturno y su relación con la del período diurno.
Una de cada 4 determinaciones es normal hasta en el 15% de los pacientes con síndrome de Cushing, lo que obliga a realizar hasta 3 determinaciones seriadas para otorgarle valor diagnóstico confirmatorio o descartador2,3,9,10. Algunos fármacos como fenofibrato, digoxina y carbamazepina pueden dar falsos resultados empleando HPLC como técnica de medida1,10,11.
Puede elevarse de forma moderada en la depresión melancólica, trastorno obsesivo-compulsivo, anorexia nerviosa, etilismo, ovario poliquístico e hipertiroidismo, situaciones que se califican como seudo-Cushing por esta razón12. Estas condiciones pueden plantear la necesidad de establecer diagnóstico diferencial con el síndrome de Cushing.
Prueba de supresión nocturna con 1 mg de dexametasona
Se basa en que los pacientes con síndrome de Cushing han perdido la capacidad de frenación de cortisol tras la administración de una dosis baja de un glucocorticoide sintético como es la dexametasona, expresando una alteración en los mecanismos de retroalimentación. En condiciones normales, tras la administración de 1 mg de dexametasona a las 23.00, el cortisol plasmático a las 8.00 del día siguiente debe ser inferior a 1,8 μg/dl. La sensibilidad alcanza el 93-96%10,13,14. Sin embargo, hasta un 3% de los pacientes con síndrome de Cushing muestran supresión, en probable relación con actividad cíclica, y en alguna serie se ha detectado hasta el 30% de falsos positivos en individuos sin síndrome de Cushing10. Dosis mayores de 1 mg no mejoran la discriminación. No es necesario modificar la dosis de dexametasona según el peso del individuo. Puede realizarse midiendo cortisol salival, aunque es necesario consensuar los valores de normalidad.
Aunque la prueba es sencilla, exige que el paciente tome el comprimido de dexametasona a la hora acordada. Las situaciones de seudo-Cushing ofrecen resultados patológicos con frecuencia. Posee las limitaciones propias de las pruebas de frenación con dexametasona (tabla 2). La determinación simultánea de dexametasona en plasma puede ayudar a confirmar que se alcanzan concentraciones suficientes como para interpretar el resultado de la prueba con fiabilidad, pero su coste impide su incorporación a una prueba de cribado habitual. En el caso de tratamiento estrogénico concomitante debe retirarse dicha medicación con 6 semanas de antelación para evitar el aumento iatrogénico de CBG y de cortisol total10. A pesar de sus limitaciones continúa siendo una de las pruebas más empleadas en el cribado de hipercortisolismo por su sencillez.
Cortisol nocturno salival
La determinación de cortisol nocturno (00.00 h) es el marcador del ritmo circadiano del eje hipotálamo-hipofisario-adrenal, que se encuentra ausente en el síndrome de Cushing.
El cortisol salival representa el 70% del cortisol libre en plasma, con el que guarda una buena correlación. La ventaja de la determinación en saliva radica en que se puede llevar a cabo en un ámbito domiciliario, sin el estrés propio de la venopunción o la hospitalización, por lo que la prueba puede contemplarse como de cribado. Además, no se ve alterada por variaciones en el flujo salival.
Por ello, es repetible y muy útil para estudiar posible síndrome de secreción periódica. La muestra se recoge en un material sólido que queda impregnado y se guarda en un tubo de plástico (Salivette) que puede enviarse al hospital de referencia. Tras centrifugación y extracción con hexano:etilacetato el extracto seco se redisuelve en buffer midiendo cortisol por enzimoinmunoanálisis o radioinmunoanálisis.
Los valores son habitualmente normales en la obesidad y los pacientes con seudo-Cushing. Una vez se ha comprobado la reproducibilidad de la medición por el laboratorio correspondiente, puede utilizarse como prueba tanto de cribado como de confirmación15.
Sin embargo, es necesario establecer los límites de normalidad propio de cada laboratorio. Hay gran dispersión en los resultados obtenidos en individuos normales, así como en el valor a partir del cual se establece la sospecha de síndrome de Cushing; según los estudios varía entre 0,13 y 0,41 μg/dl16-18. Se han descrito valores de sensibilidad y especificidad del 95100%, así como buena reproducibilidad19, aunque este último aspecto es controvertido20. También se ha propuesto un algoritmo diagnóstico con puntos de corte de cortisol salival nocturno que, combinados con valores de CLU, ayudan a descartar o confirmar el hipercortisolismo18.
Es importante instruir al paciente sobre las condiciones previas a la toma de la muestra (lavado de boca, no comer con 3 h de antelación, no hacer ejercicio, no estimular con cítricos).
Aun cuando los resultados de la investigación clínica son muy prometedores, no se ha alcanzado todavía un consenso universal para que sustituya por completo a las pruebas anteriores, por lo que posee un papel complementario.
ConfirmaciónLa repetición del CLU de 24 h es una prueba de confirmación del síndrome de Cushing. Además, en esta fase se incluyen la determinación de cortisol nocturno plasmático o salival y la supresión de cortisol plasmático tras 2 mg diarios de dexametasona durante 2 días. Es en este escalón del proceso diagnóstico cuando debe establecerse si el paciente presenta hipercortisolismo endógeno y, por lo tanto, discriminarlo de los pacientes que carecen de alteraciones en el eje hipotálamo-hipofisario-adrenal y de los que tienen seudo-Cushing.
Supresión tras 2 mg/día 2 días de dexametasona
Es una prueba de supresión que se lleva a cabo con mayor dosis que la de cribado, pero que basa su resultado en el mismo principio de alteración de los mecanismos de retroalimentación en el síndrome de Cushing. Aunque también se ha llegado a considerar como prueba de cribado, la complejidad de su realización, que implica tomas repetidas de dexametasona a horas determinadas, no la hace ideal con este fin.
Se inicia a las 12.00 del mediodía administrando 0,5 mg de dexametasona cada 6 h, para terminar el tercer día a las 6.00 de la mañana y obtener 2 h más tarde, es decir a las 8.00, una muestra para cortisol plasmático, que debe ser menor de 1,8 μg/dl en condiciones normales1,3,10. Un valor mayor es indicativo de supresión defectuosa. Las determinaciones de CLU tras dexametasona (normal < 10 μg/24 h) no añaden mayor capacidad discriminativa, por lo que es preferible evaluar la prueba con cortisol plasmático siempre que no haya elementos de interferencia (p. ej., estrogenoterapia). Los datos obtenidos de sensibilidad y especificidad son variables según el grupo y los puntos de corte. Algunos grupos obtienen rendimiento superior al 94%13,21, mientras otros sólo alcanzan sensibilidades inferiores14. Algunos grupos de trabajo la consideran una prueba esencial en el diagnóstico, mientras que otros la han abandonado por el CLU o las determinaciones de cortisol nocturno. También se ha indicado su utilidad para predecir el resultado de las pruebas de supresión con dosis alta de dexametasona y, por lo tanto, para indicar el diagnóstico de origen del síndrome de Cushing21. Se ha propuesto que una supresión de cortisol plasmático mayor del 30% tras 2 mg/ día es indicativa de una reducción mayor del 50% tras dosis altas de dexametasona.
Posee las limitaciones propias de las pruebas de dexametasona (tabla 2); muestra falsos positivos con edad > 65 años, en situaciones con aumento de CBG (como embarazo y toma de estrógenos), alteraciones del sueño y situaciones de seudo-Cushing.
Cortisol nocturno plasmático
Valora la normalidad del ritmo circadiano de cortisol. En general, su rendimiento en sensibilidad y especificidad se encuentra alrededor del 95%, aunque depende de las series. Su eficacia es superior a la de la prueba de dexametasona de 2 mg/día 2 días. Su valor normal es variable, según los grupos de trabajo que lo han estudiado y dependiendo de las condiciones de extracción. Si el paciente está dormido, lo que mejora la fiabilidad de la prueba por evitar el estrés, el valor debe ser < 1,8 μg/dl2,3, pero otros grupos han cifrado en 7,5 μg/dl la frontera entre la normalidad o el seudo-Cushing y el síndrome de Cushing22 que, según las series, puede tener menor número de falsos positivos que cuando se emplean puntos de corte inferiores18. Se debe exigir ayuno, como mínimo, desde las 21.00 y reposo con 2 h de antelación a la extracción. El catéter debe ser insertado como mínimo 1 h antes de la toma de la muestra.
En general, muestra un buen rendimiento para separar el seudo-Cushing del síndrome de Cushing. El solapamiento entre valores de ambas entidades no supera el 3% de los casos22,23. Para el diagnóstico de confirmación del síndrome Cushing la sensibilidad se ha cifrado en el 100%, es decir sin falsos negativos, y especificidad del 77%. Por las características y condiciones de la toma, es preferible llevarlo a cabo en régimen de ingreso. En cualquier caso, una cifra de cortisol nocturno en plasma < 1,8 μg/dl excluye hipercortisolismo si se exceptúan los casos cíclicos que pueden mantener normalidad bioquímica absoluta en las fases de quiescencia. Puede ser reemplazado por el cortisol salival una vez se establezca correctamente el punto de corte.
Cortisol nocturno salival
Su repetición puede considerarse como prueba de confirmación diagnóstica de síndrome de Cushing, aunque habitualmente requiere pruebas adicionales (al menos, CLU) para tener valor confirmativo de hipercortisolismo.
El problema del seudo-CushingCuando hay elevación moderada de CLU y/o falta de supresión tras dexametasona 2 mg/día 2 días, puede plantearse el diagnóstico de seudo-Cushing si la intensidad de la alteración o el cuadro clínico acompañante no son suficientemente significativos o hay dudas acerca de que la activación del eje hipotálamo-hipofisarioadrenal sea secundaria. Las causas más frecuentes de seudo-Cushing son depresión melancólica, alcoholismo y obesidad abdominal, aunque otras merecen cada vez más consideración (diabetes mellitus tipo 2 de difícil control, alteraciones del sueño, estrés). En estas situaciones clínicas se puede originar activación del eje hipotálamo-hipofisario-adrenal de intensidad leve o moderada y habitualmente transitoria, sin que el síndrome de Cushing esté establecido. Dada la comunidad sintomática que estas entidades comparten con el síndrome de Cushing (alteraciones psíquicas, obesidad, alteraciones menstruales, entre otras), es preciso recurrir a pruebas bioquímicas para establecer el diagnóstico diferencial. No obstante, conviene recordar que la evolución clínica puede ser clave al desaparecer el hipercortisolismo con el tratamiento de la causa subyacente, como puede suceder en depresión, hipertiroidismo o etilismo.
Las pruebas que más eficacia han mostrado para diferenciar seudo-Cushing de síndrome de Cushing son la determinación de cortisol nocturno, el test combinado dexametasona-CRH y el test de desmopresina, que se convierten así en pruebas de confirmación1. La eficacia de otras pruebas, como la supresión con loperamida o la estimulación con naloxona, está menos establecida10,12.
Prueba de dexametasona-CRH
Consiste en realizar una frenación de 2 mg/día 2 días por vía oral con dexametasona y aplicar a las 8.00, es decir 2 h después de la última dosis de dexametasona, una prueba de CRH (100 μg i.v.). Los pacientes con síndrome de Cushing responden a los 15 min de la inyección de CRH, con un valor de cortisol en plasma por encima de 1,4 μg/dl, mientras que los con seudo-Cushing muestran cifras inferiores24. Otros estudios proponen emplear, como punto de corte, un valor de ACTH a los 15 min de 27 pg/ml25. La prueba posee una capacidad discriminativa aceptable y carece de efectos secundarios.
Los resultados iniciales mostraron sensibilidad y especificidad del 100%24, aunque tanto la anorexia nerviosa como el ejercicio pueden generar respuestas similares al síndrome de Cushing11,26.
Sus limitaciones son, además del precio y la disponibilidad del CRH, las comunes a las pruebas de supresión con dexametasona, y además precisa de un ensayo de cortisol suficientemente sensible como para detectar un máximo de 1,4 μg/dl. En caso de duda diagnóstica la prueba es útil, aunque es necesaria mayor experiencia de cara a conocer su rendimiento real.
Prueba de desmopresina
Los pacientes con enfermedad de Cushing de origen hipofisario responden en el 80 al 90% de los casos a la administración de desmopresina (10 μg i.v.) con liberación de ACTH debido a la expresión de receptores V3 en las células adenomatosas. Se considera respuesta positiva cuando el aumento de ACTH respecto al valor basal es > 6 pmol/l. No obstante, los resultados son variables pues se han observado respuestas positivas hasta en el 36% de los pacientes con depresión27 y en el 10% de los normales. Pero los resultados de Moro et al28 y Tsagarakis et al29 son muy aceptables en la discriminación. La prueba es sencilla de realizar, aunque su precisión no es óptima. No hay datos que demuestren mayor rendimiento que el test de dexametasona-CRH para deslindar el síndrome de Cushing del seudo-Cushing. Se considera necesaria una experiencia más amplia antes de incluir esta prueba en la práctica clínica sistemática1,10, aunque en casos dudosos su aplicación es valorable.
Otras pruebas
Ni la hipoglucemia insulínica ni la administración oral de 16 mg de loperamida se han mostrado consistentemente superiores a las pruebas anteriores para diferenciar el síndrome de Cushing del seudo-Cushing1.
Situaciones especialesRecientemente la Endocrine Society ha propuesto que en algunas situaciones clínicas se empleen preferentemente determinadas pruebas1 a fin de minimizar errores diagnósticos.
En el embarazo el abordaje diagnóstico descansa sobre el CLU y no sobre las pruebas de dexametasona que dan lugar a falsos resultados, pues ya de por sí la supresión por este corticoide se encuentra alterada en el embarazo normal y la concentración estrogénica aumentada artefacta la medición de cortisol plasmático total.
En pacientes epilépticos con tratamiento la metabolización de dexametasona se ve acelerada por los anticonvulsivos, por lo que se debe utilizar cortisol nocturno y CLU como pruebas de cribado y confirmación.
En la insuficiencia renal avanzada los valores de CLU resultan alterados, por lo que el diagnóstico no debe descansar únicamente en este parámetro.
Los pacientes con incidentaloma adrenal pueden mostrar CLU normal, lo que no descarta otras alteraciones funcionales, que deben ser evaluadas mediante la supresión con dexametasona y cortisol nocturno.
Evaluación de la ACTH-dependenciaLa determinación de ACTH en plasma es esencial para saber si el síndrome de Cushing es ACTH-dependiente o independiente. Debe llevarse a cabo con la precaución de colocar la muestra en hielo rápidamente y centrifugar en frío para evitar la degradación de ACTH por endopeptidasas, un aspecto crítico para evitar errores diagnósticos.
Si la concentración es > 20 pg/ml, se establece la ACTH-dependencia. Si es < 10 pg/ml, se concluye en ACTH-independencia, y si se encuentra entre 10 y 20 pg/ml (intervalo, 5-15 pg/ml, según otros autores10), debe hacerse una estimulación con CRH para ver si la concentración de ACTH aumenta tras estimulación, en cuyo caso se debe considerar ACTH-dependencia, o sigue una trayectoria plana si se trata de síndrome de Cushing de origen adrenal9.
Habitualmente, se emplea un método inmunorradiométrico para hacer la determinación. Si se sospecha síndrome de ACTH ectópica puede hacerse además por radioinmunoanálisis, que detecta más fácilmente los fragmentos moleculares que los tumores ectópicos pueden producir5,6.
Diagnóstico diferencial bioquímico del síndrome de Cushing dependiente de ACTH
La determinación basal de ACTH no es capaz de discriminar entre el origen hipofisario y ectópico del síndrome de Cushing dependiente de ACTH, porque hay un gran solapamiento entre las concentraciones plasmáticas que se producen en ambos casos2,3,9,10. En algunos casos la sintomatología clínica (agresividad, predominio en varones) o la expresión analítica (hipopotasemia) propia del clásico síndrome ectópico por carcinoma pulmonar de células pequeñas no se manifiestan en otros tumores ectópicos, como los carcinoides bronquiales, que con frecuencia generan un síndrome oculto de expresión clínica indistinguible de la enfermedad de Cushing de origen hipofisario5,6,30. Por lo tanto, es necesario recurrir a la realización de pruebas dinámicas, que se basan en que con frecuencia se retienen parcialmente ciertas características propias del control fisiológico de la secreción de ACTH si el origen es hipofisario. Además, la actividad intermitente o periódica que producen algunos adenomas hipofisarios y tumores ectópicos complica más la interpretación.
No hay ninguna prueba dinámica no invasora que sea absolutamente infalible para establecer la diferencia entre ambas entidades, por lo que se realizan al menos dos pruebas para caracterizar la sospecha diagnóstica.
Prueba de supresión con dosis altas de dexametasona
Puede llevarse a cabo según distintos protocolos. En todos ellos se mide la supresibilidad relativa de la concentración plasmática y/o urinaria de cortisol en respuesta a la administración de dexametasona, que habitualmente está presente en la enfermedad de Cushing de origen hipofisario, y no en los tumores ectópicos secretores de ACTH. En general, la sensibilidad de las pruebas de supresión con dosis altas de dexametasona oscila entre el 60 y el 80%, y la especificidad, entre el 60 y el 90% cuando se toma como punto de corte la reducción de cortisol plasmático del 50%9,10,13,23. Hay dos estrategias para llevar a cabo esta prueba:
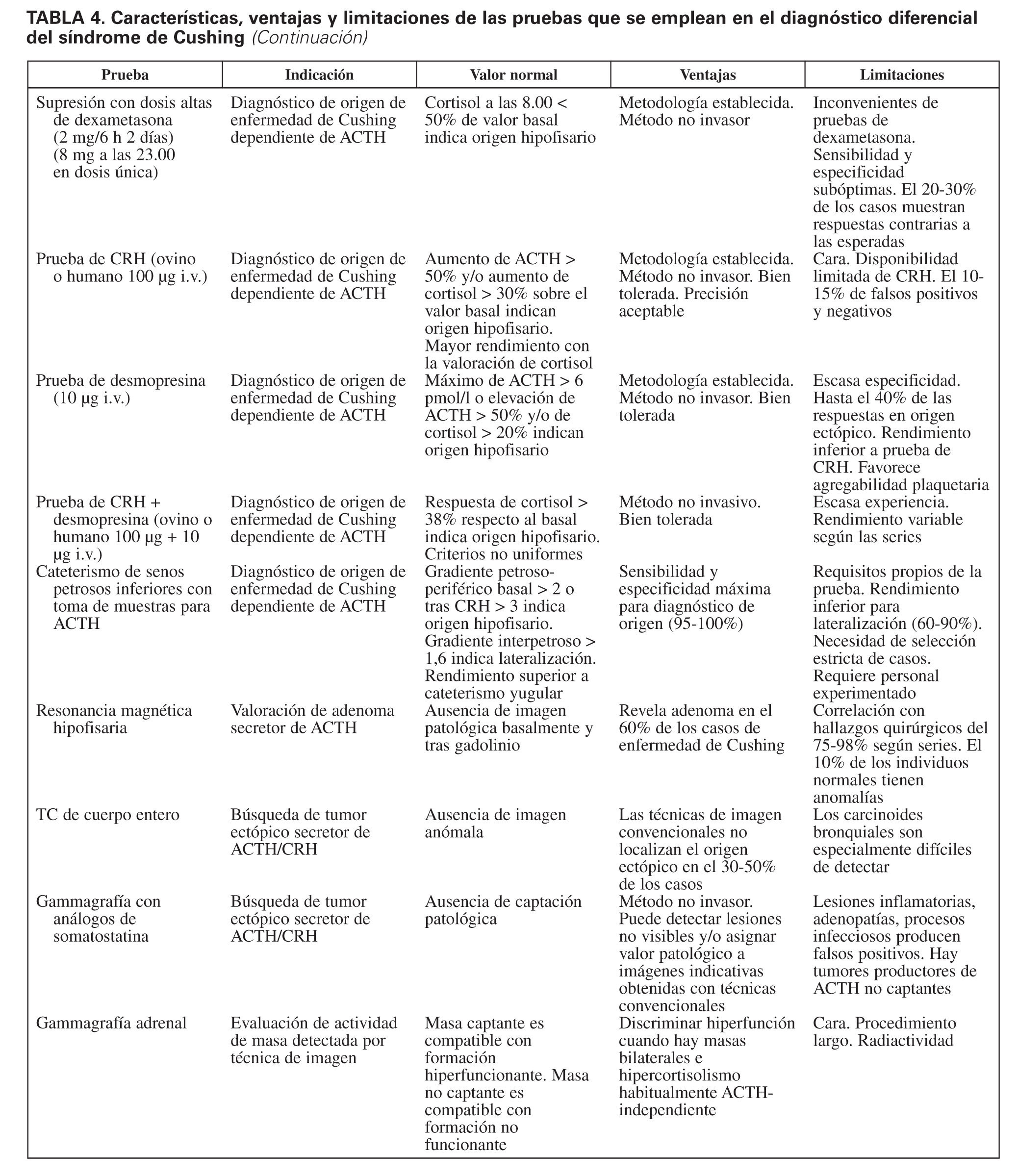
2 mg/6 h por vía oral durante 2 días. Sigue el mismo patrón de administración que la prueba de dosis baja de dexametasona que se emplea en la confirmación del diagnóstico. En este caso se considera como supresión positiva un descenso del 50% de la concentración de cortisol a las 8.00, 2 h después de recibir la última dosis de dexametasona. También puede valorarse la supresión de cortisol libre urinario, aunque se emplea menos por tener menor capacidad discriminativa.
8 mg por vía oral en dosis única nocturna a las
23.00. El criterio de supresibilidad es el mismo que para la prueba anterior, es decir reducción al 50% de la concentración de cortisol a las 8.00. Algunos autores consideran que esta prueba es más eficaz y precisa que la clásica de 2 mg/6 h, en probable relación con la facilidad de cumplimiento de la toma de dexametasona, y se obtiene sensibilidad del 92% y especificidad del 10%6,31. Parece útil en el diagnóstico diferencial en niños con hipercortisolismo33.
Infusión intravenosa de 1 mg/h de dexametasona durante 5 o 7 h. El valor de cortisol plasmático debe quedar debajo de 190 nmol/l para sospechar origen hipofisario. Responden el 94% de lo pacientes con enfermedad de Cushing hipofisaria y el 38% de los pacientes con síndrome de Cushing de origen ectópico32. Los problemas logísticos y de incomodidad para el paciente, junto con los resultados superponibles que tienen lugar con la infusión intravenosa, han descartado su uso en la práctica clínica habitual.
Como todas las pruebas de supresión con dexametasona, tienen limitaciones derivadas de su metabolismo y de la absorción, si bien este último aspecto se obvia en la infusión intravenosa.
Aproximadamente el 20-30% de los pacientes con adenomas hipofisarios no suprimen tras dexametasona oral, especialmente macroadenomas, y un porcentaje similar de ectópicos lo hacen30, por lo que las pruebas de supresión con dexametasona no son definitivas en modo alguno. Algunos autores defienden que los datos clínicos alcanzan mayor precisión diagnóstica para sospecha de síndrome de Cushing de origen ectópico que la prueba con dosis altas de dexametasona, por lo que no aconsejan esta prueba10.
Prueba de CRH
Basa su fundamento en que la mayoría de los adenomas hipofisarios productores de ACTH retienen la capacidad de estimular la secreción de ACTH tras CRH, en contraste con los tumores ectópicos que en principio carecen de receptor específico.
Puede emplearse CRH de origen ovino o humano, que es algo menos potente, a dosis de 1 μg/kg o 100 μg en inyección intravenosa, que es lo más habitual. Se toma una extracción basal y a los 30, 60, 90 y 120 min de inyectado el péptido. Es una prueba segura. Los únicos efectos secundarios son la aparición de enrojecimiento facial y leve dificultad respiratoria transitoria.
Habitualmente el criterio de respuesta positiva y, por lo tanto, indicativa de origen hipofisario es de un aumento de ACTH > 50% del valor basal y/o de cortisol > 20%, aunque estos criterios varían según las series6,34. En general, la respuesta de cortisol es más discriminativa que la de ACTH.
Como en las otras pruebas, hay falsos positivos y negativos que representan en torno al 10-15% de los casos. Entre los tumores ectópicos, los carcinoides muestran con más frecuencia respuesta significativa de ACTH y cortisol a CRH35. La disponibilidad y el precio del CRH pueden limitar su aplicabilidad práctica.
Se ha descrito que la respuesta de cortisol salival ofrece incluso mayor rendimiento que la de cortisol plasmático al CRH36, si bien, como se ha comentado antes, es necesario unificar criterios de normalidad y respuesta. En general, la estimulación con CRH representa una de las pruebas no invasoras con mayor precisión diagnóstica, que no perfecta, para diferenciar el origen hipofisario del ectópico del síndrome de Cushing dependiente de ACTH.
Prueba de desmopresina
Su utilidad para diferenciar el origen del síos casos de origen ectópico poseen receptores V3 y muestran respuesta a desmopresina37. Por lo tanto, tiene menor poder discriminativo que CRH para este fin. Los efectos secundarios y características de la prueba son idénticos a los descritos en su uso como diagnóstico diferencial del seudo-Cushing.
Se ha empleado conjuntamente con CRH, si bien no hay un consenso suficientemente amplio respecto a la eficacia de esta combinación para diferenciar el origen hipofisario del ectópico29,30,38. La sensibilidad es del 88% y la especificidad del 80% para separar el origen hipofisario del ectópico.
Otras pruebas
La supresión de la secreción de ACTH y cortisol, tras administración oral de 16 mg del agonista opiáceo loperamida, o la estimulación, tras administración de naloxona, no se han consolidado como pruebas útiles, en parte por la heterogeneidad de respuesta que es evidente incluso en individuos normales. Tampoco la administración de hexarelina se ha mostrado eficaz con este propósito. La prueba de metopirona no posee rendimiento superior a las ya comentadas, por lo que su uso ha quedado desplazado.
Establecimiento de la sospecha de origen y estudios de imagen
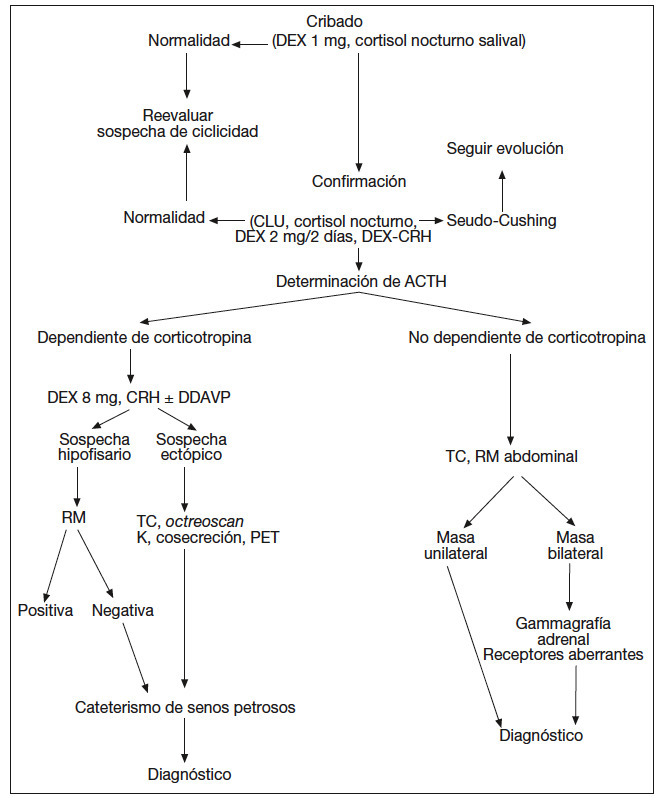
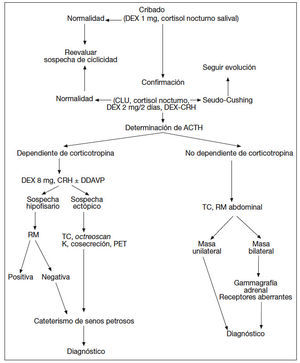
Habitualmente, según el resultado de las pruebas realizadas, se establece una sospecha diagnóstica (fig. 2).
Fig. 2. Protocolo diagnóstico del síndrome de Cushing. ACTH: corticotropina; CLU: cortisol libre urinario; CRH: corticoliberina; DDAVP: deltadesamino-arginina-vasopresina; DEX: dexametasona; PET: tomografía computarizada por emisión de positrones; RM: resonancia magnética; TC: tomografía computarizada.
Dado que ninguna de las pruebas comentadas posee una precisión diagnóstica del 100%, es frecuente que se empleen 2 pruebas que evalúen 2 mecanismos diferentes3,9-11. Las más empleadas son el test de CRH y la supresión con dosis altas de dexametasona (ya sea en 2 días o en dosis única nocturna). Dependiendo de la respuesta y supresibilidad respectivamente de estas pruebas, se considera cuál es el origen más probable.
La concentración de ACTH deslinda el origen ACTHdependiente (hipofisario o ectópico) del suprarrenal. En el diagnóstico diferencial del síndrome de Cushing ACTH-dependiente se puede considerar que hay sospecha hipofisaria cuando se confirma supresión con dexametasona y/o estimulación significativa con CRH. La ausencia de respuesta a ambas pruebas lleva a sospechar origen ectópico (fig. 2).
Una vez establecida la sospecha de origen, se procede al estudio morfológico mediante técnicas de imagen correspondientes (fig. 2). Si la sospecha es suprarrenal, se debe llevar a cabo un estudio de imagen mediante tomografía computarizada (TC) o resonancia magnética. En principio la TC es más barata y su rendimiento no es peor que la resonancia magnética para valorar masas adrenales unilaterales o bilaterales.
Cuando la masa es unilateral, el diagnóstico de adenoma cortical suprarrenal es firme.
Si la masa es bilateral, es útil realizar una gammagrafía adrenal para conocer si la actividad es unilateral (y la masa contralateral es una formación no relacionada con el síndrome) o bilateral, en cuyo caso podrá plantearse el protocolo de estudio de receptores aberrantes o ilegítimos. Este tipo de estudio comporta diversas determinaciones hormonales39, lo que aumenta su dificultad y eleva su precio. Sólo debe realizarse si se contempla la posibilidad de instaurar tratamiento médico, según los resultados que se obtengan, con bloqueadores beta, análogos de gonadoliberina, antagonistas serotoninérgicos o análogos de somatostatina, cuya indicación no ha sido aún bien consensuada.
Los casos raros de hiperplasia bilateral micronodular ACTH-independiente pueden cursar con morfología suprarrenal normal.
Si la sospecha es hipofisaria, se debe llevar a cabo una resonancia magnética del área hipotálamo-hipofisaria. Si se observa una imagen indicativa de adenoma > 6 mm, y los tests indican sospecha de origen hipofisario, el diagnóstico de adenoma hipofisario productor de ACTH es firme10. En general, la resonancia magnética revela microadenoma hasta en el 60% de los casos9,10, pero no conviene olvidar que hasta el 10% de los individuos normales presentan alteraciones en la hipófisis en la resonancia magnética40, aunque en la mayoría son < 6 mm. La sensibilidad de la TC en la detección de adenoma hipofisario en la enfermedad de Cushing sólo alcanza un 47%. En la infancia y la adolescencia el rendimiento de la resonancia magnética es pobre, puede mejorarse con la técnica de adquisición de gradientes41.
Si el estudio de imagen es discordante con las pruebas funcionales, es decir, no hay imagen o es menor de 6 mm con pruebas indicativas de origen hipofisario, o hay imagen pero las pruebas indican origen ectópico, debe llevarse a cabo un cateterismo de senos petrosos inferiores con toma de muestras basales y tras estimulación con CRH para establecer el origen de la hipersecreción de ACTH.
Cateterismo de senos petrosos inferiores con toma de muestras
Es la prueba que mejor discrimina el origen del síndrome de Cushing ACTH-dependiente. Sin embargo, dado su carácter invasivo, debe restringirse a las indicaciones ya comentadas. Es fundamental que se lleve a cabo en un centro con experiencia para conseguir buen rendimiento y evitar efectos secundarios, como la trombosis venosa profunda, la tromboembolia pulmonar o los accidentes cerebrovasculares42, que no suceden en centros experimentados en el procedimiento. Para evitar estos problemas debe realizarse siempre profilaxis con heparina, dado que el hipercortisolismo condiciona un estado protrombótico.
En primer lugar, debe comprobarse que el paciente muestra actividad cortisólica, es decir documentar hipercortisoluria para descartar que se trate de un síndrome cíclico y esté inactivo en el momento de la exploración, lo que puede ocasionar errores en la interpretación.
La técnica se lleva a cabo bajo sedación consciente. Es fundamental comprobar que los catéteres han alcanzado la localización adecuada en los senos petrosos inferiores mediante la inyección de una pequeña cantidad de contraste; así se establece que no hay alteraciones anatómicas en el drenaje venoso que, igualmente, son una fuente de falsos resultados43.
Una vez que los tres catéteres, incluidos el periférico, el del seno petroso derecho y el izquierdo, están colocados, se debe esperar 5 min para minimizar la influencia del estrés. A continuación, se procede a la toma de muestras simultáneas de los 3 catéteres como determinación basal. Es muy conveniente que para cada catéter haya una persona encargada de su extracción y otra de recoger las muestras en los tubos correspondientes, identificados con anterioridad, para colocarlas en hielo rápidamente a fin de evitar la degradación de ACTH y posibles errores.
Una vez extraída la muestra basal, se inyecta en la vía periférica 100 μg de CRH (ovino o humano) intravenoso y se toma el tiempo para que se lleven a cabo nuevas extracciones a los 3 y 5 min de administrado el estímulo. Prolongar la prueba más allá de esos tiempos no aumenta su capacidad diagnóstica.
Se puede combinar CRH con desmopresina para potenciar la respuesta10,43, aunque la experiencia más amplia y los patrones de respuesta están calculados para la administración exclusiva de CRH. La administración exclusiva de desmopresina puede constituir una alternativa al CRH para la estimulación durante el cateterismo de senos petrosos44, aunque los criterios de respuesta están estandarizados con CRH.
La valoración de la prueba se lleva a cabo mediante el cálculo de gradientes. Unos gradientes petroso-periféricos mayores de 2 en el valor basal o de 3 tras estímulo con CRH son indicativos del origen hipofisario. Un gradiente interpetroso mayor de 1,4 indica lateralización hacia la hemihipófisis desde donde drena la mayor concentración de ACTH10,45,46.
La sensibilidad y la especificidad para diferenciar origen hipofisario de ectópico se encuentra alrededor del 100% en diversas series47. La precisión que ofrece el gradiente interpetroso para lateralización es inferior, en torno al 70% según las series10,47.
Es conveniente conocer las posibles causas de errores (tabla 3) en la interpretación de los resultados de una prueba de alto rendimiento48. La valoración simultánea del gradiente de prolactina puede ayudar a corregir posibles falsos resultados49. La cateterización de otros efluentes venosos, como la vena yugular interna o los senos cavernosos, no ofrece mayor rendimiento; en este último caso genera más riesgo de afectación de pares craneales47-51.
Valoración de origen en el síndrome de Cushing ACTH-dependiente de origen ectópico
Cuando el gradiente petroso-periférico es indicativo de origen ectópico, y exceptuando que se trate de un caso de origen hipofisario con actividad cíclica en fase quiescente, está indicado el empleo de técnicas radiológicas convencionales para localizar el tumor. El más empleado en esta fase es la TC cervicotoracoabdominal con especial atención, por la frecuencia de casos, al territorio broncopulmonar, para detectar posible tumor carcinoide bronquial30. No obstante, la sensibilidad de la resonancia magnética supera a la de la TC con este fin. Sin embargo, las técnicas de imagen convencionales no localizan el origen ectópico en el 30-50% de los casos, por lo que la ayuda de otros procedimientos, como la gammagrafía con análogos de somatostatina marcados, debe considerarse especialmente una vez la sospecha de síndrome de Cushing ACTH-dependiente de origen ectópico ha sido establecida por las pruebas funcionales y, sobre todo, por el cateterismo de senos petrosos inferiores3,10,30,52.
La valoración de la cosecreción de otras hormonas, como calcitonina, serotonina y sus metabolitos o catecolaminas, puede ser de interés.
Igualmente, cuando estos métodos no han permitido esclarecer el origen, puede llevarse a cabo una tomografía por emisión de positrones, aunque su utilidad viene dada por el turnover metabólico del tumor, que no necesariamente siempre es elevado53, pero puede ser útil en algunos casos54.
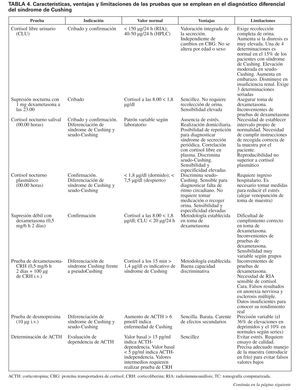
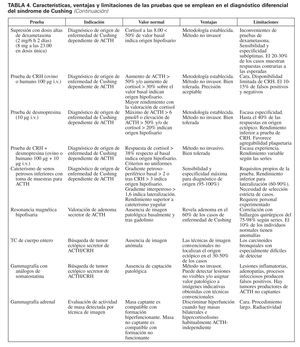
En resumen, la investigación etiológica del síndrome de Cushing y su diagnóstico diferencial constituyen un proceso complejo para cuya resolución contamos con diversas pruebas tanto funcionales como de imagen (tabla 4), cuyo rendimiento no es aún óptimo. La enorme sensibilidad y la variabilidad interpersonal de la respuesta del eje hipotálamo-hipofisario-adrenal al estrés y la heterogeneidad del comportamiento de corticotropinomas y tumores productores de ACTH ectópica son, en gran medida, causales de que el abordaje diagnóstico del síndrome de Cushing continúe representando un reto aún no resuelto. Extremar el rigor metodológico de la investigación diagnóstica, junto con el progresivo desarrollo de nuevas técnicas analíticas y de imagen, permitirá avanzar de forma significativa en la valoración de esta enfermedad endocrina de gran impacto en la calidad y la expectativa de los pacientes que la sufren.