INTRODUCCIÓN
En el momento actual vivimos un interesante debate que consiste en demostrar si las cifras elevadas de ácido úrico son un marcador o un factor de riesgo cardiovascular. El ácido úrico (AU) plasmático se relaciona con factores de riesgo cardiovascular, especialmente con la hipertensión y la diabetes mellitus1. El AU está considerado como un marcador de riesgo de enfermedad cardiovascular, cerebrovascular e infarto de miocardio, al comparar a pacientes y sujetos con concentraciones normales de AU y especialmente aquellos en el tercio más bajo del intervalo fisiológico2-4.
Kyling5, en 1923, puso en evidencia la importancia de la hiperuricemia y su relación con el síndrome metabólico cuando describió tres síndromes clínicos asociados: hipertensión, hiperglucemia e hiperuricemia. En 1988, Reaven6 mostró el papel central de la resistencia a la insulina en el síndrome X, que más tarde pasaría a conocerse como síndrome metabólico o síndrome de resistencia a la insulina6.
Siete décadas después de los estudios de Kyling, Reaven y Zavaroni proponen añadir la hiperuricemia al conjunto de desórdenes hemodinámicos y metabólicos relacionados con la resistencia a la insulina o síndrome metabólico7.
El objetivo de este estudio fue determinar el papel del AU como marcador o factor de riesgo y su relación con la diabetes mellitus, la cual tiene una incidencia de 19,1 casos/1.000 personas-año en esta población del sur de España8. Para ello, hemos examinado la relación entre las concentraciones plasmáticas de AU y el riesgo de desarrollar diabetes mellitus en una cohorte de personas sanas.
SUJETOS Y MÉTODOEste estudio se realizó en Pizarra, una ciudad de la provincia de Málaga, fundada en 1818 y con una población de origen caucásica homogénea.
Se estudió a 411 personas (el 34%, varones), con edades entre 18 y 65 años, sin alteración en el metabolismo de los hidratos de carbono tras una sobrecarga oral de glucosa, seleccionados del censo municipal, el grupo constituyó una submuestra del estudio Pizarra8. Se excluyó a mujeres embarazas, pacientes hospitalizados o aquellos con desórdenes psíquicos.
Los sujetos se reclutaron vía correo para un examen médico en el centro de salud que les correspondía.
Criterios de selecciónSe utilizaron los criterios de la Organización Mundial de la Salud (OMS)/American Diabetes Association (ADA) para la clasificación de la diabetes mellitus y el desorden en el metabolismo de los carbohidratos9.
Un mismo investigador realizó, a todos los sujetos, una entrevista y un examen clínico estandarizado basado en los procedimientos estándares. Se incluyeron los datos de peso, estatura, índice de masa corporal (IMC), circunferencia de la cadera, circunferencia de la cintura e índice cintura/cadera.
Se realizó un test de tolerancia a la glucosa, para ello se administró una sobrecarga oral de glucosa tomando las muestras de sangre basal y a los 120 min. Se separó el plasma y se congeló a –70 °C hasta su análisis.
Se midió la glucosa basal y a los 120 min, así como colesterol total, triglicéridos y colesterol de las lipoproteínas de alta densidad (cHDL) basales por métodos enzimáticos. La insulina se midió por radioinmunoanálisis (Biosource Europe). El modelo homeostático de resistencia a la insulina (HOMA) se utilizó para el cálculo del índice de resistencia a la insulina10: resistencia a la insulina = [insulina sérica en ayunas (μU/ml) × glucemia en ayunas (mmol/l)] / 22,5.
Análisis estadísticoConstruimos una variable clasificatoria con las concentraciones de ácido úrico, distribuyendo a los sujetos por encima
o por debajo del percentil 33 de las concentraciones plasmáticas de ácido úrico, este valor fue distinto para varones (291,45 μmol/l) y mujeres (208,18 μmol/l)11. Se realizó la prueba de la χ2 para estimar diferencias en la distribución de los desórdenes del metabolismo de los hidratos de carbono en función de las concentraciones de ácido úrico plasmático (P33) determinando el riesgo relativo de presentar diabetes mellitus.
Se realizó la prueba de la t de Student para analizar la diferencia de las variables biológicas estudiadas en función del percentil 33 de ácido úrico. El análisis estadístico se realizó con el paquete SPSS 12.0 para windows.
Este estudio fue aprobado por el Comité de Ética e Investigación del Hospital Regional Carlos Haya.
RESULTADOSLa incidencia de trastornos del metabolismo de los hidratos de carbono en el estudio Pizarra se ha documentado8. El análisis del subgrupo de 411 sujetos sin anomalías en el metabolismo de los hidratos de carbono al inicio del estudio muestra que 66 (25,5%) de los 259 sujetos con concentraciones plasmáticas de ácido úrico mayores que el percentil 33 presentaban, a los 8 años de seguimiento, algún desorden en el metabolismo de los hidratos de carbono (alteración de la glucemia en ayunas [IFG], alteración de la tolerancia a la glucosa [IGT], diabetes mellitus), comparados con 25 (16,4%) de los 152 sujetos con concentraciones de ácido úrico por debajo del percentil 33. Estos sujetos, además, presentaban un riesgo del metabolismo de los hidratos de carbono de 1,73 (intervalo de confianza [IC] del 95%, 1,041-2,8) al cabo de los 8 años de seguimiento (tabla 1). Cuando se separó la muestra en función del sexo, los hallazgos fueron similares (datos no mostrados).
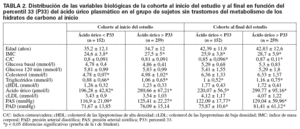
Al inicio del estudio, los sujetos sin alteración del metabolismo de los hidratos de carbono y con concentraciones de ácido úrico por encima del percentil 33 presentaban un mayor IMC (27,5 ± 5 frente a 24,6 ± 3,8) y concentraciones plasmáticas significativamente más elevadas de colesterol (4,98 ± 1,02 frente a 4,78 ± 0,97 mmol/l), triglicéridos (1,06 ± 0,65 frente a 0,88 ± 0,66 mmol/l) y ácido úrico (289,66 ± 67,21 frente a 196,28 ± 42,82 μmol/l) que los sujetos con concentraciones de ácido úrico por debajo del percentil 33 (tabla 2). Este mismo grupo de sujetos, reevaluados al cabo de 8 años, presentaron mayor IMC (28,7 ± 5,9 frente a 25,9±3,8), cociente cintura/cadera (0,87 ± 0,11 frente a 0,85 ± 0,096), triglicéridos (1,16 ± 0,75 frente a 1 ± 0,52 mmol/l), ácido úrico plasmático (299,77 ± 95,16 frente a 220,07 ± 56,5 μmol/l), insulina basal (8,5 ± 7 frente a 6,5 ± 4,1 μU/dl) e índice de resistencia a la insulina (1,95 ± 1,6 frente a 1,43 ± 1) que los individuos con valores por debajo del percentil 33 de ácido úrico plasmático. Los sujetos con mayores concentraciones de ácido úrico plasmático presentaron también mayores valores de presión arterial tanto al inicio como al final del estudio (tabla 2).
DISCUSIÓNEn este estudio hemos demostrado que hay una relación directa entre las concentraciones plasmáticas de ácido úrico y el riesgo de desarrollar alteraciones en el metabolismo de los hidratos de carbono en un grupo de sujetos de población general sana. También hemos encontrado una estrecha relación entre las concentraciones de ácido úrico y los factores clásicos de riesgo cardiovascular.
Clasificando a los sujetos en función de las concentraciones plasmáticas de ácido úrico, observamos, al inicio de la cohorte, que los pacientes que se encontraban por encima del P33 presentaban un mayor IMC y mayores concentraciones de triglicéridos plasmáticos, lo que indica una clara relación entre estas variables. Ya se ha descrito que un posible subgrupo, en cuanto al síndrome metabólico, correspondería a pacientes con marcada resistencia a la insulina, obesidad central e hipertrigliceridemia, asociación denominada cintura hipertrigliceridémica.
La relación entre IMC, triglicéridos y AU es clásica, ya en el estudio CARDIA11 se vislumbraba está asociación. En ese estudio se muestran los posibles mecanismos que explican la relación del ácido úrico con el IMC y algunos componentes del síndrome metabólico, así las concentraciones elevadas de ácido úrico pueden ser el resultado del efecto que produce la hiperinsulinemia en los túbulos renales, disminuyendo la excreción de ácido úrico11. Por otro lado, la relación entre las concentraciones elevadas de ácido úrico y triglicéridos está muy estudiada12-15. Nuestro grupo ha demostrado que hay dos grupos de sujetos con hiperuricemia, aquellos con hipertrigliceridemia y aquellos sin hipertrigliceridemia16. En los sujetos que presentan hiperuricemia e hipertrigliceridemia la modificación dietética de las concentraciones de lipoproteínas de muy baja densidad (VLDL) modifica también las concentraciones de ácido úrico y su excreción fraccionada17, además se ha demostrado una estrecha conexión entre am-bas metabolopatías y determinados polimorfismos genéticos18-20.
Otros autores han descrito que sujetos con mayor riesgo de diabetes mellitus tipo 2 (DM2) tienen concentraciones plasmáticas elevadas de ácido úrico y esta asociación podría estar mediada por el alto estrés oxidativo que presentan estos sujetos21. También está descrito que el estrés oxidativo causa las complicaciones presentadas por individuos con DM222. Se ha demostrado que la producción de radicales libres es el elemento clave en la patogenia de las complicaciones diabéticas23. Un aumento de insulina, ácidos grasos y glucosa puede incrementar la producción de especies reactivas de oxígeno y el estrés oxidativo puede producir un empeoramiento de la acción y la secreción de la insulina, que conduce a la progresión de la DM2. Este incremento de glucosa y/o ácidos grasos induce el aumento del estrés oxidativo a través de un incremento del gradiente de protones y transferencia de electrones al oxígeno, que conduce a la formación de radicales libres24. Incluso se ha observado que el estrés oxidativo tiene un papel crucial en la patogenia de algunas enfermedades y, concretamente, en la DM2, parece que empeora la captación de glucosa en el músculo y en el tejido adiposo25. Además, el tratamiento con antioxidantes mejora la resistencia a la insulina24. Parece ser que algunos estudios apuntan a una estrecha correlación entre el estrés oxidativo sistémico y el IMC26.
Hay muchos interrogantes en torno a la hiperuricemia, empezando porque en el momento actual vivimos un interesante debate que consiste en demostrar si las concentraciones elevadas de ácido úrico son un marcador de riesgo cardiovascular o un factor de riesgo cardiovascular. A este debate contribuye el paradójico efecto del metabolismo de las purinas en el estrés oxidativo. Por un lado, la acción de la xantina oxidasa en la xantina produce ácido úrico y radicales superóxidos que son derivados de especies reactivas de oxígeno27; por otro lado, está el efecto antioxidante del propio ácido úrico. Esta paradoja ha producido que aparezcan trabajos donde se demuestra que la administración de alopurinol, que es hiporuricemiante, reduce las especies reactivas de oxígeno28, y otros, que muestran que la elevación de la cifras de ácido úrico incrementa la capacidad antioxidante del plasma29.
Hay cierta unanimidad en cuanto a la capacidad antioxidante del ácido úrico. Además, resultados de estudios experimentales y clínicos indican que el ácido úrico se incrementa en respuesta al estrés oxidativo30,31. Nuestro grupo ha demostrado un descenso de las concentraciones plasmáticas de ácido úrico tras sobrecarga oral de glucosa o tras sobrecarga grasa, debido a un consumo del ácido úrico en su acción como antioxidante en circunstancias de incremento del estrés oxidativo12,32.
La asociación entre obesidad central e hipertrigliceridemia es incuestionable; además, ambas tienen una marcada capacidad proinflamatoria y prooxidante. Tanto el estrés oxidativo como el estado inflamatorio se han relacionado de forma directa con el desarrollo de resistencia a la insulina. Además, los incrementos de VLDL y quilomicrones se acompañan indefectiblemente del descenso del cHDL que también contribuye a un incremento en el estado oxidativo33.
Para verificar esta hipótesis haría falta demostrar que el ácido úrico aumenta en situaciones crónicas que cursan con un mayor estrés oxidativo, y esta situación podría ser debida a un incremento crónico de sustratos, como la glucosa y los triglicéridos, capaces de producir ese incremento del estrés oxidativo. Por ello, un incremento de las concentraciones de ácido úrico podría ser un predictor de alteraciones del metabolismo de los hidratos de carbono.