INTRODUCCIÓN
El síndrome del ovario poliquístico (SOPQ) es una endocrinopatía crónica frecuente que afecta al 6-7% de las mujeres en edad reproductiva1. El SOPQ se relaciona con alteraciones hormonales del eje hipófisis-ovario (disfunción menstrual, hiperandrogenismo, infertilidad y ovarios poliquísticos) y resistencia a la insulina2,3. Las mujeres con esta condición también muestran un perfil cardiovascular característico del síndrome metabólico o de resistencia a la insulina (hiperinsulinismo, obesidad, dislipemia, hipertensión) y un estado protrombótico4, lo cual las coloca en una condición de mayor riesgo de desarrollar diabetes mellitus tipo 2 (DM2) y enfermedad cardiovascular.
La insulina tiene un papel importante en la regulación del metabolismo lipídico, particularmente las lipoproteínas ricas en triglicéridos5,6. La condición de resistencia a la insulina frecuentemente se relaciona con hipertrigliceridemia, concentraciones bajas del colesterol de las lipoproteínas de alta densidad (cHDL), y predominancia de las lipoproteínas de baja densidad (LDL) pequeñas y densas (βLDL), las cuales son ricas en triglicéridos y tienen alto poder aterogénico7-9; este patrón lipoproteínico se lo relaciona con un mayor riesgo de enfermedad cardiovascular10. Al igual que el síndrome metabólico, las mujeres con SOPQ exhiben un patrón lipídico anormal caracterizado por concentraciones plasmáticas elevadas de triglicéridos, cLDL marginalmente elevado y cHDL bajo11-13, en relación con un aumento en la concentración de partículas de LDL pequeñas, lo cual está relacionado tanto con la resistencia a la insulina como con la adiposidad14-16. El cociente triglicéridos/colesterol de las lipoproteínas de alta densidad (TG/cHDL), frecuentemente elevado en los pacientes con resistencia a la insulina, se relaciona inversamente con el diámetro de LDL y con la sensibilidad a la insulina y ha sido postulado como un instrumento útil para predecir eventos cardiovasculares y para identificar a los individuos con resistencia a la insulina y con mayor riesgo cardiovascular; particularmente, aquellos con un valor ≥ 3,517,18. Si bien es conocida la presencia de dislipemia en el SOPQ, poco se conoce sobre la evaluación de este cociente en mujeres con SOPQ, por lo tanto, el objetivo del presente trabajo es evaluar la posible relación entre el cociente TG/ cHDL y los índices de resistencia a la insulina HOMAIR (homestasis model assesment)19 y de sensibilidad a la insulina QUICKI (quantitative sensitivity check index)20 y otros factores de riesgo cardiovascular en mujeres con SOPQ.
MATERIAL Y MÉTODOSe seleccionó a 62 mujeres mestizas, con diagnóstico de SOPQ, con edades entre 17 y 35 años, de la consulta externa de endocrinología del Instituto Autónomo Hospital Universitario de los Andes (Mérida, Venezuela). El grupo control estuvo constituido por 48 mujeres sanas, en edad reproductiva, estudiantes universitarias, con ciclos menstruales regulares, sin hirsutismo, con morfología ovárica normal a la exploración ecosonográfica transvaginal realizada durante los días 1-3 del sangrado menstrual. El diagnóstico de SOPQ se fundamentó en los criterios del Consenso Venezolano de Síndrome de Ovario Poliquístico 2007, basado en hallazgos clínicos (trastornos menstruales como amenorrea, oligomenorrea, hemorragia uterina disfuncional y signos de hiperandrogenismo: como acné y/o hirsutismo), bioquímicos (testosterona total y libre elevadas en 2 oportunidades) y ecosonográficos (12 o más folículos en cada ovario con un diámetro entre 2 y 9 mm, y/o volumen ovárico mayor de 10 ml en la exploración ecosonográfica realizada en los días 1-3 de sangrado menstrual espontáneo o inducido con medroxiprogesterona o en cualquier momento si la paciente estaba en amenorrea)21. Se excluyó del estudio a las mujeres con DM2, dislipemias, endocrinopatías: enfermedad de Cushing, hiperplasia adrenal congénita, hipotiroidismo, tumores ováricos virilizantes, así como a aquellas que recibían tratamiento con agentes sensibilizadores de insulina, hipolipemiantes o anticonceptivos orales por lo menos 2 meses antes del estudio. El protocolo de investigación fue evaluado por el Comité de Ética del Departamento de Posgrado de la Facultad de Medicina de la Universidad de Los Andes; una vez aprobado, se procedió a informar tanto a las pacientes como al grupo control y obtener el consentimiento firmado.
Se realizó, a las pacientes seleccionadas, una historia clínica que incluyó el registro de los antecedentes de trastornos menstruales, acné e hirsutismo; historia personal y familiar de diabetes gestacional, DM2, hipertensión arterial, dislipemia, obesidad, factores de riesgo cardiometabólico. La evaluación clínica incluyó el registro de peso, talla, presión arterial y perímetro de cintura. La presión arterial se midió en el brazo derecho, después de 10 min en posición sentada, por método auscultatorio, con un tensiómetro de mercurio estándar. El mismo observador midió el perímetro de la cintura, mediante cinta métrica flexible colocada en el punto medio de la línea entre el último arco costal y la cresta ilíaca. Se determinó el índice de masa corporal (IMC). Según el IMC, se agrupó a las mujeres en 3 categorías: normopeso (IMC < 25), sobrepeso (IMC > 25 y < 30) y obesa (IMC > 30). Después de un ayuno de 10-12 h se tomó una muestra de sangre venosa, durante los primeros 5 días de sangrado menstrual o en cualquier momento del período de amenorrea. En la muestra obtenida se cuantificaron lutropina (LH), folitropina (FSH), testosterona total, insulina, glucosa, triglicéridos, colesterol total (CT) y cHDL; el cLDL se estimó través de la ecuación de Friedewal (LDL = CT – cHDL – (TG / 5).
Métodos de laboratorioLa concentración plasmática de los triglicéridos, colesterol total y glucosa se analizaron por método enzimático con autoanalizador ABA-100 con reactivos de Concepta (Estados Unidos). El cHDL se cuantificó por método enzimático después de precipitación con heparina y cloruro de manganeso. La concentración plasmática de insulina, LH, FSH, testosterona total se cuantificó por duplicado por un inmunoanálisis de quimioluminiscencia mediante el autoanalizador IMMULITE® (Diagnostic Products Corporation, Estados Unidos). Se calcularon los índices de resistencia a la insulina HOMAIR19 y de sensibilidad a la insulina QUICKI20. Con los valores de triglicéridos y cHDL se calculó el cociente TG/ cHDL. Todas las determinaciones se realizaron en el Laboratorio de Endocrinología y Metabolismo del Hospital Universitario de Los Andes, Mérida, Venezuela.
Análisis estadísticoLos resultados se presentan como promedio ± error estándar de la media (EE). Previa comprobación de la distribución normal de las variables se utilizó la prueba de la t de Student no apareada para la comparación entre dos promedios y la prueba de ANOVA para la comparación de más de dos grupos; el análisis post hoc fue realizado con la prueba LSD (least significant difference) de Fisher. Se aplicó la prueba de la χ2 para evaluar la asociación causal entre las variables categóricas. Se utilizó el análisis de correlación de Pearson para determinar la relación entre dos variables continuas, y el análisis de regresión lineal, para determinar la influencia de variables predictoras. Se consideró para la significación estadística un valor de p < 0,05.
RESULTADOSLas características clínicas y metabólicas de la muestra estudiada se presentan en la tabla 1. Tanto el grupo control como las pacientes con SOPQ no mostraron diferencias estadísticamente significativas respecto a la edad, el IMC y la presión arterial. El perímetro de la cintura fue significativamente más alto en las pacientes con SOPQ. La relación LH/FSH fue significativamente más alta en las mujeres con SOPQ y la concentración de testosterona total no fue significativamente diferente aun cuando en el grupo con SOPQ el promedio fue mayor que en el grupo control. Con respecto a la presión arterial no hubo diferencias significativas. La concentración promedio de glucosa fue similar en ambos grupos; sin embargo, la concentración de insulina en ayunas y el HOMAIR fueron significativamente más altos en las mujeres con SOPQ, mientras que el índice QUICKI, como expresión de sensibilidad a la insulina, fue significativamente más bajo en las mujeres con SOPQ. En relación con el metabolismo de lipoproteínas, se puede apreciar que en el grupo con SOPQ la concentración de colesterol y triglicéridos y el cociente TG/cHDL fueron significativamente más altos que en el grupo control. La distribución del cociente TG/cHDL en percentiles obtenida en el grupo total de mujeres indicó un valor de 3,64 para el percentil 50 y de 1,92 y 6,77 para los percentiles 10 y 95, respectivamente.
Con el objeto de evaluar el impacto de la masa corporal en las variables estudiadas, la muestra se clasificó en 3 categorías: normopeso (IMC < 25), sobrepeso (IMC > 25 y < 30) y obesidad (IMC ≥ 30). Como se puede observar en la tabla 2, independientemente del SOPQ, el perímetro de la cintura, el HOMAIR y el cociente TG/cHDL fueron significativamente más altos en las mujeres con sobrepeso y obesidad, mientras que el índice QUICKI disminuyó progresivamente en función de la masa corporal. La presión arterial fue similar entre los grupos con sobrepeso y obesidad; sin embargo, en el grupo con normopeso, la presión arterial sistólica fue significativamente más alta en las mujeres con SOPQ respecto a su control (p < 0,05). La insulinemia en ayunas aumentó en función del IMC; sin embargo, dentro de las mismas categorías, fue significativamente más alta en las mujeres con SOPQ (p < 0,05). La glucosa plasmática en ayunas no mostró diferencias significativas entre los grupos de estudio. La concentración plasmática de triglicéridos no mostró diferencias significativas entre los grupos con normopeso y sobrepeso; sin embargo, en el grupo con obesidad la concentración fue significativamente más alta en las mujeres obesas con SOPQ (p < 0,05). La concentración plasmática de colesterol total y de las fracciones de LDL y HDL no fue estadísticamente diferente entre los controles y las pacientes con SOPQ. El índice HOMAIR aumentó en función de la masa corporal con valores significativamente más altos en los grupos obesos; la comparación intragrupos demostró que dentro de las mismas categorías de peso, este índice fue significativamente más alto en las mujeres con SOPQ (p < 0,05). El índice QUICKI disminuyó en función del aumento de la masa corporal; sin embargo, dentro de las mismas categorías de peso, el valor fue significativamente más bajo en las mujeres con SOPQ, particularmente en los subgrupos de normopeso y sobrepeso (p < 0,05). El cociente TG/cHDL mostró una tendencia similar al HOMAIR tanto en las controles como en las mujeres con SOPQ; sin embargo, dentro de la misma categoría de peso, este cociente fue significativamente más alto en las mujeres con SOPQ, particularmente en el grupo con normopeso y obesidad (p < 0,05).
El análisis de los componentes del síndrome metabólico en el grupo de mujeres control y en aquellas con SOPQ se presenta en la tabla 3. Comparado con el grupo control, en el grupo con SOPQ se observa una frecuencia significativamente más alta de sujetos con glucosa en ayunas > 100 mg/dl y triglicéridos > 150 mg y perímetro de cintura mayor de 80 cm (p < 0,05).
Al aplicar los criterios diagnósticos del síndrome metabólico de la International Diabetes Federation22, el síndrome metabólico se presentó con una frecuencia más alta en el grupo de mujeres con SOPQ (el 30,64 frente al 10,41%). En las mujeres con síndrome metabólico el valor promedio del cociente TG/cHDL fue 3,1 ± 0,2 en la condición de SOPQ y 2,2 ± 0,8 en las controles, la diferencia no fue significativa.
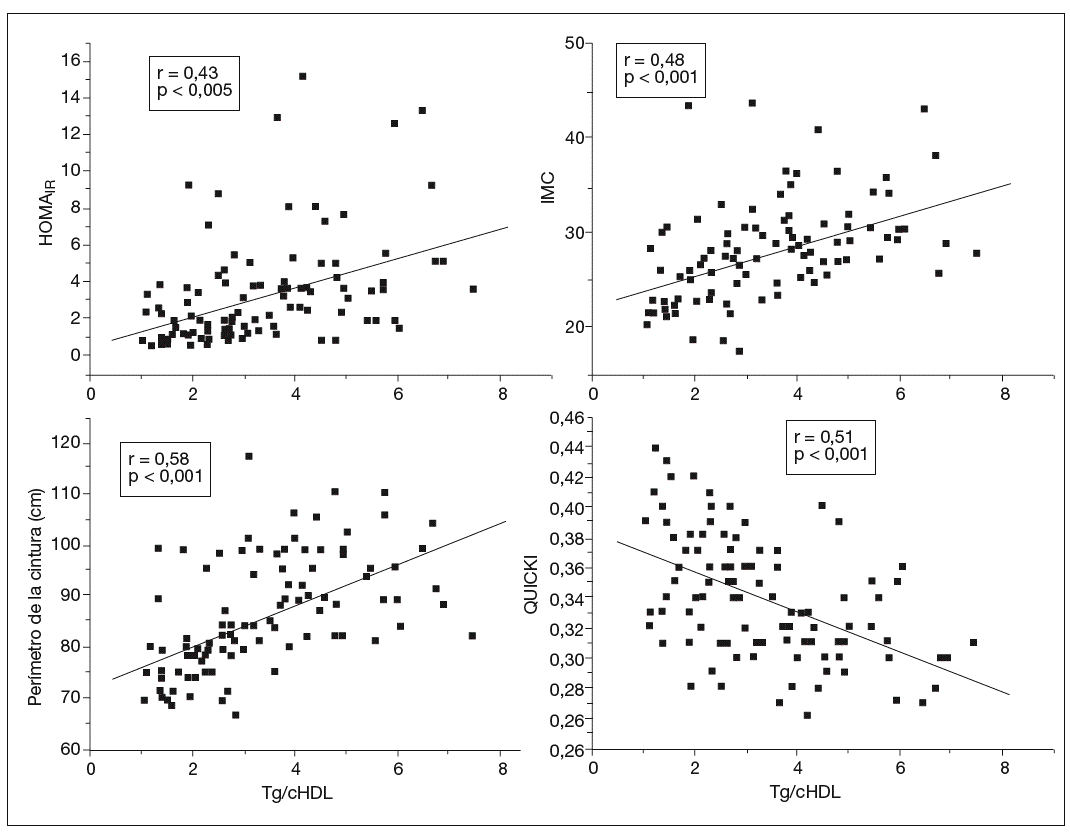
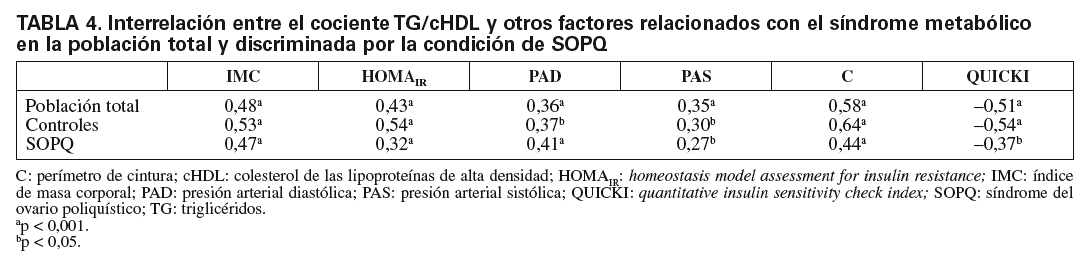
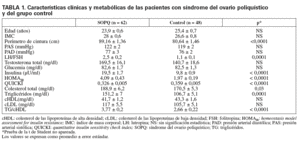
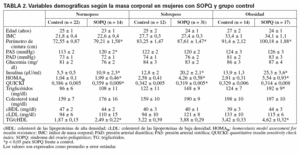
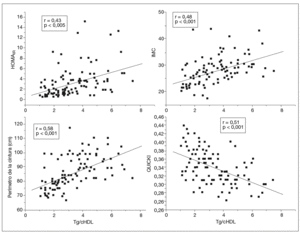
El análisis de correlación lineal de Pearson muestra que tanto en las mujeres con SOPQ como en el grupo control el cociente TG/cHDL se correlaciona positivamente con el IMC, el perímetro de cintura, el HOMAIR y la presión arterial y negativamente con el índice QUICKI (tabla 4; fig. 1). El análisis de regresión lineal puso en evidencia que el perímetro de cintura fue la única variable independiente que influyó significativamente en el índice TG/cHDL (p < 0,01).
Fig. 1. Correlación entre el cociente triglicéridos/colesterol de las lipoproteínas de alta densidad (TG/cHDL), el índice de masa corporal (IMC), el perímetro de la cintura y los índices de resistencia y sensibilidad a la insulina. HOMAIR: homeostasis model assessment; QUICKI: quantitative insulin sensitivity check index.
DISCUSIÓNEste trabajo fue diseñado para determinar la relación entre el cociente TG/cHDL y el índice de resistencia a la insulina en mujeres con SOPQ y sus resultados muestran que los valores del cociente TG/cHDL y HOMAIR son significativamente más altos en las mujeres con SOPQ respecto al grupo control. El valor más alto sencilla a los individuos sanos con resistencia a la indel índice HOMAIR, en las pacientes con SOPQ indica sulina y riesgo elevado para desarrollar enfermedad la resistencia a la insulina previamente establecida en cardiovascular y otros trastornos metabólicos relaciodiversos estudios3,23; sin embargo, el cociente TG/ nados con la resistencia a la insulina. En ese estudio se cHDL en mujeres con SOPQ, indicado como un mar-apunta a que un valor ≥ 3,5 podría indicar resistencia a cador de resistencia a la insulina, no ha sido comunica-la insulina. Cuando se analizó la distribución en per-do en estudios previos. Este cociente fue propuesto por centiles de este cociente en nuestra población total, se McLaughlin et al17 para identificar en forma rápida y pudo observar que el percentil 50 indicó un valor de 3,64, similar a lo comunicado previamente, lo cual, según lo propuesto por McLaughin et al17, podría indicar la presencia de una partícula de LDL pequeña y de mayor riesgo cardiovascular. Sería interesante realizar estudios de seguimiento de nuestra cohorte para detectar futuros eventos cardiovasculares y reafirmar o no la importancia de estimar este cociente como marcador de riesgo cardiovascular. En este estudio el cociente TG/cHDL aumentó en relación con el aumento de la masa corporal, tanto en las controles como en las mujeres con SOPQ; sin embargo, dentro de la misma categoría de peso, este cociente fue significativamente más alto en las mujeres con SOPQ, particularmente en el grupo de pacientes con peso normal y obesas, lo que indica que la condición de SOPQ per se es un factor de riesgo para causar una alteración metabólica, reflejada por este cociente. Si bien la obesidad amplifica las alteraciones metabólicas, en la condición de SOPQ la ausencia de obesidad no excluye que éstas se desarrollen. En apoyo de lo anteriormente expuesto, se aprecia que en la condición de normopeso la concentración de insulina en ayunas, el HOMAIR y el cociente TG/cHDL son más altos en esta población, en combinación con valores más bajos del índice QUICKI, indicador de sensibilidad a la insulina.
Como ya se mencionó, hay una interrelación entre los marcadores de resistencia a la insulina, el cociente TG/cHDL y la enfermedad cardiovascular. En este trabajo, tanto en el SOPQ como en el grupo control, se demostró una relación positiva significativa entre el cociente TG/cHDL, el IMC, el perímetro de la cintura, el HOMAIR y la presión arterial; sin embargo, en el análisis de regresión lineal el perímetro de la cintura fue la única variable independiente que influyó significativamente en este cociente, por lo tanto, se puede apuntar a que la medición de este cociente es importante en las mujeres con SOPQ.
El síndrome metabólico es frecuentemente referido como sinónimo de resistencia a la insulina, el cual conlleva un mayor riesgo para desarrollar DM2 y enfermedad cardiovascular24. Es importante señalar que en este síndrome frecuentemente se produce un aumento de la concentración de triglicéridos y de LDL pequeña, densa, la cual típicamente está enriquecida con triglicéridos y tiene un alto poder aterogénico5,6. Esta lipoproteína ha sido relacionada estrechamente con un aumento del cociente TG/cHDL y con mayor riesgo de enfermedad cardiovascular18.
La coexistencia de múltiples factores de riesgo cardiovascular en el SOPQ determina una mayor prevalencia de síndrome metabólico en esta población en edad temprana de la vida, por lo cual también se ha propuesto el término síndrome XX para referirse a este síndrome en la mujer con SOPQ25. Ehrmann et al26 mostraron una prevalencia del 33,4%; en nuestro trabajo, a pesar de que no fue diseñado para evaluar la prevalencia de síndrome metabólico, se observó que éste fue más frecuente en las mujeres con SOPQ (el 31 frente al 10%); la evaluación individualizada de los componentes de este síndrome indicó que en las mujeres con SOPQ su frecuencia fue mayor que en los controles27. A pesar de que no se encontró relación estadística entre la presión arterial y el SOPQ, la presión arterial sistólica fue significativamente más alta en las mujeres de peso normal con SOPQ que en sus controles. Se ha establecido que la hipertensión arterial se manifiesta más tardíamente en la vida adulta, y en edades más jóvenes sólo se ha descrito una pérdida del descenso nocturno de la presión arterial28,29. Lo anteriormente expuesto indica que en nuestra muestra de mujeres con SOPQ la frecuencia de síndrome metabólica es similar a lo publicado en otros estudios diseñados para el estudio de prevalencia26.
En conclusión, en este trabajo se demuestra que las mujeres con SOPQ, en comparación con el grupo control, tienen valores más elevados en el cociente TG/ cHDL y HOMAIR, los cuales están estrechamente relacionados, lo que indica una condición de resistencia a la insulina y, con ello, un aumento del riesgo de enfermedad cardiovascular. Si se considera las limitaciones técnicas implicadas en la cuantificación del HOMAIR por la heterogeneidad de los ensayos de laboratorio utilizados para la cuantificación de insulina, se podría considerar que el cociente TG/cHDL es más práctico y útil debido a que la cuantificación de TG y cHDL se realiza usualmente con métodos enzimáticos y, por consiguiente, hay mayor posibilidad de estandarizarlos.