La incidencia y prevalencia de sobrepeso y obesidad ha experimentado un gran incremento en las últimas tres décadas y afecta a casi todos los países del orbe. Este fenómeno no se explica fácilmente por los cambios del estilo de vida en las distintas poblaciones con hábitos de partida muy distintos. Por lo que además del cambio del estilo de vida, otros factores empiezan a tenerse en cuenta, los llamados disruptores endocrinos y más concretamente los obesógenos. Revisamos la evidencia que existe sobre sustancias químicas que polucionan el ambiente que potencialmente puedan ser obesógenos en humanos: el dietilestilbestrol (DES), la ginesteína, el bisfenol-A, los derivados orgánicos de estaño y los ftalatos. Los tres primeros actúan principalmente sobre los receptores estrogénicos y los derivados orgánicos del estaño y los ftalatos activando los PPARγ. En conclusión, existen evidencias del efecto obesógeno de estas sustancias en estudios en animales de experimentación, tanto in vitro como in vivo, pero muy pocas en humanos.
Incidence and prevalence of owerweight and obesity have greatly increased over the past three decades in almost all countries around the world. This phenomenon is not easily explained by lifestyle changes in populations with very different initial habits. This has led to consider the influence of other factors, the so-called endocrine disruptors, and more specifically obesogens. This study reviewed the available evidence about polluting chemical substances which may potentially be obesogens in humans: DES, genistein, bisphenol A, organotins (TBT, TPT), and phthalates. The first three groups of substances mainly act upon estrogen receptors, while organotins and phthalates activate PPARγ. It was concluded that evidence exists of the obesogenic effect of these chemical substances in tissues and experimental animals, but few data are available in humans.
La obesidad definida como aumento del tejido adiposo ha experimentado un aumento de su incidencia y prevalencia en prácticamente todas las poblaciones del orbe1 y nuestro país no es una excepción2–6, incluso en los países pobres. Este fenómeno ha tenido lugar en un relativamente corto periodo de tiempo. El desarrollo de obesidad se considera como la consecuencia de un desequilibrio del balance energético del organismo, ingesta calórica vs. gasto energético. Múltiples factores biológicos, conductuales, junto con los genéticos intervienen en el citado balance energético. La explicación tradicional es que desde mediados del siglo pasado, la población, principalmente de los países desarrollados, ha experimentado un aumento de la ingesta calórica, que asociada al sedentarismo progresivo en relación con los avances tecnológicos, especialmente en los niños, ha condicionado el desequilibrio hacia el aumento del depósito energético en forma de grasa7,8. Sin embargo, existen datos que no apoyan que los factores antes descritos sean la causa del aumento de la prevalencia e incidencia de las personas con sobrepeso y obesidad en distintas poblaciones con estilos de vida diferentes. Se ha evidenciado una disminución de la ingesta calórica de la población, en algunos países industrializados durante el siglo pasado9. Con respecto a la actividad física, a pesar del aumento de las actividades lúdicas con menor gasto energético como la televisión, videojuegos, la mejoría del transporte motorizado y la utilización de utensilios que facilitan los trabajos de hogar, durante el pasado siglo, no existe evidencia de que esta disminución de la actividad física sea suficiente como para explicar el aumento de la obesidad en las distintas poblaciones10,11, Por último, el control de peso no es simplemente un equilibrio entre ingesta y consumo, sino más bien comprende un fenómeno complejo11, donde el peso corporal estaría regulado homeostáticamente por ciertos mecanismos genéticamente predeterminados que permitirían mantener estable un determinado peso corporal un largo periodo de tiempo12.
El aumento explosivo de la prevalencia de obesidad en las poblaciones en las últimas décadas se explicaría por la falta de habilidad del organismo para compensar adecuadamente el estilo de vida moderno, caracterizado por una excesiva ingesta calórica y reducida actividad física. La hipótesis del fenotipo thrifty13 propone que los rasgos genéticos en la etapa histórica evolutiva en que vivimos no se adaptarían adecuadamente al ambiente obesogénico actual.
En vista de que ninguna de las posibles causas antes mencionadas explican completamente la llamada epidemia de obesidad, se ha invocado la existencia de otros factores que pudiesen jugar algún papel complementario, entre ellos, la existencia de alteraciones de la conducta alimentaria, cuya incidencia y prevalencia ha aumentado en la población, sobre todo en las formas menos conocidas tales como el síndrome del comedor nocturno, los pica pica14, la elevada prevalencia del síndrome de falta de atención e hiperactividad en niños y adultos15 y las alteraciones del sueño16.
Desde principios de la década pasada se ha invocado la posibilidad de que agentes químicos tóxicos ambientales pudiesen contribuir al aumento de la frecuencia de la obesidad en la población, Baillie-Hamilton17, después de analizar la correlación entre el aumento de la frecuencia del sobrepeso en la población adulta y el aumento de la producción de sustancias químicas industriales, formuló en 2002 la hipótesis de la relación causal entre ambos acontecimientos. Poco después se acuñó el término obesógenos, para nombrar a las sustancias químicas que polucionan el medio ambiente, y que incorporadas al organismo, puedan interferir con la regulación y conservación de la energía.
El motivo de la presente revisión es recoger las evidencias existentes sobre los obesógenos y su posible papel en el desarrollo de la obesidad en humanos.
Concepto de disrupción endocrinaEn 1996, Colbron et al.18,19 definieron el término disrupción endocrina para los agentes tóxicos que polucionan el medio ambiente y sustancias contenidas en la dieta que modulan inadecuadamente el sistema neuroendocrino. A partir de ese momento surgieron algunos interrogantes como qué agentes podrían causar efectos detectables a nivel de exposición habitual en animales y/o en humanos y la cuantificación del riesgo de exposición a un disruptor, catastrófico, insignificante o no probado. Posteriormente se aconsejó que el término disrupción endocrina se reservarse para los agentes químicos que afectan dicho sistema vía interacción con un receptor, sobre la síntesis o la eliminación de la hormona20. Numerosos estudios in vitro, sobre animales de laboratorio y en humanos realizados en la pasada década evidenciaron que numerosos xenobióticos presentes en el medio ambiente y/o en la dieta pueden interferir con el complejo mecanismo de señalización neuroendocrina produciendo efectos adversos21–24. Inicialmente creó preocupación la exposición a agentes químicos con efectos estrogénicos que alterarían la función del sistema reproductor. Posteriormente se vio que los xenobióticos tenían otros mecanismos de acción, surgiendo interés por los agentes químicos que remedan o interfieren la acción normal de prácticamente todas las hormonas, incluyendo estrógenos, andrógenos, progestágenos, hormonas tiroideas, y hormonas hipotalámicas e hipofisarias25,26.
Mecanismo de acción de los disruptores endocrinosLos disruptores endocrinos (DE) actúan uniéndose a cualquier tipo de receptores, bien sean nucleares, de membrana, receptores para neurotransmisores (receptor para la serotonina, dopamina y noradrenalina) e incluso receptores huérfanos (receptor del aril hidrocarburo). También actúan sobre rutas metabólicas de los esteroides en el sistema reproductor 24: como el dicloro-difenil-tricloro-etano (DDT), bifeniles-policlorados (PCB), bifenil-polibrominados (PBB) y algunos estrógenos vegetales, que actúan sobre los receptores estrogénicos, alterando las conductas sexuales y reproductivas. Algunos dietilestilbestrol (DE) actúan como antagonistas de hormonas, por ejemplo el vinclozolín y el dicloro-difenil-dicloro-etileno (DDE)27, metabolito del DDT, contienen sustituciones de grupos halógenos, cloro y bromo, por radicales fenólicos, simulando las hormonas esteroideas nativas e interactúan con los receptores como agonistas o antagonistas. Los DE también pueden actuar modificando la síntesis y catabolismo de las hormonas naturales, elevando o disminuyendo sus concentraciones, como los fitoestrógenos (flavonas, isoflavonas, cumestanos, lignanos) y micoestrógenos (zeranol) que favorecen la aparición de glándulas mamarias en machos28.
Un reto en el campo de los disruptores endocrinos es la diversidad de sustancias que incluso pueden no tener similitud estructural con los reguladores fisiológicos, excepto por su bajo peso molecular. Son factores importantes en la disrupción endocrina: a) La edad de la exposición, siendo más vulnerable a sus efectos la etapa de desarrollo intraútero27; b) El tiempo de latencia desde la exposición, las consecuencias de la exposición en las etapas tempranas de desarrollo pueden manifestarse en la edad adulta o incluso en la senectud; c) La importancia de la contaminación múltiple, es raro que los agentes polucionantes ambientales contaminen aisladamente, pudiendo presentarse efectos adictivos o sinérgicos28; d) La dinámica dosis-respuesta es no tradicional, ya que sorprendentemente, bajas dosis de un contaminante pueden tener más efecto que con las dosis altas29,30; e) Su efecto transgeneracional y epigenético, los disruptores endocrinos pueden no solo afectar a un individuo sino también a su descendencia e incluso a generaciones posteriores31, y f) La diversidad y complejidad de los mecanismos de acción, los disruptores endocrinos a menudo actúan por más de un mecanismo, y también los productos metabólicos de la degradación de los disruptores tienen efectos diferentes a la sustancia química inicial32.
Con respecto a los efectos moleculares de los disruptores endocrinos, se considera que estos simulan o bloquean la transcripción inducida por los esteroides naturales sobre sus receptores nucleares. Entre otros se ha demostrado que inhiben la acción de la histona-deacilasa, alteran la metilación del ADN, activan la fosforilización de coactivadores como el p160, reducen la degradación del complejo disruptor-receptor aumentando su efecto33.
ObesógenosLos obesógenos son xenobióticos que pueden estar presentes en el medio ambiente y/o en los alimentos, y que regulan y promueven de forma inapropiada la acumulación de lípidos y la adipogénesis34. Recientemente varios estudios se han centrado en la posible repercusión del efecto de disruptor endocrino del sistema de regulación energética, esto es, los obesógenos y su relación con el aumento de la prevalencia de obesidad en prácticamente todos los países del orbe35–37.
Existen unas condiciones imprescindibles para que el modelo de interacción obesógenos con la salud de la población sea plausible. Primero, que se detecten dianas moleculares de los obesógenos en el tejido adiposo, segundo, que los obesógenos tengan la capacidad de alterar la biología del tejido adiposo, induciendo aumento de contenido graso de las células, hipertrofia, y aumento del número de células, hiperplasia. Tercero, que exista una relación realista entre contaminación y efecto, esto es que la concentración del disruptor en el organismo tenga capacidad de inducir un efecto concreto sobre el balance energético, finalmente, que los estudios epidemiológicos pongan de manifiesto la relación causal de obesógenos con una parte significativa de la población.
Otro aspecto importante es el momento en que el agente químico actúa sobre nuestro organismo y tiene repercusión sobre la inducción de adipogénesis. En la actualidad existe evidencia de que el periodo de desarrollo intraútero es el más vulnerable para el efecto de los obesógenos, para el efecto específico sobre la promoción de adipogénesis en adultos36,38.
Comparado con la exposición a los DE en adultos, la exposición a los mismos en la época fetal o neonatal del desarrollo es clínicamente más relevante ya que en estas etapas los organismos son extremadamente vulnerables a sustancias químicas con efecto similar a las hormonas. Se ha demostrado que el efecto de los DE es más intenso, pronunciado y con concentraciones menores en las primeras etapas del desarrollo39. Ya que los efectos protectores que se encuentran en la etapa adulta, tales como, reparación del ADN, un sistema inmunológico competente, enzimas hepáticos desintoxicantes, y la barrera hematoencefálica no están completamente funcionales en la etapas fetal y neonatal. Además en la época fetal y prenatal el metabolismo esta aumentado en comparación con los periodos posteriores del desarrollo, lo que puede potenciar el efecto de los DE.
La idea que la salud y la enfermedad de los adultos tienen su base etiológica en la etapa fetal o neonatal no es única en el campo de la endocrinología. A finales de los años 80, estudios sobre la nutrición materna sugerían que el ambiente fetal, reflejado en el bajo peso del niño al nacer y pobre nutrición se relacionó con el aumento del riesgo de sufrir enfermedades no transmisibles, enfermedad cardiovascular, diabetes mellitus, osteoporosis, etc., surgiendo la hipótesis del origen de las enfermedades en la épocas fetal y neonatal38.
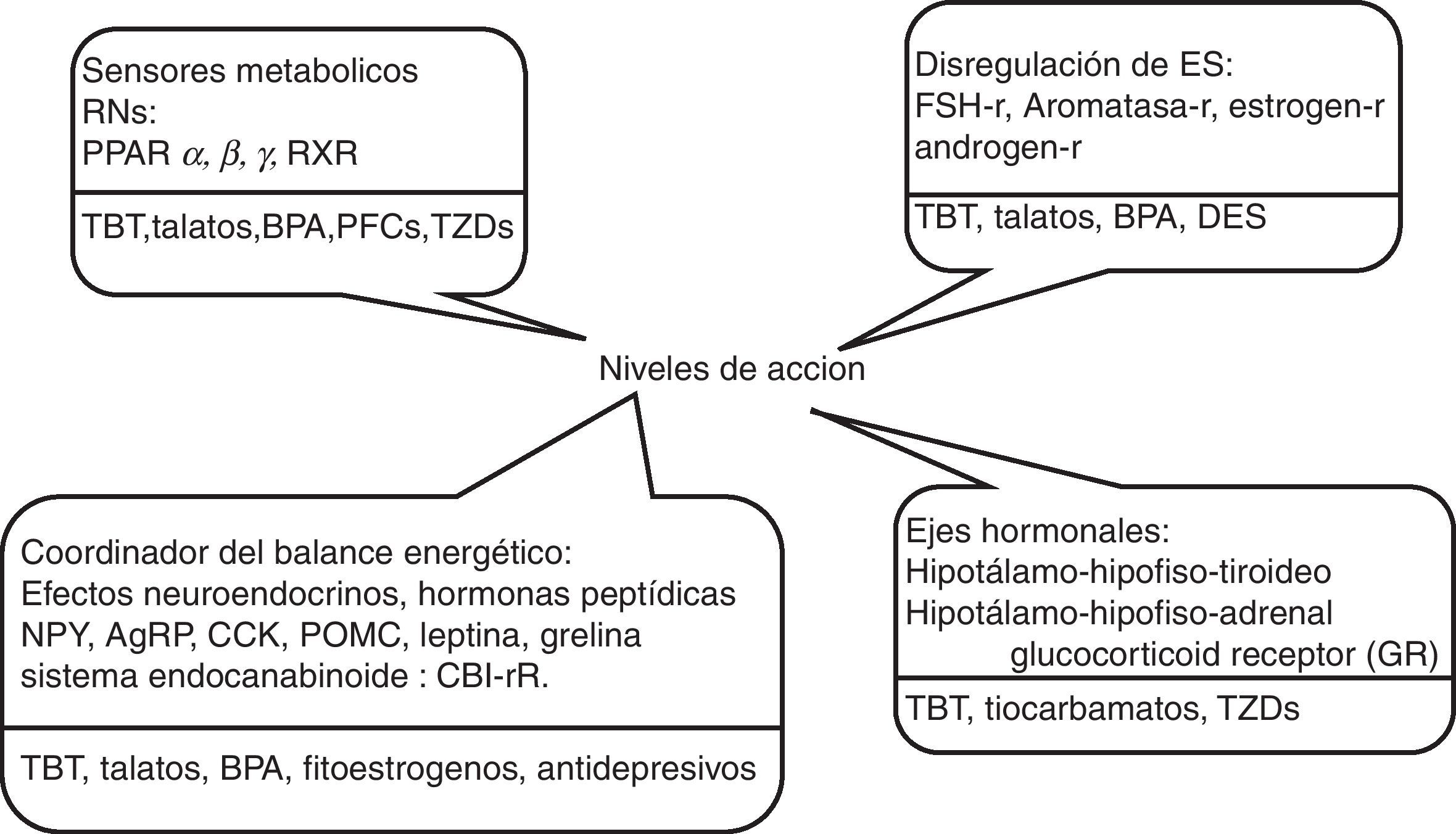
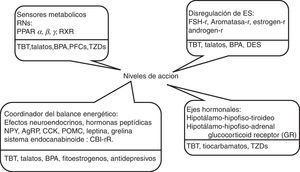
En la figura 1, se muestran algunas sustancias que en la actualidad se investigan sobre su posible propiedad obesogénica, y a continuación se revisan las evidencias que existen en la literatura actual sobre algunos potenciales obesógenos.
Modelo del dietilestilbestrolEl DES es un estrógeno sintético, ampliamente utilizado en los años 40 a 70 para tratar la amenaza de aborto espontáneo. Unos años después del comienzo de su empleo se supo que las mujeres expuestas tenían un riesgo elevado de padecer cáncer de mama, las hijas presentaban problemas de fertilidad, neoplasias y enfermedades autoinmunes, y los hijos también presentaban algunas anomalías menos severas40,41. Por este motivo se desarrollaron modelos experimentales en los que se analizaron los efectos del DES como posible DE. La exposición neonatal de ratones CD-1 a dosis de 1μg/Kg/día, no se asoció a modificaciones de peso corporal durante el tratamiento, pero sí a un aumento de peso en la edad adulta42. La administración de dosis altas de DES, 1.000μg/kg/día, en esa etapa del desarrollo causa un descenso significativo del peso durante el tratamiento, posteriormente en la pubertad se observa un incremento ponderal. El aumento de peso en estos roedores es debido al aumento del depósito graso, y este aumento de peso es precedido por el incremento en los niveles de varias adipocinas tales como leptina, adiponectina, IL-6, triglicéridos43. Por otro lado la administración prenatal a dosis de 10-100μg/Kg/día, produce bajo peso al nacer, que se mantiene el resto de la vida del animal.
Se especula que la precoz exposición al disruptor endocrino alteraría la programación genética de los adipocitos y su distribución43. El efecto antiadipogénico o proadipogénico de la exposición al DES depende de la etapa de exposición y de la dosis34. Las dianas moleculares de los xenobióticos estrogénicos son los receptores de estrógenos (ER), principalmente el tipo α, las mitocondrias y el transporte de glucosa a nivel celular44.
GenisteínaLa genisteína es una isoflavona con propiedades antioxidantes que se ha utilizado como anti-helmíntico. El mayor contacto de la genisteína con la población se produce mediante la ingesta de alimentos que contienen soja, que recientemente ha experimentado un auge en la dieta occidental como aditivo o componente. Tiene actividad estrogénica débil y su estructura química es muy similar a la del estradiol, principal estrógeno natural en humanos.
Las evidencias que existen sobre la posible actividad obesogénica de la genisteína proceden del grupo de Penza et al.44, en ratones C57BL/6 de 4 semanas, a dosis farmacológicas inhibe el depósito de grasa, mientras que en los mismos animales de experimentación a dosis nutricionales, mucho menores que las dosis farmacológicas, induce adipogénesis. Los autores concluyen que la ginesteína es adipogénica en ratones inmaduros a dosis similares a las presentes en las dietas occidentales y orientales que contienen soja. Se ha demostrado que este efecto se debe a la sobre expresión de genes adipogénicos y que el efecto esta mediado por la unión del disruptor con los receptores de los estrógenos (ER). Este efecto adipogénico se debe a la interacción con el ERα, ya que no se observa en ratones αOKER45. La ginesteína se une tanto a los ER α como a los ER β, siendo su unión preferente a estos receptores nucleares, aunque no hay que olvidar que los ER β regulan la expresión de los ER α46. Son necesarios más estudios para establecer la contribución relativa de cada uno de los citados receptores.
Se ha demostrado que el efecto estrogénico de la ginesteína depende de factores como su concentración, de la concentración de los estrógenos endógenos y del género de los animales.
La ginesteína a dosis altas, estimula los receptores activadores de la acción de los peroxisomas (PPAR) de preferencia el γ47, induciendo la adipogénesis. Así mismo, en estudios in vivo con células procedentes de ratones ovariectomizados48 y en mujeres posmenopáusicas 49,50, los fitoestrógenos disminuyen y modifican la distribución de la grasa corporal.
En general, se puede asumir que, dada la amplia exposición a la ginesteína en la población general, y sus propiedades adipogénicas demostradas en estudios in vitro e in vivo en animales, este xenobiótico es un buen candidato como un obesógeno en humanos.
Bisfenol AEl bisfenol A (BPA) y los nonil-fenoles son ubicuos para la población humana, por su amplio uso en productos industriales y de consumo. Además, son componente de los plásticos en los que se envasan alimentos. Se conoce su efecto estrogénico desde los años 30 y su concentración en suero humano varía entre 0,3-4,4ng/ml30,51. En cultivos de preadipocitos (células 3T3-L1), el BPA en presencia de insulina, activa genes adipogénicos y facilita la diferenciación celular, este efecto está mediado por su acción sobre los ER52,53. In vivo la exposición prenatal y neonatal de BPA en ratones produce obesidad e hiperlipemia asociado a un aumento de la ingesta y una disminución de la actividad física de los roedores53.
En cultivos de adipocitos humanos se ha observado que el BPA inhibe la liberación de la adiponectina, que como sabemos es un protector del organismo sobre muchos de los componentes del llamado síndrome metabólico54. Otra evidencia, obtenida en un estudio epidemiológico en humanos, es la correlación entre los niveles séricos de BPA, la prevalencia de la obesidad y el síndrome del ovario poliquístico55. Al mismo tiempo, también se ha observado una asociación positiva entre la concentración de BPA en orina y el IMC56.
Todos estos datos apoyan la actividad obesogénica del BPA en humanos. Sin embargo, un estudio reciente de Teeguarden et al,57 ha demostrado que en personas que consumen alimentos envasados ricos en BPA, esta sustancia se absorbe y elimina rápidamente por el organismo, indicando que no tendría el efecto tóxico observado en los animales de experimentación.
Compuestos órgano-estáñicosEl tributil-estaño (TBT), monobutil-estaño (MBT) y tifenil-estaño (TPT), son agentes orgánicos que de forma continua polucionan el medio ambiente. Se utilizan en el revestimiento de embarcaciones, en la industria de la madera, sistemas conductores de agua, y como fungicida en alimentos58,59. Se ha determinado su concentración en muestras de tejidos humanos en Europa y Asia; concretamente en muestras de hígado la concentración varía entre 6-84ng/g de peso para el MBT y menor de 2ng/g de peso para el TBT60. Mientras que en USA se ha determinado su concentración en sangre siendo alrededor de 21ng/ml el total de los órgano-estáñicos y alrededor de 8ng/ml para el TBT61.
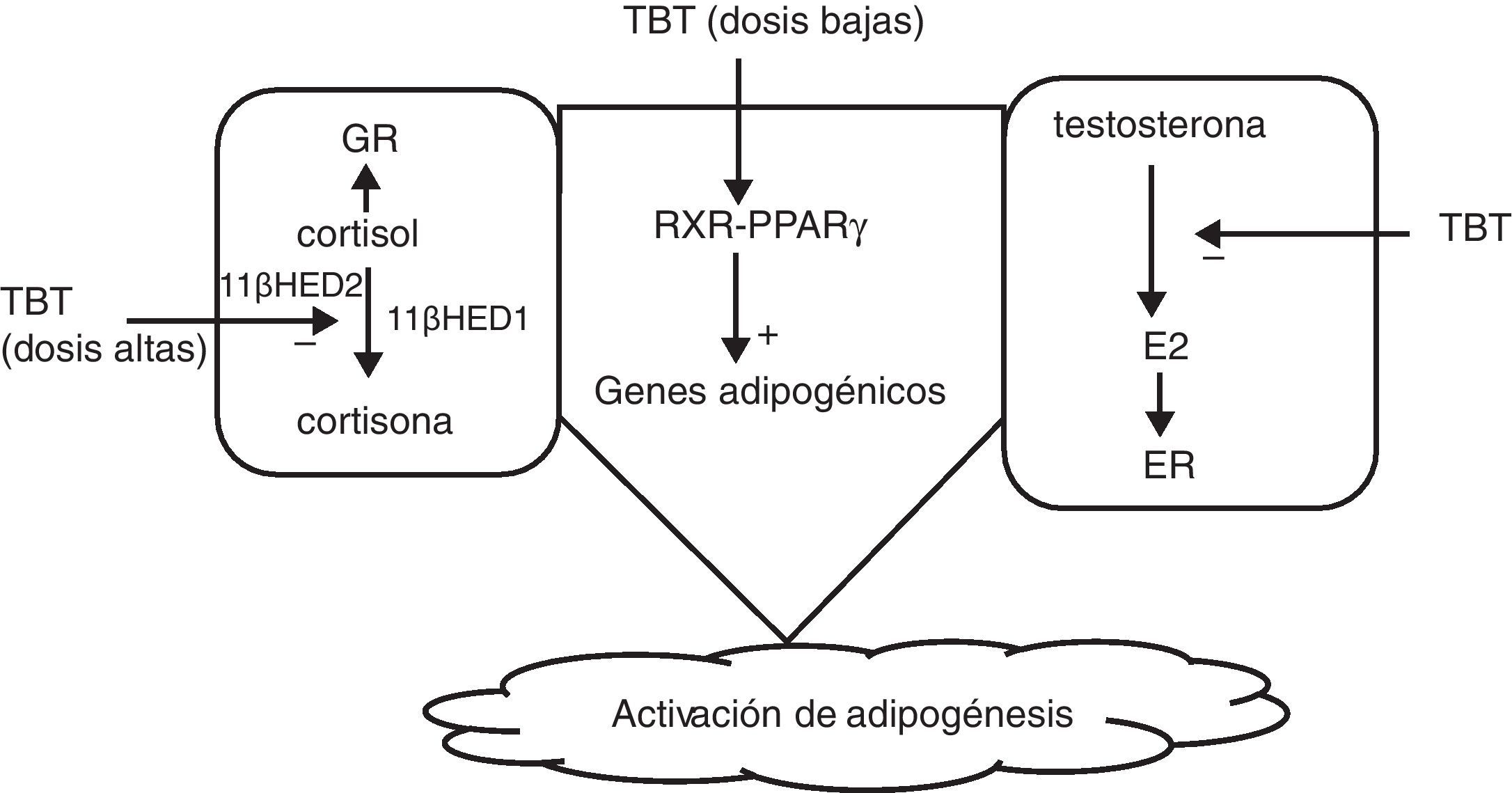
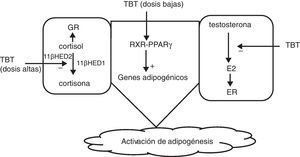
Grun y Blumberg36 sugieren que estos disruptores actuarían activando receptores nucleares tipo PPAR y RXR, sobre todo sobre el PPARγ, que juega un papel importante en la adipogénesis. También podrían actuar inhibiendo la aromatasa que convierte la testosterona en estrógenos, favoreciendo la adipogénesis, y por último a dosis altas, el TBT actuaría sobre los residuos cisteína, inhibiendo la acción de la 11 β hidroxiesteroide-deshidrogenasa, aumentando los niveles de cortisol, que favorece también la adipogénesis62 (fig. 2).
Los compuestos órgano-estáñicos, en cultivos de preadipocitos inducen su maduración, actuando sobre el heterodimero RXR-PPARγ63–65. En cultivos de células madre mesenquimales, inducen además la formación de adipocitos maduros previa activación del heterodiémero RXR-PPARγ65.
A la vista de los datos descritos anteriormente y debido a su contacto amplio y frecuente con un segmento importante de la población general, estos agentes son posibles obesógenos en humanos. Serían necesarios estudios epidemiológicos que demuestren la asociación entre la exposición a compuestos órgano-estáñicos y el desarrollo de la obesidad.
FtalatosLos ftalatos son compuestos orgánicos sintéticos derivados del ácido tálico, como los ácidos di-2-etil-hexil-talato (DEHP) y mono-2-etil-hexil-talato (MEHP). Están amplia y continuamente en contacto con la población al ser constituyentes de plásticos, productos de cosmética, juguetes, lubricantes, etc. En humanos se ha determinado que la transferencia de ftalatos en el procesado de alimentos representa aproximadamente 160μg/día66.
La exposición prenatal de DEHP en ratones a dosis mayores de 5mg/Kg de peso, induce un efecto anti-adipogénico, actuando a través de la activación de PPARα67,68. Mientras que la exposición crónica a esta misma dosis induce adipogénesis, por activación de PPARγ69. En cultivos de preadipocitos (células 3T3-L1) la exposición de MEHP induce adipogénesis actuando sobre PPARγ70,71. La exposición prenatal de ftalatos inhibe la síntesis de andrógenos y tiene un efecto adipogénico71. Por último, indicar un estudio epidemiológico en humanos varones según el cual se observó una clara correlación positiva entre la concentración de ftalatos en orina y el perímetro de la cintura72.
ConclusionesEntre los xenobióticos considerados como posibles compuestos obesogénicos en humanos se han estudiado principalmente el dietilestilbestrol, el bisfenol A, los compuestos orgánicos derivados del estaño, la genisteína y los ftalatos. De estos las evidencias proceden de estudios realizados en tejidos y en animales de experimentación, pero existen muy pocos datos de estudios en humanos que permitan establecer definitivamente su papel como obesógenos. Son necesarios estudios epidemiológicos que demuestren la relación causal entre la concentración de los distintos obesógenos en los fluidos biológicos humanos y el desarrollo de obesidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.