Proporcionar unas recomendaciones prácticas para la evaluación y el manejo de la hipoglucemia en pacientes con diabetes mellitus.
ParticipantesMiembros del Grupo de Trabajo de Diabetes Mellitus de la Sociedad Española de Endocrinología y Nutrición (SEEN).
MétodosLas recomendaciones se formularon de acuerdo al sistema Grading of Recommendations, Assessment, Development, and Evaluation para establecer tanto la fuerza de las recomendaciones como el grado de evidencia. Se realizó una búsqueda sistemática en MEDLINE (PubMed) de la evidencia disponible para cada tema, y se revisaron artículos escritos en inglés y castellano con fecha de inclusión hasta el 15 de febrero de 2013. Para las recomendaciones acerca del uso de fármacos, se consideraron tratamientos aprobados por la Agencia Europea de Medicamentos con esa misma fecha. Tras la formulación de las recomendaciones estas se discutieron conjuntamente por el Grupo de trabajo.
ConclusionesEl documento establece unas recomendaciones prácticas basadas en la evidencia acerca de la evaluación y manejo de la hipoglucemia en pacientes con diabetes mellitus.
To provide practical recommendations for evaluation and management of hypoglycemia in patients with diabetes mellitus.
ParticipantsMembers of the Diabetes Mellitus Working Group of the Spanish Society of Endocrinology and Nutrition.
MethodsRecommendations were formulated according to the Grading of Recommendations, Assessment, Development, and Evaluation system to describe both the strength of recommendations and the quality of evidence. A systematic search was made in MEDLINE (PubMed). Papers in English and Spanish with publication date before 15 February 2013 were included. For recommendations about drugs only those approved by the European Medicines Agency were included. After formulation of recommendations, they were discussed by the Working Group.
ConclusionsThe document provides evidence-based practical recommendations for evaluation and management of hypoglycemia in patients with diabetes mellitus.
La aparición de hipoglucemia inducida por el tratamiento hipoglucemiante es uno de los principales factores limitantes para la obtención de un adecuado control metabólico en la diabetes mellitus (DM), fundamental para la prevención del desarrollo de complicaciones1,2. La hipoglucemia está asociada con un exceso de morbimortalidad, incrementa el coste asociado al cuidado de la DM y conlleva una pérdida de productividad de los sujetos afectados3–6.
El Grupo de Trabajo de Diabetes Mellitus de la Sociedad Española de Endocrinología y Nutrición consideró la evaluación y el manejo de la hipoglucemia en pacientes con DM un área prioritaria para el desarrollo de directrices de práctica clínica, y elaboró estas recomendaciones basadas en la evidencia.
Método de desarrollo de las guías de práctica clínica basadas en la evidenciaLas recomendaciones se formularon de acuerdo al sistema Grading of Recommendations, Assessment, Development, and Evaluation (GRADE) para establecer la fuerza de las recomendaciones y el grado de evidencia7. En términos de fuerza de recomendación se distinguen recomendaciones fuertes, expresadas como «recomendamos» y el número 1, y recomendaciones débiles expresadas como «sugerimos» y el número 2. La calidad de la evidencia se expresa con símbolos: ⊕○○○ indica evidencia muy baja; ⊕⊕○○, evidencia baja; ⊕⊕⊕○, evidencia moderada; y ⊕⊕⊕⊕, evidencia alta. Junto a cada recomendación se describe la evidencia que sustenta dicha recomendación.
Se realizó una búsqueda sistemática en MEDLINE (PubMed) de la evidencia disponible para cada tema, y se revisaron artículos escritos en inglés y castellano con fecha de inclusión hasta el 15 de febrero de 2013. Para las recomendaciones acerca del uso de fármacos se consideraron tratamientos aprobados por la Agencia Europea de Medicamentos hasta esa misma fecha. Tras la formulación de las recomendaciones estas se discutieron conjuntamente por el Grupo de trabajo.
Definición y clasificación de hipoglucemiaRecomendaciones- -
Recomendamos evaluar la presencia y gravedad de las hipoglucemias sintomáticas o asintomáticas en cada visita realizada a los pacientes con diabetes tipo 1 (DM1) y tipo 2 (DM2) en riesgo de hipoglucemia (1⊕⊕⊕○).
- -
Sugerimos que los sujetos con DM estén alertados ante la posibilidad de desarrollar una hipoglucemia cuando en la automonitorización de glucemia capilar (AMGC) las concentraciones de glucosa desciendan rápidamente o sean inferiores a 70mg/dl (2⊕○○○).
En pacientes con DM, la hipoglucemia se define como cualquier episodio de concentración plasmática de glucosa anormalmente baja (con o sin síntomas) en el que el individuo se expone a un daño8,9. El valor por debajo del cual se define la hipoglucemia en pacientes con DM, 70mg/dl, es más alto que el empleado para diagnosticar la hipoglucemia en pacientes no diabéticos (menor de 55mg/dl), y no está exento de debate10–12. Se define tomando como base el umbral glucémico normal para la secreción hormonal contrarreguladora9 .En la práctica, la hipoglucemia se clasifica por sus consecuencias clínicas8.
Hipoglucemia graveRequiere para su recuperación de la ayuda de otra persona que administre los hidratos de carbono (CH), glucagón u otras medidas. Aunque no se disponga de medición de glucemia, la recuperación neurológica atribuible a la restauración de la concentración normal de glucosa se considera evidencia suficiente.
Hipoglucemia documentada sintomáticaLos síntomas típicos de hipoglucemia son acompañados por una determinación de glucosa en plasma inferior a 70mg/dl.
Hipoglucemia asintomáticaDeterminación de glucosa en plasma inferior a 70mg/dl sin síntomas acompañantes.
Hipoglucemia sintomática probableSíntomas típicos de hipoglucemia que no se acompañan de una determinación de glucosa plasmática, pero que presumiblemente están causados por una concentración de glucosa en plasma inferior a 70mg/dl.
Hipoglucemia relativaEl sujeto con DM muestra los síntomas típicos de hipoglucemia, y los interpreta como indicativos de hipoglucemia, pero la concentración medida de glucosa en plasma es mayor de 70mg/dl. Refleja el hecho de que los pacientes con mal control glucémico pueden experimentar síntomas de hipoglucemia con niveles de glucosa en plasma superiores a 70mg/dl.
Respuesta contrarreguladoraEn situación fisiológica, la primera respuesta ante una hipoglucemia es la inhibición de la propia secreción de insulina endógena13, situación que no es aplicable al paciente con DM1 y en muchos casos en la DM2. Además hay una serie de hormonas contrarreguladoras cuya acción conduce a un incremento de la concentración plasmática de glucosa: glucagón, adrenalina, hormona del crecimiento (GH) y cortisol13. Existe también una respuesta neurógena a la hipoglucemia iniciada por sensores neurales de glucosa a nivel periférico y central, mediada por diferentes neurotransmisores responsables de algunos de los síntomas neurológicos de la hipoglucemia14.
Los umbrales de glucemia que inician los diferentes mecanismos contrarreguladores varían14, y además se modifican por diferentes situaciones fisiopatológicas que se producen en la DM. El aumento de glucagón constituye, junto con la inhibición de la secreción de insulina, la primera línea de respuesta a la hipoglucemia; estimula la glucogenólisis y favorece indirectamente la gluconeogénesis. La secreción de adrenalina desempeña un papel secundario en la contrarregulación después del glucagón, aunque adquiere importancia cuando la secreción de glucagón es deficiente. Sus acciones incluyen la estimulación de la glucogenólisis y de la gluconeogénesis hepática (y también renal), y la disminución de la utilización periférica de glucosa13. Además, inhibe directamente la secreción de insulina por la célula beta.
La hipoglucemia genera además una respuesta del sistema nervioso autónomo simpático y parasimpático, que ejerce acciones contrarreguladoras directas por la acción neural a nivel periférico, limitando la secreción de insulina y estimulando la secreción de hormonas contrarreguladoras. Entre ellas se encuentran la GH y la corticotropina cuya secreción es estimulada a través del hipotálamo. El incremento de cortisol y de GH tiene un efecto hiperglucemiante que se inicia al cabo de 2-3h, y sus acciones suponen un aumento de la producción hepática de glucosa y una disminución de su utilización a nivel periférico.
Hipoglucemia en la diabetes tipo 1Recomendaciones- -
Recomendamos la prevención de la hipoglucemia a través de un equilibrio adecuado entre dosis de insulina, ingesta y actividad física, así como su búsqueda activa mediante la AMGC, especialmente cuando la DM tiene más de 5 años de evolución (1⊕⊕⊕⊕).
- -
Recomendamos valorar la terapia con bomba de infusión subcutánea continua de insulina (ISCI) en pacientes con DM1 e hipoglucemias frecuentes (graves o no)(1⊕⊕⊕⊕)
La hipoglucemia de causa iatrogénica va unida al tratamiento con insulina en la DM1, y es uno de los principales factores limitantes en la consecución de los objetivos de control glucémico. Se estima que la glucemia puede ser menor de 50mg/dl hasta en el 10% de la vida del paciente con DM1. Como media estos pacientes sufren 2 episodios de hipoglucemia sintomática por semana y uno de hipoglucemia grave por año13. Además, se calcula que uno de cada 25 pacientes con DM1 morirá por una hipoglucemia iatrogénica15.
El Diabetes Control and Complications Trial objetivó una incidencia de hipoglucemia grave iatrogénica de 62 episodios por cada 100 pacientes/año16. No obstante, más recientemente el United Kingdom Hypoglycaemia Study Group encontró una incidencia de hipoglucemia grave en DM1 en tratamiento con insulina durante menos de 5 años de 110 episodios por cada 100 pacientes/año17, similar a los datos del Stockholm Diabetes Intervention Study18, y una incidencia de 320 episodios de hipoglucemia grave por cada 100 pacientes/año cuando se incluyen pacientes con DM1 tratados con insulina durante más de 15 años17. Por otra parte, en un estudio observacional prospectivo que incluyó a 7.067 pacientes con DM1 la incidencia fue de 300 episodios de hipoglucemia por cada 100 pacientes/año19.
Diversos metaanálisis han demostrado que la terapia con ISCI disminuye hasta 4 veces el número de hipoglucemias graves; esta reducción es mayor en los pacientes con mayor número de hipoglucemias graves previas20. También se ha demostrado una reducción de entre el 50-75% del número total de episodios de hipoglucemias21.
Hipoglucemia en la diabetes tipo 2Recomendación- -
Recomendamos como objetivo prioritario en la DM2 evitar la hipoglucemia por su asociación con mayor probabilidad de abandono del tratamiento, mayor coste y deterioro de la calidad de vida (1⊕⊕⊕⊕).
En pacientes con DM2 en tratamiento con insulina y/o antidiabéticos orales en EE. UU., la frecuencia estimada de consulta a un centro médico por hipoglucemia de cualquier tipo fue 0,054 por paciente/año. La hipoglucemia se asoció a mayor probabilidad de abandono de tratamiento y a un mayor coste sanitario relacionado o no con la DM22.
La incidencia de hipoglucemia en DM2 descrita por los diferentes estudios es variable. En un amplio estudio observacional, la incidencia de hipoglucemia grave fue de 11,8 episodios/100 pacientes/año, similar a la encontrada en DM1 en el mismo estudio23. La frecuencia de hipoglucemias no graves es muy difícil de estimar. En un estudio retrospectivo24 realizado en 14.357 pacientes en tratamiento con antidiabéticos orales y/o insulina, el 11% de los pacientes había tenido al menos un episodio de hipoglucemia «significativa» en los 12 meses previos. En DM2, la incidencia de hipoglucemia leve y grave en pacientes tratados con insulina durante más de 5 años fue similar a la observada en pacientes con DM1, mientras que los pacientes con DM2 tratados con insulina durante menos de 2 años presentaron una incidencia de hipoglucemia similar a la observada durante el tratamiento con sulfonilureas (SU) e inferior a la reportada en la DM117.
Hipoglucemia y enfermedad cardiovascularRecomendaciones- -
Recomendamos considerar en la DM2 la hipoglucemia como factor asociado a enfermedad cardiovascular (ECV) (1⊕⊕○○) y la hipoglucemia grave como factor asociado a mortalidad total (1⊕⊕⊕○).
- -
Sugerimos que la hipoglucemia grave en DM1 no debe considerarse como un factor asociado a la aparición de ECV (2⊕⊕○○).
En el estudio Action in Diabetes and Vascular Disease (ADVANCE)5 la hipoglucemia grave se asoció con un aumento significativo en el riesgo de mortalidad total (hazard ratio [HR] ajustado: 3,30; intervalo de confianza [IC]: 2,31-4,72). El estudio Action to Control Cardiovascular Risk in Diabetes25 también demostró una asociación significativa entre hipoglucemia grave y muerte de cualquier causa, tanto en el grupo intensivo (HR: 1,41; IC: 1,03–1,93) como en el convencional (HR: 2,30; IC: 146-3,65), sin relación entre hipoglucemia no grave y/o asintomática y mortalidad26.
Los estudios observacionales también apoyan la relación entre hipoglucemia y mortalidad total, salvo un trabajo que no encontró relación entre mortalidad total e hipoglucemia grave de cualquier tipo tras 4 años de seguimiento27. En un estudio, la hipoglucemia grave autorreferida suponía un HR de mortalidad al cabo de 5 años de 3,4 (IC: 1,5-7,4) frente a los que habían referido hipoglucemia no grave o ninguna hipoglucemia28; en otro estudio el HR ajustado fue de 2,48 (IC: 1,41–4,38) para mortalidad total en caso de hipoglucemia grave o no grave29. Una revisión sistemática del Veterans Health Administration concluye que existe evidencia suficiente para establecer la asociación entre hipoglucemia grave y mortalidad total a largo plazo, aunque no a corto plazo30.
La relación entre la hipoglucemia y la mortalidad cardiovascular está menos establecida, y no existen datos suficientes para establecer o descartar esta asociación. El único dato disponible surgió del análisis post hoc del estudio ADVANCE5, que demostró una relación significativa entre hipoglucemia grave y muerte cardiovascular (HR: 3,78; IC: 2,34–6,11). No se encontró una relación temporal entre hipoglucemia grave y mortalidad y tampoco existía una relación dosis-respuesta, por lo que los autores cuestionan que la hipoglucemia grave pudiera tener un papel causal en la mortalidad o solo sea un marcador de riesgo o de vulnerabilidad para la aparición de complicaciones.
En cuanto a la relación de las hipoglucemias con la aparición de ECV global en DM2, el estudio ADVANCE5 demostró específicamente la asociación de hipoglucemia grave con ECV (HR: 2,88; IC: 2,01–4,12). El resto de la evidencia proviene de estudios observacionales: en uno de ellos se demuestra una relación significativa entre ECV e hipoglucemia de cualquier tipo en DM2 tras 4 años de seguimiento (HR: 2; IC: 1,63-2,44)26; otro estudio describe una asociación entre hipoglucemias y ECV (OR: 1,79; IC: 1,69-1,89)31, y, finalmente se ha descrito que la hipoglucemia grave o no grave supone un HR de 2,09 (IC: 1,63–2,67) de asociar ECV29. Además, un estudio transversal observó que las hipoglucemias sintomáticas estaban incrementadas en sujetos con DM2 y ECV frente a los que no presentaba ECV (OR: 3,73; IC: 1,31-10,65)32 De nuevo estos datos no permiten establecer una relación causal.
En sujetos con DM1, los grandes ensayos clínicos realizados16,33 no mostraron mayor mortalidad total o cardiovascular o ECV en el grupo de tratamiento intensivo que, además, presentaba mayor incidencia de hipoglucemias. Un estudio retrospectivo español encuentra una asociación entre antecedentes de hipoglucemia grave y desarrollo de ECV, que desaparece al ajustar por edad y duración de la DM34. Por último, en el EURODIAB Prospective Complicacions Study35, con 2.181 pacientes con DM1 seguidos durante más de 7 años, la incidencia de ECV no se asoció con la frecuencia de hipoglucemia grave.
Hipoglucemia y riesgo de fractura en el paciente con diabetes mellitusRecomendaciones- -
Recomendamos considerar que los episodios de hipoglucemia están asociados con un aumento del riesgo de fracturas en pacientes con DM (1⊕⊕○○).
- -
Sugerimos estrategias terapéuticas dirigidas a prevenir las caídas relacionadas con hipoglucemias y mejorar la salud ósea en los pacientes con DM y fragilidad (2⊕○○○).
La DM, las caídas y las fracturas son procesos comunes en personas de edad avanzada. Las caídas están relacionadas con lesiones en diferentes órganos y, particularmente, fracturas36. Los pacientes con DM2 presentan diversos factores de riesgo para caídas y fracturas: edad avanzada, menor actividad física, neuropatía periférica y autonómica, disminución de la visión, amputación de miembros inferiores, deficiencia de vitamina D y tratamiento con glitazonas37. Los fármacos antidiabéticos pueden influir en el riesgo de fracturas por diversos mecanismos incluyendo el riesgo de hipoglucemias y caídas.
Un estudio observacional retrospectivo reciente ha evaluado la asociación entre hipoglucemia y fracturas relacionadas con caídas en una cohorte de 361.210 pacientes con DM238. En este estudio, los pacientes con episodios de hipoglucemia presentaban un riesgo un 70% mayor de fracturas relacionadas con caídas que los pacientes sin hipoglucemias (OR=1,70; IC 95%: 1,58-1,53). Las fracturas de cadera y vertebrales fueron las más comunes. En otro estudio observacional de casos y controles de una cohorte de 1.945 pacientes con DM2 seguidos durante más de 4 años el tratamiento insulínico estaba significativamente asociado con fracturas en varones (OR=3,20; IC 95%: 1,32-7,74)39. El resto de la evidencia disponible procede de series de casos y descripciones de casos aislados en pacientes con DM1 y DM2, mayoritariamente asociados a convulsiones.
Hipoglucemia y ejercicio físicoRecomendaciones- -
Recomendamos la AMGC en todos los pacientes con DM1, antes, durante y después de la práctica de ejercicio físico (1⊕○○○).
- -
Recomendamos reducir el bolo de insulina rápida antes del ejercicio (cuando el ejercicio se realiza 90-120min tras este) y/o modificar la ingesta de CH para prevenir la hipoglucemia (1⊕⊕○○).
- -
Recomendamos ingerir CH antes de iniciar el ejercicio si la glucemia es menor de 100mg/dl y después del ejercicio según la glucemia (1⊕⊕○○).
- -
Sugerimos reducir la insulina después del ejercicio y/o tomar CH después del ejercicio (2⊕⊕○○) para evitar la hipoglucemia posterior a la actividad física.
- -
En pacientes con DM2 en tratamiento con SU o repaglinida y/o insulina recomendamos comprobar la glucemia antes del ejercicio físico (1⊕○○○) y ajustar el tratamiento farmacológico para prevenir la hipoglucemia asociada al ejercicio (1⊕⊕○○).
En los pacientes con DM1 debe determinarse la glucemia capilar antes, durante, poco después y varias horas tras la finalización del ejercicio40. Si la duración del ejercicio es superior a 30min y se realiza 2-3h tras la inyección de análogos rápidos o 4-6h tras insulina regular, se debe considerar la reducción entre el 50 y el 90% de la dosis de insulina dependiendo de la intensidad y duración del ejercicio planeado41,42. Además se debería ingerir una cantidad extra de CH (10-20g) si la glucemia antes del ejercicio es menor de 100mg/dl43,44. La ingesta de glucosa (bebidas o alimentos fortificados) a un ritmo de 1g/kg/h mejora el rendimiento y reduce el riesgo de hipoglucemia45.
El efecto hipoglucemiante es mayor en los 60-90min posteriores a la actividad física46, aunque persiste 6-15h tras su finalización47. Además se reduce la respuesta contrarreguladora lo que puede afectar a la percepción de la hipoglucemia48. Realizar un sprint de 10s a máxima intensidad, antes o después del ejercicio49, reduce el riesgo de hipoglucemia inmediatamente después del ejercicio al inducir una respuesta de catecolaminas. La ingesta de 5mg/kg de cafeína previamente al ejercicio reduce la hipoglucemia durante y después del ejercicio50. También se recomienda reducir la dosis de insulina basal después del ejercicio según la intensidad y duración de este. Tras la actividad es recomendable comprobar la glucemia y tomar un suplemento de unos 15-20g de CH si la glucemia es inferior a 120mg/dl. El momento de la ingesta de CH después del ejercicio afecta la síntesis de glucógeno a corto plazo: dentro de los 30min después del ejercicio (1,0-1,5g CH/kg a intervalos de 2h hasta 6h) da lugar a mayores niveles de glucógeno que cuando la ingesta se retrasa 2h51.
En pacientes con DM2 tratados con insulina y/o SU o repaglinida existe también un aumento del riesgo durante y tras el ejercicio, especialmente si la glucemia previa es inferior a 100mg/dl44. Para prevenir la hipoglucemia se recomienda reducir la medicación oral52 o la dosis de insulina antes y posiblemente después del ejercicio52,53. En ejercicios de larga duración (más de 60-90min) o no planificados se recomienda la ingesta de suplementos de CH según su duración e intensidad43; una vez acabada la actividad se recomienda comprobar la glucemia e ingerir 15-20g de CH si es inferior a 120mg/dl.
Manejo nutricional de la hipoglucemiaRecomendaciones- -
Recomendamos determinar el contenido de CH, ya sea mediante recuento, intercambio o por estimación basada en la experiencia, como estrategia esencial para conseguir un buen control glucémico y prevenir la hipoglucemia en pacientes en tratamiento con insulina (1⊕⊕⊕○).
- -
Recomendamos una dieta con bajo índice glucémico para disminuir los episodios de hipoglucemia, tanto en niños como en adultos (1⊕⊕○○).
- -
Durante un proceso intercurrente agudo, además de hidratación suficiente y AMGC, recomendamos la ingesta adecuada de CH para evitar la hipoglucemia (1⊕⊕⊕○).
Aunque la composición óptima de macronutrientes de la dieta para los pacientes con DM es controvertida54, se acepta universalmente que la gestión del contenido de CH es fundamental para un correcto control glucémico55. La American Diabetes Association recomienda el recuento de CH como el mejor medio de control de la glucemia, fomentando al mismo tiempo el consumo de granos enteros y fibra56,57.
Además del contenido de CH, es importante el índice glucémico (IG) y la carga glucémica. Diversos estudios clínicos sugieren que las dietas de bajo IG son particularmente eficaces en caso de insulinorresistencia, sobrepeso u obesidad y tratamiento insulínico58. Un metaanálisis de Cochrane ha demostrado que una dieta con CH de bajo IG mejora el control glucémico, reduce el riesgo cardiovascular y disminuye el riesgo de hipoglucemia59.
El recuento, tipo y distribución de CH es particularmente importante en pacientes en tratamiento con insulina rápida60,61. En caso de insulinización intensiva es esencial la educación por profesionales expertos para mantener la seguridad en las estimaciones62. El tratamiento con insulina premezclada precisa de la administración de alimentos con contenido estimado en CH de forma regular según las necesidades, mientras que en la terapia bolo-basal o con ISCI la estimación del contenido de CH de las ingestas permite adaptar la dosis de insulina rápida necesaria.
Las cantidades moderadas de alcohol ingeridas con la comida no aumentan significativamente el riesgo de hipoglucemia, pero sí la ingesta elevadade alcohol o la ingesta aislada sin CH63.
Intervenciones farmacológicas en diabetes mellitus: terapia oralRecomendaciones- -
Recomendamos el uso de metformina como primera opción en la DM2 por el bajo riesgo de hipoglucemia y por sus efectos beneficiosos sobre parámetros metabólicos y posiblemente sobre la morbimortalidad cardiovascular (1⊕⊕⊕⊕). En caso de contraindicación o intolerancia a metformina, recomendamos monoterapia con un fármaco oral con bajo riesgo de hipoglucemia, especialmente en pacientes con algún factor de riesgo de hipoglucemias graves (1⊕⊕⊕○).
- -
Recomendamos antes de iniciar tratamiento con SU o repaglinida evaluar los factores de riesgo para hipoglucemias y las posibles interacciones con fármacos que pueden potenciar su acción hipoglucemiante (1⊕⊕⊕⊕).
- -
Recomendamos evitar SU de acción prolongada, como la clorpropramida o la glibenclamida, por su mayor riesgo de hipoglucemias (1⊕⊕⊕⊕).
- -
Recomendamos una reevaluación inmediata del régimen terapéutico en pacientes con hipoglucemias graves o inadvertidas que estén en tratamiento con SU o repaglinida, y considerar el uso de otro fármaco sin riesgo de hipoglucemias (1⊕⊕⊕○).
- -
Sugerimos en pacientes con DM2 con terapia dual, HbA1c cercana al objetivo terapéutico y riesgo elevado de hipoglucemia utilizar una triple combinación de fármacos que no induzcan hipoglucemias (2⊕⊕○○).
Una reciente revisión de la Agency for Healthcare Research and Quality64 muestra un riesgo de hipoglucemia leve o moderada 3-7 veces superior para SU o glinidas (sin diferencias entre ambas) frente a metformina, glitazonas o inhibidores de DPP4 (IDPP4), sin diferencias entre ellos. La incidencia de hipoglucemia grave no fue diferente entre las distintas monoterapias. La revisión concluye recomendando la metformina como fármaco de primera elección en monoterapia por sus efectos sobre la HbA1c, el peso y los lípidos, con bajo riesgo de hipoglucemias y bajo coste. Dos grupos farmacológicos no incluidos en esta revisión, inhibidores de alfa-glucosidasas e inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2), muestran en monoterapia una incidencia de hipoglucemias similar a placebo. Los inhibidores de la alfa-glucosidasa han mostrado similar incidencia de hipoglucemias que metformina o IDPP4 pero menor que SU65–68.
La prevalencia de hipoglucemia leve en pacientes que toman SU es del 16-20%69. Recomendamos evaluar los factores de riesgo para hipoglucemias (tabla 1) y las posibles interacciones con fármacos que pueden potenciar su acción hipoglucemiante (tabla 2) antes de iniciar tratamiento con SU o glinidas8,70, eligiendo otro grupo terapéutico si el paciente presenta riesgo de hipoglucemia. Debe evitarse el uso de SU con mayor duración de acción (clorpropramida, glibenclamida) por su mayor frecuencia de hipoglucemias en comparación con las SU de acción más corta (glipizida, gliclazida, glimepirida) o las glinidas71–73.
Factores de riesgo para hipoglucemias en la diabetes mellitus tipo 2
| Factores de riesgo convencionales (exceso absoluto o relativo de insulina) |
| Dosis excesiva, inadecuada o errónea de insulina o secretatogo |
| Empleo de sulfonilureas de acción prolongada (glibenclamida, clorpropramida) |
| Disminución de aporte exógeno de glucosa (ayuno nocturno, omisión de comidas, malnutrición) |
| Utilización aumentada de glucosa (ejercicio) |
| Disminución de producción endógena de glucosa (ingesta de alcohol, insuficiencia hepática) |
| Aumento de la sensibilidad a la insulina (tras pérdida de peso, incremento de ejercicio físico regular, mejoría del control glucémico o durante la noche) |
| Disminución del aclaramiento de insulina (insuficiencia renal) |
| Factores de riesgo para insuficiencia autonómica asociada a hipoglucemia |
| Deficiencia absoluta de insulina endógena |
| Historia de hipoglucemias graves, inadvertidas o recientes |
| Control glucémico agresivo |
| Factores de riesgo para sufrir consecuencias graves tras una hipoglucemia |
| Profesiones de riesgo (conductores, trabajos en altura, cuerpos de seguridad…) |
| Cardiopatía: enfermedad coronaria, arritmias |
| Ancianos |
| Pacientes con frecuentes ingresos hospitalarios |
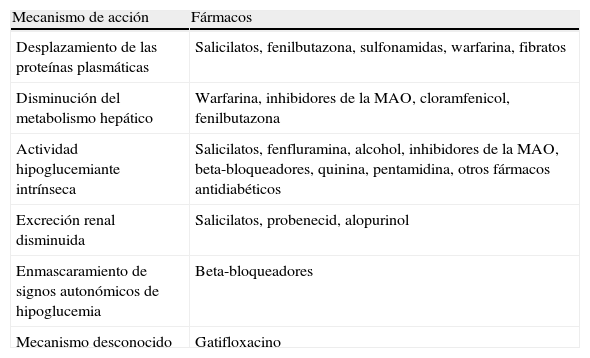
Interacciones con fármacos que pueden potenciar su acción hipoglucemiante
| Mecanismo de acción | Fármacos |
| Desplazamiento de las proteínas plasmáticas | Salicilatos, fenilbutazona, sulfonamidas, warfarina, fibratos |
| Disminución del metabolismo hepático | Warfarina, inhibidores de la MAO, cloramfenicol, fenilbutazona |
| Actividad hipoglucemiante intrínseca | Salicilatos, fenfluramina, alcohol, inhibidores de la MAO, beta-bloqueadores, quinina, pentamidina, otros fármacos antidiabéticos |
| Excreción renal disminuida | Salicilatos, probenecid, alopurinol |
| Enmascaramiento de signos autonómicos de hipoglucemia | Beta-bloqueadores |
| Mecanismo desconocido | Gatifloxacino |
MAO: monoaminoxidasa.
Como segunda opción, la revisión de la Agency for Healthcare Research and Quality mostró un mayor riesgo de hipoglucemias leves o moderadas para pacientes con terapias en combinación comparado con monoterapia64. El riesgo relativo (RR) de hipoglucemia fue 5,8 para la combinación SU-metformina frente a glitazona-metformina, y 1,8 para metformina-glinida frente a metformina-glitazona, sin diferencias significativas en la combinación metformina-glitazona frente a metformina-IDPP4.
En 2 metaanálisis, SU y glinidas se asociaron a un riesgo aumentado de hipoglucemia de 4,6-8,9 y 7,5-10,5 veces respectivamente en comparación con placebo. No se observó incremento de riesgo con glitazonas, inhibidores de alfa-glucosidasa o IDPP4 en comparación con placebo74,75. La incidencia de hipoglucemia para los inhibidores de SGLT2 en doble o triple terapia es similar a placebo, y menor que glipizida en el caso de dapagliflozina (3,4 vs. 39,7%)76.
Algunos consensos contemplan la posibilidad de añadir un tercer fármaco no insulínico y de mecanismo de acción complementario a la terapia dual, cuando el paciente presenta mal control metabólico y la HbA1c no está muy elevada (menor del 8,5%)77. Si el riesgo de hipoglucemia es alto, deben seleccionarse fármacos con bajo riesgo de hipoglucemia.
Intervenciones farmacológicas en diabetes mellitus: terapias subcutáneasRecomendaciones- -
Recomendamos el uso de análogos de insulina basal para disminuir el riesgo de hipoglucemia, especialmente la hipoglucemia nocturna (1⊕⊕⊕○).
- -
Recomendamos el uso de análogos de insulina rápida para disminuir el riesgo de hipoglucemia posprandial (1⊕⊕○○).
- -
En pacientes en tratamiento con ISCI recomendamos el uso de análogos de insulina rápida (aspart o lispro) para disminuir el riesgo de hipoglucemia (1⊕⊕○○).
- -
En pacientes con DM2 y obesidad recomendamos el uso de agonistas de glucagón-like peptide (GLP-1), en segunda o tercera línea, por su bajo riesgo de hipoglucemia, potencia antidiabética y sus efectos adicionales de reducción ponderal (1⊕⊕⊕○).
El uso de análogos de insulina ha demostrado reducir el riesgo de hipoglucemia comparado con las insulinas humanas. Considerando los análogos de insulina basal, en DM1 tanto glargina78 como detemir79 han demostrado reducir la incidencia de hipoglucemia total y especialmente la hipoglucemia nocturna. En pacientes con DM2 los análogos basales se asocian a un menor riesgo de hipoglucemia, especialmente nocturna (50% de reducción), en comparación con insulina NPH80,81. En un metaanálisis del National Institute for Health and Clinical Excellence, las tasas de hipoglucemia fueron significativamente menores en los pacientes tratados con insulina glargina (RR: 0,89; IC 95%: 0,83-0,96) o insulina detemir (RR: 0,68; IC 95%: 0,54-0,86) comparado con NPH82.
Los análogos de insulina rápida también han mostrado reducir la frecuencia de hipoglucemias respecto a la insulina regular83–86. Por último, en pacientes portadores de ISCI, tanto aspart como lispro reducen la tasa de hipoglucemias e inducen un mejor control de la glucemia posprandial87–90.
Degludec es un nuevo análogo de insulina basal con una mayor duración de acción que consigue un control glucémico comparable a glargina aunque con un efecto superior sobre la glucemia basal. En un reciente metaanálisis91 la incidencia de hipoglucemia fue menor en pacientes tratados con degludec comparado con glargina (DM2, RR hipoglucemia total: 0,83 e IC 95%: 0,74-0,94; RR hipoglucemia nocturna: 0,68 e IC 95%: 0,57-0,82; DM1, RR hipoglucemia nocturna: 0,75 e IC 95%: 0,60-0,94).
Los agonistas del receptor de GLP-1 son un grupo terapéutico que en la DM2 aportan un potente efecto normoglucemiante junto con un bajo riesgo de hipoglucemia y efectos positivos sobre el peso92. Los episodios de hipoglucemia se presentan fundamentalmente en asociación con SU o insulina92. En el programa de ensayos clínicos Liraglutide Effect and Action in Diabetes (LEAD), la incidencia global de hipoglucemia asociada a liraglutida osciló entre 0,03 y 1,9 eventos/paciente/año, sin diferencias respecto a placebo para la dosis de 1,2mg93. El tratamiento con liraglutida 1,8mg también conlleva un riesgo de hipoglucemia escaso, aunque ligeramente superior a placebo, en los estudios en combinación con SU: 0,47 vs. 0,17 eventos/paciente/año en el estudio LEAD-1-SU94; 0,6 vs. 0,2 eventos/paciente/año en LEAD-495; 0,06 y 1,2 (hipoglucemia mayor y menor respectivamente) vs. 0 y 1,0 eventos/pacientes/año en LEAD-596.
El tratamiento con exenatida también asocia un bajo riesgo de hipoglucemia. En los estudios Diabetes Therapy Utilization: Researching Changes in A1C, Weight and Other Factors Through Intervention with Exenatide Once Weekly [DURATION] 1-5), el 13% de los pacientes tratados con exenatida semanal y el 16% de los tratados con exenatida 2 veces/día presentaron algún episodio de hipoglucemia menor, aunque la incidencia en pacientes no tratados con SU fue del 1% y menor del 1% respectivamente97. En los ensayos clínicos de comparación directa, la incidencia de hipoglucemia menor fue inferior en el grupo de liraglutida respecto a exenatida (liraglutida: 1,93 vs. exenatida: 2,60 eventos/paciente/año; RR: 0,55; IC 95%: 0,34-0,88; p=0,0131) y fue similar frente a exenatida semanal (liraglutida: 10,8% vs. exenatida semanal: 8,9%; p=0,374), a pesar de un efecto significativamente superior de liraglutida sobre el control glucémico93,97,98. En pacientes insuficientemente controlados con insulina basal con o sin SU, la incidencia de hipoglucemia sintomática fue más frecuente con un nuevo análogo, lixisenatida (42,9%), comparado con placebo (23,6%), aunque fue similar en ambos grupos (32,6 vs. 28,3%) cuando se excluían los pacientes tratados con SU, y no se presentaron casos de hipoglucemia grave99.
Otras situaciones con influencia sobre la hipoglucemiaRecomendaciones- -
Recomendamos mayor atención a los sujetos diabéticos con menor índice de masa corporal (IMC) y mayor duración de la enfermedad por el mayor riesgo de hipoglucemia grave (1⊕⊕⊕○).
- -
Recomendamos intensificar los cuidados para prevenir la hipoglucemia en pacientes con insuficiencia renal, neuropatía autonómica (1⊕⊕⊕⊕) o presencia de úlceras periféricas (1⊕⊕○○).
El IMC se asocia inversamente al riesgo de hipoglucemia grave. Un IMC mayor de 30kg/m2 se asoció con una incidencia 35% menor de hipoglucemia grave que un IMC menor de 25kg/m2 (HR: 0,65; IC 95%: 0,5-0,85)100. En el estudio ADVANCE4 por cada unidad de aumento del IMC se produjo un descenso del 5% en el riesgo de hipoglucemia grave (HR: 0,95; IC 95%: 0,93-0,98). La duración de la DM también constituye un factor de riesgo para hipoglucemia grave en DM2101 y DM1102, con un incremento del riesgo del 2% por cada año de DM a partir de una evolución de unos 10-15 años4.
La insuficiencia renal100 y la neuropatía periférica103 asocian también un mayor riesgo de hipoglucemia grave, mientras que la presencia de úlceras periféricas se asocia positivamente con el riesgo de hospitalización por hipoglucemia (OR: 1,71; IC 95%: 1,2-2,44)104.
Hipoglucemia en situaciones especialesGestaciónRecomendaciones- -
Recomendamos un control glucémico estricto antes de la gestación y en el primer trimestre, evitando tanto las fluctuaciones de glucemia como las hipoglucemias (1⊕⊕○○).
- -
Recomendamos realizar educación diabetológica a la paciente y a quienes convivan con ella para prevenir y tratar las hipoglucemias eficazmente, aconsejando AMGC antes y una hora después de las comidas, al acostarse y entre las 2 y 4 AM si existe sospecha de hipoglucemia nocturna (1⊕⊕○○).
- -
Recomendamos el uso de detemir como insulina basal, asociada a análogos rápidos (aspart y lispro) (1⊕⊕○○).
Durante la gestación los objetivos de control glucémico son más rigurosos2 lo que aumenta el riesgo de hipoglucemias105, sobre todo inadvertidas y graves, en el primer trimestre del embarazo. La alteración de la respuesta contrarreguladora ante la hipoglucemia y la presencia de náuseas o vómitos contribuyen a esta situación.
Constituyen factores de riesgo para hipoglucemia grave: antecedentes de hipoglucemia grave en el año previo, hipoglucemias inadvertidas, mayor duración de la DM, HbA1c baja pregestacional, glucemias fluctuantes y uso excesivo de inyecciones suplementarias de insulina. La distribución no es homogénea, de forma que el 10% de las pacientes sufren el 60% de los eventos106.
Los análogos rápidos lispro y aspart son seguros en el embarazo107, e inducen menor frecuencia de hipoglucemias y fluctuaciones glucémicas en algunos estudios, aunque no en todos86. En el embarazo no existe un beneficio claro del uso de ISCI respecto al riesgo de hipoglucemia108. En cuanto a los análogos basales, glargina parece segura109 pero todavía no hay suficientes estudios que avalen su uso en la gestante, mientras que detemir sí tiene autorizado su uso110 al igual que NPH (categoría B para ambas).
AncianoRecomendaciones- -
Recomendamos objetivos de control individualizados en el anciano, considerando de forma prioritaria el riesgo de hipoglucemia (1⊕⊕⊕○).
- -
Recomendamos realizar educación diabetológica adaptada al paciente y a quienes convivan con él, necesaria para prevenir y tratar las hipoglucemias eficazmente (1⊕⊕○○).
- -
Sugerimos la AMGC, especialmente ante cualquier alteración de la situación neurológica (2⊕○○○).
Las hipoglucemias son frecuentes en el anciano con DM, más vulnerable a las mismas por su peor situación física, nutricional, cognitiva, de respuesta contrarreguladora y de capacidad de reacción111. Las comorbilidades y polifarmacia aumentan aún más el riesgo de hipoglucemias graves e inadvertidas112. En ellos predomina la clínica neuroglucopénica, y hay riesgo de daño neurológico113,114 y físico (caídas, arritmias, etc.)115.
La hipoglucemia grave tiene gran impacto sobre la adherencia al tratamiento, la calidad de vida116 e incluso la mortalidad del anciano101,117, ocasionando ingresos hospitalarios frecuentes118 generalmente ligados al tratamiento con SU o insulina. El tratamiento intensivo para obtener un control glucémico estricto se asocia a un mayor riesgo de hipoglucemia grave, lo que obliga a una individualización del tratamiento, considerando como factores de riesgo la edad101, la disminución de la función renal, el enlentecimiento en la regulación y contrarregulación hormonal, el estado de hidratación, el apetito variable, la ingesta nutricional y la polifarmacia119.
Tratamiento de la hipoglucemiaRecomendaciones- -
Recomendamos en pacientes conscientes el tratamiento del episodio de hipoglucemia preferentemente con 15g de glucosa, o con cualquier CH que contenga esta cantidad. Este tratamiento debe repetirse a los 15min si al realizar una glucemia capilar persiste la hipoglucemia. Cuando la glucemia ha vuelto a valores normales, recomendamos consumir un suplemento de CH de absorción lenta para prevenir una nueva hipoglucemia (1⊕⊕○○).
- -
Recomendamos en pacientes inconscientes la administración de glucagón por inyección subcutánea (1⊕⊕○○).
- -
Recomendamos en pacientes tratados con insulina, SU o repaglinida evaluar periódicamente los conocimientos acerca de la detección y el tratamiento de la hipoglucemia, así como recordar la necesidad de llevar siempre consigo CH suficientes para el tratamiento de una hipoglucemia y disponer de glucagón (1⊕○○○).
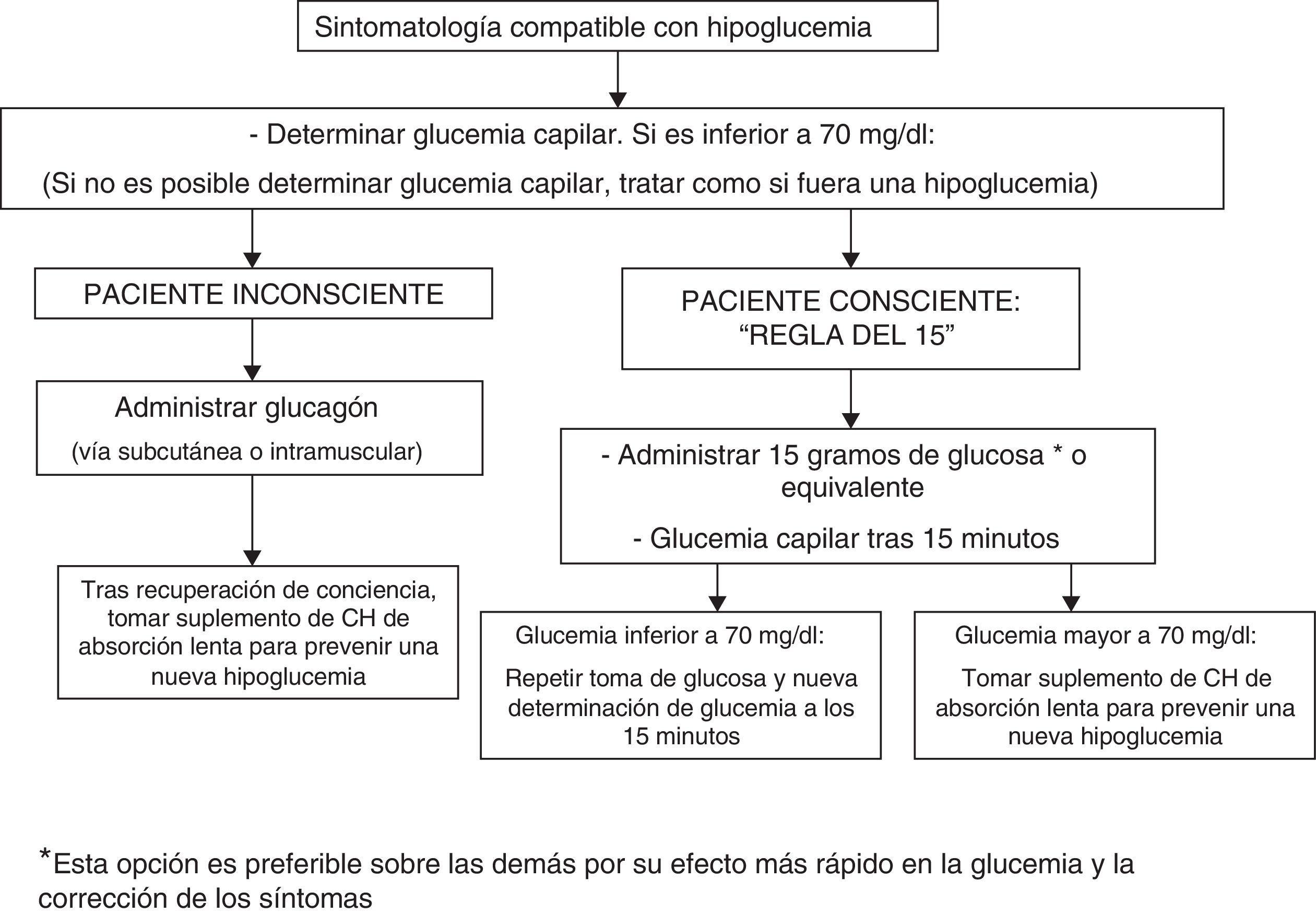
Para el tratamiento de la hipoglucemia (glucemia capilar menor de 70mg/dl) se recomienda la administración de 15g de glucosa (fig. 1) o equivalente2,120 (tabla 3). En un estudio aleatorizado con 41 pacientes con DM1 que comparó el efecto de 7 métodos de tratamiento (glucosa en solución, pastillas o gel, sacarosa en solución o pastillas, solución de polisacárido hidrolizado y zumo de naranja)121, el aumento de las cifras de glucemia fue similar para todos los compuestos, salvo para el gel y el zumo de naranja, que no mostraron efecto a los 10min y causaron una menor elevación de la glucemia a los 20min121. Por lo tanto, es preferible el tratamiento con glucosa oral por su efecto más rápido sobre la glucemia y la mejora de los síntomas121 en comparación con otras opciones (leche o zumo de naranja) con efecto más lento122, aunque en caso de no disponer de glucosa la ingesta de cualquier CH es válida.
No se recomienda el tratamiento de la hipoglucemia con alimentos ricos en grasas (dulces, chocolate), ya que retrasan la absorción de CH y puede traducirse en una mayor excursión hiperglucémica posterior. Tampoco se recomienda la ingesta de preparados que asocian cafeína y/o fructosa a la glucosa por la ausencia de evidencia acerca de sus efectos. Si el paciente presenta síntomas compatibles con hipoglucemia pero no dispone de glucómetro para su confirmación, se recomienda tratar la situación como si fuera una hipoglucemia120.
Los episodios de hipoglucemia grave pueden requerir la administración de glucagón por inyección subcutánea o intramuscular y debe comprobarse periódicamente que el paciente dispone de este fármaco. El efecto del glucagón está alterado en pacientes con enfermedad hepática avanzada y en aquellos que han consumido alcohol (más de 2 medidas) en las horas previas120. No se han observado diferencias en función de la vía de administración del glucagón (subcutánea frente a intramuscular)123. En caso de hipoglucemia grave en un contexto sanitario y si se dispone de acceso venoso es preferible la administración de glucosa al 50% (50ml intravenosa) que la de glucagón (intravenosa o intramuscular), por su efecto más rápido en la resolución de la glucemia124,125.
Asimismo, es importante que todos los pacientes que reciban tratamiento con insulina y/o SU o repaglinida sean adiestrados no solo en el reconocimiento de los síntomas de hipoglucemia sino también en las medidas para su correcto tratamiento. El conocimiento de estas medidas debe reevaluarse periódicamente durante el seguimiento de los pacientes, así como recordar al paciente la necesidad de llevar consigo CH suficientes para el tratamiento de un episodio de hipoglucemia.
Hipoglucemia inadvertidaRecomendaciones- -
Recomendamos considerar los factores de riesgo convencionales y aquellos que indican alteración de la contrarregulación en pacientes con hipoglucemias de repetición (1⊕⊕⊕⊕).
- -
Recomendamos en pacientes con hipoglucemia asintomática evitar la hipoglucemia durante al menos 2 a 3 semanas para mejorar la percepción de la hipoglucemia (1⊕⊕○○).
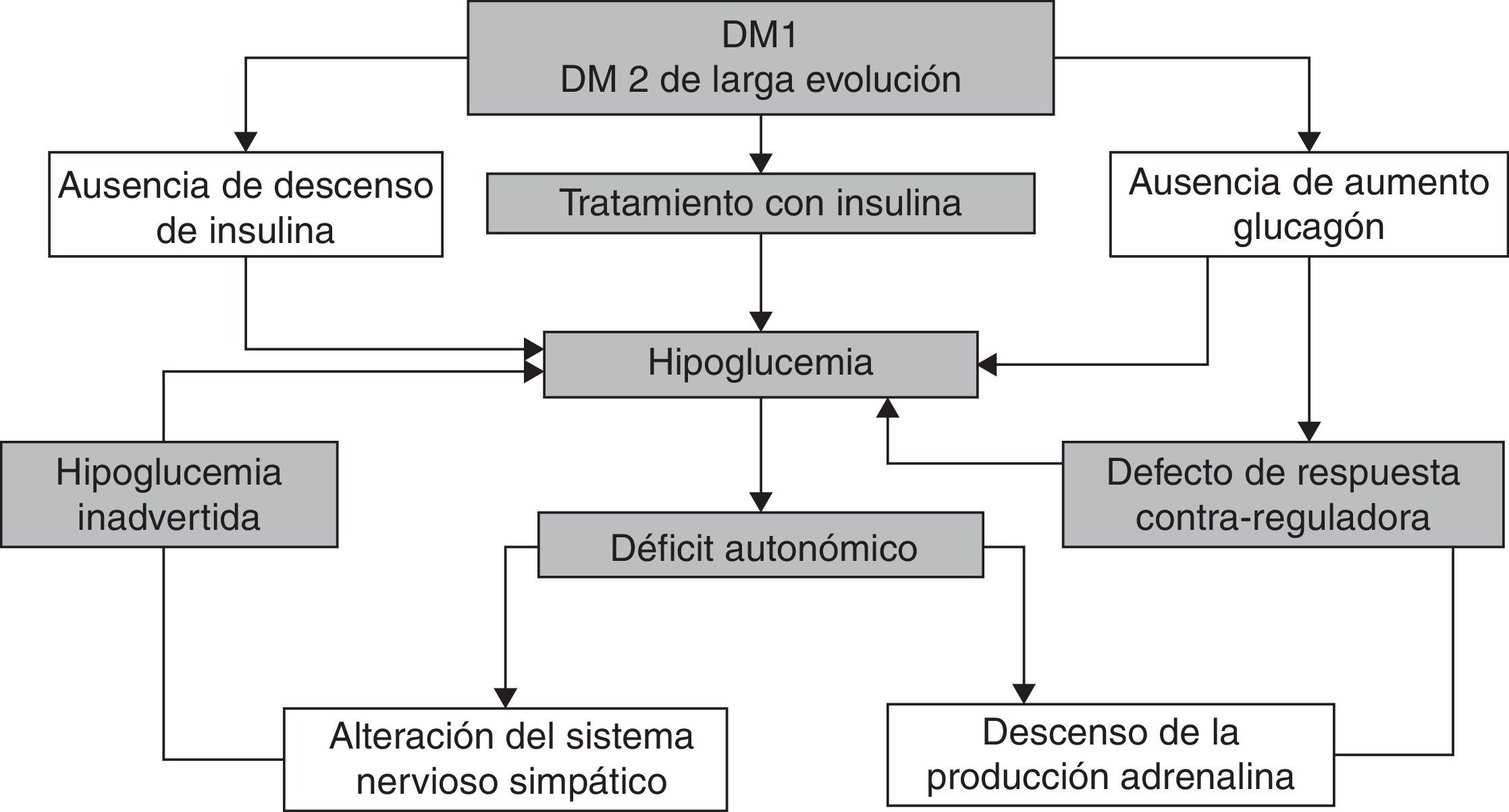
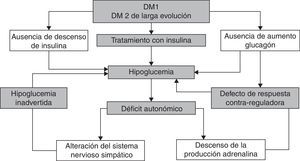
Los episodios recurrentes de hipoglucemia disminuyen la respuesta contrarreguladora simpaticoadrenal y de glucagón en un círculo vicioso que hace que los pacientes sean más vulnerables a episodios de hipoglucemia inadvertida1 (fig. 2).
Existen diferentes estrategias para la prevención y manejo de la hipoglucemia inadvertida (tabla 4)126–129. La medida fundamental es evitar las hipoglucemias para revertir la pérdida de respuesta contrarreguladora, lo que puede mejorar la percepción de la hipoglucemia tras unos 3 días y restituir la respuesta a esta en unas 3 semanas.
Estrategias para la prevención y manejo de la hipoglucemia inadvertida
| Opciones | Mecanismo | Observaciones |
| Ajuste de objetivos glucémicos | Evitar la hipoglucemia | Dos a 3 semanas es suficiente para mejorar la percepción de la hipoglucemia |
| Optimización del tratamiento de insulina | Evitar la hipoglucemia | El efecto sobre la contrarregulación depende de la eficacia de evitar la hipoglucemia |
| Terapia farmacológica | ||
| Alanina126 | Estimular la respuesta del glucagón | Ausencia de datos de ensayos clínicos |
| B2-adrenérgicos126 | Aumentar el efecto de la adrenalina | Ausencia de datos de ensayos clínicos |
| Derivados de las metilxantinas127 | Estimulo del sistema nervioso central | Su tolerancia puede limitar el efecto de uso a largo plazo |
| Fructosa128 | Modulación del sentido de la hipoglucemia | Ausencia de datos de ensayos clínicos |
| Educación diabetológica129 | Mejorar la detección exacta de la hipoglucemia | Se necesita un programa intensivo y no todos los estudios confirman su eficacia |
En pacientes con DM1 e hipoglucemia inadvertida la ISCI reduce a la mitad los episodios de hipoglucemia y especialmente las hipoglucemias graves (de 1,25 a 0,05 eventos/año)130. En caso de hipoglucemias recurrentes graves, el trasplante de páncreas e islotes de células pancreáticas debe ser considerado como una opción terapéutica10.
Objetivo de control metabólico en pacientes con hipoglucemiaRecomendaciones- -
Recomendamos fijar objetivos de control glucémico menos agresivos en personas con DM que han sufrido hipoglucemias (especialmente graves) o cuando se considere que su riesgo de hipoglucemia es mayor (1⊕⊕⊕⊕).
- -
Sugerimos en estos casos un objetivo de HbA1c entre 7 y 8%, o superior si existe muy alto riesgo (2⊕⊕○○).
- -
Recomendamos flexibilizar los objetivos de control glucémico en pacientes de alto riesgo cardiovascular (1⊕⊕⊕○).
- -
Recomendamos establecer objetivos de control más ambiciosos en DM2 si el tratamiento antidiabético incluye fármacos con bajo riesgo de hipoglucemia (1⊕⊕⊕○).
- -
Sugerimos reducir la variabilidad glucémica para disminuir el riesgo de hipoglucemia y alcanzar objetivos de HbA1c más estrictos (2⊕⊕○○).
El tratamiento intensivo de la DM se asocia con un mayor riesgo de hipoglucemias. En DM2, 2 metaanálisis recientes muestran un mayor riesgo de hipoglucemia grave en el grupo de tratamiento intensivo (HR: 2,48; IC 95%: 1,91-3,21)131 y (OR: 3,01; IC: 1,47-4,60)132. Algunas características de los pacientes se asocian a mayor riesgo de hipoglucemia y deben considerarse para fijar un objetivo de control glucémico menos estricto (tabla 1).
Entre los pacientes tratados con insulina, el riesgo de hipoglucemia es mayor en aquellos con menor glucemia media y mayor variabilidad glucémica (medida como desviación estándar en AMGC)133, por lo que se concluye que el riesgo de hipoglucemia asociado a la intensificación del tratamiento en DM2 podría minimizarse abordando la reducción de la variabilidad glucémica. En este sentido, se ha propuesto que la variabilidad glucémica podría influir en el riesgo de hipoglucemia de forma independiente del tipo de tratamiento empleado (insulinosensibilizadores, fármacos secretagogos orales o insulina) y del control glucémico global134.
Aunque se recomiendan objetivos de control glucémico menos estrictos en pacientes en riesgo de hipoglucemia grave135 no se especifican cifras concretas de HbA1c y, especialmente, de glucemia basal y posprandial, por lo que el criterio clínico resulta insustituible.
Utilidad de la automonitorización de glucemia capilarRecomendaciones- -
Recomendamos la AMGC cuando se sospeche la presencia de hipoglucemia, después del tratamiento de esta hasta que se restablezca la normoglucemia y antes de realizar actividades que puedan incrementar su riesgo (ejercicio) o sean potencialmente peligrosas (conducir, cuidado de niños, trabajos de riesgo) (1⊕⊕⊕⊕).
- -
Recomendamos comprobar periódicamente la técnica de AMGC, los resultados y la capacidad para tomar decisiones adecuadas en función de estos (1⊕○○○).
- -
Recomendamos la monitorización continua de la glucosa (MCG) en pacientes con hipoglucemia inadvertida o con hipoglucemias frecuentes (1⊕○○○).
- -
Sugerimos utilizar la MCG en la DM1, ya que reduce el tiempo en hipoglucemia comparado con la AMGC aunque no el número de hipoglucemias graves o totales (1⊕⊕⊕○).
La importancia de la AMGC, como parte integral en el tratamiento intensivo de la DM1 y en la DM2 tratada con SU o repaglinida y/o insulina es clara, ya que minimiza el riesgo de hipoglucemia y ayuda a su identificación. La frecuencia recomendada de AMGC se resume en la tabla 52,136.
Recomendaciones de automonitorización de la glucemia capilar
| Modalidad de tratamiento | Frecuencia de AMGC |
| Bolo-basal o ISCI | 3-4 determinaciones/día |
| Insulina no intensiva | 2-3 determinaciones/día |
| Insulina basal | 1-2 determinaciones/día |
| - La frecuencia de las determinaciones debe aumentar durante el ajuste de fármacos –insulina, sulfonilureas o repaglinida− y en pacientes con hipoglucemias frecuentes y/o inadvertidas- La AMGC se recomienda también en situación de ayuno, y antes de actividades peligrosas como conducir, o que exigen una función cognitiva intacta como quedar al cuidado de niños | |
En niños y adolescentes con DM1, una mayor frecuencia de AMGC se asoció a mejor HbA1c (hasta un 20% por determinación adicional entre 2 y 5 al día) y a menores complicaciones agudas, incluida la hipoglucemia137. El beneficio sobre la calidad de vida o en el control metabólico en pacientes con DM2 no tratados con insulina es discutido y los datos sobre su eficacia en la prevención de hipoglucemias son discordantes138,139.
La precisión de la AMGC es muy dependiente del usuario y del instrumento140, por lo que debe revisarse periódicamente su técnica, la necesidad de realización de AMGC, su frecuencia y momento de realización, así como los conocimientos del paciente sobre las medidas a tomar en función del valor de la AMGC140.
El efecto de la MCG sobre las hipoglucemias graves no está totalmente establecido141,142. Podría ser útil en sujetos con hipoglucemias muy frecuentes y/o inadvertidas, especialmente en pacientes con buen control. En pacientes con DM1 con HbA1c menor del 7,5% la MCG redujo el tiempo en hipoglucemia (0,48 vs. 0,97h/día; p=0,03), aunque no el número de hipoglucemias, mejorando el control glucémico y sin hipoglucemias graves143. No obstante, no se ha demostrado un beneficio claro sobre el riesgo de hipoglucemia (grave y no grave) frente a la AMGC144–148 salvo una discreta reducción en el tiempo en hipoglucemia (23% o 15min/día)149,150.
Hipoglucemia y actividad laboralRecomendaciones- -
Sugerimos que el empleador facilite turnos estables al paciente con DM y permita la realización de autocontroles de glucemia capilar y la toma de CH durante la jornada laboral (2⊕○○○).
- -
Sugerimos la adecuación de la legislación vigente para la obtención de licencias para actividades de riesgo (conducción de vehículos, armas, seguridad aérea, cuerpos de seguridad del estado) a las nuevas realidades, como la utilización de medicamentos con menor riesgo de hipoglucemias (2⊕○○○).
La presencia de hipoglucemias es un factor limitante para el trabajador con DM, siendo un factor de exclusión en determinadas profesiones. Supone un aumento de absentismo laboral, reduce la productividad y la calidad de vida6. El estudio individualizado de cada caso por el médico, la selección de terapias con bajo riesgo de hipoglucemia y la educación del paciente en el manejo de esta, son fundamentales para mantener unos estándares de calidad y seguridad laboral151.
La aparición de nuevos fármacos con bajo riesgo de hipoglucemia ha permitido el acceso de pacientes con DM2 a actividades en que tradicionalmente la hipoglucemia constituía un problema: conducción de transportes públicos, aviones, trenes, supervisión de tráfico aéreo o motorizado; trabajos relacionados con armas (policía, ejército) o con riesgo de caída (electricista, trabajo en tejados). En algunos de ellos, la DM tratada con insulina aún sigue siendo excluida. En el resto, se limita en función de la frecuencia o gravedad de crisis de hipoglucemia152.
Según la legislación vigente de Seguridad Aérea Española152, padecer una DM1 implica la pérdida o no consecución de la licencia de vuelo. En la DM2 únicamente se permite el uso de metformina y alfa-glucosidasas; no existen recomendaciones actualizadas sobre terapias incretínicas y tiazolidinedionas.
En lo relativo al carné de conducir, para el grupo 1 (A1, A2, B1 y B2) no debe existir DM con inestabilidad metabólica grave o que requiera asistencia hospitalaria y, en el caso del grupo 2 (C1, C2, D y E), se excluye además la DM1153. En las renovaciones de licencia, es obligatorio un informe médico favorable, siendo el período de vigencia para la DM1 o DM2 con insulina menor que para el resto. La legislación para los Cuerpos y Fuerzas de Seguridad del Estado es excluyente con la DM sin considerar el tratamiento o el riesgo de hipoglucemia.
Se desaconsejan los turnos de trabajo variables «en diabéticos insulinodependientes, aunque pueden adaptarse, con educación y adecuando dieta e insulina a los requerimientos laborales». El turno de noche será factible si el paciente es capaz de adaptar sus necesidades de insulina. En el personal sanitario (médicos o enfermeras), «por sus conocimientos y acceso a los recursos sanitarios en caso de urgencia» se justifica menos la exclusión de estos turnos. Se recomienda asimismo, que se eviten las temperaturas extremas que puedan provocar deshidrataciones o precipitar hipoglucemias154.
FinanciaciónEste documento de consenso ha contado con financiación externa mediante una beca de la Fundación de la Sociedad Española de Endocrinología (FSEEN), a través de una subvención educativa ilimitada (unrestricted grant) de los laboratorios Novo Nordisk y FAES Farma. Los patrocinadores no han influido en ninguna etapa de la elaboración del documento ni han tenido acceso a su contenido.
Contribución en la elaboración del manuscrito −autor (tema)−Laboratorios: A: Almirall; AZ: Astra-Zeneca; B: Boehringer Ingelheim; BMS: Bristol-Myers Squibb; E: Esteve; F: Ferrer; FF: Faes Farma; GSK: Glaxo Smith Kline; I: Intarctia J: Janssen-Cilag; L: Lilly; MSD: MSD; N: Novartis; NN: Novo Nordisk; R: Roche; SA: Sanofi-Aventis; T: Takeda.
Ó Moreno (Definición y clasificación de hipoglucemia), ponente/consultor: NN, L, MSD, N, B. JF Merino (Hipoglucemia en la diabetes tipo 1), investigador clínico: NN, L, SA, MSD, AZ; ponente/consultor: NN, L, MSD, N, B, AZ, BMS, E, SA, FF. M Botella (Hipoglucemia en la diabetes tipo 2), investigador clínico: SA, L, MSD; ponente: NN, L, SA, MSD, R, GSK. M Gargallo (Hipoglucemia y enfermedad cardiovascular), ponente/consultor: AZ, BMS, B, NN, MSD, SA. M Muñoz (Hipoglucemia y riesgo de fractura en el paciente con diabetes mellitus), investigador clínico: NN, J, GSK; ponente/consultor: NN, GSK, FF. J Escalada (Hipoglucemia y ejercicio físico), ponente/consultor: AZ, B, BMS, L, NN, MSD, SA, A. D Bellido (Manejo nutricional de la hipoglucemia), investigador clínico: L, R. SA, MSD, NN; ponente/consultor: L, N, NN, AZ, E, SA. JJ Gorgojo (Intervenciones farmacológicas en diabetes mellitus: terapia oral), consultor/ponente/investigador: NN, L, SA, GSK, A, N, MSD, BMS, AZ, D, F. R Reyes (Intervenciones farmacológicas en diabetes mellitus: terapias subcutáneas), investigador clínico: NN, J; ponente/consultor: NN, SA, GSK, FF, A, N. A. Becerra (Otras situaciones con influencia sobre la hipoglucemia), investigador clínico: NN, L, GSK, N, R, SA; ponente/consultor: L, NN, GSK, N, R, SA, A, AZ, E, FF. M López de la Torre (Hipoglucemia en situaciones especiales), consultor/ponente/investigador: NN, L, SA, GSK, A, N, MSD, BMS, FF, AZ, D, F. P Mezquita (Tratamiento de la hipoglucemia), investigador clínico: L, R, SA, NN, MSD, B; ponente/consultor: L, A, N, NN, AZ, BMS, E, MSD, SA, FF. A Soto (Hipoglucemia inadvertida), investigador clínico L, R, SA, NN, T; ponente/consultor: L, A, T, N, NN, AZ, E, SA, FF. F Gómez Peralta (Objetivo de control metabólico en pacientes con hipoglucemia), investigador: L, SA, NN, B; ponente/consultor: L, N, NN, AZ, BMS, E, MSD, as. E Jódar (Utilidad de la automonitorización de glucemia capilar), investigador B, GSK, J, L, MSD, NN, I; ponente/consultor: FF, L, N, NN; N González (Hipoglucemia y actividad laboral), ponente NN, L, B, L, R, N, MSD, GSK, FF.
Conflicto de interesesNingún autor ha reportado conflicto de intereses relevante con la elaboración de este artículo. La versión final del artículo ha sido aprobada por todos los autores. Todos los autores han contribuido por igual en la elaboración del documento.