La prevención de la alta incidencia de enfermedad cardiovascular en la diabetes es uno de los retos de la endocrinología. La validación de nuevos biomarcadores que puedan contribuir a una mejor evaluación del riesgo cardiovascular y ayuden a implementar estrategias terapéuticas es una de las aproximaciones prometedoras en la investigación dirigida a la prevención y a la reducción del riesgo cardiovascular. La modificación de las lipoproteínas de baja densidad (LDL) es un elemento clave en el desarrollo de la lesión arteriosclerótica. Varias características fisiopatológicas de la diabetes contribuyen decisivamente a que la LDL de estos pacientes tenga unos índices de modificación más elevados que la de la población sana. La dislipidemia diabética, la hiperglicemia y el estrés oxidativo favorecen de manera sinérgica la aparición de procesos de lipoperoxidación, glicosilación y glicoxidación que van a generar lipoproteínas modificadas que estimulan el desarrollo de la arteriosclerosis. Este artículo revisa el papel de los diferentes tipos de LDL modificada en el desarrollo de la arteriosclerosis en la diabetes, así como en la posibilidad de utilizar su cuantificación en la predicción del riesgo cardiovascular.
Prevention of high incidence of cardiovascular disease in diabetes is one of the challenges of endocrinology. Validation of new biomarkers that may contribute to a better assessment of cardiovascular risk and help implement treatment strategies is one of the promising approaches in research on prevention and reduction of cardiovascular risk. Modification of low density lipoprotein (LDL) is a key element in development of atherosclerotic lesions. Several pathophysiological characteristics of diabetes are crucial for the LDL of these patients to have higher modification rates as compared to the healthy population. Diabetic dyslipidemia, hyperglycemia, and oxidative stress synergistically promote the occurrence of lipoperoxidation, glycosylation and glycoxidation processes, which will generate modified lipoproteins that stimulate development of atherosclerosis. This article reviews the role of different types of modified LDL in development of atherosclerosis in diabetes, as well as the possibility of using its quantification in cardiovascular risk prediction.
La enfermedad cardiovascular derivada de procesos arterioscleróticos es la primera causa de muerte en los pacientes con diabetes mellitus. Esta enfermedad presenta una serie de características que contribuyen al aumento del riesgo cardiovascular (RCV) a través de mecanismos independientes. De una manera general, pueden distinguirse 3 fenómenos que tienen un papel relevante en el desarrollo de la arteriosclerosis en los pacientes con diabetes: 1) la dislipemia diabética; 2) la glicosilación no enzimática de proteínas; y 3) el estrés oxidativo1,2. Estos procesos son, en principio, independientes, aunque, como se intenta explicar a lo largo de la presente revisión, son fenómenos estrechamente interconectados (fig. 1). La consecuencia de la elevada incidencia de estos procesos en la diabetes es que las lipoproteínas, principalmente las lipoproteínas de baja densidad (LDL), de estos pacientes son modificadas, perdiendo su funcionalidad y sus características nativas3. Estas LDL modificadas son determinantes en el desarrollo acelerado de la arteriosclerosis que sufren los individuos con diabetes. La implicación directa de la LDL modificada en la evolución de la lesión ateromatosa sugiere que su cuantificación en la circulación plasmática podría ser una herramienta muy útil tanto para la predicción del RCV como para la monitorización de tratamientos dirigidos a disminuir este riesgo4.
Interacciones entre dislipidemia diabética, hiperglicemia y estrés oxidativo. La dislipidemia diabética se caracteriza por hipertrigliceridemia (1) que tiene como consecuencia una disminución del colesterol de la HDL y un aumento de la concentración de apoB (2). La HDL de estos pacientes no solo está disminuida cuantitativamente, sino que es parcialmente disfuncional (3) y la concentración elevada de apoB es acompañada por la presencia de partículas de LDL pequeñas y densas (sdLDL). Por otra parte, la hiperglicemia favorece la glicosilación no enzimática de proteínas (5), un proceso que estimula la aparición de fenómenos lipoperoxidativos (6). La hiperglicemia también aumenta el estrés oxidativo celular (7), potenciando la lipoperoxidación (8). Al aumento de la glicosilación no enzimática y la lipoperoxidación también contribuyen de manera decisiva el hecho de que las partículas de LDL sean pequeñas y densas (9) (más oxidables y glicosilables) y que la HDL sea parcialmente disfuncional (10) (menor potencial antioxidante).
Un fenómeno frecuentemente asociado a la diabetes de tipo 2 es la presencia del síndrome metabólico (SM) definido por obesidad abdominal, insulinorresistencia, hipertensión y existencia de un perfil lipídico anormal5. Aunque los 4 factores están asociados al desarrollo precoz de la arteriosclerosis, es probablemente el perfil lipídico anómalo el que se relaciona más directamente con la aterogénesis. Este perfil lipídico, conocido como dislipidemia diabética o aterogénica, se caracteriza por hipertrigliceridemia, colesterol de lipoproteínas de alta densidad (HDL) disminuido, concentración aumentada de apolipoproteína B (apoB)6 y aumento de la lipidemia posprandial7,8.
La apoB es el principal componente proteico de las lipoproteínas aterogénicas, LDL y lipoproteínas de muy baja densidad (VLDL). Sin embargo, la concentración de colesterol de LDL suele ser normal. Dado que el 80-90% de la apoB está asociada a la LDL, esta observación puede resultar paradójica. Esta peculiaridad se explica por la abundancia de partículas de LDL de pequeño tamaño (small, dense LDL, sdLDL), con menor contenido relativo de colesterol y mayor de apoB, y que se generan debido a una metabolización defectuosa de la VLDL9. En consecuencia, aunque en muchas ocasiones la concentración plasmática de colesterol total en los pacientes con diabetes es normal, su perfil lipídico dista mucho de lo que se puede considerar como un perfil ateroprotector. Esto hace que, a pesar de que el tratamiento farmacológico de las dislipidemias es eficiente desde el punto de vista cuantitativo10, la incidencia de eventos cardiovasculares sigue siendo muy elevada en la población diabética.
En esta situación de dislipidemia diabética hay importantes alteraciones cualitativas en la HDL y la LDL. En primer lugar, hay que tener en cuenta el efecto sobre el papel antiaterogénico de la HDL que es determinante en el transporte reverso del colesterol y tiene propiedades antiinflamatorias y antioxidantes que protegen a la LDL de la oxidación11. La concentración de la HDL no solo está disminuida en los pacientes con diabetes, sino que además es parcialmente disfuncional, con menor capacidad para estimular el transporte reverso del colesterol y menor capacidad antioxidante y antiinflamatoria12. De esta manera, la disfuncionalidad de la HDL favorece la formación de la LDL oxidada (oxLDL).
Por otra parte, la sdLDL es más aterogénica que la LDL con un tamaño y una densidad normal debido a una serie de características distintivas. Por un aparte, tiene menor afinidad por el receptor de la LDL, lo que implica una menor tasa de aclaramiento plasmático y un mayor tiempo de permanencia en la circulación. Además, la sdLDL atraviesa la barrera endotelial con mayor facilidad que la LDL nativa ya que este es un proceso dependiente principalmente del tamaño de la partícula de lipoproteína. También se une con mayor afinidad a los proteoglicanos que constituyen la pared arterial, favoreciendo la retención subendotelial de lipoproteínas. Además, la sdLDL tiene mayor susceptibilidad a ser modificada por mecanismos oxidativos y de glicación no enzimática13. Esto último relaciona la dislipidemia diabética con los otros 2 procesos implicados en el aumento del RCV anteriormente mencionados, como son la glicosilación no enzimática y el estrés oxidativo.
Glicosilación no enzimáticaEl estado continuo de la hiperglicemia tiene como consecuencia que aumentan los procesos de glicosilación no enzimática de las diferentes macromoléculas. Esto afecta de una manera muy relevante la funcionalidad de las proteínas. Este proceso se da cuando la glucosa reacciona con los aminoácidos con grupos amino (principalmente lisina y arginina), formando una base de Schiff y, posteriormente, un compuesto estable denominado producto de Amadori14. Son muy numerosas las proteínas que pueden ver afectada su funcionalidad por esta modificación. Aunque lógicamente las proteínas más afectadas por la glicosilación no enzimática son las proteínas estructurales con una vida media larga, las lipoproteínas también pueden ser glicosiladas durante su tiempo de permanencia en la circulación15. No obstante, la idea más aceptada es que este proceso estaría potenciado en las LDL retenidas en la pared arterial durante un periodo de tiempo superior. Esta modificación afecta su funcionalidad y un ejemplo de ello es que la LDL glicada pierde afinidad por el receptor de la LDL16. La sdLDL, frecuente en pacientes con diabetes, es más susceptible a los procesos de glicosilación no enzimática que la LDL de tamaño normal17, lo que confiere una mayor relevancia a esta modificación en los pacientes con dislipidemia diabética. La glicosilación no enzimática, a su vez, induce la formación de radicales libres de oxígeno con la consecuente estimulación de procesos oxidativos, fenómeno que se conoce como glicoxidación18. Este proceso genera una reordenación de los enlaces moleculares y da lugar a la formación de productos avanzados de glicación (advanced glycation end-products [AGE])18. Este es un grupo heterogéneo de compuestos que altera seriamente y de manera irreversible la función de las proteínas. Todos estos procesos ocurren in vivo, lo que ha hecho posible la detección de la LDL glicosilada (glLDL) y la LDL modificada con AGE (AGE-LDL) en la circulación plasmática19. La AGE-LDL, tanto generada in vitro como aislada de la circulación plasmática, tiene propiedades inflamatorias e induce apoptosis en las células de la pared vascular20–22, procesos ambos implicados en el desarrollo de la arteriosclerosis.
La relativamente corta vida media de la LDL en circulación (2,5-3,5 d) siempre ha sido un argumento en contra de que la glicosilación no enzimática afecte «in vivo» de manera significativa a la LDL durante la circulación plasmática ya que, en ausencia de agentes reductores, generalmente son necesarios 6-7 d para que la glucosa modifique proteínas de forma significativa23. Por ello, se ha asumido implícitamente que la formación de la glLDL y, sobre todo, de la AGE-LDL ocurriría principalmente en la LDL que ha quedado retenida en la pared arterial durante un periodo superior a su tiempo de vida plasmática23. De esta manera, se supone que la glLDL y la AGE-LDL detectadas en la circulación plasmática se habrían formado en zonas lesionadas de la pared arterial y su presencia en la sangre sería un reflejo del desarrollo de lesiones arterioscleróticas.
Otro tipo de modificación relacionado con la hiperglicemia pero que no implica directamente a la glucosa es la modificación mediante metilglioxal (MG) u otros compuestos similares24. Diferentes investigadores han estudiado el efecto de metabolitos de la glucosa del tipo dicarbonilo con un elevado poder reductor, de los que el más importante es el MG. Este metabolito es capaz de reaccionar rápidamente con residuos de arginina. Especialmente importantes son los estudios de Thornalley et al. que han demostrado la existencia en la sangre de la LDL modificada con MG (MG-LDL) y han observado que su concentración está aumentada en pacientes con diabetes y disminuye tras el tratamiento con metformina25. La LDL modificada mínimamente con MG presenta una serie de características aterogénicas que incluyen un menor tamaño, una mayor susceptibilidad a la agregación y una mayor afinidad para la unión a los proteoglicanos de la pared arterial26. La modificación de arginina con MG da lugar a un compuesto heterocíclico (hidroimidazolona) que forma parte de la familia heterogénea de los compuestos AGE, por lo que la MG-LDL es una forma específica del grupo de AGE-LDL. Sin embargo, lo relevante de la MG-LDL, dentro del conjunto de AGE-LDL, es que, dada la elevada reactividad del MG, podría formarse perfectamente durante la circulación plasmática de la LDL.
Estrés oxidativoLa modificación de las proteínas mediante glicosilación y la posterior formación de AGE no es el único mecanismo mediante el cual el estrés oxidativo interviene en el desarrollo de la arteriosclerosis en los pacientes con diabetes. De hecho, un aumento del estrés oxidativo sistémico es una característica de la diabetes1. Probablemente, la principal causa es que como consecuencia de la hiperglicemia hay un aumento en la actividad mitocondrial que favorece la producción de especies reactivas del oxígeno (radical oxygen species [ROS])27. Esto hace que sea muy frecuente detectar una alteración en los parámetros que cuantifican el estrés oxidativo en el plasma de estos individuos. El estrés oxidativo tiene un papel especialmente importante en el espacio subendotelial de la pared arterial, un microambiente rodeado de células metabólicamente activas (células endoteliales, células musculares lisas, macrófagos) que generan ROS y que carece de las abundantes defensas antioxidantes del plasma sanguíneo. La modificación oxidativa puede afectar a todas las macromoléculas pero las lipoproteínas, y concretamente la LDL, son muy sensibles al ataque oxidativo de las ROS28. Estos radicales oxidan principalmente los ácidos grasos insaturados de los fosfolípidos situados en la superficie de la lipoproteína, un proceso conocido como lipoperoxidación. Tres décadas de investigaciones, iniciadas con las investigaciones pioneras de Steinberg et al. a principios de los años 80, han mostrado que la modificación oxidativa de la LDL es un evento clave en el desarrollo de la arteriosclerosis28–30. A diferencia de la LDL nativa, no modificada, que no presenta propiedades potencialmente aterogénicas, la oxLDL tiene la capacidad de promover y/o intervenir en prácticamente todos los eventos que se producen durante la evolución de la lesión arteriosclerótica. Así, la oxLDL es capaz de inducir la acumulación masiva intracelular de ésteres de colesterol por parte de los macrófagos, induciendo la formación de células espumosas, probablemente la característica anatomopatológica más típica de la lesión arteriosclerótica31. Esto es debido a la pérdida de afinidad por el receptor de la LDL, que viene acompañada por el aumento de afinidad por receptores «basureros» (scavenger receptors [SR]), cuya expresión no está regulada por el contenido intracelular de colesterol. Además, la oxLDL puede inducir a las diferentes células de la pared arterial a expresar citoquinas, quimioquinas y factores de crecimiento. De esta manera, la oxLDL promueve el proceso inflamatorio crónico y la proliferación celular característicos de la arteriosclerosis30,32,33. También es citotóxica y apoptótica, promoviendo la formación del núcleo necrótico que presentan las lesiones ateromatosas avanzadas34. La figura 2 muestra los efectos que tiene la modificación, oxidativa o mediante otros mecanismos, sobre la LDL y su implicación en el desarrollo de la arteriosclerosis.
Papel de la modificación de la LDL en el desarrollo de la arteriosclerosis. La LDL puede ser modificada mediante diferentes mecanismos durante su permanencia en la circulación (hiperglicemia, estrés oxidativo, carbamilación, sobrecarga con NEFA) o una vez ha quedado atrapada en la pared arterial (hiperglicemia, estrés oxidativo, lipólisis, proteólisis, agregación). El resultado de estas modificaciones es que se generan compuestos, principalmente lipídicos (fosfolípidos oxidados, colesterol oxidado, cetonas, lisofosfatidilcolina, NEFA, ceramida), aunque también derivados de la apoB (aductos MDA-Lys, AGE) que tienen un potencial inflamatorio, apoptótico y proliferativo. Estos compuestos activan vías de señalización mediadas por kinasas (MAPK, PI3K/Akt, TAT/JAK) que a su vez estimulan la translocación y/o activación de factores de trascripción (NFkB, AP1, PPARγ) que producen una disfunción endotelial, estimulan la secreción de citoquinas, quimioquinas y factores de crecimiento y mediadores de apoptosis. Por otra parte, otras modificaciones fragmentan la apoB, incrementan la carga negativa, favorecen la agregación y aumentan su unión a los proteoglicanos que constituyen la pared arterial. Esto tiene como consecuencia que se estimula la acumulación subendotelial de la LDL y la formación de células espumosas característica de la lesión ateromatosa.
Numerosas evidencias indican que las LDL pueden ser modificadas por otros mecanismos adicionales a la modificación oxidativa y de los procesos de glicosilación no enzimática. La figura 3 muestra un resumen de los diferentes procesos que pueden generar los distintos tipos de LDL modificada35. En las lesiones arterioscleróticas hay una hiperexpresión de enzimas lipolíticos como la fosfolipasa A2 (PLA2), la esfingomielinasa (SMasa) o la colesterol esterasa (CEasa) y también de diversas proteasas (metaloproteinasas, catepsinas)36–41. En consecuencia, se presume que la LDL retenida en la pared arterial es afectada no solo por procesos lipoperoxidativos y glicoxidativos, sino también por proteasas y lipasas. Una prueba indirecta de esto es que las lipoproteínas aisladas de la pared arterial muestran una fragmentación de la apoB (constituye el 98-99% de la proteína de la LDL) y un contenido elevado de diversos productos de la degradación enzimática de los lípidos como la lisofosfatitilcolina, la ceramida y el colesterol no esterificado31,42,43. Algunos de estos productos podrían generarse también a partir de procesos oxidativos (fragmentación de apoB, lisofosfatidilcolina) pero otros no se explican por estos fenómenos. Además, el hecho de que los productos de oxidación no estén excesivamente elevados en las lesiones arterioscleróticas ha relativizado la contribución de la modificación oxidativa al desarrollo de la lesión arteriosclerótica44. A esto ha contribuido también la falta de resultados positivos en grandes ensayos clínicos utilizando diferentes moléculas antioxidantes45,46. Actualmente, la percepción general es que, si bien se sigue aceptando que la lipoperoxidación tiene un papel importante en la aterogénesis, otros mecanismos de modificación de la LDL, como la modificación enzimática mediante lipasas o proteasas, podrían tener un papel, incluso más preponderante que la oxidación, en la generación de la LDL modificada en la pared arterial44,47.
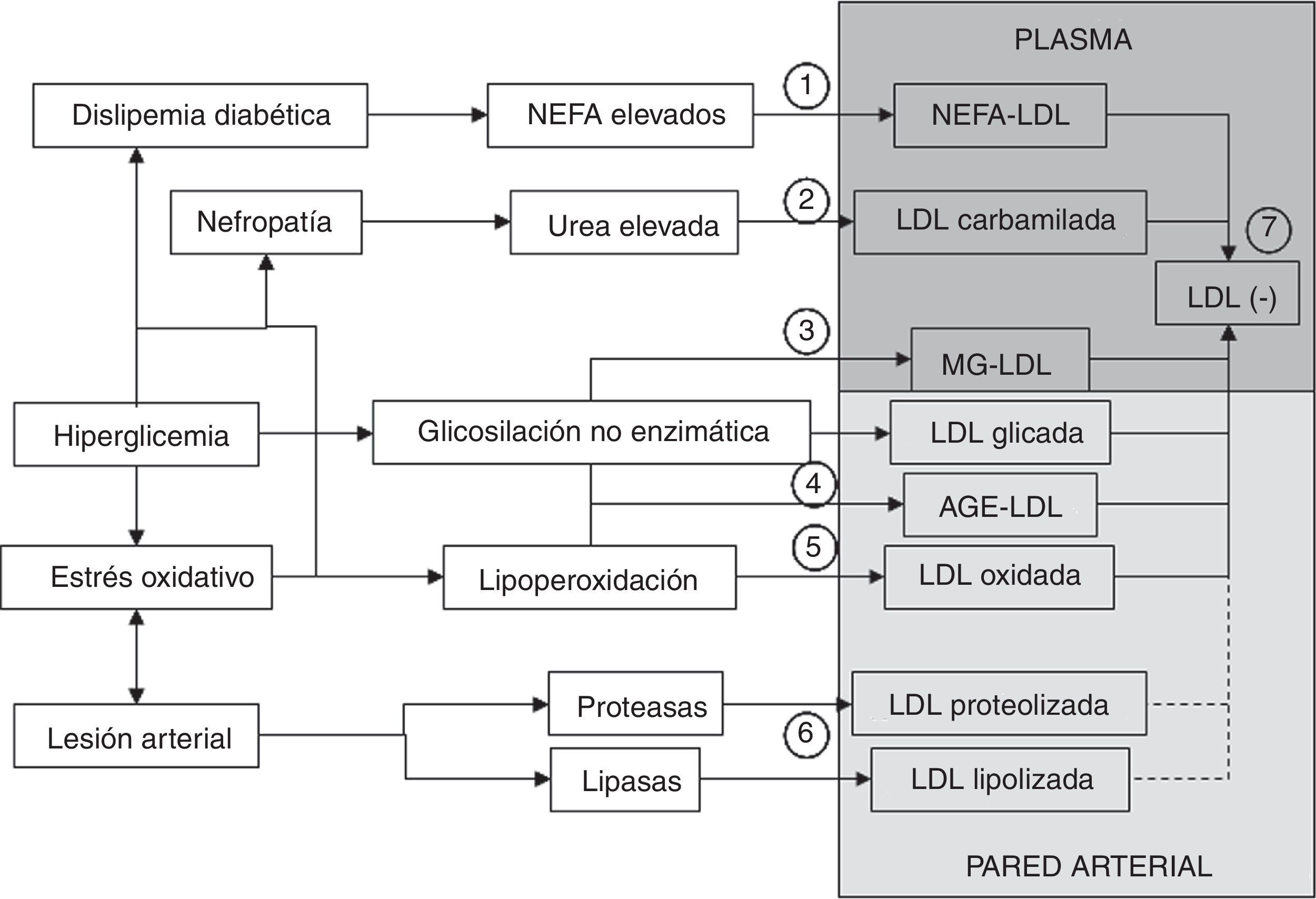
Mecanismos de formación de la LDL modificada. La LDL puede ser modificada en el plasma o en la pared arterial por diferentes mecanismos. La concentración plasmática elevada de NEFA característica de la dislipidemia diabética favorece la sobrecarga con NEFA de la LDL (1). En caso de nefropatía e hiperuremia se ve estimulada la carbamilación de la LDL (2). Otro proceso que puede darse en la circulación plasmática es la modificación con metilglioxal (MG) (3). Más difícil es que en el plasma se modifique significativamente la LDL por glicosilación no enzimática, por lo que es más probable que la formación de la LDL glicada y de la AGE-LDL se produzca en la pared arterial (4). De igual manera, aunque la modificación oxidativa se podría producir en el plasma, también es más probable que ocurra más extensamente en la pared arterial (5). La modificación mediada por lipasas y proteasas también ha de ocurrir preferentemente en la pared arterial (6). Una característica común a todas estas modificaciones es un aumento de la carga eléctrica negativa de la partícula de LDL, lo que se ve reflejado en la formación de la LDL electronegativa (LDL(-)), una forma modificada de la LDL que se puede asilar de la circulación plasmática (7). La LDL(-) estaría formada, al menos, por NEFA-LDL, LDL carbamilada, MG-LDL, LDL glicada, AGE-LDL y LDL oxidada y quizás también por la LDL lipolizada y/o proteolizada cuyo origen sería la pared arterial.
Además de los procesos descritos hasta ahora, que ocurren preferentemente en la pared arterial, la LDL también puede modificarse por otros mecanismos en la circulación sanguínea. Recientemente se ha descrito la presencia de la LDL carbamilada en plasma48,49. La carbamilación es una modificación química generada por la reacción con la molécula de cianato que se deriva del tiocianato formado a partir de la urea48. Se ha observado que esta forma de modificación es especialmente importante en fumadores ya que el humo de tabaco favorece la formación de tiocianato y en pacientes con uremia crónica por insuficiencia renal severa. Esto abre la posibilidad de que la LDL carbamilada esté aumentada en pacientes con diabetes y enfermedad renal. No obstante, esto no ha sido todavía confirmado experimentalmente.
También se ha descrito la presencia en la circulación de la LDL desializada, es decir, con un contenido disminuido en ácido siálico, uno de los carbohidratos que forman las cadenas de glicosilación enzimática de la apoB. La LDL desializada está aumentada en pacientes con diabetes y tiene la capacidad de inducir la formación de células espumosas, por lo que es potencialmente aterogénica50. La desialización se ha atribuido a los procesos de oxidación ya que estos favorecen la pérdida del ácido siálico unido a la apoB. Por ello, la LDL desializada podría ser un reflejo de la presencia de la oxLDL51.
Otra modificación de la LDL, que cuantitativamente puede ser muy relevante, es la sobrecarga con ácidos grasos no esterificados (NEFA). Estos compuestos son generalmente transportados en la sangre asociados a la albúmina. Cuando al aumentar la concentración plasmática de NEFA la capacidad de transporte de la albúmina se ve excedida los NEFA se unen a otras macromoléculas, principalmente lipoproteínas52. La LDL con un contenido aumentado en NEFA tiene un mayor potencial inflamatorio y ve alterada su estructura favoreciendo su agregación53–55. Este fenómeno es importante en la diabetes, donde es frecuente que los niveles plasmáticos de NEFA estén incrementados. En este contexto, se ha descrito que la LDL de pacientes diabéticos tiene un contenido elevado de NEFA56. Esto podría explicar las observaciones de otros estudios que han mostrado que la LDL de estos individuos es más inflamatoria que la de sujetos sin diabetes, a pesar de no tener aumentados los índices de lipoperoxidación57,58.
Una propiedad común a las diferentes formas de LDL modificada descritas anteriormente es un aumento en la carga eléctrica de la partícula59. Aprovechando esta característica, Avogaro et al. fueron los primeros en aislar del plasma una fracción de la LDL modificada con un aumento de la carga negativa que denominaron LDL electronegativa (LDL(-))60. La LDL(-) se puede considerar un «pool» que contiene las diferentes formas modificadas de la LDL (fig. 2) que están presentes en la sangre y representa aproximadamente un 5% de la LDL total en individuos sanos. La LDL(-) está 2-4 veces aumentada en diferentes grupos de individuos con un elevado RCV o con arteriosclerosis avanzada, incluyendo pacientes con diabetes de tipo 1 y de tipo 259,61,62. La proporción de LDL(-) es mucho más alta que los valores que generalmente se describen de oxLDL o AGE-LDL (0,1-1%)63,64. En consecuencia, tanto la oxLDL como la AGE-LDL serían formas minoritarias dentro de la LDL(-) y, probablemente, la mayor parte de LDL(-) es LDL con un contenido aumentado en NEFA, con más apolipoproteínas minoritarias (diferentes de la apoB) asociadas y/o con mayor densidad (sdLDL). Por ello, la LDL(-) sería un reflejo de las anormalidades metabólicas presentes en las diferentes enfermedades, mientras que la oxLDL o la AGE-LDL estarían relacionadas con la presencia de lesiones arterioscleróticas subyacentes.
Utilidad de la lipoproteína de baja densidad modificada como biomarcadorIndependientemente de la relevancia relativa de cada tipo de modificación en la generación de la LDL modificada y de las propiedades aterogénicas que cada uno de estos mecanismos confiere a la LDL, está ampliamente aceptado que la modificación de la LDL tiene un papel clave en la aterogénesis. Esto hace que muchos investigadores se hayan planteado que la cuantificación de la LDL modificada pueda ser utilizada como un marcador de RCV e incluso que pueda servir para hacer una estimación de la extensión y la evolución de las lesiones arterioscleróticas presentes en pacientes con arteriosclerosis4,64. Aunque no puede descartarse de manera absoluta que una parte de la oxLDL y la AGE-LDL se haya formado durante su tiempo de vida en la circulación plasmática, la percepción general es que la oxLDL y la AGE-LDL se han formado en la pared arterial. De esta manera, la existencia en el plasma de estas formas de LDL modificadas podría ser un reflejo de la presencia silente de lesiones arterioscleróticas activas ya que la LDL se oxida y/o glicoxida en zonas lesionadas de la pared arterial pero no se encuentra en zonas sanas. Por esta razón, la oxLDL podría ser considerada no solo un biomarcador de la arteriosclerosis, sino también podría indicar la presencia de placas arterioscleróticas inestables y/o fracturadas que liberarían parte de su contenido a la circulación64–69.
Para demostrar esta implicación de la LDL modificada y valorar su utilidad como biomarcador ha sido necesario el desarrollo de métodos rápidos, reproducibles y relativamente sencillos que permitan su cuantificación en grandes grupos de pacientes. Desde principios de los años 90 los avances en el desarrollo de inmunoensayos han permitido describir la presencia en la circulación plasmática de diferentes formas modificadas de LDL. Holvoet et al. desarrollaron un inmunoensayo capaz de detectar MDA-LDL, una forma de LDL modificada generada por oxidación, y fueron los primeros en describir una concentración aumentada en pacientes con arteriosclerosis70. Desde entonces se han comercializado al menos 3 métodos basados en anticuerpos diferentes (4E6, E06 y DLH3) que reconocen distintos epitopos oxidativos generados en la oxLDL (aducto MDA-Lys, fosforilcolina y fosfatidilcolina oxidada, respectivamente)4,70–72. Cohen et al. desarrollaron en 1993 un método de inmunoensayo para cuantificar la LDL glicada73 que fue comercializado poco después. También se han desarrollado métodos para detectar la AGE-LDL74 y, más recientemente, se han implementado inmunoensayos capaces de detectar la LDL carbamilada49 y la LDL(-). No obstante, estos últimos métodos no han sido comercializados, lo que ha limitado hasta ahora el desarrollo de estudios multicéntricos que puedan validar estos tipos de LDL modificada como marcadores de RCV. Con estas herramientas el objetivo que se han planteado muchos investigadores es determinar si, además de ser un agente causal, la cuantificación de la LDL modificada podía servir como biomarcador de la enfermedad arteriosclerótica que añadiera una información adicional a los factores de riesgo más clásicos. Con mucho, la mayoría de estudios se han realizado cuantificando la oxLDL, aunque los estudios que han evaluado la AGE-LDL y la LDL(-) han ido cobrando relevancia en los últimos años.
Asociación de la lipoproteína de baja densidad oxidada con el riesgo cardiovascularNumerosos estudios poblacionales han descrito una concentración aumentada de oxLDL en grupos de pacientes con un elevado RCV, incluyendo la hipercolesterolemia, la hipertrigliceridemia, el síndrome metabólico, la obesidad, la diabetes, la hipertensión o la enfermedad renal severa4,64,70,75–77. También se ha descrito una mayor concentración de oxLDL en el plasma de pacientes con arteriosclerosis angiográficamente documentada y esta concentración se ha asociado a la severidad de la enfermedad coronaria65,78–80. No obstante, a pesar de que la implicación de la oxLDL en el desarrollo de la arteriosclerosis está ampliamente aceptada, su valor como biomarcador independiente del RCV es moderado81–83. Esto puede ser debido a diversas razones. Por una parte, sobre todo en los individuos con dislipidemia, existe una fuerte correlación con los parámetros lipídicos, especialmente con el colesterol total y la LDL81. Esto enmascara el papel de la oxLDL como biomarcador y relativiza el valor de su cuantificación. Otro factor que explica la falta de estudios concluyentes es que no existe una estandarización de los diferentes inmunoensayos que utilizan anticuerpos que reconocen distintos epitopos generados durante el proceso oxidativo en la LDL4,64. Dado que este proceso es enormemente complejo y genera, de una manera más o menos secuencial, productos que aparecen en unas fases de la oxidación y son degradados en otras, los distintos inmunoensayos podrían detectar diferentes estados oxidativos de la LDL. Está claro que es necesaria una estandarización exhaustiva de estos métodos para poder comparar los resultados obtenidos con los estudios realizados.
Más unanimidad, y probablemente más aplicabilidad, tiene la observación de que la oxLDL, independientemente del método utilizado, aumenta su concentración temporalmente durante la fase aguda del infarto agudo de miocardio o del accidente vascular cerebral y también tras una angiografía transluminal percutánea84–86. Estas observaciones apoyan el concepto de que la oxLDL en la circulación proviene de la pared arterial lesionada y sugieren que la cuantificación en la sangre de oxLDL pudiese ser una herramienta muy útil para tener mayor conocimiento de la vulnerabilidad de las lesiones ateromatosas y para la prevención secundaria de eventos cardiovasculares en pacientes con arteriosclerosis.
Lipoproteína de baja densidad modificada como biomarcador de riesgo cardiovascular en la diabetesLa mayor parte de los estudios realizados en pacientes con diabetes, tanto de tipo 1 como de tipo 2, han demostrado una concentración aumentada de los diferentes tipos de LDL modificada, incluyendo la oxLDL, la LDL glicada, la AGE-LDL y la LDL(-)62,73,87–92. En general, se ha observado que un mal control glicémico se asocia a concentraciones más elevadas de la LDL modificada y que su optimización, mediante diferentes terapias, resulta en la disminución de estas concentraciones62,93,94. De forma similar a lo observado en los estudios realizados en la población sin diabetes, el tratamiento con hipolipidemiantes también disminuye los niveles de las LDL modificadas en los pacientes con diabetes, existiendo una clara relación con los efectos sobre el perfil lipídico90,95,96. Por ello, su valor predictivo como factor independiente de eventos clínicos cardiovasculares no está totalmente claro. Especialmente en la diabetes de tipo 2, donde el perfil lipídico suele estar alterado, los estudios han arrojado importantes discrepancias97,98. Algunos estudios realizados en una población con diabetes han señalado a la oxLDL como un factor predictivo de la aparición de eventos cardiovasculares, aunque algunos autores no han encontrado esta asociación independiente cuando se han considerado las anormalidades del perfil lipídico99–101. Sin embargo, y a diferencia de la débil asociación de la LDL modificada con eventos clínicos, otros estudios han encontrado asociaciones independientes con otros marcadores de la evolución de la arteriosclerosis como el grosor de la íntima-media carotidea o la nefropatía diabética102–106.
Un avance importante en la utilización de la LDL como biomarcador es la cuantificación de inmunocomplejos formados por anticuerpos y LDL modificadas (IC-oxLDL o IC-AGE-LDL), principalmente en estudios llevados a cabo en sujetos con diabetes de tipo 1107. Una de las propiedades de los diferentes tipos de LDL modificadas es que tienen capacidad inmunogénica108–113. Esta propiedad ha permitido detectar en el plasma autoanticuerpos específicos contra las diferentes LDL modificadas, incluyendo la oxLDL, la AGE-LDL y la LDL(-). Diversos estudios han mostrado que la concentración de estos autoanticuerpos se asocia con la presencia de la enfermedad arteriosclerótica, aunque existen numerosas discrepancias al respecto. Las evidencias actuales sugieren que los anticuerpos del tipo IgG estarían asociados positivamente con el desarrollo de arteriosclerosis, mientras que los anticuerpos de tipo IgM tendrían un papel ateroprotector114.
Los estudios más relevantes en este aspecto los ha realizado el grupo de Virella y Lopes-Virella, principalmente en sujetos con diabetes de tipo 1. Estos autores han mostrado en estudios in vitro que los IC-LDL tienen más potencial aterogénico que las LDL modificadas no unidas a anticuerpos97,115. Esto sería debido a que, además de la activación de la vía mediada por receptores «scavenger» que reconocen la LDL modificada, también activan en monocitos la vía del receptor Fc, específico de anticuerpos, potenciando el proceso inflamatorio20,115,116. Por otra parte, es importante señalar que la mayor parte de la oxLDL y la AGE-LDL presente en la circulación plasmática circula en forma de IC20,74,117. Esto refuerza el concepto de que «in vivo» los inmunocomplejos con la oxLDL o la AGE-LDL tendrían un papel más relevante en el desarrollo de la arteriosclerosis que estas mismas LDL en forma libre.
En concordancia con esta idea, los estudios realizados por este grupo han mostrado que las concentraciones de IC-oxLDL y de IC-AGE-LDL están fuertemente asociadas con el grosor íntima-media carotidea y su progresión en la diabetes de tipo 1 de manera independiente a otros factores de riesgo88. Estos IC también están asociados con el grado de calcificación coronaria118, con el riesgo de desarrollar nefropatía119 y con la progresión de retinopatía120. La importancia de estos estudios es que se han llevado a cabo con un número importante de individuos que forman parte de la cohorte del estudio DCCT/EDIC, por lo que la consistencia de los resultados es alta. Sin embargo, no se han realizado todavía estudios donde se analice la asociación de los IC-LDL con la incidencia de eventos coronarios en diabéticos de tipo 1. Donde sí se ha analizado esta asociación es en diabéticos de tipo 2 (cohorte VADT)102. Curiosamente, en estos pacientes no hay una asociación entre la incidencia de eventos clínicos y IC-oxLDL o IC-AGE-LDL pero sí con la concentración de inmunocomplejos de MDA-LDL, una forma específica de oxLDL, la cual no estaba asociada con la progresión de la arteriosclerosis en diabéticos de tipo 188. Las razones que pueden explicar estas diferencias no están claras, aunque podrían ser atribuidas a una diferente evolución de las lesiones entre ambos tipos de pacientes con diabetes. El principal inconveniente de este método analítico es que requiere un paso previo de precipitación de los inmunocomplejos antes de la cuantificación mediante un inmunoensayo de la LDL modificada. Esto incrementa la complejidad técnica de la medida y, por tanto, su realización es difícil para la mayor parte de laboratorios clínicos.
ConclusionesLa concentración plasmática de diferentes LDL modificadas está elevada en pacientes con diabetes, aunque en muchas ocasiones esta observación ha sido estrechamente asociada a la presencia de dislipidemia. Sin embargo, los últimos estudios que han valorado la concentración de LDL modificadas asociadas a inmunocomplejos han mostrado una asociación con la presencia y la progresión de la arteriosclerosis tanto en la diabetes de tipo 1 como en la diabetes de tipo 2. Esta es una aproximación prometedora que podría ayudar a una mejor predicción del RCV no solo en pacientes con diabetes, sino también en otras enfermedades con un desarrollo acelerado de la arteriosclerosis. Sin embargo, para definir mejor la implicación de cada tipo de LDL modificada en el desarrollo de la arteriosclerosis son necesarios más estudios realizados por diferentes grupos de investigación en pacientes con diferentes enfermedades o situaciones asociadas con la arteriosclerosis precoz.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores de este trabajo han sido financiados por el Instituto de Salud Carlos III (CIBERDEM, FIS PI05-2099, FIS CP06-0220 y FIS PI10-00265) y la Generalitat de Catalunya (2009-SGR-1205).