En la diabetes tipo 1 se ha descrito un retraso en la maduración puberal.
ObjetivosDescribir la edad de inicio puberal y la edad de la menarquia en niñas con diabetes tipo 1 diagnosticadas antes de la pubertad. Analizar las variables relacionadas con las mismas.
Pacientes y métodosEstudio retrospectivo de las niñas diabéticas tipo 1 diagnosticadas antes de la pubertad y seguidas en nuestra consulta que han tenido la menarquia. Todas han sido tratadas desde el debut con insulinoterapia intensiva. Se recogieron como variables dependientes las edades al inicio de la pubertad (brote mamario) y a la menarquia y como independientes el tiempo de evolución de la diabetes, el nivel de hemoglobina glucosilada, el requerimiento diario de insulina y el índice de masa corporal (en escala de desviación estándar para cada edad y sexo). Las variables se expresan como media ± desviación típica. Se utilizó la regresión lineal múltiple con el programa SPSS.
ResultadosSe incluyeron 38 adolescentes. La edad de inicio puberal fue 10,4 ± 1,1 años y la edad de la menarquia 12,6 ± 1,0 años. El tiempo de evolución de la diabetes fue la única variable relacionada de forma estadísticamente significativa con retraso del inicio puberal (β = +0,12; p=0,047). El mayor índice de masa corporal se asoció con adelanto de la edad de la menarquia (β = -0,39; p=0,014).
ConclusiónLa cronología de la pubertad en las niñas con diabetes tipo 1 se relaciona con el tiempo de evolución de la diabetes y con el índice de masa corporal.
Delayed pubertal maturation has been reported in girls with type 1 diabetes.
ObjectivesTo report the age of onset of puberty and menarche in girls with type 1 diabetes diagnosed before puberty. To investigate clinical factors affecting the occurrence of puberty and menarche in this population.
Patients and methodsA retrospective study of 38 girls with type 1 diabetes, all of them on intensive insulin therapy since diagnosis and followed up at our hospital until menarche.
Age of onset of puberty and age of menarche were collected as dependent variables, and time since onset of diabetes, glycosylated hemoglobin levels, daily insulin requirements, and body mass index standard deviation score were collected as independent variables. Variables are expressed as mean ± standard deviation. Multivariate linear regression models tested the associations between dependent and independent variables. Statistical analysis was performed using SPSS software.
ResultsThirty-eight girls were enrolled. Age of onset of puberty was 10.4 ± 1.1 years and age of menarche, 12.6 ± 1.0 years. Time since diabetes onset influenced age at onset of puberty (β = +0.12; p=0.047). A negative association was found between body mass index standard deviation score and age at menarche (β=-0.39; p=0.014).
ConclusionDiabetes duration and body mass index were correlated with age of onset of puberty and age of menarche in girls with type 1 diabetes.
En la diabetes mellitus tipo 1 (DM1) se ha descrito un retraso en la maduración puberal con respecto a la población no diabética, relacionado con el tiempo de evolución de la enfermedad y su grado de control metabólico1–6. Sin embargo, las diferencias parecen ir reduciéndose: mientras que los trabajos realizados hace 20 años hablan de un retraso puberal en torno a doce o dieciséis meses1,5, las publicaciones del último quinquenio lo reducen a menos de seis2,4, muy probablemente por los recientes avances en el tratamiento insulínico.
Desde la publicación del estudio DCCT (Diabetes Control and Complications Trial), el tratamiento intensivo se ha convertido en el de primera elección en jóvenes con DM1, demostró que la mejoría del control metabólico se traducía en una reducción en la frecuencia y la gravedad de las complicaciones crónicas7. A nivel pediátrico, si bien no hay un consenso sobre el régimen insulínico a utilizar, sí hay una clara tendencia a potenciar el uso del tratamiento intensivo8,9.
Los objetivos de nuestro estudio son describir la edad de inicio puberal y la edad de la menarquia en niñas con DM1 diagnosticadas antes de la pubertad y tratadas con insulinoterapia intensiva desde el debut, y analizar las variables relacionadas con las mismas.
Pacientes y métodosEstudio retrospectivo realizado en una Unidad de Endocrinología Pediátrica de un hospital de segundo nivel que atiende a unos 200 niños y adolescentes con DM1 diagnosticados antes de los 14 años de edad.
Se incluyeron en el estudio las niñas con DM1 diagnosticadas antes de la pubertad y seguidas en la consulta trimestralmente que habían tenido la menarquia. Todas habían sido tratadas desde el inicio de la diabetes con insulinoterapia intensiva con multidosis (tres o más inyecciones al día) o infusión continua y, al menos, cuatro mediciones diarias de glucemia capilar y modificaciones de las dosis de insulina por parte de las pacientes o de sus padres.
La presencia de otra enfermedad crónica (tanto autoinmune como de cualquier otro origen) se consideró criterio de exclusión, así como la pertenencia a alguna minoría étnica.
Se recogieron como variables dependientes la edad al inicio de la pubertad (brote mamario o estadio II de Tanner) y la edad de la menarquia y como independientes el tiempo de evolución previa de la diabetes (desde la primera dosis de insulina), el nivel de hemoglobina glucosilada medio en los tres años previos (o con los valores disponibles en aquellos casos de más corta evolución), el requerimiento diario de insulina (en unidades internacionales por kilogramo [kg] de peso y día) y el índice de masa corporal (calculado dividiendo el peso en kg por la talla en metros al cuadrado) expresado en escala de desviación estándar (EDE) según las referencias españolas10. Se definió obesidad cuando el índice de masa corporal era mayor a 2 DE para la edad y el sexo. La hemoglobina glucosilada se analízó por cromatografía líquida de alta presión (valores normales 3,0-5,0%).
Las variables se expresan como media ± desviación típica. Se estudió la asociación entre las variables mediante regresión lineal múltiple. Un valor de alfa de 0,05 se usó como umbral de significación estadística. Para los cálculos estadísticos se utilizó el programa SPSS versión 11,0 para Windows.
Se contó con la aprobación de los comités ético y de investigación de nuestro centro.
ResultadosSe incluyeron 38 adolescentes. La edad de inicio puberal fue 10,4 ± 1,1 años y la edad de la menarquia 12,6 ± 1,0 años.
Las variables al inicio de la pubertad se muestran en la tabla 1. En ese momento, aproximadamente dos tercios (26/38) presentaban un control metabólico aceptable, si se entiende como tal un nivel de hemoglobina glucosilada medio en los tres años previos de hasta el 7,5%. Había seis niñas obesas (aproximadamente un 16% de la cohorte) y en 13 casos el requerimiento insulínico superaba una unidad por kg de peso y día.
Variables al inicio de la pubertad (media ± desviación típica [rango])
| Número de pacientes | 38 |
| Edad (años) | 10,45±1,08 (8,1-13,2) |
| Tiempo de evolución de la diabetes (años) | 3,65±2,78 (0,1-9,9) |
| Hemoglobina glucosilada media en los 3 años previos (%) | 7,41±1,18 (5,5-11,5) |
| Índice de masa corporal (kg/m2) | 19,37±2,71 (15,2-25,7) |
| Índice de masa corporal (escala desviación estándar) | 0,62±1,12 (-0,88, +2,92) |
| Dosis de insulina (UI/kg/día) | 0,92±0,26 (0,32-1,69) |
Las variables en el momento de la menarquia se muestran en la tabla 2. Aquí el control metabólico fue peor ya que sólo un tercio (13/38) tenían entonces un control metabólico aceptable en el promedio de los tres años previos. Seguía habiendo seis niñas obesas y el requerimiento insulínico había aumentado, siendo ya en 24 casos superior a una unidad por kg de peso y día.
Variables en la menarquia (media±desviación típica [rango])
| Número de pacientes | 38 |
| Edad (años) | 12,61±1,01 (10,2-14,5) |
| Tiempo de evolución de la diabetes (años) | 5,81±2,78 (1,53-11,30) |
| Hemoglobina glucosilada media en los 3 años previos (%) | 8,05±0,93 (6,7-11,0) |
| Índice de masa corporal (kg/m2) | 21,31±2,64 (16,4-25,6) |
| Índice de masa corporal (escala desviación estándar) | 0,67±1,00 (-0,93,+3,21) |
| Dosis de insulina (UI/kg/día) | 1,18±0,28 (0,71-2,00) |
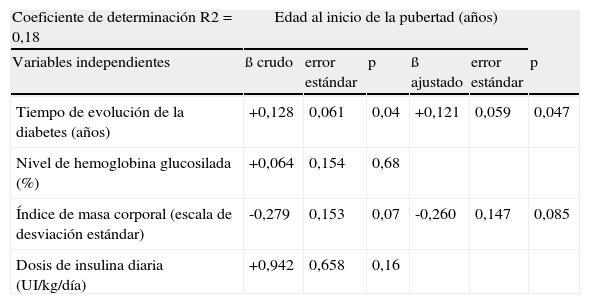
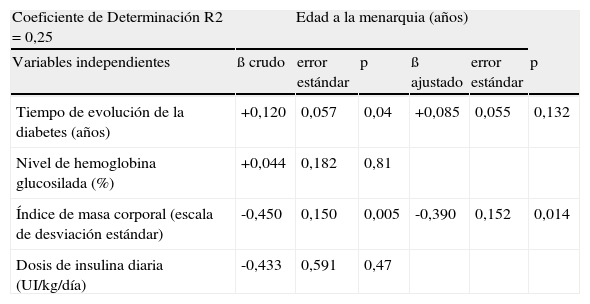
En las tablas 3 y 4 se muestran las asociaciones entre las distintas variables y la edad de inicio de la pubertad y la edad de la menarquia respectivamente. Tras ajustar por el resto de variables, el tiempo de evolución de la diabetes fue la única relacionada de forma estadísticamente significativa con la edad de inicio puberal (β = +0,12; p=0,047). El mayor índice de masa corporal se relacionó con un adelanto de la edad de la menarquia (β = -0,39; p = 0,014) y, de forma no significativa por el escaso tamaño muestral, con la edad del inicio de la pubertad (β = -0,26; p=0,085).
Variables relacionadas con la edad de inicio de la pubertad
| Coeficiente de determinación R2 = 0,18 | Edad al inicio de la pubertad (años) | |||||
| Variables independientes | ß crudo | error estándar | p | ß ajustado | error estándar | p |
| Tiempo de evolución de la diabetes (años) | +0,128 | 0,061 | 0,04 | +0,121 | 0,059 | 0,047 |
| Nivel de hemoglobina glucosilada (%) | +0,064 | 0,154 | 0,68 | |||
| Índice de masa corporal (escala de desviación estándar) | -0,279 | 0,153 | 0,07 | -0,260 | 0,147 | 0,085 |
| Dosis de insulina diaria (UI/kg/día) | +0,942 | 0,658 | 0,16 | |||
Variables relacionadas con la edad de la menarquia
| Coeficiente de Determinación R2 = 0,25 | Edad a la menarquia (años) | |||||
| Variables independientes | ß crudo | error estándar | p | ß ajustado | error estándar | p |
| Tiempo de evolución de la diabetes (años) | +0,120 | 0,057 | 0,04 | +0,085 | 0,055 | 0,132 |
| Nivel de hemoglobina glucosilada (%) | +0,044 | 0,182 | 0,81 | |||
| Índice de masa corporal (escala de desviación estándar) | -0,450 | 0,150 | 0,005 | -0,390 | 0,152 | 0,014 |
| Dosis de insulina diaria (UI/kg/día) | -0,433 | 0,591 | 0,47 | |||
El retraso en la cronología de la pubertad en las niñas con DM1 se ha demostrado tanto en estudios que las comparan con otras en las que la diabetes fue diagnosticada después de la menarquia1,6, como en los que lo hacen con niñas sanas de la misma población1–5. Según varios estudios este retardo correlaciona positivamente con la duración de la diabetes y el grado de control metabólico3,4,11. La fecha de la menarquia es unos 20-40 días más tarde por cada 1% de aumento de la hemoglobina glucosilada media en los tres años previos3,4. En un amplio estudio longitudinal con 643 niñas se relacionó inversamente con el índice de masa corporal y con la dosis de insulina3.
Aunque se ha especulado sobre la presencia de receptores insulínicos en el ovario, soportando la idea de un papel de la insulina en la maduración gonadal, parece más claro que los cambios de peso derivados de la deficiencia o exceso de esta hormona y de la hiperglucemia crónica podrían afectar a la secreción de gonadotropinas12. Un posible rol de la autoinmunidad antiovario que con mayor frecuencia se presentan en la DM1 está por dilucidar13.
A nivel de la población general, sabemos en base a grandes estudios que hay un adelanto en la aparición de la pubertad y de la menarquia a mayor índice de masa corporal. En el Third National Health and Nutrition Examination Survey, las niñas con sobrepeso tenían una prevalencia más alta de inicio puberal y de menarquia adelantada14. En un estudio transversal con 1.840 niñas escolares sanas, aquellas con obesidad y sobrepeso alcanzaban la menarquia cinco meses antes que aquellas con normopeso, mientras que las que tenían déficit ponderal lo hacían 10 meses más tarde15. Se habla de la existencia de un umbral del peso corporal como desencadenante del desarrollo puberal, totalmente independiente de la edad y de la talla, cifrado alrededor de 47 o 51kg para la menarquia15,16.
En el último siglo y con la mejora en el aporte nutricional en los países desarrollados, se ha descrito un adelanto en la cronología de la pubertad17. En Alemania por ejemplo, la mediana de la edad de la menarquia ha bajado de 15,5 años en 1869 a 12,5 en 197818.
En nuestro país, en la Comunidad de Aragón, contamos con un estudio longitudinal que incluye la cronología de la pubertad10. En las niñas aragonesas sanas tanto la edad del inicio de la pubertad, 10,7 ± 1,03 años (rango: 8,64-12,76), como la edad de la menarquia 12,6 ± 0,95 años (rango: 10,7-14,5), son muy parecidas a las del presente estudio. El hecho de no encontrar diferencias puede deberse a que con las actuales pautas insulínicas intensivas nos acercamos a un tratamiento sustitutivo cuasifisiológico. Observemos también que las niñas con diabetes del presente estudio tienen mayor índice de masa corporal que la población española sana y, quizá, les correspondiera un adelanto de la cronología de la pubertad en base al mismo. Sería interesante comparar las niñas diabéticas con controles no diabéticas con el mismo índice de masa corporal.
Sabemos que la adolescente con DM1 tiene una tendencia al sobrepeso relacionada con una mayor insulinización11,19. El índice de masa corporal es un fiel reflejo de la cantidad de insulina administrada, mientras que la dosis prescrita o referida por las pacientes puede no ser la real, en una edad de dificultad de adherencia a las prescripciones. Así pues, la niña con DM1 tiene riesgo de retraso puberal en base a su mal control metabólico e hipoinsulinización, y cuando se hiperinsuliniza se convierte en grupo de riesgo de adelanto de la pubertad.
Las principales limitaciones de nuestro estudio son su carácter retrospectivo, que impide establecer relaciones causales, y el escaso tamaño muestral que impide la significación estadística de algunas asociaciones entre variables. Se requerirían estudios multicéntricos prospectivos con el adecuado cálculo del tamaño muestral que asegurara la potencia necesaria para demostrar nuestra hipótesis. Si se pudiera disponer de suficientes pacientes, sería interesante comparar la cronología de la pubertad en subgrupos de niñas con distintas pautas insulínicas, así como en las distintas categorías de normopeso, sobrepeso y obesidad.
A pesar de las limitaciones, podemos concluir de nuestro estudio, que la cronología de la pubertad en las niñas con diabetes tipo 1 en nuestro centro se relaciona con el tiempo de evolución de la diabetes y con el índice de masa corporal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.